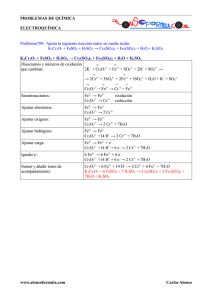
aFe SO bNaI dI eFeSO fNa SO + → + + :2 1 :3 2 :12 4 4 3 : 2 4 : 2 5
Anuncio

http://www.matematicaaplicada.info [email protected] 1 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 1. Se hacen reaccionar 180g de sulfato férrico con 200g de ioduro de sodio (85% de pureza) obteniéndose 98g de iodo, sulfato ferroso y sulfato de sodio. a) Escribir y balancear la ecuación. b) ¿Cuál es el reactivo limitante? c) ¿Qué cantidad de reactivos en exceso? d) ¿Cuántos gramos de cada reactivo y cada producto se obtienen? e) ¿Cuál es el rendimiento de la reacción? SOLUCIÓN aFe2 ( SO4 )3 + bNaI → dI 2 + eFeSO4 + fNa2 SO4 Realizando el balance por elemento químico: Fe : 2a = e 1 S : 3a = e + f 2 O :12a = 4e + 4 f 3 Na : b = 2 f 4 I : b = 2d 5 Con base en las proporciones del número de incógnitas que son CINCO (5) y el número de ecuaciones que son CINCO (5). Se encuentran equilibradas y podre asignarle el valor directo a la variable libre d, le asignare un valor a la variable con mayor asociación. Finalmente existen dos ecuaciones que son múltiplos y por lo http://www.matematicaaplicada.info [email protected] 2 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 tanto desequilibra el modelo, son equivalentes la ecuación <2> y <3>: d =1 Expresando todas las incógnitas en función de e: 2a = e 1 a= e 6 2 Reemplazando el valor asignado anteriormente en la ecuación <5> b = 2d 5 b=2 Reemplazando los valores obtenidos hasta el momento y la ecuación <6> en la ecuación <2> 3a = e + f 2 e 3 = e + f 2 3e e f = −e → f = 7 2 2 Observando el denominador de las expresiones algebraicas que representan la solución de todas las incógnitas en función de e, concluyo que lo más aconsejable para que las incógnitas den valores enteros es: e=2 Reemplazando el valor de e en las ecuaciones anteriores, obtendré las magnitudes http://www.matematicaaplicada.info [email protected] 3 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 de todas las incógnitas: a = 1; b = 2; d = 1; f =1 Con base en los valores anteriormente obtenidos, concluyo que la ecuación química tiene el siguiente balance: Fe2 ( SO4 )3 + 2 NaI → I 2 + 2 FeSO4 + Na2 SO4 COMPUESTO PESO MOLECULAR Fe2 ( SO4 )3 399.885 NaI I2 149.893 FeSO4 151.910 Na2 SO4 142.043 180 g _ de _ Fe2 ( SO4 )3 × 253.808 1mol _ de _ Fe2 ( SO4 )3 399.885 g _ de _ Fe2 ( SO4 )3 = 0.450mol _ de _ Fe2 ( SO4 )3 = moles _ de _ Fe2 ( SO4 )3 = 0.450mol _ de _ Fe2 ( SO4 )3 Cantidad de iodo sódico puro: http://www.matematicaaplicada.info [email protected] 4 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 200 g _ de _ NaI × 85% = 170 g _ de _ NaI _ puro 1mol _ de _ NaI 170 g _ de _ NaI × = 149.893g _ de _ NaI = 1.134mol _ de _ NaI moles _ de _ NaI = 1.134mol _ de _ NaI Con base en las proporciones molares de los reactivos en la ecuación química: COMPUESTO Fe2 ( SO4 )3 MOL DE ECUACIÓN MOL DE ENTRADA 1 0.450 2 1.134 NaI Concluyo que el RECTIVO LÍMITE es el sulfato férrico. 180 g _ de _ Fe2 ( SO4 )3 × 1mol _ de _ Fe2 ( SO4 )3 399.885 g _ de _ Fe2 ( SO4 )3 2mol _ de _ NaI 149.893g _ de _ NaI × × = 1mol _ de _ Fe2 ( SO4 )3 1mol _ de _ NaI = 134.942 g _ de _ NaI × http://www.matematicaaplicada.info [email protected] 5 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 masa _ de _ NaI = 134.942 g _ de _ NaI Exceso _ g _ de _ NaI = 170.000 − 134.942 Exceso _ g _ de _ NaI = 35.058 180 g _ de _ Fe2 ( SO4 )3 × 1mol _ de _ Fe2 ( SO4 )3 399.885 g _ de _ Fe2 ( SO4 )3 × 1mol _ de _ I 2 253.808 g _ de _ I 2 × × = 1mol _ de _ Fe2 ( SO4 )3 1mol _ de _ I 2 = 114.246 g _ de _ I 2 masa _ de _ I 2 = 114.246 g _ de _ I 2 180 g _ de _ Fe2 ( SO4 )3 × 1mol _ de _ Fe2 ( SO4 )3 399.885 g _ de _ Fe2 ( SO4 )3 2mol _ de _ FeSO4 151.910 g _ de _ FeSO4 × × = 1mol _ de _ Fe2 ( SO4 )3 1mol _ de _ FeSO4 × http://www.matematicaaplicada.info [email protected] 6 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 = 136.758 g _ de _ FeSO4 masa _ de _ FeSO4 = 136.758 g _ de _ FeSO4 180 g _ de _ Fe2 ( SO4 )3 × 1mol _ de _ Fe2 ( SO4 )3 399.885 g _ de _ Fe2 ( SO4 )3 × 1mol _ de _ Na2 SO4 142.043g _ de _ Na2 SO4 × × = 1mol _ de _ Fe2 ( SO4 )3 1mol _ de _ Na2 SO4 = 63.937 g _ de _ Na2 SO4 masa _ de _ Na2 SO4 = 63.937 g _ de _ Na2 SO4 COMPUESTO Fe2 ( SO4 )3 NaI I2 REACTIVOS PRODUCTOS 180.000 134.942 114.246 FeSO4 136.758 Na2 SO4 63.937 http://www.matematicaaplicada.info [email protected] 7 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 TOTAL 314.942 314.942 El rendimiento de la reacción es: Eficiencia _ de _ la _ reacción masa _ teórica _ de _ I 2 ×100% masa _ real _ de _ I 2 98.000 ×100% = 85.779% 114.246 Eficiencia _ de _ la _ reacción = 85.779% 2. Para transformar completamente el fósforo blanco en ácido H3PO4 utilizando ácido nítrico se debe emplear un exceso del 50% de ácido nítrico respecto de la cantidad estequiométrica ¿Qué cantidad (en kg) de ácido nítrico del 35% deberá emplearse para oxidar completamente 10kg de fósforo blanco de acuerdo con la reacción: 3P + 5HNO3 + 2 H 2O → 3H 3 PO4 + 5 NO 1mol _ de _ P 10 Kg _ de _ P × × 30.973Kg _ de _ P http://www.matematicaaplicada.info [email protected] 8 de 8 MATEMÁTICA APLICADA TECNOLOGÍA EN REGENCIA DE FARMACIA QUÍMICA GENERAL SOLUCIÓN EXAMEN DE ESTEQUIOMETRÍA, REACTIVO LÍMITE, REACTIVOS EN EXCESO, PORCENTAJE DE PUREZA Y EFICIENCIA DE LA REACCIÓN Marquetalia, 27 de Noviembre de 2011 5mol _ de _ HNO3 63.013Kg _ de _ HNO3 × × = 1mol _ de _ P 1mol _ de _ HNO3 = 33.907 Kg _ de _ HNO3 masa _ de _ HNO3 = 33.907 Kg _ de _ HNO3 Acido nítrico al 35% de pureza, conduce a que se tengan que utilizar, con base en la cantidad teórica: 33.907 Kg _ de _ HNO3 = 96.877 Kg _ de _ HNO3 0.35 Con base en que la reacción requiere de un 50% de exceso de ácido nítrico, concluyo con la cantidad exacta de éste reactivo para obtener la oxidación completa del fosforo blanco. (1.5) × 96.877 Kg _ de _ HNO3 = 145.315Kg _ de _ HNO3 masa _ de _ HNO3 = 145.315Kg _ de _ HNO3