igualacio redox
Anuncio

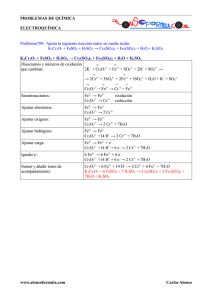
IGUALACIO REDOX Volem igualar la següent equació química redox: KMnO4 + H2SO4 + FeSO4 MnSO4 + Fe2(SO4)3 + K2SO4 Fem la dissociació de les species què són acids, bases o sals… +1 +7 -2 +1 +6-2 +2 +2 +6-2 +3 +1 K+ + MnO4- + H+ + SO42- + Fe2+ Mn2+ + SO42- + Fe3+ + K+ Mirem les species que canvien de valència +7 SEMIEQUACIÓ DE REDUCCIÓ: +2 SEMIEQUACIÓ DE OXIDACIÓ: +2 MnO4- Mn2+ Fe2+ +3 Fe3+ Igualem els oxigens i els hidrogens (recordem que estem en medi acid): 8H+ + MnO4- Mn2+ + 4H2O Fe2+ Fe3+ Igualem les càrregues elèctriques i multipliquem per un valor perquè el nombre d’electrons quedi igualat: ( 8H+ + MnO4- ---(+5e-) ( Fe2+ ---(–1e-) Mn2+ + 4H2O ) * 1 Fe3+ ) *5 5Fe2+ + 8H+ + MnO4- 5Fe3+ + Mn2+ + 4H2O Afegim els ions que falten de manera que lligui amb els compostos inicials KMnO4 + 4H2SO4 + 5FeSO4 MnSO4 + 5/2 Fe2(SO4)3 + 4H2O + (K+) + ½ (SO4)2- (això darrer és el que he afegit a l’esquerra) Per treure denominadors multipliquem l’equació anterior per 2: 2 * (KMnO4 + 4H2SO4 + 5FeSO4 MnSO4 + 5/2 Fe2(SO4)3 + 4H2O ) Ens quedarà el següent: 2 KMnO4 + 8 H2SO4 + 10 FeSO4 2 MnSO4 + 5 Fe2(SO4)3 + 8 H2O + 2(K+) + (SO4)2- (això és un mol de K2SO4) Finalment, reordem com a l’equació inicial i afegim el K2SO4 que faltava… 2KMnO4 + 8H2So4 + 10FeSO4 2MnSO4 + 5Fe2(SO4)3 + 8H2O + K2SO4