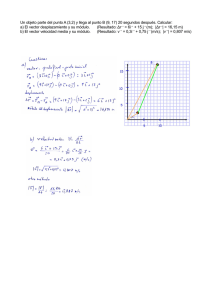
López, María Gabriela. 2010 "Complementación de baculovirus que
Anuncio

Complementación de baculovirus que no forman cuerpos de oclusión mediante líneas celulares establemente transformadas con el gen poliedrina López, María Gabriela 2010 Tesis Doctoral Facultad de Ciencias Exactas y Naturales Universidad de Buenos Aires www.digital.bl.fcen.uba.ar Contacto: [email protected] Este documento forma parte de la colección de tesis doctorales de la Biblioteca Central Dr. Luis Federico Leloir. Su utilización debe ser acompañada por la cita bibliográfica con reconocimiento de la fuente. This document is part of the doctoral theses collection of the Central Library Dr. Luis Federico Leloir. It should be used accompanied by the corresponding citation acknowledging the source. Fuente / source: Biblioteca Digital de la Facultad de Ciencias Exactas y Naturales - Universidad de Buenos Aires UNIVERSIDAD DE BUENOS AIRES Facultad de Ciencias Exactas y Naturales “Complementación de baculovirus que no forman cuerpos de oclusión mediante líneas celulares establemente transformadas con el gen poliedrina” Tesis presentada para optar al título de Doctor de la Universidad de Buenos Aires en el área: Ciencias Biológicas Lic. María Gabriela López Director: Dr. Oscar Taboga Consejero de estudio: Dr. Esteban Hopp Laboratorio de Virus Animales Instituto de Biotecnología CNIA, INTA-Castelar Buenos Aires, 2010 Complementación de baculovirus que no forman cuerpos de oclusión mediante líneas celulares establemente transformadas con el gen poliedrina Resumen Los baculovirus son un grupo diverso de virus que infectan artrópodos. AcMNPV presenta un ciclo de vida bifásico, con dos fenotipos virales: los virus brotantes y los virus derivados de los cuerpos de oclusión (ODV). Los ODV, responsables de la infección primaria, se embeben en una matriz de poliedrina, proteína que no es esencial para la propagación de los virus en cultivos celulares. Este trabajo de tesis tuvo como objetivo desarrollar una línea transformada de insecto empaquetadora de baculovirus defectivos en poliedrina, bajo la hipótesis de que es posible complementar esta deficiencia en trans desde el genoma celular. Para ello, en primer lugar, se evaluaron diferentes secuencias regulatorias del promotor del gen poliedrina controlando el gen reportero CAT, en ensayos de transfección transitoria. Luego de la infección con un baculovirus occ-, los mayores niveles de actividad reportera se obtuvieron con una región regulatoria de 2.735 pb que incluye el promotor mínimo de poliedrina y secuencias con funciones de enhancer de la transcripción en baculovirus (hr1, AcSp). Esta región fue seleccionada para regular la transcripción de poliedrina en las líneas establemente transformadas. La infección de una de estas líneas, Sf9POL, demostró que la morfogénesis de poliedros ocurre de manera similar a la de la infección natural y los baculovirus resultantes mostraron además una infectividad similar a los salvajes, en larvas de Rachiplusia nu. Las larvas infectadas oralmente mostraron sólo una progenie viral de genotipo pol- y fenotipo occ-, incapaz de propagar la infección por vías naturales. Colateralmente, se describe una mutación en la posición 130 del gen poliedrina, responsable de alteraciones en tamaño, morfología y capacidad de oclusión de poliedros. En conjunto, los resultados y conclusiones de este trabajo contribuyen al conocimiento de los mecanismos de morfogénesis de los cuerpos de oclusión en el baculovirus AcMNPV, con importantes implicancias en el diseño de baculovirus recombinantes para el control de plagas y la producción de proteínas recombinantes en larvas de lepidópteros. Palabras clave: baculovirus, poliedrina, líneas estables, complementación occ-, larvas de lepidóptero. UNIVERSIDAD DE BUENOS AIRES Facultad de Ciencias Exactas y Naturales “Complementation of baculovirus that do not form occlusion bodies by stably transformed insect cell lines with polyhedrin gene” Thesis presented to obtain the PhD degree Lic. María Gabriela López Director: Dr. Oscar Taboga Advisor: Dr. Esteban Hopp Laboratorio de Virus Animales Instituto de Biotecnología CNIA, INTA-Castelar Buenos Aires, 2010 Complementation of baculovirus that do not form occlusion bodies by stably transformed insect cell lines with polyhedrin gene Abstract Baculovirus is a diverse family of virus infecting arthropoda. AcMNPV has a bifasic life cycle, with two viral phenotypes: budded virus and occlusion-derived virus (ODV). ODVs are responsible of primary infection and occlude into a polyhedrin matrix to form polyhedra. Polyhedrin is a nonessential protein for multiplication in cell cultures. The main goal of this work was to develop a transformed insect cell line for packaging polyhedrin defective virus, hypothesizing that it is possible to complement this deletion in trans from the cellular genome. In this way, different polh gene regulatory sequences driving CAT were evaluated by reporter gene assays. After infection of transiently transformed insect cells with pol- baculovirus, the highest CAT levels were obteined when a 2,735 bp regulatory region containing the minimum polyhedrin promoter preceded by hr1 and AcSp sequences with known enhancer activities, was positioned upstream CAT gene. This region was selected to regulate the transcription of polyhedrin in stably transformed cell lines. The infection of one line named Sf9POL demonstrated that morphogenesis of polyhedra occurred in a similar way to the natural infection and that rendered baculovirus also showed similar infectivity for Rachiplusia nu larvae. Oral infection of larvae with polyhedra from infection of Sf9POL line, generated a viral progeny genotypically pol- and phenotypically occ-, unable to propagate the infection by natural means. Colaterally, a mutation in the polyhedrin gene mapped in the position 130 and responsible for alterations in size, shape and capacity for virion occlusion, is described. Together, results and conclusions presented here contribute to the knowledge of the morphogenesis of occlusion bodies in AcMNPV, with important implicances in the design of recombinant baculovirus for plague control and production of heterologous proteins in lepidoptera larvae. Keywords: baculovirus, polyhedrin, stable lines, occ-complementation, Lepidoptera larvae. “Cuando el hombre, inducido a una viva observación, comienza a mantener una lucha con la naturaleza, siente ante todo el impulso irrefrenable de someter a sí mismo los objetos. Sin embargo, muy pronto éstos se le imponen con tal fuerza que siente cuán razonable sea reconocer su poder y respetar su acción. Apenas se convenza de ese influjo recíproco, caerá en la cuenta de un doble infinito: por parte de los objetos, la multiplicidad del ser, del devenir y de las relaciones que se entrecruzan de un modo viviente; por parte de él mismo, la posibilidad de un perfeccionamiento ilimitado en la medida en que sea capaz de adaptar, tanto su sensibilidad como su juicio, a formas siempre nuevas de recepción y de reacción. Esto le proporciona un goce elevado, y decidiría la fortuna de su vida si obstáculos internos y externos no se opusiesen al bello transcurso de ella hasta su culminación”. Johann Wolfgang Von Goethe, “Teoría de la naturaleza” Mi reconocimiento a la Universidad de Buenos Aires por la completa formación que me otorgó, al Instituto Nacional de Tecnología Agropecuaria (INTA) por abrirme las puertas de su Institución y brindarme el espacio para continuar mis estudios de postgrado y al Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) por haber hecho posible la realización de este trabajo. Agradecimientos En primer lugar quiero agradecer a mi director, Oscar Taboga, por confiar en mí desde un primer momento. Por orientarme hacia la buena ciencia, por enseñarme tantas cosas no sólo de biotecnología sino de “la vida” y de la manera más divertida. Oski, gracias por todo lo que desinteresadamente me diste, por la buena onda de todos los días… realmente me siento muy orgullosa de ser parte de tu grupo de trabajo, gracias por ayudarme a llegar hasta acá!! A la directora del Instituto, Elisa Carrillo, por todo lo que me brindó siempre, desde su confianza hasta su preocupación porque nunca me falte nada y que logre mis metas de la mejor manera. Sinceramente sentir tu apoyo me hizo mucho más fuerte para recorrer este camino… Gracias por todo, Lela! A mis compañeras de laboratorio. A Victoria, mi “coequiper”, gracias por tus consejos y tus siempre acertadas sugerencias (sobre todo por el tiempo que invertiste en las últimas correcciones, tu ayuda fue invaluable!). Gracias además, Vic, por tu preocupación constante por mis cosas, tu seguridad, empeño y ese espíritu crítico del que aprendí mucho. A Pauli, por todo lo que vivimos juntas dentro de este lab, por tus consejos y tu fuerza! A Marie, la más nuevita de este grupo, por su buenísima disposición para colaborar en lo que sea, por el interés, dedicación y cariño que ponés en todo lo que hacés. Y a Andre, que me conoce desde el comienzo y fuimos mutuas testigos de un hermoso crecimiento personal! A las cuatro, mil gracias por estar siempre dispuestas a ayudarme en lo que necesitara, por aportar tanto a esta etapa de mi formación, por nuestras charlas de virología y de lo demás (aprendí mucho de maternidad, ahora sólo me falta experimentarla!), por todo lo que compartimos día a día… Es un placer realmente trabajar con uds. También quiero agradecer a Paola Chabay, una invitada de lujo! Por los días de trabajo compartidos, nuestras charlas de viajes y de cosas de mujeres, tus buenos consejos, tus riquísimos mates! Me encantó haberte conocido, Pao! Gracias a las 5, las quiero mucho, chicas! A todo el grupo Virus Animales: a mis antiguas compañeritas del lab, Silvi, Eva y Sole, extraño nuestro día a día pero se que sigo contando con uds siempre, gracias!! A Analía, Gaby, Flavia, Guido, Paula, Flor, Rubén, Bernardo, Sebastián y Juan, por el lindo grupo que formamos, por la buenísima energía que siempre siento de parte de uds, porque la pasamos bien, porque así vale la pena todo! Me siento orgullosa, además, de estar rodeada por profesionales de tal calidad académica y humana. Gracias por su apoyo, sepan que es recíproco!! A todo el Instituto de Biotecnología del INTA, porque me hacen sentir en casa! Por las buenas intensiones, los buenos deseos, la buena onda que percibo de uds. Porque además de trabajar mucho, nos divertimos! Me alegro de haberlos conocido. Gracias a todos!! A las secres que son divinas y están siempre dispuestas a ayudarnos: Perla, Sandra y Cintia, gracias! A la gente que nos ayuda día a día con el material: Isa, Vilma, Majo, Roxana, Fabián, Jorge y Haydee. Sin su ayuda todo sería más difícil, gracias por todo lo que hicieron y hacen por nosotros! A la gente del IMyZA. A María y Débora de Cría de Insectos por el mantenimiento de las larvas, fue importante contar con ellas! A Alicia Sciocco por compartir sus conocimientos conmigo y por su gestión en temas entomológicos. A Ricardo Salvador, otro tesista baculovirólogo, por tu buena onda! Y en especial agradezco a Marcelo Berretta, por invertir parte de su tiempo en explicarme la regulación génica de baculovirus, por su excelente predisposición y el aporte desinteresado a la discusión de estos temas y por generar en mí el beneficio de la duda! A las chicas del Laboratorio de Entomología del INTA Sáenz Peña, Chaco. A Marita Simonella, Mariela Fogar y Elisa por enviarme larvas y por su recibimiento tan cálido cuando viajé para allá a buscarlas. A Luis por mandarme en el día los papers que le pedía y a Ma. José Gravisaco por su colaboración con el citómetro y por venir y aportar a los seminarios, gracias!! A Blanca y Julián por su ayuda con las muestras y el microscopio electrónico. A los chicos de la cátedra de Biotecnología de la facu de Farmacia y Bioquímica. A Victoria, Lucía, Gustavo y Alexandra, compañeros del curso de baculovirus que nos ha traido tantas penas como alegrías… por la buena onda con la que siempre me trataron. Gracias! A Paola Talia del Instituto y a los doc Sergio Rodríguez Gil y Pablo Rebagliati de Exactas por la mano que me dieron en la incursión de la técnica PRINS (que a pesar de no haberla empleado, la aprendí por ellos). Gracias por el valioso tiempo que me dedicaron!! A la gente de la cátedra de Farmacología de la Facultad de Odontología. En particular a los doc Carlos Mendez y Lucila Busch por confiar en mí, por todo lo que me enseñaron de fármaco y de docencia. Realmente es un placer trabajar con uds. Y a todos mis compañeros que son buenísimos conmigo: Betina, Silvia, Sabrina, Gabriel, Florencia, Ale, Andrea, Dani, Fabi y especialmente a Alejandra Delgado y Gabriel Fiszman por las clases compartidas y por su buenísima onda, me encantó haberlos conocido! A mis amigos biólogos, Romi Petrigh, Caro Poncini, Caro Pontillo, Marce Cucher, Diego Urteaga y Diego Kormes porque siempre están presentes como colegas y amigos, adoro nuestras charlas de biología y de la vida, es esencial saber que cuento con uds en los momentos más importantes de mi vida, los quiero mucho amigos!! A Irene y Diego, por sus buenísimos viajes al INTA (me encantó ver crecer a Cata y conocer a Mateo!), porque son excelentes personas y aprendí mucho de uds, gracias por su generosidad y cariño, amigos!! También agradezco a Goyo, que nos conocemos desde la facu. Gracias por tus viajes y tu buena onda! A mis amigos de la vida: Male, Mechi, Luján, Pia, Mei, María José y Martín, Conrado,Vero, Majo, gracias por estar siempre! Comparto esto con uds! A toda mi familia. Principalmente a mi mamá y a mi papá porque entre tantas cosas, de ellos aprendí que la felicidad llega de hacer lo que a uno le apasiona y los logros, del esfuerzo diario. A mis hermanos Juan Pablo y María Martha. A los 4 por todo el amor que me brindaron siempre, la comprensión y el apoyo incondicional que me hacen sentir en todo momento, no alcanza un gracias! Les dedico lo que soy. A mis tíos y primos también les agradezco el interés y los buenos deseos que siempre me dedican, es tan importante saber que están, los quiero mucho!! Y a los Scovenna y Gallardo de Suipacha, les agradezco el inmenso cariño que me dieron siempre y por hacerme parte de su hermosa familia. Los adoro!! Y a mi amor Alexis, por TODO. Por ser mi compañero, mi inspiración. Por todo lo que compartimos! Gracias por tu paciencia, por tu contención, por tus consejos (aprendo tanto de vos!), por aguantarme… y por hacerme feliz cada día de mi vida!! Nada sería lo mismo sin vos… En fin, a toda la gente que de una u otra manera me acompañó desinteresada y amablemente en esta etapa de mi historia, tanto en lo laboral como en lo personal… Muchas gracias a todos!! Gaby Abril, 2010 Parte de los resultados de este trabajo de tesis han sido publicados en el siguiente artículo: López, M.G., Alfonso, V., Carrillo, E., Taboga, O. (2010) “Trans-complementation of polyhedrin by a stably transformed Sf9 insect cell line allows occ- baculovirus occlusion and larval per os infectivity”. Journal of Biotechnology 145:199-205. ÍNDICE Abreviaturas ............................................................................................................................ II Introducción.............................................................................................................................. 3 1. Los baculovirus: generalidades............................................................................................................................. 3 2. La oclusión, última etapa de la infección viral.................................................................................................. 14 3. Aplicaciones de los baculovirus.......................................................................................................................... 22 Objetivos................................................................................................................................. 35 Materiales y Métodos ............................................................................................................ 36 1. Virus........................................................................................................................................................................ 36 2. Células .................................................................................................................................................................... 36 3. Cepas bacterianas.................................................................................................................................................. 36 4. Metodología del ADN recombinante ................................................................................................................. 37 5. Electroforesis de proteínas en geles de poliacrilamida .................................................................................... 39 6. Identificación de proteínas mediante Western blot............................................................................................ 40 7. Obtención de los baculovirus recombinantes ................................................................................................... 41 8. Amplificación de los baculovirus recombinantes............................................................................................. 45 9. Titulación viral ...................................................................................................................................................... 46 10. Construcción de los plásmidos utilizados en transfecciones transitorias ................................................... 46 11. Expresión transitoria por las distintas regiones regulatorias de poliedrina ............................................... 51 12. Obtención de los vectores para transfecciones estables ................................................................................. 54 13. Transfecciones ..................................................................................................................................................... 56 14. Metodologías utilizadas con la línea estable que expresa poliedrina .......................................................... 58 15. Bioensayos............................................................................................................................................................ 61 Resultados............................................................................................................................... 64 CAPÍTULO I ............................................................................................................................. 65 1. Construcción de los baculovirus recombinantes utilizados en este trabajo.................................................. 65 2. Determinación de los elementos regulatorios mínimos necesarios río arriba de poliedrina: estudio de la expresión transitoria de un gen reportero ............................................................................................................. 70 3. Obtención de una línea celular Sf9 establemente transformada con el gen poliedrina............................... 78 4. Caracterización de los poliedros obtenidos de la línea Sf9POL infectada con baculovirus pol- ............... 87 5. Estudio de la infectividad de los poliedros resultantes de la línea Sf9POL infectada con baculovirus pol-92 CAPÍTULO II............................................................................................................................ 97 1. Antecedentes.......................................................................................................................................................... 97 2. Construcción de un baculovirus con poliedrina mutante en el aminoácido 44: .......................................... 99 3. Caracterización de los poliedros anormales.................................................................................................... 100 4. Infectividad de los poliedros mutantes............................................................................................................ 103 Discusión .............................................................................................................................. 106 Desarrollo de una línea celular empaquetadora de baculovirus pol-.............................................................. 106 Caracterización de una mutanción puntual en el gen poliedrina .................................................................... 113 Potenciales aplicaciones de la línea Sf9POL ........................................................................................................ 117 Conclusiones ........................................................................................................................ 120 Anexo..................................................................................................................................... 121 Bibliografía ........................................................................................................................... 124 Abreviaturas °C: grados centígrados (Celsius) aa: aminoácido/s AcMNPV: Autographa californica multiple nucleopoliedrovirus ADN: ácido desoxiribonucleico ADNc: ADN copia ARN: ácido ribonucleico ARNm: ARN mensajero BEVS: del inglés Baculovirus Expression Vector System, sistema de expresión por baculovirus BmMNPV: Bombyx mori multiple nucleopoliedrovirus BV: baculovirus brotado CAT: cloranfenicol acetil transferasa CIP: del inglés calf intestinal phosphatase, fosfatasa alcalina intestinal CPV: cipovirus cpm: cuentas por minuto DL50: dosis letal media dpi: días post infección dpt: días post transfección DTT: ditiotreitol, inhibidor de proteasas EDTA: ácido etileno diamino tetracético, quelante de iones bivalentes GFP: del inglés green fluorescent protein, proteína verde fluorescente GV: granulovirus h: horas hpi: horas post infección hrs: del inglés homologous regions, secuencias de repetición homólogas ies: del inglés immediate early factors, factores de expresión inmediata temprana kDa: kilodaltons kpb: kilo pares de bases lefs: del inglés, late expression factors, factores de expresión tardía min: minutos MNPV: múltiple nucleopoliedrovirus moi: multiplicidad de infección NC: nucleocápside nm: nanómetros NPV: nucleopoliedrovirus OB: del inglés occlusion bodies, cuerpos de oclusión occ-/+: oclusión negativo o positivo ODV: del inglés, occlusion derived virus, baculovirus derivado de oclusión ORF: del inglés open reading frame, marco abierto de lectura pb: pares de bases PCR: del inglés polimerase chain reaction, reacción en cadena de la polimerasa pif: del inglés per os infection factors, factores de infectividad por vía oral PMSF: phenyl methyl sulfonyl fluoride, inhibidor de serin-proteasas POL: poliedrina pol+/-: poliedrina positivo o negativo pol/polh: gen poliedrina POV: del inglés pre-occluded virus, baculovirus preocluido PPBP: del inglés polyhedrin promoter binding protein, proteína de unión al promotor de poliedrina pu: del inglés polyhedrin upstream, secuencia río arriba de poliedrina rpm: revoluciones por minuto s: segundos SAP: del inglés shrimp alcaline phosphatase, fosfatasa alcalina Sf9 o Sf21: Líneas celulares derivadas de Spodoptera frugiperda SFB: suero fetal bovino SNPV: simple nucleopoliedrovirus TBP: del inglés TATA binding protein U/μl: Unidades por microlitro UV: ultravioleta vlf-1: del inglés, very late factor, factor de transcripción de genes muy tardíos VLP: del inglés virus like particles, partículas semejantes a virus wt: del inglés wild type, tipo salvaje μm: micrómetros μM: micromolar Introducción Introducción Introducción 1. Los baculovirus: generalidades 1.1 Descripción y clasificación Los baculovirus son un grupo diverso de virus que infectan artrópodos, aislados de más de 600 especies de insectos del orden Lepidoptera, Hymenoptera, Diptera, Orthoptera, Coleoptera, Neuroptera, Thysanera y Trichoptera (Adams y McClintock, 1991; Herniou et al., 2003; Martignoni e Iwai, 1986; Murphy et al., 1995; Tinsley y Kelly, 1985). Los baculovirus que infectan lepidópteros son los más ampliamente descriptos. Presentan un genoma circular de ADN de doble cadena, contenido en una nucleocápside (NC) de forma de bastón. El nombre baculovirus hace referencia a la morfología de las partículas virales cuyo tamaño oscila entre los 30-60 nm de ancho por 250-360 nm de largo, dependiendo del tamaño del genoma. La familia Baculoviridae comprende este grupo de virus y a su vez se divide en dos subfamilias: Eubaculovirinae (baculovirus ocluidos) y Nudibaculovirinae (baculovirus no ocluidos). La primera subfamilia es capaz de producir estructuras cristalinas llamadas “cuerpos de oclusión” (OB, del inglés Occlusion Bodies) y a su vez se puede subclasificar en dos géneros: virus de la granulosis (GV por Granulovirus) y virus de la poliedrosis nuclear (NPV por Nucleopoliedrovirus), que se distinguen según la proteína mayoritaria que conforma los cuerpos de oclusión. Los NPV presentan OB de un tamaño aproximado entre 0,15 y 3 μm cuya proteína mayoritaria es la poliedrina y los del género GV se caracterizan por producir OB más pequeños, de geometría ovoide de entre 0,13 y 0,5 μm que normalmente contienen un solo virión y cuya proteína mayoritaria es la granulina. Recientemente se ha propuesto una nueva división para estos virus específicos de lepidópteros: Alphabaculovirus (NPV) y Betabaculovirus (GV). Esta reclasificación se asocia con el aumento de evidencia molecular a partir de la cual se infiere que estos virus pertenecen a grupos filogenéticamente distintos. Los NPV se subdividen según el número de nucleocápsides que contienen: MNPV (del inglés Multiple Nuclear Polyhedrosis Virus) para aquellos que contienen múltiples nucleocápsides empaquetadas dentro de una membrana común y SNPV (del inglés Single Nuclear Polyhedrosis Virus) si contienen una sola. 3 Introducción 1.2 Estructura La capacidad de los baculovirus de replicarse eficientemente dentro del hospedante y diseminar la infección dentro de una población de insectos se debe principalmente a la existencia de dos fenotipos de partículas infectivas dentro del ciclo de vida del virus: virus ocluidos (ODV del inglés Oclusion-Derived Virus) y virus brotantes (BV, del inglés Budded Virus) (Figura I1). Los ODV son embebidos por una matriz cuasicristalina de poliedrina y son responsables de la transmisión horizontal de la enfermedad entre los individuos susceptibles de una población así como de iniciar la infección primaria en las células epiteliales del mesenterón (Granados y Williams, 1986). Los BV son los responsables de la transmisión de la infección de una célula a la otra y de un tejido a otro dentro del insecto. Viriones brotantes (BV) Componentes comunes de los viriones Viriones derivados de cuerpos de oclusión (ODV) Estructura apical Cuerpo de oclusión (OB) ADN viral (circular superenrollado) Glicoproteina de fusión de la envoltura, gp64 cápside Estructura basal Proteína básica de unión al ADN (p6.9) Proteínas principales de la cápside (vp39, p80, p24) Proteína Terminal de la cápside (ORF 1629) Matriz de poliedrina Figura I1. Comparación entre las estructuras de los dos fenotipos virales de MNPV. A la izquierda se presenta la estructura de los viriones brotantes (BV) con su característica envoltura, en cuya parte apical se encuentra la glicoproteína mayoritaria, GP64. La parte central del esquema correlaciona los componentes estructurales de las nucleocápsides con los viriones derivados de cuerpos de oclusión (ODV). Dentro de la envoltura, de distinto origen que la envoltura de los BV y por lo tanto, de distinta composición proteica y lipídica, los ODV pueden coexistir de a grupos. Estos “paquetes” de virus son los que, embebidos en una matriz de poliedrina, conforman el cuerpo de oclusión (OB). 4 Introducción Los miembros de la familia Baculoviridae se caracterizan por poseer un genoma circular cerrado de doble cadena de ADN con tamaños que varían entre los 80 y 180 kpb, empaquetado dentro de una cápside proteica (Theilmann et al., 2005). El ADN genómico se encuentra condensado unas 100 veces por unión a la proteína del core p6.9 que neutraliza sus residuos ácidos y permite su compactación. La nucleocápside de los nucleopoliedrovirus presenta una típica forma de bastón asimétrica con una base en un extremo y un ápice en el otro (Federici, 1986; Fraser, 1986) y está compuesta mayoritariamente de la proteína VP39 (Figura I1). Asociada a la cápside también se encuentra una proteína con actividad de quinasa que cataliza la fosforilación de la proteína básica p6.9 produciendo el desempaquetamiento del ADN y su liberación en el núcleo de la célula hospedante para iniciar la replicación (Oppenheimer y Volkman, 1995). En un momento dado de la replicación, las NC adquieren una envoltura lipoproteica cuyo origen y composición de proteínas, lípidos y ácidos grasos difiere entre los fenotipos baculovirales (BV u ODV) (Braunagel et al., 2003) y les confiere selectividad de infección. Los BV adquieren la envoltura por brotación de la membrana plasmática de la célula infectada y presentan en la misma dos proteínas mayoritarias: la glicoproteína GP64 y la proteína de fusión F (Monsma, 1996; Westenberg, 2002; Westenberg, 2004; Pearson, 2001; Lung, 2002), las cuales se ubican en un extremo del virón que se denomina peplómero, que coincide con el ápice de la nucleocápside. Estas proteínas poseen N-glicosilaciones que son adquiridas en el tránsito por el retículo endoplasmático y están involucradas en la entrada del virus a una nueva célula a través de un mecanismo de endocitosis mediada por receptor (Hefferon, 1999; Blissard, 1992) (Figura I2). Los NPV se clasifican en grupo I si poseen GP64 y grupo II si carecen de un homólogo de GP64, como se observa en los GV. En ese caso, la fusión de la membrana dependiente de bajo pH durante la entrada de viral ocurre mediada por la proteína F. Mientras que la proteína GP64 es exclusiva del grupo I de NPV, existen homólogos de la proteína F de envoltura no sólo en los virus de insectos, sino también en algunos virus de vertebrados (Westenberg et al., 2004). En etapas más tardías de la infección, las nuevas NC permanecen en el núcleo celular y adquieren una membrana lipoproteica, dando lugar a los ODV. El origen de la membrana que recubre este fenotipo viral no ha sido aún bien dilucidado. Algunos autores sugieren que es sintetizada de novo (Blissard, 1996b), mientras que otros sostienen que el origen de la envoltura está asociado a la formación de microvesículas a partir de invaginaciones de la membrana nuclear interna (Slack y Arif, 2007). Se conoce que en este fenotipo baculoviral existen cinco o 5 Introducción más proteínas de envoltura, entre las que se destaca P74 y otras que son probables componentes de las mismas como los factores de infectividad por vía oral o factores pif (del inglés, per os infection factors). Más tarde en el ciclo de infección, grupos discretos de viriones dentro de una membrana común se embeben en una matriz constituida principalmente por la proteína poliedrina para dar lugar a los cuerpos de oclusión (comúnmente denominados poliedros), liberados al ambiente una vez que ocurre la lisis de la célula infectada. Los OB resultan una forma de resistencia del virus, ya que constituyen una protección mecánica de los viriones a las agresiones ambientales, que les permite sobrevivir fuera de una célula hospedadora por períodos largos hasta ser ingeridos por un insecto susceptible. 1.3 Ciclo viral Como se hizo mención anteriormente, los baculovirus presentan dos fenotipos distintivos durante su ciclo viral, los virus brotantes (BV) y los virus derivados de los cuerpos de oclusión (ODV) (Blissard y Rohrmann, 1990), por lo tanto poseen un ciclo replicativo “bifásico”. El ciclo de la infección comienza en los insectos cuando en la naturaleza las larvas ingieren los poliedros presentes en las hojas que constituyen su dieta (Figura I2). Los mismos alcanzan el intestino medio de la larva que posee un pH superior a 9.5 y la matriz de poliedrina se disuelve en este ambiente alcalino liberando los ODV. Hay trabajos que sugieren que la disolución de la matriz de los OB en el intestino podría verse facilitada por una proteasa alcalina viral denominada "enhancina" (Lepore et al., 1996) cuya acción aumenta la susceptibilidad de las larvas a las infecciones por baculovirus y disminuye su tiempo de supervivencia (Derksen y Granados, 1988). Los ODV atraviesan la membrana peritrófica, una red de proteínas y quitina secretada por las células intestinales con el fin de proteger el intestino del contacto directo con los alimentos, para luego entrar en las células epiteliales por fusión de la envoltura del virión con la membrana celular (Granados, 1978; Horton y Burand, 1993). Los ODV son capaces de infectar con mucha mayor eficiencia las células epiteliales del intestino de la larva que las de cualquier otro tipo celular del insecto. Una vez dentro de la célula, las NC son transportadas hacia el núcleo, el ADN se desnuda y se da comienzo a la transcripción y replicación. Esta se denomina infección primaria. 6 Introducción A Tomado de Kalmakoff y Ward, 2003. B Estroma Estroma Virogénico virogénico Membrana plasm ática Membrana plasmática Membrana nuclear Membrana nuclear Poro Poronuclear nuclear Envoltura Envoltura Oclusión ón Oclusión Desnuda Desnuda miento miento Los poliedros se Fusión con Fusión con las lascélulas céluas intestinales intestinales Infección Infección primaria primaria liberan al ambiente por Los poliedros se liberan al lisis celular y muerte ambiente por lisis celular y muerte del hospedador del insecto Endocitosis Endocitosis Infección Infección secundaria secundaria brotación brotación Ingesta por el el Ingesta por hospedador hospedador Virus VirusBrotante Brotante (BV) (BV) Tomado de Lars Keld Nielsen, Universidad de Queensland, Australia. Solubilizaci ón de de Solubilización los poliedros en el los poliedros en el intestino intestino Virus Derivados de Virus Derivados de Cuerpos Oclusión Cuerpos dede Oclusi ón (ODV) (ODV) Figura I2. Ciclo infectivo de MNPV. A) Esquema que ilustra la infección primaria de los ODV en el intestino de las larvas hospedadoras. B) Esquema que ilustra los principales eventos del ciclo de los nucleopoliedrovirus en células de insecto tanto en la etapa de infección primaria, como en la etapa de infección secundaria. 7 Introducción Posteriormente se producen viriones de fenotipo brotante que salen de la célula para infectar nuevas células e iniciar lo que se denomina infección secundaria. Estos BV entran a la célula hospedadora mayoritariamente por endocitosis, probablemente mediada por interacción de GP64 con un receptor aún no identificado (Volkman y Goldsmith, 1985; Wickham et al., 1990; Wickham et al., 1992). En el citoplasma, el endosoma se acidifica provocando la liberación de las nucleocápsides por fusión de membranas. Las NC migran entonces al núcleo donde ocurre la transcripción y el ADN es replicado y ensamblado en nuevas NC. En una etapa más tardía de la infección, las NC salen del núcleo y se dirigen a la membrana plasmática de la cual brotan al igual que en la infección primaria. En una etapa muy tardía de la infección, las NC adquieren su envoltura en el núcleo y se convierten en ODV. Los ODV se ocluyen en una matriz paracristalina de poliedrina para formar los OB maduros, que son liberados por lisis celular quedando disponibles para iniciar un nuevo ciclo de infección. En la figura I3 se ilustran las distintas etapas que sufren las células del insecto luego de la de la infección por NPV. Figura I3. Evolución de la infección por NPV en células de insecto. Las NC son inicialmente traslocadas a la membrana celular para la producción de BV y en una etapa más tardía de la infección son retenidas en la zona nuclear en anillo (nuclear ring zone) para la producción de ODV. MNI significa membrana nuclear interna, la que provee de envoltura a los ODV. Modificado de Slack y Arif, 2007 1.4 Regulación de la transcripción Los baculovirus han sido extensamente estudiados a nivel molecular, en particular el virus de la poliedrosis nuclear de Autographa californica (AcMNPV). El mismo ha sido tomado como modelo 8 Introducción para el estudio de la transcripción, ya que su genoma de 134 kpb con sus aproximadamente 150 genes ha sido totalmente mapeado y secuenciado (Ayres, 1994). La expresión de los genes baculovirales ocurre de manera secuencial. Sus genes son expresados en forma de cascada en la que se distinguen tres fases principales: fase temprana (early) que es anterior a la replicación del ADN viral, fase tardía (late) y fase muy tardía (very late) (Lu y Miller, 1995) (Tabla I1). Cada fase requiere de la transcripción de genes de las fases anteriores (Hasnain et al., 1997). A continuación se describen brevemente las tres fases a fin de distinguir los procesos que transcurren en cada una. Fase temprana El ADN viral entra en el núcleo de la célula hospedadora y comienza la transcripción de los genes reconocidos por la ARN polimerasa II de la célula hospedadora. La expresión de los genes virales tempranos ocurre en un periodo que abarca desde las 0 a las 6 horas post infección (hpi). Dos tipos de genes son transcriptos en forma temprana: los denominados genes inmediatamente tempranos (ie, de inglés immediate early), que no requieren de la síntesis de novo de otros factores virales para su transcripción (como ie-0, ie-1, ie-2, pe38) ni utilizan elementos enhancers de la transcripción y los genes llamados tempranos retrasados (delayed-early), que están involucrados en la replicación del virus y la manipulación de funciones celulares del hospedador y requieren la síntesis de factores virales como el IE-1, que unidos a enhancers llevan la transcripción al nivel requerido para el progreso de la infección (Guarino y Smith, 1992; Guarino y Dong, 1991; Pullen y Friesen, 1995). Estudios llevados a cabo por Guarino y Summers (1986) demostraron la inducción mediada por IE-1 en ensayos de expresión transitoria del gen 39K. La proteína IE-1 sintetizada inicialmente forma dímeros en el citosol y es transportada al núcleo, donde se une a palíndromes de 28 pb presentes en regiones específicas del genoma, denominadas secuencias homólogas (hrs, del inglés homologous regions) (Olson et al., 2002). La interacción del dímero de IE-1 con las hrs recluta factores de transcripción celulares, actuando así como un enhancer transcripcional de genes tempranos en cis. Por lo tanto, IE-1 se ve involucrada tanto en la replicación viral (es un componente necesario en el complejo de replicación del ADN) (Kool et al., 1994a), como en la regulación de la transcripción de genes tempranos. Otros productos de la fase temprana como IE-0, IE-2 y PE38/PE34 también regulan la transcripción por transactivación. 9 Introducción Fases Temprana (early) Tardía (late) Muy tardía (very late) Tiempo 0 h a 6-8h 6-8 h a 18-24 h 18-24 h a 76 h Transcripción mediada por: ARN polimerasa II celular Promotores utilizados TATA (A/G/T)TAAG (A/G/T)TAAG Secuencia de inicio de la transcripción CA(C/G/T)T Primera A de la secuencia TAAG Primera A de la secuencia TAAG Motivos de unión a proteínas involucradas en la transcripción (T/A)GATA(A/G)CACGTG ie-0, ie-1, eap-1, iap-2, me53, dna-pol, dna-hel, lef-10, lef-1 (primasa), lef2, lef-3, lef-4, lef-8, lef-9, p47, vlf-1, p6.9, vp39, gp64, 39K, p74, ubi, pp78/83, etc. p10, polh, vp39, vchi, ubi, p74, gp41, odv-e66, odv-ec27, odv-e56, etc. ARN polimerasa viral Replicación del ADN Genes transcriptos ie-0, ie-1, ie-2, pe38, me53, dna-pol, dna-hel, etl (pcna)p47, lef-1, lef-3, lef-5, lef-6, lef-7, lef-8, iap-1, iap2, p35, gp64, egt, etc. Producción de BV Producción de OB Tabla I1. Etapas en la infección con NPV. La expresión de genes baculovirales se divide en tres etapas: temprana, tardía y muy tardía. La transcripción de genes tempranos depende de la ARN polimerasa celular. La replicación del ADN es un prerrequisito para la expresión de genes tardíos y muy tardíos, los cuales se transcriben utilizando la ARN polimerasa viral. La mayoría de los promotores de genes tempranos poseen una caja TATA seguida de un motivo CABT [CA(C/G/T)T] a 20-40 nt río abajo que corresponde al inicio de la transcripción. La proteína TBP (del inglés TATA Binding Protein) se une a la secuencia TATA y se reclutan factores transcripcionales; se cree que la secuencia CABT influye en la afinidad por el factor de transcripción TFIID (Blissard, 1996). En cuanto a los cambios sufridos por la célula como consecuencia de la infección, se puede considerar la acción de los factores de síntesis temprana que al bloquear la continuidad del ciclo 10 Introducción celular dejan las células infectadas detenidas en fase S y G2/M (Braunagel et al., 1998; Ikeda y Kobayashi, 1999). La estructura del citoesqueleto se reacomoda drásticamente como consecuencia de la expresión de otros genes tempranos. Los filamentos de actina y los microtúbulos son redistribuidos ocasionando la hipertrofia del núcleo y el cambio de morfología celular (Charlton y Volkman, 1991). Por otro lado, la inhibición de la apoptosis es requerida para una eficiente replicación y expresión génica, para lo cual el virus cuenta con el producto del gen p53 que es un inhibidor de caspasas. Fase tardía Replicación La etapa tardía de la infección transcurre entre las horas 6 y 12 post infección hasta la hora 18 aproximadamente. Comienza con la replicación del ADN viral, que resulta esencial para la transcripción de genes tardíos. Para este proceso, el virus cuenta con los productos de los genes tempranos. La evidencia actual sugiere que la replicación del genoma de AcMNPV requiere de elementos que actúan en cis y en trans. La existencia de orígenes de replicación (oris) requeridos en cis ha sido comprobada por análisis de genomas defectivos obtenidos luego de varios pasajes virales en cultivo de células de insecto (Kool et al., 1994b; Lee y Krell, 1994). La actividad ori se encontró asociada con las regiones homólogas (hrs) (Cochran y Faulkner, 1983). AcMNPV contiene ocho hrs: hr1, hr1a, hr2, hr3, hr4a, hr4b, hr4c y hr5 (Figura I4). Estas regiones contienen secuencias palindrómicas interespaciadas con repeticiones directas cortas y se encuentran dispersas a lo largo del genoma de baculovirus cumpliendo el rol de enhancers transcripcionales (Friesen, 1997). Además de los oris del tipo hr se han identificado otros orígenes de replicación no-hr mediante ensayos de replicación transitoria en AcMNPV (Kool et al., 1994b). Estos ori no-hr consisten en secuencias que carecen de las estructuras palindrómicas y repeticiones propias de los hrs, aunque poseen estructuras básicas que se encuentran en el contexto de los orígenes de replicación eucariotas, tales como múltiples repeticiones invertidas y directas, palíndromes y estructuras ricas en AT. La estructura secundaria de éstos es quizás más importante que la secuencia en sí misma para la función de origen de replicación. En ensayos previos fue posible lograr la replicación de un plásmido de origen bacteriano sin inserciones genómicas baculovirales en células de insecto al ser cotransfectado con ADN viral (Guarino y Summers, 1988; Wu et al., 1999). Estos grupos demostraron que la replicación del 11 Introducción plásmido era independiente de la existencia de elementos en cis, pero que se iniciaba por la maquinaria de replicación viral como concatémeros o integrados al genoma viral. Estos datos sugieren un mecanismo de replicación del ADN del tipo círculo rodante. Aún se desconoce el rol individual de los ocho orígenes identificados en AcMNPV en la replicación y si son activos simultáneamente. Los elementos requeridos en trans para la replicación incluyen algunos lefs (del inglés late expression factors), la ADN polimerasa viral (dnapol) y la helicasa p143. En AcMNPV se han identificado cinco genes esenciales (p143, ie-1, lef-1, lef-2, lef-3) y cinco genes estimulantes de la replicación (dnapol, p35, ie-2, lef-7 y pe38) (Crouch y Passarelli, 2002). Figura I4. Localización de los genes involucrados en la replicación y las regiones homólogas (hrs) en el genoma de AcMNPV. Los números indican la cantidad de repeticiones en cada hr. Las flechas grandes y pequeñas indican la orientación relativa de los genes y hrs, respectivamente. Tomado de Kool et al., 1995 Transcripción La expresión de genes tardíos, la producción de proteínas estructurales y la formación de BV ocurre ente las 8 y 24 hpi. Los factores esenciales para la transcripción de genes tardíos son diecinueve (Rapp et al., 1998) e incluyen los llamados lefs, cuatro de los cuales (lef-4, lef-8, lef-9 y p47) codifican para una ARN polimerasa resistente a α-amanitina (Grula et al., 1981; Guarino et al., 1998). Esta enzima es esencial para la transcripción de genes tardíos y muy tardíos y reconoce secuencias promotoras con el consenso (A/T/G)TAAG. La fuerza de la expresión a partir de los promotores tardíos depende del contexto de esta secuencia TAAG. Generalmente, en estos casos la transcripción se inicia en la primera A de la secuencia consenso. 12 Introducción En el transcurso de la fase tardía de la infección se forma en el núcleo una zona denominada estroma virogénico (Harrap, 1972) donde las nucleocápsides se ensamblan (Bassemir et al., 1983). Fase muy tardía La expresión de genes muy tardíos transcurre entre las 18 y 76 hpi aproximadamente y se caracteriza por un marcado incremento en la transcripción de los genes denominados muy tardíos: p6.9, pol y p10 (Lu y Miller, 1995). Estos genes son transcriptos por la ARN polimerasa viral a partir de promotores muy tardíos. En estos promotores, a diferencia de los tardíos, el nivel de expresión no depende del contexto inmediato en el que se encuentra la secuencia TAAG sino de una secuencia denominada burst sequence, una región rica en A+T de la secuencia 5´ no codificante de sus ARNm. Esta región se localiza entre el sitio de inicio de la transcripción y el codón de inicio de la traducción. Se ha observado que mutaciones en la burst sequence reducen la expresión durante la etapa muy tardía de la infección unas 10 a 20 veces y más, tanto los niveles basales de ARNm de poliedrina como la tasa de inicio de la transcripción a partir de su promotor (Ooi et al., 1989). En contraste, mutaciones en la secuencia río arriba del motivo TAAG del promotor de poliedrina tienen efectos menos drásticos en la regulación del gen pol (Weyer y Posse, 1989). Esta secuencia burst interactúa con proteínas celulares que resultan imprescindibles para alcanzar los altos niveles de expresión de genes como pol y p10 en NPV, y otros genes que codifican proteínas necesarias para la formación de los cuerpos de oclusión. El gen vlf-1 (del inglés very late factor) de AcMNPV cumple un rol importante en la expresión muy tardía a partir de los promotores pol y p10. La presencia de vlf-1 en ensayos de expresión transitoria estimula la transcripción mediada por promotores muy tardíos, no así la mediada por promotores tardíos (Todd et al., 1996). Se observó posteriormente que el factor VLF-1 se une directamente a las regiones no codificantes de los promotores pol y p10, provocando de manera directa su transactivación (Yang y Miller, 1999). Los OB se acumulan en el núcleo formando una zona en anillo (ring zone) entre el estroma virogénico y la membrana nuclear y eventualmente pueden llenar todo el núcleo. La lisis celular ocurre entre las 60 y 72 hpi. Como consecuencia de la infección, las células dejan de sintetizar proteínas y entran en apoptosis. La figura I5 es un esquema simplificado de las distintas etapas que sufre el ADN baculoviral dentro de la célula en el transcurso de la infección, en el modelo AcMNPV. 13 Introducción ADN primasa (LEF-1/LEF-2) ADN ligasa (hospedador?) ADN polimerasa ARN polimerasa celular Cebador de ARN Fragmento de Okazaki IE1 + enhancers Topoisomerasa (hospedador?) ADN polmerasa Genes tempranos helicasa Proteína de unión al ADNsc (LEF-3) Modificado de Rohrmann, 2008 Genoma viral Replicación del ADN Lefs virales RNA polimerasa viral + VLF-1 Viriones ocluidos Genes muy tardíos RNA pol viral Genes tardíos viriones ARN polimerasa viral Modificado de Rohrmann, 2008. Proteína de unión a hr1 Otros factores celulares Factores Promotor POL celulares tipo Sp VLF-1 Regulación transcripcional de poliedrina Modificado de Ramachandran et al., 2001 Figura I5. Esquema simplificado de la cascada de transcripción de los genes de AcMNPV. Dentro de la ilustración del ciclo del ADN baculoviral se detalla el proceso de replicación a partir de la enzima ADN polimerasa viral y factores de la célula hospedadora y la regulación transcripcional de poliedrina como modelo de gen muy tardío. 2. La oclusión, última etapa de la infección viral En una etapa muy tardía de la infección, la mayoría de las nucleocápsides que se ensamblan son destinadas a permanecer en el núcleo para su posterior envoltura y oclusión. La producción de cuerpos de oclusión depende del tipo celular. Para algunos virus, las células intestinales no permiten la formación de poliedros. Sin embargo, para otros virus la oclusión ocurre en esas células, exclusivamente. La razón de esto no se conoce aún. En las infecciones por nucleopoliedrovirus, los viriones que permanecen en el núcleo adquieren su membrana a partir de la membrana interna nuclear a la cual modifican ciertas proteínas específicas del fenotipo ODV, codificadas por el genoma viral (Braunagel y Summers, 2007). 14 Introducción La última etapa de la replicación viral tiene lugar luego de que la mayor parte del ADN ha sido replicado y ocurre una hiperexpresión de los genes muy tardíos aumentando dramáticamente los niveles de las proteínas poliedrina y P10. Poliedrina se acumula en el núcleo y en un momento cristaliza en una estructura que envuelve los viriones. No queda claro si la oclusión viral resulta un evento dependiente de la concentración, es al azar, o si los viriones sirven para enuclear la formación de cuerpos de oclusión. Se demostró que al menos una proteína (Ac68) está involucrada en este proceso porque cuando se eliminó su ortólogo de BmMNPV (Bm56), los viriones producidos no se incorporaron dentro de los poliedros (Xu et al., 2008). La proteína P10 forma estructuras tubulares que penetran tanto en el núcleo como en el citoplasma (Patmanidi et al., 2003; Carpentier et al., 2008). Cuando los cuerpos de oclusión maduran, las fibrillas de P10 se alinean en la superficie de los poliedros y se cree que están íntimamente asociados al ensamblado de la envoltura de los mismos, otorgándole una superficie de aspecto más plano y parejo. 2.1 Evolución de los cuerpos de oclusión Ya se mencionó el origen de los poliedros como forma de resistencia de los baculovirus. Estas estructuras otorgan protección mecánica y físico-química a los viriones mientras éstos se encuentran en un ambiente desfavorable fuera del insecto. De hecho, las poblaciones de insectos no tienen una estructura constante en el tiempo sino que se expanden y colapsan durante los períodos cálidos y húmedos y los períodos fríos y secos, respectivamente. Esto se relaciona con la disponibilidad de fuentes de alimento, presencia de predadores y ciclos de temperaturas óptimas para la reproducción. Además de los cambios estacionales, bajo ciertas circunstancias en las que se produce una combinación óptima de condiciones, las poblaciones de insectos pueden expandirse dramáticamente. Estos períodos de expansión pueden estar separados por largos períodos, a veces muchos años. Una implicancia trascendente de esta naturaleza cíclica de las poblaciones de insectos es que los patógenos se quedan sin sus hospedadores de manera estacional o por períodos aún mayores. Para esto, distintos patógenos desarrollaron diferentes estrategias de supervivencia, como permanecer en pupas, huevos o en hospedadores alternativos. Aunque existe alguna evidencia de persistencia dentro de sus hospedadores, algunos virus han desarrollado los cuerpos de oclusión como una estrategia de sobrevida fuera 15 Introducción de su hospedador. Dentro de estas estructuras cristalinas proteicas, lo virus son protegidos de las adversidades del ambiente, principalmente del calor y la desecación, por muy largos períodos. Esta estrategia puede ser tan ventajosa que ha sido incorporada en los ciclos de vida de tres diferentes tipos de virus de insectos: en los reovirus (cipovirus, virus de ARN de doble hebra con genomas segmentados), en los poxvirus (entomopoxvirus, virus de ADN de doble hebra con replicación citoplasmática) y en los baculovirus. Se sugiere, por lo tanto, que la existencia de dos fases dentro del ciclo de vida de los baculovirus refiere a una coevolución con su hospedador. 2.2 Componentes de los cuerpos de oclusión Además de los viriones que contienen, los cuerpos de oclusión se componen de una matriz y una estructura en su superficie. Otras proteínas también se asocian con los poliedros, detalladas en la tabla I2. ORF/Proteína Ac8 Poliedrina Ac131 Envoltura/Cálix Enhancina Ac137 p10 Proteasas alcalinas Distribución en NPV Efecto de la deleción Todos Todos excepto CuniNPV Algunos Todos Contaminantes, no baculovirales Viable Viable Viable Viable Tabla I2. Proteínas asociadas a los cuerpos de oclusión de baculovirus. Las proteínas se listan con su número de marco abierto de lectura, su distribución y los efectos observados de su deleción. POLIEDRINA Es la proteína mayoritaria de los cuerpos de oclusión de los NPV. En AcMNPV posee 246 aa y un peso molecular aproximado de 29 kDa. Es una de las proteínas más conservadas de los baculovirus. El ensamblaje de poliedrina resulta en la formación de estructuras supramoleculares cúbicas que empaquetan viriones en una etapa tardía de la infección. El gen pol no es esencial cuando los baculovirus se replican en cultivo celular, pero son de importancia 16 Introducción vital en infecciones naturales a campo. La cubierta de poliedrina asegura la persistencia del material genético, protegiendo al virión de la desecación y de los rayos UV. CÁLIX El OB está rodeado por una cubierta externa llamada Cálix o envoltura del poliedro (PE, del inglés polyhedron envelope) formada principalmente por carbohidratos asociados a una proteína de 34 kDa producto del ORF 131. Esta proteína le confiere a la matriz de poliedrina cobertura y rigidez, otorgando al poliedro una mayor estabilidad. En el laboratorio, cuando los poliedros se someten a tratamiento alcalino, la estructura cristalina se disuelve, pero la envoltura persiste como una bolsa en la cual los viriones quedan atrapados. La proteína PE se asocia con las estructuras fibrilares formadas por P10. P10 La proteína P10 no es la proteína mayoritaria de los cuerpos de oclusión, pero se sabe que se requiere para el correcto ensamblado de la envoltura del poliedro. Los poliedros de virus que no poseen el gen PE poseen una apariencia similar a los poliedros de virus que no poseen el gen p10: ambos presentan una superficie rugosa o interrumpida y la envoltura del poliedro parece estar fragmentada o no existir (Williams et al., 1989). ENHANCINAS Las enhancinas son una clase de metaloproteinasas codificadas por ciertos NPV de lepidópteros, como LdNPV, CfNPV, MacoNPV y algunos GVs como AgGV, AsGV, etc. En un estudio sobre el virus LdMNPV se encontró asociación de las enhancinas con las envolturas de ODV. Se cree que estas proteínas facilitan la infección al degradar la mucina de la membrana peritrófica permitiendo así el acceso de los viriones a las células intestinales (Wang y Granados, 1997). PROTEASAS Se hallaron proteasas asociadas a los OB, pero que poseían propiedades similares a las del intestino medio de las larvas. Por otro lado, los poliedros aislados de cultivos celulares carecían de estas proteasas asociadas (McCarthy et al., 1979). A pesar de que muchos baculovirus codifican para una proteasa de la familia de las catepsinas (Ac127), ésta es más activa bajo 17 Introducción condiciones ácidas (pH 5) (Slack et al., 1995). Por lo tanto, las proteasas asociadas a OB probablemente son una combinación de enzimas derivadas de bacterias, intestinos de insectos y el virus. 2.3 Morfogénesis de poliedros en AcMNPV Sobre la estructura de poliedrina y el ensamblaje en poliedros Como ya se mencionó, dos familias de virus no emparentadas producen poliedros en su ciclo de multiplicación. Los cipovirus (CPV), cuyos poliedros a menudo presentan miles de viriones icosaédricos en su interior (Yu et al., 2008) y los baculovirus. Estos últimos producen poliedros que contienen menos cantidad de partículas virales y que se envuelven en una capa de proteoglicanos (cálix), ausente en los poliedros de cipovirus. A pesar de las diferencias en tamaño y forma de los OB y de los diferentes tipos de virión que contienen, se ha observado que la simetría de los cristales formados por ambos grupos es muy similar. Las proteínas poliedrina de baculovirus contienen entre 243 y 249 aa y están conservadas en alrededor de un 50 % entre α- y β-baculovirus, mientras que las proteínas poliedrina de cipovirus contienen entre 247 y 252 aa y existe una identidad de alrededor de un 20 % entre clados. No se han hallado altos grados de similitud entre las secuencias aminoacídicas de las proteínas de los cuerpos de oclusión de estos dos grupos de virus. Sin embargo, cuando se analizó la estructura de los poliedros de cipovirus y de AcMNPV por difracción de rayos X, éstos presentaron parámetros tan similares que sugieren una evolución conjunta de ambas proteínas (Anduleit et al., 2005). El advenimiento de nuevas técnicas cristalográficas, como la cristalografía de proteínas por microdifracción (Riekel et al., 2005), permitió la resolución de la estructura cristalográfica de los poliedros del cipovirus del gusano de seda, dando los primeros detalles de la organización de esos cristales. La estructura reveló un intrincado arreglo de trímeros de poliedrina entrelazados con α-hélices N-terminales. Esta estructura explicaría la notable estabilidad de los poliedros (Coulibaly et al., 2007). Posteriormente, se utilizaron métodos similares para determinar la estructura cristalográfica de los poliedros producidos por AcMNPV (Coulibaly et al., 2009). A pesar de que no se ha podido brindar evidencia concluyente sobre las relaciones evolutivas entre los poliedros de CPV y NPV, la estructura de la poliedrina de AcMNPV explica varios aspectos 18 Introducción funcionales, incluyendo el desensamblado dependiente del pH y la adaptación de los baculovirus a sobrevivir dentro de un poliedro. Las últimas investigaciones describen que las moléculas individuales de poliedrina se pliegan en un dominio β-sandwich con una proyección de 52 aa hacia el extremo N-terminal y una proyección más corta de 10 aa hacia el extremo C-terminal. El dominio interno fue descrito como un dominio “jelly-roll” clásico. Los residuos N-terminales 10 a 52 forman una horquilla β seguida de una larga hélice curva (H1/2) que se extiende hacia el exterior del cuerpo principal de la molécula y perpendicular al sandwich central (Figura I6). Tomado de Caulibaly et al., 2009. Figura I6. Estructura de la poliedrina de NPV. A) y B) Estructura terciaria de la molécula de poliedrina. La cadena polipeptídica está coloreada en un gradiente de azul a rojo desde su extremo Nterminal a extremo C-terminal. C) y D) Trímeros de poliedrina. Vistas ortogonales. 19 Introducción En los poliedros, cuatro trímeros idénticos se asocian íntimamente en un grupo de geometría tetraédrica. En la periferia este ensamblaje se mantiene por dos loops que se extienden del sandwich central. El área de contacto es pequeña pero involucra uniones fuertes, como puentes disulfuro (Cys131-Cys131). En el centro del grupo tetraédrico, las proyecciones de los extremos Nterminales fortalecen el ensamblaje en un dominio de intercambio en el que las hélices H1/2 de los trímeros interacciona entre sí. La figura I7 muestra un esquema de ese ensamblaje que conforma la unidad con la que se construyen los poliedros. Tomado de Caulibaly et al., 2009. Figura I7. Grupos tetraédricos que conforman los poliedros de NPV. A) Con diferentes colores se representan los cuatro trímeros que conforman el grupo tetraédrico. B) Vista detallada del área de contacto entre los trímeros de poliedrina, donde se destacan las uniones entre residuos (recuadrado). C) Detalle de las interacciones entre los cuatro trímeros, mediadas por el dominio de intercambio de los extremos N-terminales de tres trímeros (rojo, amarillo y verde) con los dominios centrales tipo “jellyroll” del cuarto trímero (azul). Importancia de la secuencia aminoacídica de poliedrina en la morfogénesis de los poliedros No existe en la bibliografía información suficiente y completa acerca de los eventos que desencadenan la morfogénesis de poliedros en una etapa tardía de la infección con baculovirus. Se conoce que la formación de poliedros depende de la interacción entre poliedrina y otras 20 Introducción proteínas presentes en la envoltura del virión (Woo et al., 1998). Sin embargo, la morfología de los poliedros depende no sólo de las interacciones entre poliedrina y otras proteínas virales o de la célula hospedadora, sino de su propia secuencia aminoacídica (Carstens et al., 1992; Cheng et al., 1998; Hu et al., 1998). El grupo de Ji en el año 2010 explicó, a partir de esquemas basados en la estructura cristalográfica de poliedrina, cómo ocurre el ensamblaje de las unidades que conforman los poliedros de AcMNPV (Ji et al., 2010). Ellos postularon que los cambios puntuales en la secuencia aminoacídica de poliedrina pueden dar origen a virus mutantes que generan poliedros de morfología distinta de los baculovirus salvajes. Se propuso un dominio requerido para el ensamblaje supramolecular de los poliedros para poliedrina de AcMNPV (Jarvis et al., 1991) que corresponde a la región entre los aminoácidos 19 y 110. Se han estudiado mutaciones dentro de esa región que provocaban cambios en la morfogénesis de poliedros así como también efectos en la oclusión de los baculovirus. Se han hallado y caracterizado mutantes de AcMNPV, la mayoría de las cuales contienen mutaciones puntuales en el gen poliedrina que provoca un fenotipo de poliedros alterado (Carstens et al., 1992; Lin et al., 2000; Ribeiro et al., 2008). La tabla I3 muestra la posición de distintos cambios aminoacídicos en la proteína poliedrina, en mutantes tanto de baculovirus AcMNPV como de BmMNPV (Ribeiro et al., 2008). Las diferentes mutantes puntuales en el gen poliedrina dan por resultado dos fenotipos definidos en la bibliografía como: occ- cuando se observa una masa proteica dispersa que no ocluye baculovirus en lugar de la formación de poliedros u occ+ cuando se observa la formación de grandes estructuras cristalinas de forma cúbica que ocluyen deficientemente. Hasta el año 2008 en el modelo de AcMNPV se han caracterizado 5 mutaciones puntuales en el gen poliedrina. El fenotipo occ- fue la consecuencia de mutaciones en la región carboxi terminal. Cambios aminoacídicos en la posición 85 (Carstens et al., 1987), 118 (Ribeiro et al., 2008) y 183 (Carstens et al., 1992) producen la acumulación de abundantes cantidades de partículas conformadas por poliedrina en el interior del núcleo de la célula infectada y ausencia de formación de estructuras poliédricas. Sin embargo, las dos mutaciones puntuales halladas hacia el extremo amino terminal correspondientes a cambios aminoacídicos en las posiciones 25 (Lin et al., 2000) y 59 (Carstens et al., 1986) mostraron un fenotipo mutante caracterizado por la presencia de poliedros anormalmente grandes, conformados por poliedrina que se ha ensamblado de manera anormal. El hallazgo de estas mutantes y su descripción permitieron 21 Introducción inferir que la estructura molecular de poliedrina juega un rol esencial en la correcta morfogénesis de poliedros y la oclusión de baculovirus infectivos. Nombre del mutante/ virus parental Posición aminoacídica (wt/mut) Oclusión AcMNPVTkmt513/AcNPV 25 (Gly/Asp) Occ+ M5/AcNPV 59 (Pro/Leu) Occ+ # 220/BmNPV 58 (Asp/Asn), 222 (Ile/Thr) Occ+ M29/AcNPV 85 (Leu/Pro) Occ- Masa proteica dispersa Carstens et al. (1987) vSynlitx1B12P/AcNPV 118 (Val/Phe) Occ- Masa proteica dispersa Ribeiro et al. (2008) # 136/BmNPV 141 (Leu/Phe) Occ- Masa proteica dispersa Katsuma et al. (1999) # 211/BmNPV 144 (Glu/Leu) Occ+ # 128/BmNPV 171 (Leu/Pro) Occ+ # 126/BmNPV 178 (Cys/Tyr) Occ- Formas irregulares o pequeños Similar a wt con poca o nula oclusión viral Masa proteica dispersa M934/AcNPV 183 (Leu/Phe) Occ- Masa proteica dispersa Morfología de poliedros Grandes y cúbicos con poca o nula oclusión viral. Grandes y cúbicos con poca o nula oclusión viral. Grandes y cúbicos con poca o nula oclusión viral. Referencia Lin et al. (2000) Carstens et al. (1986) Katsuma et al. (1999) Katsuma et al. (1999) Katsuma et al. (1999) Katsuma et al. (1999) Carstens et al. (1992) Tabla I3. Lista de los baculovirus mutantes en poliedrina descriptos hasta el momento. Las mutaciones en la secuencia aminoacídica de poliedrina de AcMNPV y BmMNPV se listan detallando el cambio de aminoácido y su sitio, así como también los cambios fenotípicos que generan. 3. Aplicaciones de los baculovirus Tanto las propiedades físicas como la biología molecular de los baculovirus han permitido su utilización en múltiples aplicaciones. En los últimos veinte años, el sistema de expresión por baculvirus se convirtió en uno de los sistemas más utilizados en la producción de proteínas recombinantes (Possee, 1997). Numerosas innovaciones tecnológicas se llevaron a cabo para mejorar el sistema y hoy en día resulta el de elección por su practicidad y rapidez, así como por su bioseguridad y posibilidad de un fácil escalado de la proteína de interés (Kost et al., 2005). Sin embargo, las aplicaciones biotecnológicas del sistema baculovirus-células de insecto van más allá de la producción de proteínas heterólogas funcionales de distintos orígenes en células de insecto en cultivo. Se trata 22 Introducción de un sistema muy versátil cuyas múltiples funciones están siendo a su vez optimizadas. Hoy en día este sistema se utiliza con éxito en la generación de partículas semejantes a virus (VLP del inglés virus like particles) para el estudio de los procesos de ensamblado viral en ausencia de virus infectivo o para la producción de inmunógenos y proteínas diagnósticas, e incluso para transferencia de genes (Maranga et al., 2002; Petry et al., 2003). Por otro lado se desarrollaron estrategias para la inclusión de péptidos heterólogos y proteínas en la envoltura de los baculovirus, mediante fusión a la glicoproteína de superficie GP64 (Boublik et al., 1995; OkerBlom et al., 2003; Peralta et al., 2007). Por lo general, el vector se diseña de tal manera de poseer tanto la copia salvaje de gp64 como la fusionada a la proteína heteróloga. Estos baculovirus resultan muy efectivos como inmunógenos. Como ya se mencionó, los baculovirus no son capaces de infectar células de mamífero pero sí logran transducirlas (Hofmann et al., 1995) y esta propiedad fue aprovechada en el desarrollo de tecnologías como el delivery de genes mediado por baculovirus (Kost y Condrey, 2002). El uso de baculovirus recombinantes que contienen cassettes de expresión en células de mamífero fue primero ensayado en células hepáticas. El sistema se denominó BacMam® y se encuentra actualmente en auge ya que la innovación permitió avances en los campos de la genómica, desarrollo de nuevos fármacos y terapia génica. En los últimos años se ha demostrado que los baculovirus poseen propiedades adyuvantes en el sistema inmune de los mamíferos, mediadas por la activación de la respuesta innata (Abe et al., 2005). Este descubrimiento contribuye al empleo de los baculovirus como una excelente plataforma para el desarrollo de vacunas. 3.1 El uso de los baculovirus como sistema de expresión 3.1.1 El sistema baculovirus-célula de insecto Probablemente la expresión de proteínas a partir de baculovirus recombinantes sea la aplicación más conocida y más utilizada de los baculovirus. Las características de los genes muy tardíos tales como sus altos niveles de expresión y su carácter no esencial han permitido el desarrollo de vectores de expresión de proteínas en sistemas eucariotas. El sistema de expresión de proteínas más utilizado en células de insecto infectadas con baculovirus está basado en el reemplazo del gen poliedrina en el genoma de baculovirus por un gen heterólogo mediante recombinación 23 Introducción homóloga. Este nuevo gen queda bajo el control del promotor de poliedrina y generalmente se expresa a niveles comparables a la proteína de oclusión. Como consecuencia de esa recombinación, el baculovirus recombinante adquiere un fenotipo oclusión negativo (occ-), ya que por reemplazo alélico se elimina la secuencia codificante de poliedrina y de esta manera el baculovirus recombinante queda imposibilitado de ocluirse en poliedros. El sistema de expresión por baculovirus (BEVS, del inglés Baculovirus Expression Vector System) resulta ser uno de los sistemas de expresión de proteínas recombinantes más versátiles y poderosos (Luckow y Summers, 1988). Ha sido utilizado para la obtención de proteínas recombinantes de una gran diversidad de orígenes como bacterias (Bigi et al., 1999), hongos (Germain et al., 1992), plantas (Srinivas et al., 2001), virus (Maranga, 2003) e incluso proteínas humanas (Rose et al, 1993). El baculovirus más utilizado como vector de expresión es el aislado del lepidóptero Autographa californica, AcMNPV. Otro baculovirus empleado como vector es el que naturalmente infecta el “gusano de seda” Bombyx mori, BmMNPV. Como ya se mencionó, se aprovechan de estos nucleopoliedrovirus los promotores de las proteínas no esenciales poliedrina y P10 para regular la expresión del gen de interés. Varias líneas establecidas de células de insecto son susceptibles a la infección por AcMNPV. Entre ellas están las provenientes de Spodoptera frugiperda y Trichoplusia ni. Las líneas más utilizadas son Sf9 y Sf21, ambas obtenidas a partir de tejidos de ovario de S. frugiperda. Existen características particulares del sistema de expresión baculovirus-células de insecto que lo distinguen de los sistemas de expresión bacterianos. A menudo, las proteínas expresadas en sistemas bacterianos son insolubles, se agregan o se pliegan espacialmente de manera incorrecta. En contraste, las proteínas expresadas en este sistema son solubles y funcionalmente activas en la mayoría de los casos. Las ventajas del BEVS como sistema de expresión de proteínas recombinantes son listadas a continuación, haciendo una breve referencia a las propiedades que hacen de este sistema el de elección cuando se trata de la expresión de altos niveles de proteínas eucariotas de interés. • Sistema de expresión eucariótico. La expresión de genes en un sistema eucariota resulta esencial para la producción de proteínas con actividad biológica. El BEVS provee del entorno eucariota necesario para un correcto plegamiento, formación de puentes disulfuro, oligomerización y otras modificaciones postraduccionales requeridas por ciertas proteínas 24 Introducción para mantener su actividad biológica, tales como N- y O-glicosilaciones, acilaciones, amidaciones, fosforilaciones, prenilaciones y carboximetilaciones. La eficiencia de esos procesos está sujeta a la etapa de la infección, ya que en las etapas muy tardías las funciones de la célula hospedadora se encuentran reducidas. • Muy altos niveles de expresión. Esta es la característica que distingue al sistema BEVS, por basarse en el uso de los promotores fuertes p10 y pol. En particular, el promotor de poliedrina en condiciones salvajes alcanza niveles de expresión de hasta el 50 % de las proteínas totales de la célula. No se han alcanzado hasta el momento tan excepcionales niveles de expresión de proteínas heterólogas, pero sí se han obtenido en algunos casos hasta el 25 % de las proteínas totales, lo que es considerado un alto nivel en comparación a otros sistemas de expresión eucariota (O´Reilly et al., 1994). • Capacidad de incorporar grandes inserciones de ADN. La capacidad de expansión de la nucleocápside permite el empaquetamiento y expresión de genes de hasta 100 kpb. Sin embargo, las inserciones encuentran limitaciones en la capacidad del vector de transferencia. • Expresión de múltiples genes. Se lograron expresar con éxito dos y más genes simultáneamente dentro de una misma célula infectada. Esta capacidad hace especialmente interesante el uso de BEVS para la obtención, por ejemplo, de partículas semejantes a virus por coexpresión de las subunidades de la cápside y ensamblado de las mismas dentro de las células hospedadoras (Belkyaev y Roy, 1993). • Capacidad de splicing. A pesar de que en la mayoría de los trabajos que emplean BEVS se utiliza ADNc, se ha visto que las células de insecto tienen la capacidad de realizar splicing de intrones y exones de genes de mamífero, siendo una herramienta poderosa para los casos que no es factible la obtención de ADNc (Iatrou et al., 1989). • Simplicidad de tecnología. Dado que los baculovirus no requieren de virus helper, son más sencillos de utilizar que otros vectores virales. Con este sistema es posible producir proteínas recombinantes fácilmente en tan sólo semanas. La construcción de un baculovirus recombinante se considera más rápida y sencilla que la obtención de líneas eucariotas estables que expresan de forma satisfactoria una proteína de interés. 25 Introducción • Bioseguridad. Los baculovirus tienen un rango acotado de hospedadores, siendo susceptibles principalmente los insectos del orden Lepidoptera. AcMNPV es capaz de ingresar en células de mamífero pero no replicarse en ellas, lo que confirma la seguridad de este baculovirus para ser utilizados como vector viral, biopesticida e incluso como vector para terapia génica somática (Carbonell y Miller, 1987). Clásicamente, la obtención de baculovirus recombinantes se basa en la transfección simultánea de células de insecto con ADN de baculovirus y ADN de plásmido de transferencia llevando el gen de interés, la recombinación dentro de las células de insecto llevada a cabo por la maquinaria celular y la selección de los baculovirus recombinantes. Como se mencionó, la infección con baculovirus salvajes resulta en la producción de cuerpos de oclusión constituidos mayoritariamente por poliedrina en las células de insecto susceptibles. Este fenómeno fue utilizado en el pasado para identificar baculovirus recombinantes con el gen de poliedrina reemplazado por el gen de interés: los virus recombinantes que expresan la proteína heteróloga en lugar de poliedrina no producen cuerpos de oclusión y las placas de lisis producidas por éstos pueden ser fácilmente distinguibles de las producidas por virus salvajes. Sin embargo, ya que los baculovirus recombinantes derivan de eventos de recombinación homóloga entre el plásmido y el genoma viral a una baja frecuencia (Kitts et al., 1990), la gran mayoría de los virus producidos no son recombinantes. Además, debido a que las placas de lisis tempranas de virus salvajes muestran a menudo un fenotipo oclusión negativo, existe el riesgo de seleccionar falsos positivos. En los últimos años se han introducido numerosas mejoras a fin de aumentar la cantidad de eventos de recombinación, facilitar la selección de recombinantes y aumentar la proporción de estos últimos en relación a los virus salvajes. En principio, pudo producirse mediante técnicas de ingeniería genética una deleción letal en el genoma viral, de manera que sólo aquellos genomas virales que recombinaran con el vector de transferencia que llevara la secuencia afectada junto con el gen de interés pudieran replicar dentro de las células de insecto. Esto llevó a la obtención de poblaciones recombinantes homogéneas tras la cotransfección, además de aumentar el número de eventos de recombinación por el hecho de que el genoma viral estuviera en forma lineal, con las secuencias a recombinar en los extremos, en vez de estar en su conformación natural, superenrollada (Kitts y Posse, 1993). Desde entonces, este sistema ha sido utilizado de 26 Introducción rutina para la generación de baculovirus recombinantes, bajo el nombre comercial de BaculoGoldTM. Una alternativa al empleo de ADN genómico viral linealizado es la utilización de un bácmido que lleva el genoma modificado del baculovirus AcMNPV. Esta construcción tiene la ventaja de que puede replicarse en bacterias E.coli gracias a la presencia de un replicón miniF (Luckow et al., 1993). El sistema se conoce comercialmente como Bac-to-Bac® y se basa en la transposición sitio específica entre un vector de transferencia y un bácmido receptor dentro de la bacteria modificada (DH10Bac®). El bácmido recombinante aislado de las bacterias se transfecta en células de insecto, las cuales generan la progenie viral que se amplifica para obtener el stock de uso. Estos baculovirus son también de fenotipo occ-, incapaces de ocluirse en poliedros. Más adelante se diseñó un sistema para obtener baculovirus de genotipo pol+, también basado en un bácmido que porta el genoma de AcMNPV (Je et al., 2001). Este bácmido, denominado bAcGOZA, lleva una deleción en el ORF 1629 cuya expresión, como se mencionó, es esencial para su replicación en células de insecto. La cotransfección del bAcGOZA y el vector de transferencia que contiene el ORF 1629 intacto y secuencias de la región río arriba de poliedrina que flanquean el gen de interés, permite la recombinación homóloga en las células de insecto, recuperándose sólo virus recombinante, ya que a partir del ADN parental no es posible obtener progenie viable. Luego de la recombinación, además de recuperar el ORF 1629 completo, el baculovirus resultante contiene el gen de interés bajo el promotor de poliedrina y además, el gen de poliedrina bajo el promotor de p10. Estos baculovirus son de fenotipo occ+ y por lo tanto se ocluyen en poliedros en una etapa tardía de la infección. Según lo expuesto anteriormente, existen varias metodologías para la obtención de baculovirus recombinantes, tanto si se busca que los mismos se ocluyan en poliedros, como si no se requiere su fenotipo occ+. Para la construcción de los baculovirus utilizados en esta tesis se utilizaron las tres técnicas descritas. 3.1.2 El sistema baculovirus-larvas de lepidóptero Una de las ventajas que ofrecen las células de insecto es su capacidad de crecer en biorreactores de manera análoga a los microorganismos y asegurar de esa forma la obtención de cantidades de proteína industrialmente aceptables. Sin embargo, la producción de proteínas recombinantes en cultivos celulares en suspensión resulta muy costosa, ya que requiere de grandes volúmenes de 27 Introducción medio de cultivo rico en nutrientes, suero fetal bovino como suplemento e insumos que encarecen el proceso. Algunas proteínas pueden producirse de una manera más económica en larvas de insecto. Además de la conveniencia en cuanto al costo final del proceso, la ventaja de la expresión in vivo radica en la posibilidad de realizar modificaciones post-traduccionales que no son factibles en los sistemas celulares, como fue demostrado por Andersons y colaboradores en el año 1991. La mayor eficiencia en la expresión de proteínas que requieren modificaciones posttraduccionales puede deberse a la existencia en las larvas de los “cuerpos grasos”, tejido que juega un rol muy importante en la síntesis y maduración de las proteínas del insecto. Además, las larvas poseen otros tejidos con capacidad de realizar diferentes modificaciones a las proteínas sintetizadas por el insecto. La principal diferencia respecto a la producción en células radica en que las líneas que se utilizan para cultivos in vitro están compuestas por un único tipo celular. Se conoce por ejemplo que las células Sf9 fallan en la α-amidación de proteínas heterólogas, mientras que ciertas especies de lepidópteros pueden realizar dichas modificaciones normalmente (Hellers et al., 1991). Las limitaciones de este sistema suelen tener lugar al momento de la purificación de la proteína recombinante, ya que la extracción a partir de larvas es compleja y la presencia de proteasas puede dar lugar a pérdidas de la función biológica. La expresión de proteínas recombinantes utilizando este sistema se encuentra en permanente desarrollo, tanto en la sofisticación tecnológica como en el número de laboratorios académicos y comerciales que lo adoptan. Uso de larvas como como “biofábricas” de proteínas heterólogas: antecedentes Existen numerosos ejemplos publicados del uso de larvas de lepidóptero para la producción de proteínas mediante el sistema BEVS. La utilización de larvas de lepidóptero como “minibiorreactores” comenzó en los años ‘80 en países asiáticos como Japón, China e India, con el gusano de seda Bombyx mori, para la producción de α-interferón (Maeda et al., 1985) e interleuquina- 3 murina (Miyajima et al., 1987), entre otros productos, utilizando como vector el baculovirus BmNPV. Este insecto como hospedador sigue siendo ampliamente utilizado tanto para investigación, como es el caso de la IgG murina (Reis et al., 1992) e Il-18 porcina (Muneta et al., 2003), como así también para la producción comercial de proteínas tales como el interferón τ (Nagaya et al., 2004) por la firma japonesa Katakura. 28 Introducción Otros lepidópteros hospedadores han sido también utilizados en investigación para la producción de proteínas, como la oruga del tabaco Manduca sexta (Gretch et al., 1991), la polilla de cecropia Hyalophora cecropia (Hellers y Steiner, 1992), el gusano soldado Spodoptera exigua (Ahmad et al., 1993), el gusano Heliothis virescens (Kuroda et al., 1989), la oruga medidora Rachiplusia nu (Loustau et al., 2008) y probablemente la más utilizada, la plaga de la soja Trichoplusia ni que es considerada especie exótica en Argentina, por lo que se suele emplear R. nu como especie más representativa de ésta. A pesar de que AcMNPV afecta un amplio rango de hospedadores, no todos los lepidópteros son susceptibles a su infección. Entre los insectos resistentes a AcMNPV se encuentran B. mori y tanto M. sexta como H. cecropia, S. exigua presentan una susceptibilidad mucho menor que H. virescens (Groener, 1989) o S. frugiperda. T. ni es un excelente hospedador para AcMNPV y ha sido extensamente utilizado para la expresión de numerosas proteínas tales como la Il-2 humana (Pham et al., 1999) y la adenosina deaminasa humana (Medin et al., 1990). Existen empresas dedicadas a la producción de proteínas en larvas de T. ni a escala comercial. Ejemplos de ellas son Entopath, Easton, PA (www.entopath.com) y Chesapeake PERL, Savage, MD (www.c-perl.com) que diseñaron sistemas sencillos que automatizan la expresión en larvas para la producción a pequeña y mediana escala en el laboratorio. Como ya se ha destacado, el sistema de expresión in vivo presenta más ventajas que las células en cultivo, las que incluyen no sólo la reducción del costo total del proceso sino también la simplicidad del escalado (scaling-up) con respecto a los requerimientos de un fermentador de células de insecto. Sin embargo, se debe tener en cuenta que la optimización de la expresión de proteínas en larvas es compleja y algunos aspectos del proceso deben analizarse para cada caso en particular. Rachiplusia nu Las larvas de la especie Rachiplusia nu son vulgarmente llamadas “orugas medidoras” debido a su particular manera de desplazarse, arqueando su cuerpo a medida que avanzan con sus dos pares de patas en los segmentos abdominales. Esta especie es una de las plagas más frecuentes en cultivos de leguminosas en Argentina y su importancia es variable según el cultivo que dañe (Arretz et al.,1985). Su ciclo natural presenta los brotes más importantes entre diciembre y marzo y la etapa más destructiva de la larva como plaga desfoliadora se alcanza durante los últimos estadios larvales (Figura I8). 29 Introducción Figura I8. Larva de Rachiplusia nu (oruga medidora) del último estadio larval en una hoja de Glycine max (soja). Las hembras son capaces de oviponer entre 100 y 500 huevos en el envés de las hojas, los que eclosionan entre los 7 y 8 días post oviposición. El ciclo larval presenta 5 o 6 estadios y transcurre durante 15 a 25 días. Al final del último estadio, la larva deja de alimentarse y comienza a formar un capullo sedoso dentro del cual pasa al estadio de pupa. Siete a 10 días después emerge el estadio adulto del capullo, completando el ciclo. La cría en el laboratorio de larvas de R. nu se basa en el conocimiento de los tiempos del ciclo natural del insecto y de los requerimientos nutricionales mínimos para la formulación de una dieta artificial apropiada para esta especie. Por lo general, se requiere de un fotoperíodo de 14 h de luz y 10 h de oscuridad, una temperatura de entre 26 y 27 °C y humedad entre 65 y 70 %. Infección de larvas con baculovirus recombinantes Como se describió anteriormente, los ODV transmiten la infección entre los insectos mediante la oclusión en OB y los BV transmiten la infección entre células del mismo insecto. Basados en este paradigma, se utilizan básicamente dos métodos para iniciar la infección y producir proteínas recombinantes en larvas de insecto: inyección intrahemocélica con baculovirus brotantes (obtenidos de cultivos de células) o infección por vía oral por administración de poliedros en la dieta del insecto. Variantes de estos dos métodos fueron descritas y probadas, como la administración de OB en una gota líquida que la larva sorbe (Kunimi y Fuxa, 1996) o la inoculación por aerosoles sobre el cuerpo de la larva (Jinn et al., 2009). La infección por inyección de baculovirus genotipo pol- en la hemolinfa del insecto suele rendir altos niveles de expresión de proteínas de interés (López et al., 2005), pero presenta la desventaja de ser un proceso tedioso, ya que requiere la necesidad de infectar larva por larva y además se genera una cierta variabilidad dada por el operador. Además, un porcentaje considerable de larvas muere como consecuencia de la inoculación. 30 Introducción La infección oral de larvas con poliedros recombinantes resulta una metodología más simple y segura. A pesar de que AcMNPV ha sido utilizado en una amplia variedad de cultivos celulares de lepidópteros (McIntosh et al., 2005), el número de especies de insectos susceptibles a infección por este virus por vía oral es limitado. La resistencia a la infección en los hospedadores semisusceptibles a menudo se asocia con los hemocitos, que juegan un rol crucial en la transmisión de la infección dentro del insecto (Trudeau et al., 2001; Clarke y Clem, 2002). El uso de proteínas fluorescentes como la proteína GFP (del inglés green fluorescent protein) o la DsRed (Discosoma coral) se ha convertido en una herramienta útil para estudios de expresión génica in vivo, movilización y localización de proteínas y microorganismos (Cha et al., 1999; Jinn et al., 2005). En particular, en este trabajo se utilizó GFP como proteína reportera y modelo: las células infectadas por un baculovirus recombinante que expresa GFP fluorescen al ser irradiadas con luz azul, permitiendo una fácil diferenciación entre las células infectadas y las no infectadas. De igual manera, su uso permite la detección de larvas infectadas simplemente por visualización al microscopio óptico o bajo lupa con lámpara de luz azul. Infección por vía oral Las ventajas de la infección por vía oral de larvas de lepidóptero para la obtención de altos niveles de proteínas de interés son amplias. La administración de poliedros sobre la dieta de los insectos resulta una metodología inocua para las larvas y práctica en la medida de que se pueden infectar grandes números de insectos en un solo evento. La producción del inóculo puede realizarse tanto por infección de cultivos celulares con el baculovirus de interés como por infección de larvas por inyección y aislamiento de poliedros de las mismas a tiempos muy tardíos. Este último proceso permite obtener grandes cantidades de cuerpos de oclusión de una manera fácil y económica. Los fenotipos baculovirales que resultan infectivos por vía oral son el denominado POV o virus preocluido, que se encuentra en el núcleo previo a la oclusión y los ODV incluidos en los poliedros. Como ya fue mencionado, estos tipos virales presentan proteínas en su envoltura que lo distinguen del fenotipo brotante o BV ya que varias de esas proteínas resultan esenciales para la infección primaria de las células del intestino de la larva. La obtención de baculovirus recombinantes que se basan en el reemplazo del gen poliedrina por la secuencia del gen de interés resulta en baculovirus que no forman poliedros, ya que son 31 Introducción de genotipo pol-. Esto se convierte en un impedimento para la inoculación de larvas por vía oral. Sin embargo, se ha demostrado la infectividad de los baculovirus pol- en su fase POV aislados del núcleo de la célula infectada, al ser inoculados por vía oral en forma líquida (droplet feeding method, o método de la absorción de la gota) en larvas neonatas de Trichoplusia ni (Wood et al., 1993). Baculovirus occ- como inóculo de infección de larvas por vía oral A pesar de la infectividad oral del fenotipo viral POV, la metodología para su obtención resulta impráctica, ya que requiere la lisis celular y su extracción de los núcleos infectados. Así, la oclusión de baculovirus que carecen del gen poliedrina para su utilización como inóculo de infección por vía oral resulta un desafío biotecnológico. Para ello, se han descrito al menos dos métodos que permitieron obtener baculovirus recombinantes ocluidos. La primera estrategia consiste en la coinfección de células con baculovirus recombinantes occ- y baculovirus AcMNPV wt para la obtención de cuerpos de oclusión de naturaleza mixta: en su interior coexisten ambas poblaciones virales (Hamblin et al., 1990). La segunda estrategia consiste en la construcción de un baculovirus recombinante de genotipo pol+ que porta el gen de interés bajo el promotor de poliedrina y el gen poliedrina bajo el promotor de la proteína no esencial P10 de AcMNPV. (Heldens et al., 1997; Je et al., 2001). Ambos métodos de obtención de poliedros recombinantes presentan ventajas y desventajas con respecto al rendimiento. Los poliedros de naturaleza mixta generan dos poblaciones virales diferentes dentro de la larva, donde posiblemente los baculovirus salvajes tengan mayor aptitud frente a los recombinantes. (López, tesis de licenciatura). Con la segunda estrategia se generan poliedros que sólo contienen baculovirus recombinantes, pero que no alcanzan el máximo de expresión obtenido con los baculovirus occdebido posiblemente a la coexistencia en el mismo genoma del gen de interés y el gen poliedrina. El promotor p10 es un promotor fuerte que también ha sido utilizado para la expresión de genes heterólogos (Farrel et al., 1998; Wu et al., 2000). Sin embargo, el ARN mensajero de poliedrina es muy estable y posee secuencias río arriba y río abajo del codón de iniciación que le confieren una alta tasa traduccional. Compitiendo ambos mensajeros por la maquinaria traduccional de las células infectadas, podría existir una ventaja en la traducción de poliedrina, por lo que se observan menores niveles de expresión del gen de interés (López, tesis de licenciatura). Una solución de compromiso entre estas dos metodologías consiste en la 32 Introducción coinfección entre dos baculovirus recombinantes, uno occ- y otro occ+ para la obtención de poliedros con mayor proporción de genoma recombinante. 3. 2 Empleo de los baculovirus como biopesticidas En los últimos años, se ha puesto gran atención al uso de agentes entomopatógenos como factores de regulación de algunas poblaciones de insectos, especialmente aquellas que afectan la producción agrícola. Esta tecnología ofrece grandes ventajas sobre los conocidos pesticidas químicos, como la seguridad que representan para la salud de humanos y otros organismos y la reducción de residuos tóxicos, tanto en los alimentos producidos como en el suelo. Sin embargo, la principal desventaja es que no alcanzan una alta eficacia a campo (Moscardi, 1999). En condiciones naturales, existe un período relativamente largo entre la infección del insecto y su efecto letal, durante el cual el insecto susceptible continúa alimentándose y causando daños en las especies vegetales de interés. Este retardo en la acción, la susceptibilidad de los baculovirus a la luz UV y el requerimiento de sistemas de producción con organismos vivos representan las principales limitantes en la aplicabilidad del sistema. Actualmente se realizan grandes esfuerzos para equiparar la potencia de los baculovirus a la de los pesticidas químicos. Estos desarrollos apuntan a aumentar la virulencia y disminuir el tiempo de muerte, a mejorar la performance de los baculovirus bajo distintas condiciones climáticas, a aumentar la eficiencia de producción y a mejorar las formulaciones, entre otros objetivos (Lacey et al., 2001). La introducción en el genoma de los baculovirus de genes que codifican proteínas que interfieren con el metabolismo del insecto o la metamorfosis (por ejemplo, la hormona diurética o la hormona protoracicotrópica) (Black et al., 1997) o toxinas específicas (por ejemplo TxP-I, AaIT, LqhIT1/2) ha mostrado una importante mejora en la patogenicidad de los baculovirus como bioinsecticida. Otro ejemplo de utilización de proteínas tóxicas para los insectos es la incorporación en el genoma de AcMNPV del gen de la proteína Cry1A de Bacillus thuringensis que constituyó una buena estrategia para el aumento de la dosis letal media (DL50) (Merryweather et al., 1990). Afortunadamente, hasta el momento no existe evidencia que sugiera que los baculovirus recombinantes de este tipo representen un riesgo, ni para el mundo animal ni para el ambiente, mayor al que producen los baculovirus parentales (Szewczyk et al., 2006). Sin embargo, resulta conveniente evitar que los baculovirus modificados se propaguen por generaciones en el campo. Los baculovirus recombinantes que carecen de poliedrina en su genoma aparecen entonces 33 Introducción como la alternativa más segura para el control biológico de plagas. Los conocimientos sobre la biología de los baculovirus progresan en pos del mejoramiento de las formulaciones de biopesticidas basadas en baculovirus porque no quedan dudas de que éstas poseen un riesgo mucho menor para el ambiente que los clásicos pesticidas químicos. 34 Hipótesis y Objetivos Hipótesis y Objetivcs Hipótesis La hipótesis en la que se basa este trabajo de tesis es que es posible complementar baculovirus de genotipo pol- mediante la expresión en trans de poliedrina desde el genoma de células de insecto, dotándolos de infectividad oral. Objetivos Objetivo general El objetivo general de este trabajo consiste en determinar la mejor estrategia para la construcción de una línea estable de células Sf9 que exprese poliedrina y evaluar su capacidad empaquetadora de baculovirus de genotipo pol-. Objetivos específicos Para desarrollar el objetivo general se plantean los siguientes objetivos específicos: Determinar las secuencias requeridas para regular de forma óptima la expresión del gen poliedrina mediante ensayos de expresión transitoria de un gen reportero. Obtener una línea establemente transformada con el gen poliedrina y sus secuencias regulatorias, evaluar la expresión de poliedrina luego de la infección con un baculovirus poly estudiar la morfogénesis de poliedros en este sistema. Analizar la oclusión de baculovirus pol- mediada por la línea establemente transformada. Estudiar la infectividad por vía oral de los baculovirus ocluidos por la línea estable, en larvas de Rachiplusia nu. 35 Materiales y Métodos Materiales y Métodos Materiales y Métodos 1. Virus El baculovirus utilizado en este trabajo fue el virus de la poliedrosis nuclear Autographa californica (AcMNPV). Su multiplicación se realizó en células Sf9 crecidas en forma de monocapa a 27 °C. Los stocks virales de uso se obtuvieron luego de dos o tres pasajes de virus por células a una baja multiplicidad de infección (moi). 2. Células Se utilizaron células de insecto de la línea Sf9 (Invitrogen) que es un clon aislado de la línea IPLBSF21-AE (Sf21), derivada de tejido ovárico del lepidóptero Spodoptera frugiperda. Las células se crecieron a 27 °C en forma de monocapa en medio de cultivo Sf900II SFM (Gibco-BRL) suplementado con 1 % de suero fetal bovino (SFB) (Gibco-BRL) y una solución de antibióticoantimicótico (penicilina 10.000 U/ml, estreptomicina 10 mg/ml, anfotericina B 25 µg/ml, GibcoBRL). 3. Cepas bacterianas Para las estrategias de clonado se utilizó la cepa DH5α de E. coli de genotipo: supE44 thi-1 recA1 gyrA (NaIr) relA1 ∆(lacIZYA-argF)U169 deoR (φ80dlac∆lacZ)M15. Para la generación de bácmidos recombinantes se utilizó la cepa de E. coli DH10Bac (Invitrogen) cuyo genotipo es: F- mcrA ∆ (mrr-hsdRMS-mcrBC) φ80lacZ∆M15 ∆lacX74 deoR recA1 endA1 araD139 ∆(ara, leu) 7697 galU galK λ-rpsL nupG/ bMON14272/pMON7124. Los cultivos líquidos se realizaron en medio LB (5 g/l Triptona, 5 g/l extracto de levadura, 10 g/l NaCl), con agitación constante de 200 rpm a 37 °C. 36 Materiales y Métodos 4. Metodología del ADN recombinante 4.1 Preparación de ADN plasmídico de alta calidad Para la obtención de ADN plasmídico de alta calidad se utilizaron las columnas de intercambio aniónico comerciales QIAGEN. La purifiación del ADN plasmídico se realizó a partir de 3 ml de sobrenadante de cultivo saturado de bacterias transformadas, rindiendo aproximadamente 20 µg de ADN que fue eluido de la columna con 100 µl de una solución de Tris-HCl 10 mM pH 8. 4.2 Digestión con enzimas de restricción Para las digestiones de los diferentes plásmidos se utilizaron 500 ng de ADN, 5 U de enzima de restricción (provistas por New England Biolabs o Promega), buffer apropiado y un volumen final de 20 µl. Las reacciones se incubaron 2 h a la temperatura recomendada para cada enzima. 4.3 Defosforilación de los extremos 5’ fosfato La reacción de remoción de los grupos fosfato de los extremos 5’ de los plásmidos digeridos se realizó utilizando 5 U de la enzima fosfatasa alcalina de intestino de ternera (CIP, New England Biolabs) agregada directamente al volumen de reacción de digestión. La reacción se incubó por 15 min a 37 °C. En algunos casos se optó por utilizar la enzima SAP (shrimp alcaline phosphatase) (Promega) para lo cual se adicionó 1 U de SAP al volumen de reacción, 1X final de buffer SAP 10X y se incubó 15 min a 37 °C. Para inactivar esta enzima se calentó la reacción a 65 °C por 15 min. 4.4 Incorporación de nucleótidos a fragmentos cohesivos de ADN Para el emparejamiento de las hebras en fragmentos de ADN producto de digestiones con enzimas de restricción que generaron extremos cohesivos, se procedió al “llenado” de los nucleótidos faltantes utilizando el fragmento klenow de la enzima ADN polimerasa (New England Biolabs). Para esto se incubó por cada μg de ADN molde, 2,5 mM de cada uno de los dNTPs y 10 U del fragmento klenow directamente en la reacción de digestión. La reacción se incubó 30 min a 37 °C. 37 Materiales y Métodos 4.5 Electroforesis en geles de agarosa Se realizaron geles de agarosa de concentraciones entre 0,8 % y 1,5 %. Los geles se corrieron en buffer TAE (Tris-acetato 10 mM, EDTA 1 mM) a 5-10 V/cm a temperatura ambiente. Con el fin de visualizar las bandas de ADN se utilizó bromuro de etidio a una concentración de 0,5 µg/ml de gel. Para sembrar las muestras se utilizó un buffer de siembra de concentración 10X (glicerol 50 %, TAE 10X, azul de bromofenol 1 %). Los marcadores de peso molecular uilizados fueron 1 kb y 1 kb Plus (Invitrogen). Los geles fueron fotografiados utilizando un equipo Fotodyne y el programa Collage (Macintosh). 4.6 Purificación de ADN a partir de geles de agarosa Las bandas de ADN resueltas mediante geles de agarosa se escindieron del gel mediante el uso de bisturí y se purificaron utilizando el kit “QIAEX II purification system” (QIAGEN). El ADN obtenido se resuspendió en una solución de Tris-HCl 10 mM pH 8 siguiendo las recomendaciones del fabricante. 4.7 Reacciones de ligado molecular Para el ligado molecular de los diferentes insertos a los plásmidos correspondientes, se utilizaron entre 50 y 100 ng de vector y diferentes relaciones molares vector: inserto (1:1 y 1:3). La reacción se llevó a cabo en un volumen de 10 µl, en presencia de buffer de ligado (Tris-HCl 50 mM pH 7,5, MgCl2 10 mM, dithiothreitol 10 mM, dATP 1 mM, seroalbúmina bovina 25 µg/ml) y 10 U de enzima T4 ADN ligasa (New England Biolabs). La reacción se incubó a 16 °C toda la noche, incluyendo un control de vector sin inserto. 4.8 Transformación de bacterias Las bacterias E. coli DH5α se hicieron competentes para la transformación mediante el método de Hanahan (1985) y se mantuvieron congeladas a –70 °C hasta su uso. Entonces se descongelaron y se mantuvieron en hielo por 10 min. A 50 µl de bacterias se agregaron 5 µl del 38 Materiales y Métodos producto de las diferentes reacciones de ligado, se mezcló suavemente y se incubó en hielo por 30 a 45 min. Posteriormente se realizó un choque térmico a 42 °C por 90 s y se dejó en hielo por 2 min adicionales. Luego, se agregaron 200 µl de medio LB, se incubó a 37 °C con agitación suave y se plaqueó en medio LB agarizado conteniendo ampicilina a una concentración final de 100 μg/ml. Las placas se incubaron a 37 °C toda la noche y las colonias se picaron con escarbadientes esterilizados, que se usaron para inocular cultivos de 3 ml de LB/Ampicilina. 4.9 Minipreparaciones de ADN Se utilizó el método de Birnboim y Doly (1979) con ligeras modificaciones. Se partió de 3 ml de cultivo de bacterias en medio LB/ampicilina crecido toda la noche a 37 °C. Las bacterias se cosecharon por centrifigación a 10.000 x g en una microcentrífuga de mesa y se resuspendieron en 200 µl de Solución I (Tris-HCl 25 mM pH 8, EDTA 10 mM, glucosa 50 mM). Luego, se agregaron 200 µl de Solución II (NaOH 0,2 N, SDS 1 %) se mezcló suavemente por inversión y se incubó 5 min a temperatura ambiente. Finalmente se agregaron 200 µl de Solución III (acetato de potasio 3 M) y se mezcló por inversión. Se centrifugó el floculado a 10.000 x g durante 10 min. Se tomó el sobrenadante libre de floculado y se traspasó a un tubo de microcentrífuga limpio donde se precipitó el ADN plasmídico por el agregado de 0,6 volúmenes de isopropanol y centrifugación a 10.000 x g durante 20 min. Se enguajó el precipitado con etanol 70 %, se secó bajo vacío y se resuspendió en 50 µl de H2O conteniendo ARNasa (100 ug/ml). Para verificar la presencia, integridad y orientación de los diferentes insertos en cada estrategia de clonado, se digirieron de 2 a 6 µl de esta solución con las enzimas de restricción apropiadas. 4.10 Secuenciación de ADN Se realizó en el Servicio Interno de Genotipificación y Secuenciación Automática (SIGYSA) del Instituto de Biotecnología mediante secuenciación automática. 5. Electroforesis de proteínas en geles de poliacrilamida Se utilizaron geles desnaturalizantes de poliacrilamida de concentraciones 10 %, 12 % y 15 %, dependiendo del tamaño de la proteína a ser visualizada en cada caso. El grado de 39 Materiales y Métodos entrecruzamiento acrilamida:bisacrilamida utilizado fue 29:1. Se utilizaron minigeles (6 x 9 cm, Miniprotean III, Biorad), los que se corrieron a una corriente constante de 100V en buffer Trisglicina-SDS (Tris-HCl 25 mM pH 8,8, glicina 190 mM, SDS 0,1 %). 6. Identificación de proteínas mediante Western blot 6.1 Electrotransferencia Luego de efectuada la electroforesis, los geles de poliacrilamida se equilibraron durante 2 min con buffer de transferencia (Tris-HCl 25 mM pH 8,8, glicina 190 mM, metanol 20 %). Entonces se cortó un rectángulo de nitrocelulosa (S&S BA 0,45 µm, Schleicher & Schuell) de tamaño algo mayor que el del gel y se hidrató durante 5 min. Se dispuso sobre la cara del cassette de transferencia correspondiente al electrodo negativo (Bio-Rad): una esponja del tipo Scotch Brite (Bio-Rad), un papel de filtro Whatmann 3 mm, el gel de poliacrilamida, el filtro de nitrocelulosa, un papel de filtro Whatmann 3 MM y una esponja del tipo Scotch Brite. Se montó el cassette dentro de la cuba de transferencia (Bio-Rad), se llenó con buffer de transferencia y se transfirieron las proteínas del gel al filtro de nitrocelulosa aplicando una corriente constante de 200 mA a 4 °C por 1,5 h. 6.2 Detección inmunológica de proteínas Se bloquearon los filtros 1 h a temperatura ambiente en buffer TBS-Tween-leche 5 % (Tris-HCl 50 mM pH 7,4, NaCl 150 mM, Tween 20 0,005 %, leche descremada 5 %). Luego, se lavaron con buffer TBS-Tween y se incubaron con diluciones apropiadas de los anticuerpos específicos (1:1.000 para el suero de pollo anti-poliedrina, GenTex®; 1:2.000 para el monoclonal anti-VP39, Whitt y Manning, 1988; 1:20 para el monoclonal N25 8c anti-P74, Faulkner et al., 1997 y 1:1.000 para el anticuerpo monoclonal AcV5 anti-GP64, Hohmann y Faulkner, 1983) en TBS-Tweenleche descremada 3 %. Tras 1 h de incubación a temperatura ambiente con agitación suave, se lavaron los filtros 3 veces con solución de lavado TBS-Tween por 10 min y se incubaron con el segundo anticuerpo en TBS-Tween-leche 3 % (cabra anti-pollo conjugado con la enzima fosfatasa alcalina 1:30.000, AXELL; cabra anti-ratón conjugado con la enzima fosfatasa alcalina 1:15.000, SIGMA; cabra anti-ratón conjugado con la enzima peroxidasa 1:2.000, SIGMA). Para los anticuerpos conjugados a fosfatasa alcalina, tras 1 h de incubación a temperatura ambiente con 40 Materiales y Métodos agitación suave se lavaron los filtros 3 veces con solución de lavado por 10 min, una vez con el buffer de revelado de fosfatasa alcalina (Tris-HCl 100 mM pH 9,5, NaCl 100 mM, MgCl2 5 mM) por 10 min y se agregaron 5 ml de solución de revelado [10 ml de buffer de revelado, 66 µl de Nitro blue tetrazolium (NBT, 50 mg/ml en dimetilformamida 70 %, Promega)] y 33 µl de bromocloro-indoil-fosfato (BCIP, 50 mg/ml en dimetilformamida 100 %, Promega). Se incubó con agitación suave por 3 a 15 min con luz tenue, hasta visualizar las bandas de interés. La reacción de revelado se detuvo por lavados con agua y los filtros se secaron al aire y se resguardaron de la luz. Para el anticuerpo conjugado a peroxidasa, el revelado se realizó por quimioluminiscencia utilizando el kit comercial Pierce ECL Western Blotting Substrate (Thermo Scientific), según el protocolo sugerido. 7. Obtención de los baculovirus recombinantes 7.1 Metodologías utilizadas Para la construcción de los baculovirus recombinantes AcGFPpol-, AcGFPpol+, AcPOL- y AcPOLE44G se utilizaron distintas metodologías, ya descritas en la Introducción. Los baculovirus AcGFPpol- y AcPOLE44G fueron obtenidos mediante el sistema Bac-to-Bac® (Invitrogen), que consiste en la obtención de un vector de transferencia basado en la inserción del gen de interés en el plásmido pFastBac-1 (Invitrogen), para la transposición con el genoma completo de baculovirus que contienen las bacterias modificadas DH10Bac. El baculovirus AcGFPpol+ se obtuvo mediante la co-transfección en células de insecto del bácmido bAcGOZA y el vector de transferencia pBacPAK8 portando el gen poliedrina. El baculovirus AcPOL- se construyó por la técnica BaculoGoldTM, utilizando el vector pVL1393 (BD Biosciences) modificado (pVL1629). 7.2 Construcción de los vectores de transferencia Para la construcción del vector de transferencia pFastBacGFP necesario para la obtención del baculovirus AcGFPpol-, se amplificó el gen de la proteína fluorescente verde GFP utilizando como templado el plásmido PCDNA-GFP obtenido previamente en el laboratorio. El oligonucleótido sentido (GFP-for 5´ TTCTAGAGTATGGTGAGCAAGGGC 3´) fue diseñado incluyendo el triplete propio de iniciación de la traducción de GFP y sitios de 41 Materiales y Métodos reconocimiento para la enzima de restricción XbaI (subrayada). Además, se consideraron las secuencias consenso que rodean el ATG para una óptima traducción en el sistema baculovirus/células de insecto (ANYATGNY). El oligonucleótido antisentido (GFP-rev 5´ TTCTAGACTTGTACAGCTCGTC 3´) fue diseñado incluyendo el codón de terminación de la traducción y la secuencia de reconocimiento para la enzima de restricción XbaI. La reacción de PCR se realizó utilizando aproximadamente 100 ng de templado y las siguientes concentraciones finales de reactivos: 0,3 mM de cada uno de los oligonucleótidos, 1X PCR buffer (Promega), 0,3 μM de cada dNTP y 1 U de GoTaq (Promega) en un volumen de reacción final de 20 µl. El ciclo de temperaturas utilizado fue: 94 °C, 5 min; (94 °C 30 s, 58 °C 30 s, 72 °C 1 min) x 35 ciclos, 72 °C 7 min. El fragmento amplificado de GFP resultó de 716 pb, el que fue purificado por gel de agarosa 1 % y extraído del mismo con el kit de purificación de ADN de tacos de agarosa QIAEX II. Este producto de PCR se ligó al vector pGEMT-easy (Promega) y se transformaron bacterias DH5α que fueron plaqueadas en medio LB agarizado en presencia de ampicilina 100 µg/ml, IPTG 40 µg/ml y X-Gal 100 µg/ml. Se seleccionaron las colonias blancas y se analizó la presencia del inserto mediante digestión con enzimas de restricción. Para constatar la identidad de los genes obtenidos se secuenciaron las regiones de interés del pGEMT-GFP utilizando los oligonucleótidos comerciales T7 y SP6. Posteriormente se digirieron los plásmidos pFastBac-1 y pGEMT-GFP con la enzima XbaI, se removieron los grupos 5’ fosfato del vector, se resolvieron los fragmentos mediante electroforesis en geles de agarosa y se purificaron las bandas de ADN del tamaño esperado (716 pb GFP y 4.700 pb pFB). Luego, los fragmentos vector e inserto se ligaron molecularmente en una relación V:I de 3:1 durante toda la noche y se utilizaron 5 µl de la reacción de ligación para transformar 50 µl de bacterias E.coli DH5α competentes. Se seleccionaron las bacterias transformadas mediante plaqueo en medio LB-agar con ampicilina. Se analizó la presencia y orientación de GFP en varios clones por digestión con enzimas de restricción y posterior secuenciación. Se obtuvo así el vector pFastBacGFP. De manera similar se obtuvo de vector pFastBacPOLE44G, utilizado en la construcción del baculovirus AcPOLE44G. La secuencia codificante de poliedrina con la mutación en el nucleótido 130 (sustitución de A por G) fue amplificada a partir del vector en la cual se detectó la mencionada mutación, utilizando el oligonucleótido sentido POL-ATG (5´ TAAATATGCCGGATTATTCA 3´) que incluye el codón de iniciación de la traducción (en negrita) y el antisentido POL-STOP (5´ TTTTAATACGCCGGACCAGT 3´) que incluye el codón 42 Materiales y Métodos terminación de la traducción (en negrita). La reacción de PCR se realizó utilizando aproximadamente 100 ng de templado y las siguientes concentraciones finales de reactivos: 1X Pfx Amplification buffer (Invitrogen), 0,3 μM de cada dNPT, 1 mM de MgSO4, 1 U de Platinum® Pfx ADN polimerasa (Invitrogen) y agua bidestilada hasta un volumen final de 20 μl. El ciclado se llevó a cabo a las siguientes temperaturas: 94 °C 10 min; (94 °C 15 s, 55 °C 30 s, 68 °C 1 min) x 35 ciclos, 68 °C 10 min. El producto de PCR de tamaño esperado se purificó de agarosa y se clonó en el vector pGEMT-easy. Se seleccionó un clon por análisis de restricción y se corroboró la presencia del gen mutado por secuenciación. A continuación se digirieron los plásmidos pFastBac-1 y pGEMT-POLE44G con la enzima EcoRI, se removieron los grupos 5’ fosfato del vector, se resolvieron los fragmentos mediante electroforesis en geles de agarosa y se purificaron las bandas de ADN del tamaño esperado (740 pb POLE44G y 4.700 pb pFB). Luego, se ligaron los fragmentos vector e inserto y se transformaron 50 µl de bacterias E.coli DH5α competentes. Se seleccionaron colonias de bacterias que crecieron en medio LB-agar con ampicilina y se analizó la orientación y presencia de la mutación de POL en varios clones por digestión con enzimas de restricción y posterior secuenciación. Se obtuvo así el vector pFastBac-POLE44G. El vector pBacPAK-GFP utilizado en la construcción del baculovirus AcGFPpol+ se obtuvo por digestión del plásmido pBacPAK8 (Clontech) con la enzima BglII y digestión del plásmido pGEMT-GFP con la enzima BamHI. Luego de remover los grupos 5’ fosfato del vector se obtuvieron los fragmentos de peso molecular esperado (5.500 pb pBP y 650 pb GFP), se purificaron y se ligaron toda la noche. A continuación, se transformaron bacterias competentes con el producto de ligación y se seleccionaron varios clones resistentes a ampicilina. El análisis de la integridad del vector se realizó por PCR utilizando el oligonucleótido sentido pHEcoRV (5´ GTTGCTGATATCATGGAG 3´) que hibrida dentro del promotor de poliedrina y el oligonucléotido antisentido GFP-rev. Se utilizó la enzima GoTaq y el ciclado se realizó de la siguiente manera: 94 °C 5 min; (94 °C 30 s, 50 °C 30 s, 72 °C 40 s) x 35 ciclos, 72 °C 7 min. Para la construcción del baculovirus AcPOL- se generó un vector de transferencia sin regiones de poliedrina, denominado pVL1629, que posee el ORF 1629 intacto. Para ello se partió del plásmido comercial pVL1393 (BD Biosciences), del cual se eliminaron por digestión con las enzimas BamHI y SnaBI, los restos de secuencia de poliedrina. Como resultado de la digestión se desprendieron 690 pb que incluyen la secuencia de poliedrina desde el nt 174. El fragmento de 77 pb del ORF 1629, que se perdió en ese evento de digestión (desde el nt 4.834 al 4.911 del 43 Materiales y Métodos genoma de AcMNPV), se obtuvo por PCR utilizando los siguientes oligonucleótidos: 1629FOR (5´ AGGATCCACGATACATTGTT 3´) que posee el sitio para la enzima BamHI (subrayado) y 1629REV (5´ATACGTACAACAATTGTCTG 3´) que posee el sitio de corte para la enzima SnaBI (subrayado). Como templado se utilizó ADN de baculovirus wt. Se utilizó para la la reacción de PCR la enzima Gotaq y el siguiente ciclo de temperaturas: 94 °C 10 min; (94 °C 20 s, 50 °C 30 s, 72 °C 10 s) x 35 ciclos, 72 °C 10 min. Una vez clonado en el vector pGEMT-easy, el fragmento se desprendió por digestión con las enzimas BamHI y SnaBI y se subclonó en el vector pVL1393 digerido con las mismas enzimas. La identidad del plásmido pVL1629 fue comprobada por restricción y posterior secuenciación. 7.3 Generación de los bácmidos recombinantes por el método Bac-to-Bac Se transformaron 50 µl de bacterias E. coli DH10Bac con los plásmidos de transferencia pFastBacGFP o pFastBac-POLE44G. La selección de las bacterias que incorporaron el plásmido se realizó en placas con LB agar con los antibióticos kanamicina, tetraciclina y gentamicina a concentraciones finales de 50 μg/ml, 7 μg/ml y 7 μg/ml respectivamente. El evento de transposición fue seleccionado por el color de la colonia (fenotipo blanco), en presencia de IPTG 50 μg/ml y Bluogal 40 μg/ml. Se seleccionaron varias colonias blancas que se crecieron en LB líquido en presencia de los tres antibióticos y los bácmidos se extrajeron con el protocolo de minipreparaciones de ADN, teniendo en cuenta que el tamaño del mismo es de aproximadamente 140 kpb (O'Reilly, 1994). Posteriormente, se confirmó la presencia del cassette transpuesto en el bácmido recombinante mediante PCR con los oligonucleótidos específicos universales M13 for y M13 rev. Para esta reacción se utilizó la polimerasa Taq Platinum (Invitrogen) y el ciclo de amplificación fue: 95 °C 10 min, (94 °C 30 s, 55 °C 30 s, 72 °C 5 min) x 35 ciclos, 72 °C 15 min. Una vez confirmada la identidad de los bácmidos recombinantes, se procedió a transfectarlos en células Sf9. 7.4 Obtención de los baculovirus recombinantes Los baculovirus recombinantes AcGFPpol- y AcPOLE44G se obtuvieron por transfección de bácmidos recombinantes por el método de transfección con lípidos catiónicos (Cellfectin®, Invitrogen, o también llamada Celfectina). Brevemente, se mezcló 1 µg de ADN de bácmido recombinante contenidos en 1 ml de medio Sf900II SFM con 10 μl de Celfectina, en un tubo de 44 Materiales y Métodos 1,5 ml. La mezcla se incubó 30 min a temperatura ambiente y se agregó sobre monocapas de células Sf9 crecidas en placas de seis pocillos a una densidad de 1 x 106 células/pocillo. Las placas se incubaron por 4 h a 27 °C, se removió el medio de transfección y se agregaron 3 ml de medio SF900II SFM-1 % SFB. Tras 6 días de incubación a 27 °C se colectaron los sobrenadantes en forma estéril y se clarificaron por centrifugación a 1.000 x g a 4 °C. Con una dilución 1/5 de esos primeros pasajes virales se infectaron botellas de 25 cm2 conteniendo 1,6 x 106 células en monocapa. A los 5 dpi, se colectaron los sobrenadantes, se clarificaron por centrifugación a 1.000 x g y se conservaron a 4 °C al resguardo de la luz, hasta su uso. 7.5 Obtención del baculovirus recombinante por el método bAcGOZA El baculovirus AcGFPpol+ se obtuvo por co-transfección de células Sf9 con el vector de transferencia pBacPAK-GFP y ADN del bácmido bAcGOZA (Je et al., 2001) en medio Sf900II SFM mediante la técnica de lípidos catiónicos, tal cual fue descrito en el punto 7.4. 7.6 Obtención del baculovirus recombinante por el método BaculoGold El baculovirus AcPOL- se construyó por co-transfección de células Sf9 con ADN lineal de Baculovirus (BD Biosciences) y el vector de transferencia pVL1629 utilizando el lípido catiónico Celfectina de igual manera a lo descrito en el punto 7.4. 8. Amplificación de los baculovirus recombinantes Para aumentar el título viral se realizaron tres pasajes por células Sf9. Brevemente, se infectaron 1 x 106 células Sf9, crecidas en frascos de 25 cm2 con 100 µl de los sobrenadantes de transfección o infección. Luego de 1 h de adsorción, se agregaron 4 ml de medio de cultivo SF900II SFM-1 % SFB y se incubaron las células por 6 días a 27 °C. Los sobrenadantes de infección se colectaron de forma estéril, se clarificaron por centrifugación a 1.000 x g a 4 °C y se mantuvieron refrigerados protegidos de la luz. El tercer pasaje, realizado en un frasco 175 cm2, constituyó el stock viral. 45 Materiales y Métodos 9. Titulación viral La titulación de los baculovirus se realizó mediante los métodos dilución a punto final y número de placas de lisis. 9.1 Titulación por placas de lisis Para titular los baculovirus recombinantes, se infectaron monocapas de células Sf9 crecidas en placas de 6 pocillos a una densidad de 3 x 105 células/pocillo, con 0,5 ml de diluciones seriadas de los stocks virales en medio de cultivo (10-5 a 10-9). Tras 1 h de adsorción, se agregaron 3 ml de medio de cultivo-SFB conteniendo 0,5 % de agarosa SeaKem (FMC) y se incubaron las células por 5 días a 27 °C. Sobre la primera capa de medio con agar se agregaron 3 ml de medio con agar conteniendo el colorante vital rojo neutro a una concentración final de 50 μg/ml. Tras dos días de incubación a 27 °C, se contaron las placas de lisis y se calculó el título viral, expresado en unidades formadoras de placa por unidad de volumen de stock viral (ufp/ml). 9.2 Titulación por dilución a punto final Los baculovirus que expresan GFP fueron titulados por este método mediante la visualización de pocillos con células fluorescentes. Brevemente, se agregaron 300 µl de diluciones desde 10-3 a 10-9 de los stocks virales a 2,7 ml de células Sf9 a una densidad de 2,5 105 células/ml para la preadsorción del virus a las células. Luego, 200 µl de cada una de estas siete suspensiones fueron colocados en 12 pocillos (una fila) de una placa de de 96 pocillos, mientras que en la fila restante se colocaron células sin infectar (control negativo). La placa se incubó por 4 a 5 días en cámara húmeda a 27 °C y se contaron pocillos infectados por visualización al microscopio en presencia de luz azul. El título viral se calculó según lo descripto por Reed y Muench (1938). 10. Construcción de los plásmidos utilizados en transfecciones transitorias Para los ensayos de transfección transitoria, se construyeron plásmidos en base a los vectores comerciales pIB/V5-His/CAT (Invitrogen) y pVL1393 (Invitrogen) (Figura M1). El vector pIB/V5- 46 Materiales y Métodos His/CAT fue denominado pCCAT porque posee el promotor baculoviral constitutivo OpIE2 guiando la transcripción del gen reportero cloranfenicol acetil transferasa (CAT). Este vector cuenta con un sitio de múltiple clonado río abajo del promotor OpIE2, para introducir la secuencia de interés. Además porta resistencia al antibiótico ampicilina para su selección en bacterias. El promotor de poliedrina y sus regiones regulatorias fueron tomados del vector pVL1393. Las modificaciones sobre el vector pCCAT consistieron en el reemplazo del promotor constitutivo por regiones promotoras de poliedrina de distinta complejidad. La figura M2 muestra un esquema de las construcciones obtenidas y los nombres asignados a las mismas para su fácil reconocimiento. A continuación se detalla la obtención de cada una de ellas. Figura M1. Plásmidos utilizados para obtener las construcciones reporteras con distintas regiones promotoras de poliedrina, probadas en ensayos de transfección transitoria. 10.1 Obtención del plásmido pLCAT El vector pLCAT (4.026 pb) se obtuvo sustituyendo el promotor constitutivo OpIE2 del plásmido pCCAT por el promotor de poliedrina delimitado por el sitio NaeI, 222 pb río arriba de la región promotora básica (L por fragmento largo del promotor, que comprende del nucleótido 3.497 al 4.196 del genoma secuenciado de AcMNPV). Para ello, se obtuvo por PCR la secuencia del promotor de poliedrina del vector pVL1393 con el oligonucleótido sentido POLseqFOR (5´ ATCATGAATAGTACGCAGCTTCTTC 3´) que posee un sitio de reconocimiento de la enzima BspHI (subrayado) y el oligonucleótido antisentido POLseqREV (5´ TTTCCTTGAAGAGTGAG 47 Materiales y Métodos 3´). La reacción se llevó a cabo utilizando 1 U de la enzima Taq DNA Polimerase (Invitrogen) con un ciclo de temperaturas de: 95 °C 5 min, (94 °C 30 s, 50 °C 30 s, 72 °C 1 min) x 35 ciclos, 72 °C 5 min. El producto de 432 pb fue purificado a partir del gel de agarosa y clonado en el vector pCR2.1 TOPO (Invitrogen). Este vector al igual que el pGEMT-easy, permite la diferenciación colorimétrica de las colonias de bacterias que poseen vector con inserto, por lo que al crecer en placas de LB agarizado en presencia de ampicilina, IPTG y X-Gal fue posible aislar colonias blancas. La presencia del inserto en los clones seleccionados fue confirmada por restricción. El plásmido con el fragmento largo del promotor fue posteriormente digerido con las enzimas BspHI y BglII para desprender el fragmento de 415 pb que fue purificado, cuantificado y clonado dentro del plásmido pCCAT digerido con BspHI y BamHI. De esta manera se obtuvo el plásmido con 222 pb río arriba del promotor mínimo de poliedrina. EcoRV SpeI pSCAT XhoI CAT 95 bp BspHI pLCAT 657 pb NaeI CAT 222 bp pXLCAT XXLrev BspHI AcSp XLfor CAT 30 pb pXXLCAT 700 bp BspHI hr1REV hr1 AcSp CAT 881 pb hr1FOR 1537 bp 2640 bp Figura M2. Esquema que p representa las distintas regiones regulatorias ubicadas río arriba del gen 10.2 Obtención del vector XLCAT reportero CAT para ser evaluadas en ensayos de expresión transitoria. 48 Materiales y Métodos Para la construcción del vector pXLCAT (4.276 pb), se modificó el plásmido pLCAT agregándole otra sección de la secuencia regulatoria existente río arriba del promotor de poliedrina. Para ello se diseñaron un par de oligonucleótidos para amplificar una región de 700 pb río arriba del sitio NaeI que delimitaba el promotor L. Utilizando como templado el vector pVL1393, se amplificó el fragmento de 700 pb por PCR con el oligonucleótido sentido XLFOR (5´ AATCATGAAACATATTGTACAAAACCGACGA 3´), con sitio de corte para la enzima BspHI (subrayado) y el oligonucleótido antisentido XXLREV (5´ AATCATGATTGCAAACGTGGTTTTCGTGTGC 3´), también provisto del sitio de corte para la enzima BspHI (subrayado). La reacción se llevó a cabo utilizando la polimerasa GoTaq con los reactivos ya descritos y se utilizó el siguiente ciclado: 95 °C 5 min, (95 °C 30 s, 60 °C 30 s, 72 °C 1 min) x 35 ciclos, 72 °C 5 min. El producto de esta reacción fue purificado y clonado en el vector pCR-2.1 TOPO. La presencia del inserto en el plásmido TOPO-XL fue analizada por restricción y el mismo fue aislado mediante digestión con la enzima BspHI. Por otro lado se digirió el plásmido pLCAT con la misma enzima, se purificó el vector linealizado y se realizó la desfosforilación de sus extremos 5´ con la enzima CIP. El vector y el inserto fueron ligados molecularmente en una relación V:I de 3:1 y se aislaron colonias de bacterias resistentes a ampicilina. Los clones positivos se reconocieron por restricción y una posterior secuenciación confirmó la identidad del vector con el promotor de poliedrina XL (por extra largo). 10.2 Obtención del vector pSCAT El vector con el promotor mínimo de poliedrina fue obtenido a partir del plásmido pLCAT, por restricciones secuenciales. El vector pSCAT (S por short, corto en inglés) debía poseer solamente la región promotora básica de 95 pb, delimitada por el sitio EcoRV. La restricción del plásmido pLCAT con las enzimas BspHI y EcoRV permitió eliminar las secuencias río arriba de ese promotor mínimo. Debido a que la enzima EcoRV presenta dos sitios de corte en el vector pLCAT, fue necesario realizar una digestión parcial para obtener el vector digerido en el sitio deseado, pero intacto en el otro, y luego digerir con BspHI para obtener el fragmento necesario para la religación. Brevemente, la digestión parcial con EcoRV se llevó a cabo en varias reacciones utilizando diluciones seriadas al medio de enzima, desde 1 μl a 0,015 μl para aislar el vector linealizado, es decir, digerido sólo en un sitio EcoRV. Las reacciones se incubaron a 37 °C por 2 h y se sometieron a electroforesis en geles de agarosa al 1 %. Se logró purificar el vector 49 Materiales y Métodos digerido en el sitio deseado, por reconocimiento del tamaño esperado, utilizando como referencia el marcador de peso molecular 1 kb Plus. Luego, el vector linealizado fue sometido a restricción por la enzima BspHI, para eliminar el fragmento de 222 pb río arriba del promotor mínimo de poliedrina. El producto de la digestión total con BspHI se sometió a electroforesis en gel de agarosa y se aisló el vector linealizado de 3.804 pb. El siguiente paso fue el rellenado de extremos cohesivos utilizando nucleótidos y el fragmento klenow de la polimerasa, como fue descrito en el punto 4.4 de Materiales y Métodos. De esta manera, se pudo ligar molecularmente este fragmento que no posee regiones regulatorias de poliedrina río arriba del promotor básico delimitado por el sitio EcoRV. La identidad de este vector fue analizada por restricción con las enzimas BglII y XbaI (esperándose un patrón de tres bandas de 738 pb, 1.217 pb y 1.849 pb) y posterior secuenciación. 10.3 Obtención del vector pXXLCAT El vector con la región regulatoria más extensa río arriba del promotor mínimo fue obtenido utilizando como base al plásmido pLCAT. En primer lugar, se amplificó la secuencia de la región homóloga hr1 (nucleótidos 133.696 al 682 del genoma secuenciado de AcMNPV) (Guarino et al., 1986) que sería introducida a manera de enhancer transcripcional. Se diseñaron los oligonucleótidos hr1FOR (5´ ATTGATCATCATGAATCGATGATTGACCCCAACAAAA 3´) que posee sitios de corte para las enzimas BclI (subrayado) y BspHI (negrita) y hr1REV (5´ ATTGATCAATCGATTATTGCTCCAATACTAG 3´) que posee sitio de corte para la enzima BclI (subrayado). Utilizando como molde ADN de baculovirus AcMNPV salvaje, los oligonucléotidos hr1FOR y hr1REV y la enzima Gotaq, se amplificó una secuencia de 881 pb utilizando el siguiente ciclado de temperaturas: 95 °C 5 min, (95 °C 40 s, 56 °C 40 s, 72 °C 50 s) x 35 ciclos, 72 °C 5 min. La banda del peso molecular esperado fue escindida del gel de agarosa, purificada utilizando el kit comercial QIAEX II y clonada en el vector pGEMT-easy. El fragmento de la región hr1 se recuperó por digestión con la enzima BclI. Esta enzima de restricción es sensible a la metilación dam ya que su sitio de reconocimiento incluye la secuencia GATC, donde la metilasa dam agrega un grupo metilo (sobre el nitrógeno 6 de la adenina). El ADN aislado a partir de bacterias dam+ contiene Gm6ATC y no es digerido por BclI. Por lo tanto, se seleccionaron 2 clones que poseían el inserto y con ellos se transformaron bacterias de genotipo dam- , incapaces de metilar. De igual manera se procedió con el plásmido pVL1393. Una vez 50 Materiales y Métodos aislados el nuevo plásmido pGEMT-hr1 y el vector pVL1393 no metilados, se procedió a la digestión de ambos con la enzima BclI a 50 °C por 2 h. Se corrieron los productos de digestión en geles de agarosa 1 % y se purificaron las bandas correspondientes al vector pVL1393 linealizado y del fragmento de 881 pb. Se desfosforilaron los extremos 5´ con la enzima CIP y luego de su purificación se los ligó molecularmente en una relación V:I de 3:1. Se analizó por restricción un grupo de clones positivos, para corroborar la presencia del inserto en la orientación correcta. Se seleccionó un clon, cuya identidad fue confirmada por secuenciación. A este plásmido se lo llamó pVL-hr1. De este vector se extrajo la región regulatoria de 1.537 pb río arriba del promotor de poliedrina más la región hr1 de 881 pb, es decir, una secuencia de 2.418 pb que fue denominada región XXL. Una vez obtenida, se introdujo en el vector pLCAT. Para ello, se amplificó la región XXL a partir del plásmido pVL-hr1, utilizando los oligonucleótidos hr1FOR y XXLREV y la enzima Gotaq con un ciclo de temperaturas de: 95 °C 5 min, (95 °C 30 s, 53 °C 30 s, 72 °C 1 min 30 s) x 35 ciclos, 72 °C 7 min. El producto de la reacción de PCR fue corrido en gel de agarosa 1 % y purificado para ser clonado en el plásmido pCR-2.1 TOPO. Una vez analizada la integridad del inserto en el vector intermediario, se lo liberó por digestión con la enzima BspHI y se lo subclonó en el vector pLCAT digerido con la misma enzima y al cual se le desfosforilaron los extremos 5´ utilizando la enzima SAP (Promega). Los clones obtenidos fueron analizados para corroborar la orientación del inserto XXL mediante ensayos de PCR, utilizando los oligonucleótidos hr1FOR y SBR (5´ TAACGGTTCGTACAACA 3´ que hibrida en una región del promotor de poliedrina existente en el plásmido pLCAT). Una vez reconocido el clon que portaba el inserto en orientación correcta, se lo secuenció para corroborar su identidad. Así se obtuvo el plásmido pXXLCAT de 6.448 pb con una región regulatoria de 2.640 pb río arriba del promotor mínimo de poliedrina. 11. Expresión transitoria por las distintas regiones regulatorias de poliedrina 11.1 Transfecciones e infecciones para la expresión transitoria del gen reportero Las transfecciones con los plásmidos anteriormente descritos se llevaron a cabo en células Sf9 cultivadas en placas de 24 pocillos. Brevemente, se sembraron 10 placas con 1,5 x 105 células por pocillo en medio Sf900II SFM sin agregado de suero fetal y se las dejó adherir 1 h a temperatura 51 Materiales y Métodos ambiente. Las transfecciones se realizaron utilizando dos placas por plásmido a ensayar. De ambas, una sólo fue transfectada y la otra transfectada e infectada. Las transfecciones se realizaron por triplicado por cada plásmido y por cada tiempo de cosecha: desde el 1° al 7° día post transfección (dpt). Se transfectaron los vectores pSCAT, pLCAT, pXLCAT, pXXLCAT y como control pcCAT, utilizando el lípido catiónico Celfectina. Por cada pocillo, se agregó un volumen total de mezcla de transfección de 100 μl conteniendo 0,8 μg de vector más 2,5 μl de Celfectina en medio Grace´s (Gibco). Se dejó incubando a 27 °C. Debido a que el promotor de poliedrina es activado por factores virales tardíos, 4 h después de la transfección a las células de la segunda placa de cada construcción se les retiró el medio de transfección y se las infectó con el baculovirus AcPOL- a una moi de 1. Se dejó adsorber el virus durante 1 h a 27 °C y luego se retiró el inóculo y se agregó a las células medio fresco suplementado con 3 % SFB. En una placa separada se incluyeron los siguientes controles: i) células sin transfectar ni infectar; ii) células mock transfectadas (transfectadas utilizando Celfectina sin ADN); iii) células mock transfectadas e infectadas; iv) células sólo infectadas. Luego del tratamiento, las células fueron incubadas a 27 °C. La cosecha de las muestras se realizó a los 1, 2, 3, 4, 5, 6 y 7 dpt (Figura M3). D7 D7 D7 D7 Figura D7 D7 M3. Diseño del experimento para analizar la expresión del gen reportero D7 D7 CAT utilizando los plásmidos con distintas regiones regulatorias de poliedrina. D7 D7 52 Materiales y Métodos 11.2 Análisis de la actividad del gen reportero CAT 11.2.1 Cosecha de las muestras Desde el día 1 hasta el día 7 post transfección se cosecharon las células correspondientes a los triplicados de ambos eventos: transfección o transfección-infección de cada plásmido. Los controles se cosecharon a los 3 dpt. A cada tiempo, se retiró el medio de transfección, se lavaron las células tres veces con PBS pH 6,2, libre de Ca++ y Mg++ con cuidado de no despegar las células y se agregó 80 μl de Reporter Lysis Buffer 1X (Promega) en cada pocillo. Se incubó 15 min a temperatura ambiente agitando cada tanto y se colectó el contenido de cada pocillo en tubos de 1,5 ml, en hielo. Se agitó cada muestra utilizando vortex por 15 s y se calentó a 60 °C durante 10 min para inactivar la actividad de desacetilasas. Luego de esa incubación, se centrifugó 2 min a 8.000 x g y se pasó el sobrenadante a nuevos tubos. Las muestras fueron guardadas a - 80° C hasta que fue realizado el ensayo de medición de actividad del reportero. 11.2.2 Ensayo de CAT La expresión y actividad de la enzima CAT se determinó cuantitativamente a través de la combinación de los sustratos 14 C-cloranfenicol y n-butiril CoA (Promega). El producto de reacción (n-butiril-cloranfenicol) se separa del cloranfenicol libre por ser soluble en solventes orgánicos. Los extractos celulares fueron diluidos al cuarto para evitar saturación enzimática y fueron medidos en un contador de centelleo líquido EG&G/Wallac 1414-001 WinSpectral, con un protocolo para el isótopo 14C. Brevemente, por cada 75 μl de muestra diluida en Reporter Lysis Buffer, se agregaron 50 μl de una mezcla de 3 μl n-butirilCoA 5 mg/ml y 5 μl de 14 C-cloranfenicol 60 mCi/mmol en agua bidestilada. En paralelo se realizó una curva de actividad de CAT, utilizando la enzima en cinco concentraciones distintas. Partiendo de una concentración inicial de 0,1 U/μl, se ensayaron las diluciones 1/16, 1/64, 1/264 y 1/1.024. A un volumen de 5 μl de cada dilución de enzima CAT se le agregó una mezcla de 120 μl con 3 μl n-butirilCoA y 5 μl de 14 C-cloranfenicol en agua bidestilada. Todas las muestras fueron incubadas durante 3 h a 37 °C, para que proceda la reacción. 53 Materiales y Métodos 11.2.3 Extracción y medición de radioactividad Una vez transcurrido el tiempo de reacción, se tomaron las muestras y se les extrajo la fracción acetilada mediante el agregado de una fase orgánica en la cual quedarían retenidas. Se utilizó para ello 300 μl de una mezcla de xilenos (MP Biomedicals) por tubo de reacción y se extrajo 3 veces, recuperando la fase orgánica y agregando 100 μl de Tris-HCl pH 8 frío para eliminar todo resto de sustrato libre. Por último, se agregaron 200 μl de muestra en tubos para contador de centelleo (Polistor) y se agregaron 1,5 ml de líquido de centelleo (SIGMA) para ser medidos en el contador. Los resultados de la medición de actividad de CAT obtenidos en cuentas por minuto (cpm) fueron promediados para los triplicados de cada muestra y se realizó el cálculo del desvío estándar. 12. Obtención de los vectores para transfecciones estables La transformación de células de insecto para la expresión de poliedrina se llevó a cabo con el sistema InsectSelectTM BSD (Invitrogen). Se obtuvieron construcciones basadas en los plásmidos pXXLCAT (Figura R4) y pIB/V5-His (Invitrogen) (Figura M4). El plásmido pIB/V5-His posee el promotor constitutivo OpIE2 río arriba de un sitio de múltiple clonado y posee resistencia al antibiótico blasticidina S (Invitrogen) para su selección en células de insecto. Figura M4. Vector utilizado para obtener las construcciones finales empleadas en la transformación de células Sf9. 54 Materiales y Métodos 12.1 Construcción del plásmido pXXLPOL El vector con el gen poliedrina bajo el control de una región regulatoria de 2.640 pb río arriba del promotor mínimo se obtuvo a partir del plásmido pXXLCAT. Para su construcción, la secuencia codificante de poliedrina fue amplificada por PCR a partir del genoma de baculovirus utilizando el oligonucleótido sentido POL-ATG, que incluye en su secuencia el codón de inicio de la traducción, y el antisentido POL-STOP, que incluye el codón te terminación de la traducción de poliedrina. La reacción de PCR se llevó a cabo utilizando la enzima Gotaq y el siguiente ciclo de temperaturas: 95 °C 5 min, (95 °C 30 s, 55 °C 30 s, 72 °C 30 s) x 35 ciclos, 72 °C 7 min. Una banda de 736 pb correspondiente al gen pol se purificó del gel de agarosa y se clonó en el vector pCR2.1 TOPO. Posteriormente, el vector TOPO-POL fue digerido con la enzima EcoRI para desprender el gen de interés. Por otro lado, se digirió al vector pXXLCAT con las enzimas SpeI y XhoI para eliminar del vector la secuencia del gen reportero CAT. Ambos fragmentos de tamaño esperado (vector de 5.345 pb e inserto de 736 pb) fueron purificados del gel de agarosa, tratados con el fragmento Klenow de la enzima ADN Pol II para rellenar los extremos cohesivos y ligados molecularmente en una relación V:I de 3:1, previo tratamiento del vector con la enzima SAP. El producto de ligación fue transformado en bacterias DH5α. La presencia del inserto en los clones resistentes seleccionados se analizó por restricción y se confirmó por secuenciación. 12.2 Construcción del plásmido pCPOL El plásmido pCPOL, equivalente a pCCAT, fue construido por inserción de poliedrina bajo el control del promotor constitutivo OpIE2 de baculovirus en el vector pIB/V5-His. Brevemente, la secuencia codificante de poliedrina fue amplificada por PCR a partir de ADN de baculovirus salvaje utilizando el oligonucleótido sentido POL-ATGk (5’ TAAATATGGCGGATTATTCATACCGTCC 3´) que contiene, rodeando el codón de inicio de la traducción (subrayado), el consenso de Kozak para la expresión a partir de promotores baculovirales tempranos (en negrita) (Kozak, 1987); y el oligonucleótido antisentido POL-STOP. La reacción se llevó a cabo con la enzima Gotaq y el siguiente ciclo de temperaturas: 95 °C 5 min, (95 °C 30 s, 55 °C 30 s, 72 °C 30 s) x 35 ciclos, 72 °C 7 min. La banda correspondiente a la secuencia codificante de poliedrina fue escindida del gel, purificada y clonada en el vector pCR2.1 TOPO. Se digirieron los vectores TOPO-POLk y pIB/V5-His con la enzima EcoRI. El vector receptor fue tratado con la enzima SAP y las reacciones se corrieron en un gel de agarosa 1 %. 55 Materiales y Métodos Los fragmentos de tamaño esperado (760 pb de POL y 3.521 de pIB/V5-His) fueron purificados y tanto vector como inserto fueron ligados molecularmente a 16 °C toda la noche. Con el producto de ligación se transformaron bacterias competentes y se aislaron colonias resistentes a ampicilina. Los clones positivos fueron reconocidos por restricción y posterior secuenciación. 13. Transfecciones 13.1 Construcción del vector pCGFP para el cálculo de la eficiencia de transfección Para la construcción del vector pcGFP, la secuencia codificante de EGFP se obtuvo por digestión del plásmido pCDNA-EGFP (previamente construido en el laboratorio) con las enzimas HindIII y XbaI y se ligó al vector pIB/V5-His digerido con las mismas enzimas. Los clones positivos por restricción con la enzima BamHI fueron confirmados por secuenciación. 13.2 Determinación de la eficiencia de transfección bajo distintas condiciones Se probaron distintas condiciones de transfección en células crecidas en placas de 24 pocillos. Brevemente, se sembraron 2 x 105 células por pocillo en medio Sf900II SFM sin agregado de SFB y se dejaron adherir aproximadamente 1 h a temperatura ambiente. En cada pocillo se ensayó una combinación distinta de ADN y Celfectina. En una placa de 96 pocillos se realizaron las combinaciones que permitieron ensayar las siguientes cantidades de Celfectina: 1; 1,5; 2; 2,5; 3 y 3,5 μl y las siguientes cantidades de ADN: 0,2; 0,4; 0,8 y 1 μg. Las mezclas de transfección se realizaron en un volumen final de 200 μl y se incubaron a temperatura ambiente por 15 min. Las células de la placa de 24 pocillos fueron lavadas con medio fresco una vez y se les agregó el volumen total de cada mezcla de tranfección. Se incubó la placa a 27 °C por 5 h y se les retiró el medio de transfección para agregar medio Sf900II SFM fresco, suplementado con SFB. Luego de 24 horas post transfección (hpt) se observó fluorescencia al microscopio óptico y se determinó el número de células fluorescentes y de células totales por campo, para calcular el porcentaje de células transfectadas en cada condición. 56 Materiales y Métodos 13.3 Transfecciones transitorias Como primera aproximación al estudio de la expresión de poliedrina a partir de los plásmidos obtenidos, se realizaron transfecciones transitorias de células Sf9. Para ello, se sembraron placas de 6 pocillos con 7x105 células en cada uno y se transfectaron con: pCPOL o pXXLPOL, por duplicado. La mezcla de transfección contenía 2,5 μg de plásmido y 5 μl de Celfectina para cada pocillo, en un volumen final de 1 ml. Para el cálculo de la eficiencia de transfección se transfectó 1 pocillo de células con el vector pCGFP bajo las mismas condiciones. A las 4 hpt, se retiró el medio de transfección y se infectó uno de los duplicados para cada plásmido con el baculovirus AcGFPpol-, a una moi de 1, lo que permitió monitorear el curso de la infección mediante visualización de fluorescencia al microscopio. A los 4 dpt las células fueron cosechadas para el análisis de expresión del transgén. 13.4 Determinación de la concentración mínima inhibitoria del antibiótico de selección Las construcciones derivadas del plásmido pIB/V5-His contienen la secuencia que confiere resistencia al antibiótico blasticidina S que será utilizado como agente selectivo para obtener líneas transformadas. Se ensayaron diferentes concentraciones de blasticidina en células Sf9 para determinar la concentración mínima inhibitoria del mismo. Para esto se sembraron 2 x 105 células por pocillo en placas de 24, en medio Sf900II SFM-3 % SFB y se trataron con distintas concentraciones del antibiótico (20, 40, 60, 80, 100 μg/ml). La viabilidad celular se evaluó en el transcurso de 4 días mediante la técnica de exclusión del colorante azul tripán. 13.5 Transformación estable de células Sf9 Las transfecciones estables se realizaron en placas de 6 pocillos con 7 x 105 células Sf9 en cada uno, utilizando 2,5 μg de plásmido y 5 μl de Celfectina por reacción. Los controles del experimento consistieron en i) células mock transfectadas ii) células sin tratamiento iii) células sólo infectadas. Paralelamente, se transfectaron células Sf9 con el plásmido pCGFP para el cálculo de la eficiencia de transfección. A las 48 hpt, se retiró el medio y se agregó medio nuevo con 60 μg/ml de blasticidina, para la selección de las células establemente transformadas. Para establecer las líneas celulares policlonales, las monocapas confluentes se transfirieron consecutivamente a soportes de mayor 57 Materiales y Métodos tamaño (frascos de 25 y 75 cm2) en medio de cultivo Sf900II SFM y blasticidina en concentración decreciente con los pasajes, hasta mantenerlas con una concentración constante de 10 μg/ml. Una vez alcanzada esta concentración de antibiótico, parte de las células fueron congeladas en N2 líquido y otra parte fue utilizada en posteriores ensayos de caracterización de la línea establemente transformada. 14. Metodologías utilizadas con la línea estable que expresa poliedrina 14.1 Extracción de ADN de células Sf9 Para aislar ADN total de células de insecto se procedió a resuspender las células provenientes de un frasco de 75 cm2 en 3 ml de buffer RSB-1 % NP40 (Tris-HCl pH 7,4 10 mM; NaCl 10 mM; MgCl2 1,5 mM; NP40 1 %), pipeteando hasta que no queden grumos. Luego de incubar el lisado por 30 min en hielo, se centrifugó por 30 s a 8.000 x g para precipitar los núcleos celulares. El sobrenadante se descartó y se resuspendió el pellet en 1,5 ml de buffer de proteinasa K (200 mM Tris-HCl pH 7,5; 25 mM EDTA; 300 mM NaCl; 2 % SDS; en agua). Se agregó 1,2 mg de la enzima proteinasa K (60 μl de un stock de 20 mg/ml) y se incubó por 2 h a 50 °C. Luego se extrajo la fracción soluble con un volumen de fenol-cloroformo-alcohol isoamílico (25:24:1) y se centrifugó 3 min a 10.000 x g para recuperar la fase acuosa. El ADN se precipitó con dos volúmenes de etanol, previa incubación a -70 °C al menos 30 min. El pellet se obtuvo por centrifugación 20 min a 10.000 x g, se lavó con etanol 70 %, se secó y se resuspendió en 200 μl de TE (Tris-HCl pH 8 10 mM, EDTA 1 mM) 0,1X con ARNasa A a una concentración final de 40 μg/ml. 14.2 PCR de muestras de ADN de la línea Sf9POL Para corroborar que el transgén se insertó en el genoma de las células Sf9, se realizó una PCR a partir de ADN de la línea Sf9POL utilizando los oligonucleótidos que permitieron amplificar la secuencia completa de poliedrina de 737 pb de longitud (POL-ATG y POL-STOP). La reacción se llevó a cabo utilizando la enzima Gotaq y con un ciclo de temperaturas como en el descrito en el item 12.1 58 Materiales y Métodos 14.3 RT-PCR La extracción de ARN total a partir de células Sf9 se realizó utilizando el kit comercial RNeasy Mini Kit (QIAGEN), siguiendo el protocolo sugerido por el comerciante. En un primer paso el ARN se sometió al a la acción de ADNasas, incubando 2 μg de ARN con 1 U de DNAsaI (Invitrogen) en 1X final de buffer DNAsa. La reacción se incubó 15 min a temperatura ambiente y se inactivó la enzima por agregado de 25 mM EDTA y calentamiento a 65 °C por 15 min. En un segundo paso se realizó la transcripción reversa. Brevemente, al ARN tratado con DNAsaI se lo desnaturalizó junto al oligonucleótido específico POL-STOP a 70 °C por 5 min, y luego se lo mantuvo en hielo. La reacción de transcripción reversa se llevó a cabo por agregado de 1X final de MMLV buffer, 0,1 M de DTT, 10 mM de una mezcla de los 4 deoxi-nucleótidos y 1 U de la enzima transcriptasa reversa (MMLV-RT, Promega). Esta reacción se incubó 1 h a 42 °C y luego fue colocada en hielo. El paso final fue la amplificación por PCR a partir de 3 μl de ADNc, como se describió en el punto 12.1. 14.4 Inducción de la expresión de poliedrina por infección A partir de la segunda semana de selección con blasticidina, se procedió a infectar las líneas estables con el baculovirus AcGFPpol- o AcPOL- a una moi de 1. Se investigó la presencia de cuerpos de oclusión al microscopio óptico a partir de las 48 h. 14.5 Cinética de expresión de poliedrina Para estudiar la expresión de poliedrina, en placas de 6 pocillos se sembraron 2 x 106 células Sf9 por pocillo y en otras placas se sembró el mismo número de células de la línea Sf9POL por pocillo. Las células se infectaron con los baculovirus AcMNPV wt y AcPOL-, respectivamente a una moi de 10. Las cosechas se realizaron a las 6, 18, 24, 30, 42, 48, 54 y 66 hpi, por duplicado. Se retiró el medio de cultivo y se resuspendieron las células en 1 ml de PBS pH 6,2. Luego de centrifugar 2 min a 8.000 x g, las células se resuspendieron en 500 μl de H2O bidestilada y se disolvieron los poliedros existentes en las muestras por agregado de 0,1 M de Na2CO3. Luego se agregó un volumen adecuado de buffer cracking 4X (Tris-HCl 200 mM pH 6,8, glicerol 40 %, SDS 8 %, 2-mercaptoetanol 400 mM, azul de bromofenol 0,1 %). Los extractos se guardaron a -20 °C 59 Materiales y Métodos hasta que fueron sometidos a SDS-PAGE y Western blot utilizando un anticuerpo policlonal de pollo anti-poliedrina y como segundo anticuerpo un anti-pollo conjugado con fosfatasa alcalina. 14.6 Aislamiento de OB Los cuerpos de oclusión a partir de la línea Sf9POL se obtuvieron infectando 1,2 x 107 células totales en botellas de 175 cm2 con los baculovirus AcPOL- o AcGFPpol-. A los 5 dpi los poliedros se purificaron según O´Reilly (O´Reilly et al., 1994). Brevemente, las células fueron sedimentadas a 5.000 x g por 5 min y resuspendidas en 7 ml de SDS 0,5 %. El lisado fue centrifugado por 10 min a 5.000 x g y resuspendido en el mismo volumen de NaCl 0,5 M. Finalmente los poliedros fueron sedimentados a 5.000 x g por 5 min, resuspendidos en 1 ml de H2O bidestilada y contados en una cámara de Neubauer. 14.7 Muestras de ADN extraídas de poliedros El ADN de los virus ocluidos se obtuvo según O´Reilly (O´Reilly et al., 1994). Los poliedros fueron sedimentados y disueltos agregando Na2CO3 0,1 M a una concentración de 1 x 109 poliedros/ml por 30 min a temperatura ambiente. Se agregó Tris-HCl 1 M pH 7,6 a una concentración final de 0,1M, se clarificó la suspensión a 8.000 x g por 10 min y se agregó EDTA y SDS a concentraciones finales de 10 mM y 25 %, respectivamente. Finalmente, se agregó 500 μg/ml de proteinasa K y se dejó proceder la digestión 6 h a 37 °C. El ADN se purificó por extracciones secuenciales con fenol, fenol-cloroformo-alcohol isoamílico y cloroformo. Se precipitó con etanol y se resuspendió en 100 μl de TE. 14.8 Determinación de la presencia de VP39 en los poliedros como prueba de oclusión de la línea Sf9POL Se tomaron 50 μl de solución de poliedros salvajes (wt) y de la línea Sf9POL (ambas soluciones contenían el mismo número de poliedros) y se les colocó un volumen adecuado de buffer cracking 4X. La muestra se calentó a 65 °C por 10 min para desprender los baculovirus que pudieran quedar adheridos a la superficie de los poliedros. A continuación se centrifugó, se separó el sobrenadante (S) y se procedió a disolver la poliedrina de los pellets (P) con una solución alcalina 60 Materiales y Métodos de Na2CO3 0,5 N. Las muestras S y las P se corrieron en geles de poliacrilamida 12 % y se transfirieron a membranas de nitrocelulosa para ser enfrentadas con un anticuerpo monoclonal anti-VP39. A continuación, se incubó con un segundo anticuerpo anti-ratón acoplado a fosfatasa alcalina y se reveló con el reactivo NBT-BCIP. 14.9 Microscopía electrónica de transmisión Las células se fijaron en glutaraldehido al 2,5 % en buffer Millonig pH 7,2 (Millonig, 1961), luego se lavaron 3 veces con el mismo buffer, centrifugando a 2.000 x g cada vez. Luego, se realizó una post fijación en tetróxido de osmio 2 % en agua durante 2 h, se lavaron 3 veces con agua bidestilada por centrifugación a 2.000 x g y se empaquetaron en agar. Las muestras así empaquetadas se deshidrataron en etanol de concentración ascendente (50, 70, 96, 100 %) y acetona y se realizó una preinclusión en resina durante toda la noche (1 volumen de acetona y 1 volumen de resina Spurr). Al siguiente día, se realizó la inclusión en un taco de resina Spurr pura, que polimeriza durante 72 h a 56 °C. El taco fue tallado y se realizaron cortes de 60-90 nm con un ultramicrótomo. Los cortes se recogieron en grillas de cobre y se contrastaron con sales pesadas (coloración de Uranilo-Reynold's), para luego observarse en el microscopio electrónico de transmisión JEOL 1200EX-II del Servicio de Microscopía Electrónica del Instituto Nacional de Tecnología Agropecuaria (INTA), Castelar. 15. Bioensayos 15.1 Larvas Las larvas de Rachiplusia nu fueron mantenidas en el Laboratorio de Cría de Insectos del Instituto de Microbiología y Zoología Agrícola (IMyZA) del INTA-Castelar según métodos clásicos para la especie. Se las alimentó con una dieta artificial, en base a porotos de soja y vitaminas. Cuando las larvas alcanzaron el tercer estadio, fueron separadas en placas de 24 compartimientos. En la figura M5 se puede observar una placa de mantenimiento con larvas del último estadio. 61 Materiales y Métodos Figura M5. Larvas de Rachiplusia nu mantenidas en placas de 24 compartimientos, ingiriendo cubos de dieta artificial. 15.2 Prueba de infectividad en larvas de Rachiplusia nu 15.2.1 Condiciones de infección Se eligieron al azar 3 grupos de 6 larvas del tercer estadio de R. nu y se los infectó oralmente con distintas fuentes de inóculo: poliedros obtenidos por infección de células con el baculovirus recombinante AcGFPpol+, poliedros wt y poliedros obtenidos de la línea celular Sf9POL infectada con el baculovirus AcGFPpol-. Luego de hambrear las larvas durante toda la noche, se colocaron 1 x 105 poliedros totales por inóculo, embebidos en la dieta artificial. Las larvas se colocaron separadas en placas de 6 pocillos, a 26 °C y en oscuridad. Día a día se las monitoreó bajo lupa y microscopio óptico con luz UV, para observar fluorescencia de GFP como signo de infección. 15.2.2 Medición de fluorescencia Al día 4 post infección se realizaron extractos larvales para medición de fluorescencia. Brevemente, se pesó cada larva en tubos de 1,5 ml y se le agregó dos volúmenes de buffer de lisis con inhibidores de proteasas (DTT 5 mM, Tritón X-100 0,5 %, EDTA 1 mM, PMSF 10 mM y leupeptina 10 g/ml en PBS pH 6,2). Se homogeneizó cada muestra y se clarificó dos veces por centrifugación, 5 min a 10.000 x g. El sobrenadante, libre de cutícula y otros componentes de la larva, fue separado. Se dosaron proteínas totales de cada muestra con el kit Protein Assay Kit (Biorad) que se basa en el método de Bradford y se sembraron cantidades iguales de proteínas en placas de 96 pocillos negras opacas. La lectura de la fluorescencia, a la longitud de onda que corresponde a GFP, se realizó en el fluorómetro Spectra MAX Gemini EM (Molecular Devices). 62 Materiales y Métodos 15.2 Curvas de mortalidad Se realizaron curvas de mortalidad en larvas de R. nu infectadas oralmente con poliedros de distinta composición: AcPOLE44G, AcPOL- ocluido por la línea Sf9POL (AcPOL-/Sf9POL) y AcMNPV wt. Para ello, se seleccionaron al azar larvas del tercer estadio. Se individualizaron en 8 placas de 6 compartimientos y se las mantuvo en ausencia de alimento por 6 h hasta el momento de la infección. La dosis de inóculo ensayada fue 1 x 105 poliedros totales depositados sobre cubos de alimento artificial de 3 mm2. Se infectaron 12 larvas por inóculo. A dos grupos de 6 larvas se le administró el mismo volumen de PBS como control negativo. Luego de la infección las placas se incubaron a 26 °C y fueron monitoreadas diariamente para determinar el porcentaje de muertes, hasta que todas las larvas inoculadas con PBS llegaron al estado de pupa. 63 Resultados Resultados Resultados Este trabajo de tesis propone ampliar los conocimientos acerca de los requisitos necesarios para situar el gen de poliedrina con sus regiones regulatorias en el genoma de células de insecto, de manera de lograr que se produzca la síntesis de poliedrina luego de la infección con baculovirus pol- y que los mismos se ocluyan en poliedros. El Capítulo I describe los resultados obtenidos en el desarrollo de una línea celular de insecto que expresa poliedrina. Se trata sobre la eficiencia de las regiones promotoras diseñadas para guiar la transcripción del gen pol y ensayadas en transfecciones transitorias, la expresión y capacidad de acople de poliedrina para conformar los cuerpos de oclusión y los bioensayos para evaluar la eficiencia de la línea transformada para ocluir baculovirus infectivos. En el Capítulo II se describe el efecto de una mutación puntual en el gen poliedrina que produce poliedros morfológicamente diferentes a los que se observan por infección con un baculovirus salvaje, posiblemente como consecuencia de un defecto en el ensamblaje de las proteínas que conforman el cuerpo de oclusión. 64 Resultados- Capítulo I Capítulo I Oclusión de baculovirus pol- por trans-complementación de poliedrina en una línea Sf9 establemente transformada 1. Construcción de los baculovirus recombinantes utilizados en este trabajo 1.1 Obtención del baculovirus AcGFPpolEl baculovirus AcGFPpol- fue construido por reemplazo alélico de poliedrina por el gen de la proteína verde fluorescente (GFP) a fin de facilitar el seguimiento del proceso de infección, mediante la visualización de la fluorescencia emitida por GFP cuando es irradiada por fotones de una longitud de onda de 450-490 nm. En cultivos in vitro de células Sf9, la infección con el baculovirus AcGFPpol- genera el efecto citopático característico de los baculovirus occ- visible a luz blanca y al ser irradiado con luz azul, el citoplasma de las células fluoresce de color verde intenso. Este baculovirus fue empleado no sólo en el seguimiento de la infección de líneas celulares, sino también para la evaluación de la infección de larvas inoculadas por vía oral. 1.1.1 Construcción del vector de transferencia pFastBacGFP Para la construcción del vector de transferencia pFastBacGFP empleado en la obtención del baculovirus AcGFPpol- por la metodología Bac-to-Bac, la secuencia del gen GFP de 716 pb se clonó en el vector pFastBac-1 según se describe en Materiales y Métodos. La presencia de GFP en varios clones aislados se analizó por digestión enzimática y posterior secuenciación (no mostrado). La figura R1 muestra el vector de transferencia pFastBac-GFP. Tn7L Origen f1 SV40 pA Promotor bla XbaI Amp(R) GFP Figura R1: Esquema del vector de pFastbac-GFP XbaI 5499 bp Promotor POL transferencia construido para la obtención del baculovirus AcGFPpol-. Origen pUC Promotor Pc Gm(R) Tn7R 65 Resultados- Capítulo I 1.1.2 Obtención del baculovirus recombinante Para obtener el bácmido recombinante que porta el gen GFP bajo la regulación del promotor de poliedrina, se transformaron bacterias E. coli DH10Bac con el plásmido de transferencia pFastBac-GFP. Se seleccionaron bacterias resistentes a los antibióticos kanamicina, tetraciclina y gentamicina y un número discreto de colonias blancas se cultivó en medio líquido con los tres antibióticos mencionados. Los bácmidos de aproximadamente 140 kpb fueron extraídos y la presencia del cassette transpuesto se confirmó mediante PCR con oligonucleótidos específicos amplificándose en el caso de los bácmidos recombinantes una banda de aproximadamente 3.300 pb en contraste con una de 300 pb correspondiente al producto de amplificación de los bácmidos que no recombinaron (Figura R2). Una vez confirmada la identidad del bácmido recombinante, se procedió a la transfección de células Sf9 como fue descrito en Materiales y Métodos. A los 5 días post-transfección (dpt) el sobrenadante de transfección se separó y con éste se infectaron nuevas células en botellas de 75 cm2, para la generación de un stock viral de trabajo. Al microscopio, las células infectadas con el baculovirus AcGFPpol- no presentaron poliedros y fluorescieron. El inóculo fue titulado por la técnica de dilución a punto final, rindiendo un título de 3,8 x 107 ufp/ml. M - B B/A A Figura R2: Análisis por PCR de los bácmidos 3054 ~3300 pb 2036 recombinantes aislados para la construcción del 1636 baculovirus AcGFPpol-. (-), control negativo de la reacción; B, colonia blanca; B/A, 506 ~300 pb colonia “mixta”; A, colonia azul. 1.2 Obtención del baculovirus AcGFPpol+ Como control positivo para la infección oral de larvas se construyó un baculovirus recombinante capaz de formar cuerpos de oclusión (occ+) que transporta el gen GFP bajo la regulación del 66 Resultados- Capítulo I promotor de poliedrina y conserva el gen poliedrina bajo la regulación de otro promotor tardío, p10. El baculovirus AcGFPpol+ fue construido según la técnica desarrollada por Je y colaboradores (Je et al., 2001) que consiste en la cotransfección de un plásmido de transferencia con ADN de un bácmido portador del genoma baculoviral, denominado bAcGOZA, con capacidad de replicación en bacterias E. coli. 1.2.1 Construcción del vector de transferencia pBacPAK-GFP Para la construcción del vector de transferencia se obtuvo la secuencia de GFP a partir del vector pGEMT-GFP y se insertó en el vector pBacPak8 bajo el control del promotor de poliedrina, manteniendo un copia de la secuencia codificante de poliedrina bajo el promotor p10. El análisis de la integridad del vector pBacPAK-GFP se realizó por PCR utilizando los oligonucléotidos PHEcoRV y GFPrev, que amplifican desde el sitio EcoRV del promotor de poliedrina hasta el final del gen GFP, esperándose una banda de 800 pb, aproximadamente (Figura R3). Seq AcNPV Ori + - M Promotor POL Amp(R) pBacPAK-GFP 6354 pb GFP ~800 pb 850 650 Origen f1 6xHis Señal PolyA ORF 1629 Figura R3: Esquema del vector de transferencia pBacPAK-GFP utilizado en la construcción del baculovirus recombinante AcGFPpol+. A la derecha se muestra el análisis por PCR con los oligonucleótidos PHEcoRV y GFPrev que confirma la identidad del vector. 1.2.2 Construcción del baculovirus recombinante El baculovirus AcGFPpol+ se obtuvo a partir de la cotransfección de células Sf9 con el plásmido pBacPAK-GFP y ADN del bácmido bAcGOZA. Este bácmido fue amplificado en bacterias E. coli 67 Resultados- Capítulo I y purificado a partir de las mismas. Luego de 5 dpt fue posible observar efecto citopático en las células, caracterizado por la presencia de cuerpos de oclusión. Con el sobrenadante de transfección se infectaron nuevas células en botellas de 75 cm2. Se realizaron dos pasajes del virus en células hasta obtener el stock de trabajo, el cual fue titulado por dilución a punto final rindiendo un título de 2,2 x 10 7 ufp/ml y fue utilizado en subsiguientes ensayos. En la figura R4 se esquematiza el genoma del baculovirus AcGFPpol+ obtenido mediante esta metodología. Promotor P10 Promotor POL Seq AcNPV POLIEDRINA Señ al Po lyA GFP ORF 1629 Figura R4: Esquema del baculovirus recombinante occ+, AcGFPpol+. Este baculovirus fue obtenido por Obtención cotransfección células Sf9 con el bácmido bAcGOZA y el vector pBAcPAK-GFP. 1.2.2 deldebácmido recombinante 1.3 Obtención del baculovirus AcPOLCon el objetivo de obtener un baculovirus que no pueda recombinar con secuencias del gen poliedrina, se construyó el baculovirus AcPOL- mediante la técnica BaculoGold. El diseño de este baculovirus se basó en la eliminación de todas las secuencias remanentes de poliedrina en el vector de transferencia. 1.3.1 Construcción del vector de transferencia pVL-1629 El plásmido pVL-1629 se construyó a partir del plásmido pVL1393, del cual se eliminaron por digestión 690 pb que incluyen la secuencia de poliedrina a partir del nucleótido (nt) 174. Debido a que esta metodología elimina una región del ORF 1629 esencial para la viabilidad de los baculovirus, se amplificó por PCR el fragmento faltante y se lo subclonó en el vector pVL1393 delecionado. La correcta inserción del fragmento del ORF 1629 en el vector pVL1393 se confirmó 68 Resultados- Capítulo I por restricción con la enzima HindIII. El fragmento del ORF 1629 interrumpe un sitio de corte de esta enzima en el vector pVL1393, esperándose un patrón de tres bandas en lugar de las cuatro que se observan por digestión del vector solo. El producto final de la estrategia de clonado y el ColE ori in d 29 H l-16 pV Amp(R) pV L13 93 H in d II I II I patrón de restricción que confirma la identidad del vector pVL-1629 se ilustran en la figura R5. M 4494 pb 5000 3422 pb 3000 pVL-1629 2000 1650 9029 bp 1036 pb 1000 850 650 500 Promotor POL ORF 1629 200 F1629 Figura R5: Esquema del vector de transferencia pVL-1629 utilizado en la construcción del baculovirus AcPOL-. A la derecha se muestra el análisis por restricción con la enzima HindIII. 1.3.2 Obtención del baculovirus recombinante por el método BaculoGold El baculovirus AcPOL- se obtuvo por cotransfección de células Sf9 con ADN lineal de baculovirus y el vector de transferencia pVL-1629. Luego de 5 dpt, habiéndose observado efecto citopático en las células, se recolectó el sobrenadante de transfección, se clarificó y se realizó una dilución al décimo con la que se infectó nuevamente células Sf9 en monocapa, para obtener el stock viral de trabajo. El mismo fue titulado por el método de placas de lisis rindiendo un título de 1,5 x 107 ufp/ml y conservado a 4 °C para utilizarse en ensayos posteriores. 69 Resultados- Capítulo I 2. Determinación de los elementos regulatorios mínimos necesarios río arriba de poliedrina: estudio de la expresión transitoria de un gen reportero La regulación transcripcional del gen muy tardío poliedrina (POL) en AcMNPV es un proceso complejo que aún no fue desentrañado con exactitud. Como se describió en el apartado 1.4 de la Introducción, se conoce que este proceso involucra factores tanto del baculovirus como de la célula hospedadora. Con el objetivo de definir las regiones regulatorias necesarias para una óptima expresión de poliedrina, se diseñaron vectores con distintas regiones del promotor POL regulando el gen reportero cloranfenicol acetil transferasa (CAT) para ser utilizados en ensayos de expresión transitoria. Las construcciones se obtuvieron a partir del plásmido comercial pIB/V5-His/CAT (Invitrogen) que lleva el gen reportero bajo la regulación del promotor temprano y constitutivo baculoviral OpIE2. Las modificaciones consistieron en el reemplazo del promotor OpIE2 por las distintas regiones regulatorias de poliedrina a ensayar. 2.1 Construcción de los plásmidos reporteros 2.1.1 Obtención del plásmido pLCAT El vector pLCAT, de 4.026 pb, se obtuvo sustituyendo el promotor constitutivo OpIE2 del plásmido pIB/V5-His/CAT por el promotor de poliedrina delimitado por el sitio NaeI, 222 pb río arriba de la región promotora básica (L por fragmento largo del promotor), con la estrategia ba I descrita en Materiales y Métodos. El vector se esquematiza en la figura R6. Ampicilina(R) M CAT 4052 bp XbaI (1178) Blasticidina(R) V5 650 Esquema vector reportero 222 pb río arriba de la secuencia promotora mínima. A 1000 850 R6. pLCAT, 4000 3000 pLCAT Figura del p XbaI (396) LC A T/ X Promotor L 782 pb la derecha se muestra el 6xHis OpIE2 PolyA Promotor OpIE1 pUC Ori análisis por restricción con la enzima XbaI. 70 Resultados- Capítulo I 2.1.2 Obtención del plásmido pXLCAT Para la construcción del vector pXLCAT de 4.726 pb, se modificó el plásmido pLCAT agregándole una secuencia regulatoria adicional de 700 nucleótidos río arriba del promotor de poliedrina. Esta secuencia contiene una región cuyo motivo CACCC se une a la proteína Sp1 de la célula hospedadora denominada AcSp. La estrategia de construcción se describe en Materiales y /B sp HI Métodos y sus principales características se detalla en la figura R7. p XL C Región XL Ampicilina(R) AT BspHI (1) M BspHI (706) Promotor L pXLCAT 4751 bp Blasticidina(R) CAT Promotor OpIE1 V5 6xHis pUC Ori OpIE2 PolyA Figura R7: Esquema del vector reportero pXLCAT con el promotor de poliedrina de 1.129 pb. Este vector posee 700 pb de una secuencia regulatoria río arriba del pL. A la derecha se muestra el análisis por restricción con la enzima BspHI. 2.1.3 Obtención del plásmido pSCAT El vector con el promotor mínimo de poliedrina fue obtenido a partir del plásmido pLCAT, por restricciones secuenciales. El vector pSCAT (S por short, corto en inglés) posee la región promotora básica de 95 pb, delimitada en el genoma por el sitio EcoRV. La restricción del plásmido pLCAT con las enzimas BspHI y EcoRV permitió eliminar las secuencias río arriba de ese promotor mínimo. Su construcción se detalla en Materiales y Métodos y las características más salientes se detallan en la figura R8. 71 I/X ba I glI I/X ba I Resultados- Capítulo I XbaI 3815 bp 6xHis Blasticidina(R) OpIE2 PolyA 2000 TB 1650 1849 1000 1217 850 738 650 Promotor EM7 p EcoRV pSCAT BglII M CAT p Ampicilina(R) L CA BglII S CA TB glI ex EcoRV Promotor S pUC Ori Promotor OpIE1 Figura R8: Esquema del vector reportero pSCAT, con el promotor mínimo de poliedrina de 95 pb. A la derecha se muestra el análisis de restricción con las enzimas BglII y XbaI que confirma la identidad del vector. 2.1.4 Obtención del vector pXXLCAT Para construir el vector con la región regulatoria más extensa río arriba del promotor mínimo se empleó como base el plásmido pLCAT. La secuencia de hr1 de 881 pb se encuentra en el genoma a una distancia aproximada de 5 kpb, por lo que fue necesario colocarla a menor distancia del promotor de poliedrina. Para ello se obtuvo dicha región por PCR a partir del genoma de baculovirus AcMNPV y se la insertó en el plásmido pVL1393. El plásmido obtenido, denominado pVL-hr1, fue utilizado como molde para la amplificación por PCR de la región regulatoria de 2.418 pb. El plásmido pXXLCAT de 6.448 pb, que porta una región regulatoria de 2.640 pb río arriba del promotor mínimo de poliedrina, se originó por inserción en el plásmido pLCAT. Un esquema simplificado de los vectores obtenidos se presenta en la figura R9. 72 Resultados- Capítulo I hr1 1537 pb pVL-hr1 Promotor POL (10489 bp) Amp(R) ORF 1629 ColE ori M (-) 1 2 3 5000 PCR hr1FOR/ XXLREV hr1 BspHI 2000 1650 XXL 1537 pb Fragmento XXL (2418 pb) Ampicilina(R) Promotor XXL Blasticidina(R) pXXLCAT Promotor EM7 7144 bp 6448 pb Promotor OpIE1 pUC Ori OpIE2 PolyA 6xHis CAT V5 Figura R9. Esquema que ilustra la obtención de la región XXL. Esta secuencia se obtuvo a partir del vector pVL-hr1. Se muestra a continuación el vector reportero final pXXLCAT, que porta una región regulatoria de 2.640 pb río arriba del promotor mínimo de poliedrina. 73 Resultados- Capítulo I 2.2 Optimización de las condiciones de transfección Una vez obtenidos los vectores reporteros a ser utilizados en ensayos de transfección transitoria de células Sf9, fue necesario establecer las condiciones óptimas de transfección. Para ello, en primer lugar se construyó el plásmido reportero pCGFP para el cálculo de la eficiencia de transfección, según se detalla en Materiales y Métodos y se representa en la figura R10. Promotor OpIE2 Ampicilina (R) M HindIII (558) pCGFP XbaI XbaI (612) 4000 3000 EGFP pCGFP 2000 1650 4252 bp Basticidina (R) XbaI (1337) XbaI (1369) V5 1000 850 GFP 650 6xHis Promotor OpIE1 Origen pUC Figura R10. Esquema de clonado para la obtención del plásmido pCGFP utilizado para el cálculo de la eficiencia de transfección de células Sf9. A la derecha se muestra el análisis por restricción con la enzima XbaI. Determinación de la eficiencia de transfección bajo distintas condiciones Se ensayaron distintas combinaciones de Celfectina: 1; 1,5; 2; 2,5; 3 y 3,5 μl y las siguientes cantidades de ADN: 0,2; 0,4; 0,8 y 1 μg. Luego de 24 horas de transfección se observó fluorescencia al microscopio óptico y se determinó el número de células totales y de células fluorescentes por campo, para calcular el porcentaje de células transfectadas en cada condición. De esta manera, se determinó que la máxima eficiencia obtenida fue de 32 % de células transfectadas (fluorescentes) en la condición óptima definida por 2,5 μl de Celfectina y 0,8 μg de ADN por pocillo. Estas condiciones fueron utilizadas en todas los experimentos de transfección. 74 Resultados- Capítulo I 2.3 Ensayo de expresión transitoria del gen reportero CAT regulado por distintas regiones promotoras de poliedrina 2.3.1 Transfecciones e infecciones para la expresión transitoria del gen reportero Se transfectaron células Sf9 con el objeto de comparar la actividad de CAT alcanzada con cada una de las construcciones reporteras entre el 1° y el 7° dpt. Se emplearon los vectores pSCAT, pLCAT, pXLCAT, pXXLCAT y pcCAT. Debido a que el promotor de poliedrina es activado por factores virales tardíos, 4 horas más tarde, parte de las células transfectadas con cada construcción fueron infectadas con el baculovirus AcPOL- a una moi de 1. En una placa separada se incluyeron los siguientes controles: i) células sin transfectar ni infectar; ii) células mock transfectadas (transfectadas utilizando Celfectina sin ADN); iii) células mock transfectadas e infectadas; iv) células sólo infectadas. El ensayo se llevó a cabo por triplicado. 2.3.2 Ensayo de actividad de CAT Antes de medir las muestras y para determinar la cinética enzimática de CAT en este sistema, se realizó una curva de actividad utilizando la enzima en cinco concentraciones distintas, partiendo de una concentración inicial máxima de 0,1 U/μl. La figura R11 muestra la curva de calibración, con la cual se determinó que la actividad máxima registrada fue entre 180.000 y 200.000 cuentas por minuto (cpm). Se utilizaron diluciones ¼ de los extractos para aproximar los valores 200000 180000 160000 140000 120000 100000 80000 60000 40000 20000 0 Figura R11. Curva de calibración de 0,1 T CA 1/ 4 T CA 6 CA T 1/ 1 4 1/ 6 T CA /2 54 T1 CA an c o actividad de CAT. Bl Cuentas por minuto 14C (cpm) máximos medibles a ese rango y evitar la saturación enzimática y subestimación de datos. Diluciones CAT 75 Resultados- Capítulo I La expresión y actividad de la enzima CAT se determinó cuantitativamente a través de la combinación de los extractos celulares lisados con los sustratos 14C-cloranfenicol y n-butiril CoA. Se les extrajo la fracción acetilada (n-butiril-cloranfenicol) y se midieron en el contador de centelleo líquido. La actividad de CAT obtenida en cpm fueron promediados para los triplicados de cada muestra y se calculó el desvío estándar para cada una. El resultado para todos los plásmidos medidos se muestra en la figura R12. Los resultados mostraron que en ausencia de infección sólo con el promotor constitutivo se registró actividad del gen reportero. En células transfectadas con las construcciones de los promotores inducibles, pXXLCAT mostró los niveles más altos de expresión de CAT después de la infección con baculovirus, que alcanzó un máximo a los 3 dpt y se mantuvo constante a lo largo de 7 días. Dichos niveles fueron comparables a los que se observaron para el plásmido con el promotor constitutivo, pCCAT, en ausencia de infección. El resto de los vectores con promotores inducibles mostraron niveles de expresión menores, que alcanzaron un nivel máximo de actividad de CAT al día 6 post transfección y luego decayeron. 14 Actividad CAT (cpm C) 250000 200000 150000 100000 50000 0 0 2 4 6 Días post transfección (dpt) 8 pXXL + pC + pC pXL + pL + pS + pXXL pXL pL pS Sf9 + Mock + Mock Sf9 s/t (-) Figura R12. Actividad transitoria de CAT registrada desde el 1° al 7° dpt para los plásmidos reporteros con distintas regiones regulatorias de poliedrina. Los signos + y - indican infección con el baculovirus AcPOL- a las 4 hpt o ausencia de la misma, respectivamente. 76 Resultados- Capítulo I A pesar de que a los 6 dpt los niveles alcanzados con las construcciones pXLCAT y pXXLCAT parecen ser similares, al 7º dpt la actividad de CAT para la construcción pXLCAT decae abruptamente y la de pXXLCAT se mantiene constante. La figura R13 muestra la actividad relativa de CAT a los 7 dpt para cada una de las muestras ensayadas. (-) S/T S/I Mock Mock + Sf9 + Muestras pC pC + pS pS + pL pL + pXL pXL + pXXL pXXL + 0 50000 100000 150000 200000 Actividad de CAT relativa (cpm 14C) al 7º dpt Figura R13. Actividad transitoria de CAT registrada a los 7 dpt para los plásmidos reporteros con distintas regiones regulatorias de poliedrina. Los signos + indican infección con el baculovirus occ- a las 4 hpt. Las actividades alcanzadas en presencia de infección se representan con barras negras. 77 Resultados- Capítulo I Los niveles de expresión alcanzados por la construcción pXXLCAT luego de la infección se mantienen cercanos a los obtenidos con el promotor constitutivo en ausencia de infección (barra gris), incluso luego de una semana de transfección, mientras que con las demás construcciones no fue posible alcanzar ni mantener dichos niveles. Luego de la infección, las células transfectadas con la construcción llevando el promotor constitutivo mostraron un descenso en los niveles de expresión del gen reportero, probablemente debido al shut-down que ocurre en la célula durante la infección viral. 3. Obtención de una línea celular Sf9 establemente transformada con el gen poliedrina En base a los resultados obtenidos, se decidió utilizar la región regulatoria XXL de 2.640 pares de bases río arriba del promotor mínimo de poliedrina para guiar la transcripción de poliedrina en el desarrollo de una línea Sf9 establemente transformada. Con ese fin, se construyó el vector pXXLPOL que porta la secuencia codificante de poliedrina bajo la región regulatoria XXL y como control se construyó un vector que contiene el gen poliedrina bajo la regulación del promotor constitutivo OpIE2. 3.1 Construcción de los vectores pXXLPOL y pCPOL El vector con el gen poliedrina bajo el control de la región regulatoria XXL se obtuvo utilizando el plásmido pXXLCAT como base. Para su construcción, la secuencia codificante de poliedrina (nt 4.515–5.261 de AcMNPV) fue insertada en el vector pXXLCAT en reemplazo de la secuencia de CAT para obtener el vector pXXLPOL. El plásmido pCPOL fue construido por clonado de la secuencia de poliedrina bajo el control del promotor constitutivo en el vector pIB/V5-his. Para ello se tuvo en cuenta el agregado en la secuencia del consenso óptimo para la expresión a partir de promotores baculovirales tempranos rodeando el inicio de la traducción, según se detalla en Materiales y Métodos. Los vectores finales y su análisis por restricción se representan en la figura R14. 78 Resultados- Capítulo I pXXLPOL SacI/BamHI Ampicilina(R) 1 * 2 * 3 M 5000 Blasticidina(R) Promotor EM7 Promotor XXL pXXLPOL Promotor OpIE1 2000 1650 6556 bp 1000 850 ~ 560 650 500 ~ 250 pUC Ori 200 OpIE2 PolyA BamHI Bam HI 6xHis V5 Sac II SacI BamHI POL BamHI * clones positivos Promotor OpIE2 Ampicilina (R) M KpnI (568) pCPOL KpnI KpnI 4000 pCPOL POL 2000 1650 4258 bp KpnI Basticidina (R) 3000 KpnI (1236) 1000 V5 850 6xHis 650 POL Promotor OpIE1 Origen pUC Figura R14. Esquema de los plásmidos pXXLPOL y pCPOL utilizados para transfectar establemente células Sf9. A la derecha de cada uno se muestra el análisis por restricción con las enzimas específicas. 3.2 Transfecciones transitorias Con el objeto de evaluar, en primer lugar, si la proteína poliedrina codificada fuera del genoma viral es capaz de expresarse en células Sf9 infectadas, se llevaron a cabo experimentos de transfección transitoria del plásmido pXXLPOL e infección con el baculovirus AcGFPpol-. Para ello, se utilizaron células en monocapa que se transfectaron con pCPOL o pXXLPOL utilizando Celfectina de acuerdo a las proporciones óptimas ya determinadas. Los controles consistieron en la mock transfección de las células utilizando la misma cantidad de Celfectina 79 Resultados- Capítulo I pero sin ADN y células sin transfectar. Para el cálculo de la eficiencia de transfección se transfectó un pocillo de células con el vector pCGFP bajo las mismas condiciones ensayadas para los plásmidos con poliedrina. Este control se utilizó en cada evento de transfección realizado, dando valores de eficiencias de transfección de entre 16 % y 35 % (Figura R15 A1). A las 4 hpt se infectó uno de los duplicados para cada plásmido con el baculovirus AcGFPpol-, monitoreando diariamente el curso de la infección mediante visualización de fluorescencia al microscopio óptico. Al 5 dpt se registraron fotografías de las células al microscopio óptico bajo luz blanca y de fluorescencia. Como se observa en la figura R15 A2 y 3, los controles sin infección no presentaron estructuras similares a poliedros ni modificaciones en la forma o en el crecimiento celular con respecto a las células mock transfectadas, indicando que la mera transfección de los plásmidos que expresan poliedrina no genera cuerpos de oclusión ni ningún agregado intracelular que sugiera la acumulación de poliedrina. Al ser infectadas con el baculovirus occque expresa GFP, fue posible observar la presencia de estructuras poliédricas en los núcleos de las células transfectadas con el plásmido pXXLPOL en las que coincidieron la transfección e infección identificada por flurescencia (Figura R15 C8 y 9). En las células transfectadas con el plásmido pCPOL no se observaron modificaciones más allá del efecto citopático típico tras la infección con baculovirus (Figura R15 B5 y 6). 80 Resultados- Capítulo I A B C I Figura R15. Visualización al microscopio de células Sf9 transfectadas transitoriamente al 5 dpt. A) Controles. 1) Células transfectadas con el plásmido pCGFP para el cálculo de la eficiencia de transfección; 2) Células mock transfectadas; 3) Células sin tratamiento. B) Células transfectadas con el plásmido pCPOL 4) en ausencia de infección; 5) infectadas con el baculovirus AcGFPpol- a moi=1 visualizadas bajo luz blanca. 6) El mismo campo que 5 pero visualizado bajo luz azul. C) Células transfectadas con el vector pXXLPOL 7) en ausencia de infección. 8) infectadas con el baculovirus AcGFPpol- a moi=1 visualizadas bajo luz blanca. 9) El mismo campo que 8 pero visualizado bajo luz azul. La flecha muestra las estructuras poliédricas refringentes en el interior de los núcleos. I) Detalle de células transfectadas con el plásmido pXXLPOL e infectadas que presentaron estructuras poliédricas en su interior. 81 Resultados- Capítulo I Para corroborar que las estructuras poliédricas observadas dentro de las células transfectadas con pXXLPOL e infectadas con baculovirus estaban conformadas por la proteína poliedrina, se realizaron ensayos de Western blot con extractos de células transfectadas con ambas construcciones e infectadas. En cada caso se realizaron extractos celulares y como control se utilizó un extracto de células infectadas con AcMNPV salvaje. Las muestras se resolvieron en geles de poliacrilamida 12 % y se reveló la presencia de poliedrina por ensayos de Western blot con un suero policlonal anti-poliedrina. El resultado se muestra en la figura R16. pCPOL - + pXXLPOL - + Sf9 wt Poliedrina Figura R16. Detección de poliedrina en muestras de células transfectadas transitoriamente. Extractos de células transfectadas con los plásmidos PCPOL y pXXLPOL fueron enfrentadas a un anticuerpo anti-poliedrina. Los signos + y – indican infección con baculovirus pol- o ausencia de la misma, respectivamente. Fue posible detectar una banda nítida de movilidad electroforética correspondiente a poliedrina únicamente en el caso de las células transfectadas con pXXLPOL e infectadas con el baculovirus pol-. De esta manera se confirmó que existe expresión de poliedrina a partir de un plásmido, inducida por infección viral. Esta observación sugiere que las estructuras refringentes observadas en el núcleo de algunas células están conformadas por poliedrina. No se detectó expresión de poliedrina en las células transfectadas con la construcción de promotor constitutivo. 82 Resultados- Capítulo I 3.3 Establecimiento de líneas transformadas con poliedrina Una vez confirmada la expresión transitoria de poliedrina por el plásmido pXXLPOL, se continuó con la transformación estable de células Sf9 con la misma construcción y la caracterización de estas líneas. Adicionalmente, se transformaron células establemente con la construcción pCPOL como control. 3.3.1 Determinación de la concentración mínima inhibitoria del antibiótico de selección Para determinar la concentración mínima inhibitoria del antibiótico empleado como agente selectivo y elegir la concentración a utilizar en la selección, se ensayaron diferentes concentraciones de blasticidina S en células Sf9. Las células se trataron con 20, 40, 60, 80 y 100 μg/ml de blasticidina y la viabilidad celular se evaluó en el transcurso de 4 días mediante la técnica de exclusión del colorante azul tripán. La figura R17 muestra la mortalidad de las células a las distintas concentraciones de antibiótico. La concentración de 60 μg/ml de antibiótico resultó la mínima que presentó más del 50 % de mortalidad celular al segundo día post tratamiento y que alcanzó un 100 % al cuarto día. Así, se determinó que esta concentración sería la utilizada para la primera selección de las líneas 120 100 muertas) Muerte celular (% células transfectadas. Dia 1 80 Dia 2 60 Dia 3 40 Dia 4 20 0 0 20 40 60 80 100 Concentración de blasticidina (ug/ml) Figura R17. Mortalidad celular frente a blasticidina. Se grafican los porcentajes de mortalidad frente a distintas concentraciones del antibiótico utilizado en células Sf9 hasta el cuarto día post tratamiento. La flecha muestra la concentración que mató más del 50 % de las células al 2° día post tratamiento. 83 Resultados- Capítulo I 3.3.2 Transformación estable de células Sf9 Una vez confirmada la producción de estructuras poliédricas empleando la construcción pXXLPOL en ensayos de expresión transitoria, se utilizó el plásmido pXXLPOL para transformar células Sf9 de manera estable. En el mismo evento también se transfectaron células con la construcción PCPOL. Los controles del experimento consistieron en i) células mock transfectadas ii) células sin tratamiento iii) células sólo infectadas. Paralelamente se transfectaron células Sf9 con el plásmido pCGFP para el cálculo de la eficiencia de transfección. A las 48 hpt, se retiró el medio y se agregó medio nuevo conteniendo 60 μg/ml de blasticidina para la selección de las líneas celulares establemente transformadas. Para establecer las líneas celulares policlonales (Sf9POL y pCPOL), las monocapas confluentes se transfirieron consecutivamente a soportes de mayor tamaño en medio de cultivo y blasticidina en concentración decreciente con los pasajes, hasta mantenerlas con una concentración constante de 10 μg/ml. Para confirmar la presencia del gen poliedrina en el genoma de las líneas transformadas, se realizó un ensayo de PCR utilizando los oligonucleótidos POL-ATG y POL-STOP a partir de ADN genómico extraído de las líneas obtenidas. La figura R18 muestra la amplificación de un producto del tamaño esperado para poliedrina a partir de los genomas de células de ambas líneas. El control positivo corresponde a la misma reacción utilizando como templado al plásmido pGEMT-POL, y el negativo a ADN de células Sf9 sin transfectar. PXXL PC - + M 6108 Figura R18. Detección del gen poliedrina 3054 en el genoma de las líneas establemente 2036 1636 transformadas. Se observa la presencia de un 850 producto de amplificación del tamaño esperado para poliedrina a partir de ADN POL 506 genómico de las líneas estables Sf9POL y pCPOL. 84 Resultados- Capítulo I Para determinar la transcripción del gen poliedrina en las líneas celulares, se realizó un ensayo de RT-PCR utilizando el oligonucleótido específico POL-STOP para la retrotranscripción. La reacción se llevó a cabo en presencia y en ausencia de la enzima DNAsaI. Como control se realizó la PCR (sin retrotranscripción) sobre las muestras de ARN, para detectar una posible amplificación debida a la presencia de ADN contaminante. El resultado se muestra en la figura R19. Se demostró la presencia de ARNm de poliedrina sólo en la línea Sf9POL infectada con el baculovirus AcPOL-. RT-PCR pCPOL PCR ARN Sf9POL - + pCPOL Sf9POL POL AcPOL- - + - + - + - + DNAsa I - - + + - - + + - + - + Figura R19. Ensayo de RT-PCR para evaluar la existencia de ARN mensajero de poliedrina en la línea estable. Se observa la presencia de ARNm de poliedrina sólo en el caso de la línea Sf9POL infectada con el baculovirus AcPOL- . A partir de la segunda semana de selección, se evaluó la capacidad de la línea estable Sf9POL de expresar poliedrina luego de la infección con un baculovirus de genotipo pol-. Con el objeto de descartar la posibilidad de que el baculovirus AcGFPpol- adquiera un fenotipo occ+ por recombinación homóloga con las secuencias de poliedrina en el genoma celular, se construyó el baculovirus AcPOL- que no posee ninguna secuencia homóloga a este gen (ver punto 1.3 de Resultados). La infección de la línea Sf9POL se llevó a cabo a una moi de 1 y a partir de los 3 dpt se visualizaron cuerpos de oclusión, como lo muestra la figura R20. 85 Resultados- Capítulo I A C B D E Figura R20. Fotografías de células Sf9 establemente transformadas con la construcción pXXLPOL: línea celular Sf9POL. A) Línea Sf9POL sin infectar. B) Línea Sf9POL infectada con el baculovirus AcPOL-. La flecha muestra los poliedros refringentes en el interior de una célula infectada. C), D) y E) Visualización al microscopio de células de la línea Sf9POL infectada, tres campos distintos de un mismo cultivo infectado. Como se puede observar en las fotografías, los poliedros resultaron morfológicamente similares a los observados en las transfecciones transitorias y se los halló, a diferencia de lo que ocurre en la expresión transitoria, en un mayor porcentaje de células totales. Las líneas establemente transformadas se mantuvieron estables y capaces de producir poliedros tras la infección con baculovirus pol-, por al menos 30 pasajes. Para determinar en qué momento de la infección comienza a producirse la proteína poliedrina codificada en el genoma celular, se realizó una cinética de expresión cosechando células de la línea Sf9POL infectadas a distintos tiempos y comparando esa expresión con la de AcMNPV en células Sf9. La figura R21 muestra cinéticas similares, aunque ligeramente desfasadas, en las que se puede observar que la expresión de poliedrina en la línea establemente transformada comienza a ser detectable a las 30 hpi, mientras que en las células Sf9 infectadas con el baculovirus wt la poliedrina comienza a detectarse a las 24 hpi. 86 Resultados- Capítulo I 0 6 18 24 30 42 48 54 66 hpi Sf9POL/AcPOL- Sf9/AcMNPV wt Figura R21. Cinética de expresión de poliedrina por la línea celular Sf9POL en comparación con células Sf9 infectadas con el baculovirus salvaje. A) Western blot de extractos de células de la línea Sf9POL infectada con el baculovirus AcPOL-, cosechadas a distintos tiempos post infección. B) Western blot de extractos de células Sf9 infectadas con el baculovirus AcMNPV wt, cosechadas a distintos tiempos post infección. 4. Caracterización de los poliedros obtenidos de la línea Sf9POL infectada con baculovirus polPara continuar con el estudio de la línea de poliedrina estable e inducible, se comenzó por determinar si los poliedros obtenidos contenían baculovirus en su interior; es decir, si la línea era capaz de ocluir baculovirus de genotipo pol-. A partir de estos resultados, se realizaron bioensayos para confirmar la naturaleza infectiva de los poliedros. 4.1 Ensayos de oclusión por la línea Sf9POL Los cuerpos de oclusión obtenidos por infección de la línea Sf9POL con el baculovirus AcPOLfueron purificados de acuerdo a lo descrito en Materiales y Métodos. Para determinar la presencia o ausencia de baculovirus ocluidos dentro de los poliedros se ensayaron cuatro estrategias. En primer lugar, se aisló ADN de los poliedros purificados y se detectó la presencia de ácido nucleico por electroforesis en geles de agarosa (Figura R22). 87 Resultados- Capítulo I WT Figura R22. Aislamiento de ADN de poliedros de Sf9POL la línea estable Sf9POL infectada en comparación con ADN aislado de poliedros wt. En ambos casos se observa la presencia de ADN dentro de los poliedros. La segunda estrategia consistió en la detección de la proteína baculoviral P74 (exclusiva del fenotipo ODV) por Western blot en poliedros aislados, previa disolución de la matriz de poliedrina utilizando una solución alcalina de Na2CO3, para liberar los baculovirus ocluidos. Como control, se realizó el mismo ensayo para la línea PCPOL en la cual no se observó producción de poliedros ni se detectó ARNm de poliedrina. La figura R23 muestra los resultados del ensayo, donde se puede observar una banda correspondiente a la proteína P74 sólo en el caso de la línea Sf9POL infectada. En paralelo se sometió a la membrana a un anticuerpo anti-poliedrina, para corroborar que la disolución de los poliedros fue satisfactoria. La ausencia de una banda de reconocimiento de P74 en el caso de la línea PCPOL infectada sugiere que las concentraciones de ODV recuperadas mediante el protocolo utilizado son despreciables en ausencia de oclusión. p C POL - + Sf9POL - + P74 POL Figura R23. Ensayo de Western blot de la fracción insoluble de las líneas estables utilizando anticuerpos contra las proteínas baculovirales P74 y POL. Los signos - y + refieren a la ausencia o presencia de infección, respectivamente. La proteína P74 se reveló por quimioluminiscencia y poliedrina por el método de fosfatasa alcalina. 88 Resultados- Capítulo I La tercera estrategia consistió en determinar por Western blot la presencia de la proteína mayoritaria de nucleocápside VP39, tanto en el exterior como en el interior de los poliedros aislados. Para ello, se tomaron suspensiones de poliedros salvajes (wt) y de la línea Sf9POL y se las enfrentó a SDS 0,5 %. Se calentó la muestra a 65 °C para desprender los baculovirus que pudieran quedar adheridos a la superficie de los poliedros. A continuación se centrifugó, se separó el sobrenadante (S) y se procedió a disolver la poliedrina de los pellets (P) utilizando Na2CO3. La figura R24 muestra el resultado de este ensayo, donde se observa una banda correspondiente a la proteína VP39 únicamente en los pellets de poliedros provenientes de la línea Sf9POL y del control de poliedros wt. En paralelo sobre la misma muestra se ensayó la detección de la proteína GP64, presente en la envoltura de los BV pero no en los ODV. En la fracción interna de los poliedros en ambas muestras en las que se observa la presencia de VP39, no se observa detección de la proteína GP64, indicando que los baculovirus detectados pertenecen al fenotipo ODV. Estos resultados en conjunto sugieren fuertemente la existencia de baculovirus ocluidos dentro de los poliedros de la línea estable. wt Sf9POL Sf9 S P S P BV GP64 VP39 Figura R24. Ensayos de Western blot utilizando anticuerpos contra las proteínas baculovirales GP64 y VP39 en muestras de poliedros. Las suspensiones de poliedros fueron extraídas con SDS 0,5 % para desprender los baculovirus adsorbidos en la superficie (S) y tratados con Na2CO3 con el objeto de disolver la poliedrina y liberar los baculovirus de su interior (P). Muestras de poliedros de la línea Sf9POL y wt así tratados fueron enfrentados a anticuerpos específicos. Sf9 corresponde a células sin tratamiento, como control negativo del ensayo. BV corresponde a baculovirus brotados purificados como control positivo de las proteínas GP64 y VP39. 89 Resultados- Capítulo I Finalmente, para confirmar la presencia de baculovirus ocluidos, se realizaron cortes de células de la línea Sf9POL y pCPOL infectadas y sin infectar y se observaron al microscopio electrónico. Como se puede observar en la figura R25, los poliedros de la línea Sf9POL son capaces de ocluir baculovirus (D-H) mientras que la línea pCPOL no presenta formación de poliedros y los virus preocluidos permanecen en el interior del núcleo (B). Los signos de infección de la línea pCPOL resultan similares a los de la infección de células Sf9 con un baculovirus de fenotipo occ-, observándose viriones en el interior del núcleo; mientras que la línea Sf9POL infectada con el baculovirus pol- muestra signos muy característicos de la infección con baculovirus AcMNPV wt (occ+), con formación de poliedros que contienen baculovirus en su interior. A B BV EV ODV 500 nm 500 nm C D P ODV 500 nm POV 1 µm 90 Resultados- Capítulo I E P F POV P POV ODV ODV 500 nm 200 nm G P H ODV POV 200 nm 1 µm Figura R25. Micrografías electrónicas de las líneas establemente transformadas. A) Célula de la línea pCPOL. B) Célula de la línea pCPOL infectada con el baculovirus AcPOL-. C) Célula de la línea Sf9POL sin infectar. EV: Estroma Virogénico. POV: Virus Preocluido. ODV: Virus Derivado de Cuerpo de Oclusión. Aumento en A, B y C: 100.00X. D) Núcleo de una célula de la línea Sf9POL infectada con el baculovirus AcPOL-. P: Poliedro. Aumento: 6.000X. E), F) y G) Detalle de poliedros en el interior de las células la línea Sf9POL infectada con AcPOL-. Aumento: E, 15.000X; F y G, 25.000X. H) Poliedros producidos por el baculovirus AcMNPV en células Sf9 (fotografía tomada de Woo y Ahn, 2006). 91 Resultados- Capítulo I 5. Estudio de la infectividad de los poliedros resultantes de la línea Sf9POL infectada con baculovirus pol5.1 Ensayos de infectividad en larvas de Rachiplusia nu Para estudiar la infectividad de los poliedros obtenidos por oclusión en la línea Sf9POL, se dispusieron 3 grupos de 6 larvas de R. nu del tercer estadio seleccionadas al azar y se los infectó oralmente con distintas fuentes de inóculo: poliedros obtenidos por infección de células con el baculovirus recombinante AcGFPpol+, poliedros wt y poliedros obtenidos de la línea celular Sf9POL infectada con el baculovirus AcGFPpol-. Las larvas se infectaron con 1 x 105 poliedros totales por inóculo embebidos en la dieta artificial. Diariamente se las monitoreó bajo lupa y microscopio para observar fluorescencia de GFP como signo de infección. A los 4 dpi, tanto las larvas infectadas con poliedros AcGFPpol+ como las infectadas con poliedros de la línea Sf9POL mostraron fluorescencia, mientras que ninguna de las larvas control infectadas con poliedros wt lo hizo. La figura R26 muestra larvas infectadas con los distintos inóculos visualizadas bajo lámpara de luz azul. Los resultados demuestran que los poliedros derivados de la línea Sf9POL contienen baculovirus que son infectivos para las larvas. En la figura R27 se detallan fotografías de larvas infectadas con poliedros derivados de la línea Sf9POL que contenían baculovirus AcGFPpol- a los 5 dpi, observadas al microscopio. La fluorescencia detectada en todo el cuerpo de la larva sugiere que los baculovirus liberados de los poliedros derivados de la línea celular empaquetadora se diseminaron de manera similar a la que ocurre en infecciones naturales. 92 Resultados- Capítulo I Figura R26. Larvas infectadas con poliedros de distinto origen. a) Larva infectada con poliedros derivados de la infección de células Sf9 con el baculovirus AcGFPpol+, b) Larva infectada con poliedros wt, c) Larva infectada con poliedros derivados de la línea Sf9POL infectada con el baculovirus AcGFPpol-. Figura R27. Observación al microscopio de larvas enteras infectadas por vía oral con baculovirus AcGFPpol- ocluidos por la línea Sf9POL. Las imágenes del panel superior corresponden a fotografías tomadas bajo luz blanca en un aumento de 10X. Las imágenes del panel inferior corresponden a las mismas imágenes pero tomadas bajo luz azul. 93 Resultados- Capítulo I Para determinar el nivel de infección de las larvas, al 4° dpi se realizaron extractos larvales para medición de fluorescencia. Cada muestra se homogeneizó y se clarificó dos veces por centrifugación y el sobrenadante libre de cutícula y otros componentes fue separado. Se sembraron iguales cantidades de proteínas de cada una en placas de 96 pocillos negras opacas y fluorescencia se realizó la medición en un fluorómetro. En la figura R28 se muestran los resultados. 4000 3500 3000 2500 2000 1500 1000 500 0 Sin infectar GFPpol- 1 2 3 4 5 6 7 8 9 10 11 12 # de larva Figura R28. Medición de fluorescencia en extractos de larvas infectadas por vía oral con el baculovirus AcGFPpol- ocluido por la línea Sf9POL. Cada barra corresponde a una larva infectada con 1 x 105 poliedros totales adsorbidos en la dieta artificial. Se muestra una larva sin infección como representación de los controles negativos. Los distintos niveles de fluorescencia alcanzados por las larvas mostraron variabilidad de infectividad entre individuos de un mismo grupo. A pesar de estas diferencias observadas, todas las larvas inoculadas se infectaron con el baculovirus reportero AcGFPpol- ocluido por la línea Sf9POL. 5.2 Comparación de la infectividad de poliedros AcPOL-/Sf9POL y poliedros wt Con el objetivo de comparar la infectividad de los poliedros derivados de la línea Sf9POL infectada con el baculovirus AcPOL- y los poliedros AcMNPV wt, se realizaron bioensayos con larvas R. nu. Para ello, se seleccionaron al azar larvas del tercer estadio y se colocaron en placas 94 Resultados- Capítulo I de 6 compartimientos. Se inocularon 12 larvas con 1 x 105 poliedros totales por inóculo: AcMNPV wt y AcPOL-/Sf9POL, embebidos en la dieta artificial. A un grupo adicional se le administró el mismo volumen de PBS como control negativo. Luego de la infección, las placas se incubaron a 26 °C y se monitorearon diariamente para determinar el porcentaje de muertes por día por inóculo. La determinación del número de larvas muertas se realizó hasta el momento en que las larvas control alcanzaron el estado de pupa. En la figura R29 se puede observar a una placa conteniendo larvas infectadas con 1 x 105 poliedros provenientes de la línea Sf9POL a los 5 dpi. El aspecto de las larvas infectadas se corresponde con el de la muerte debida a infección por baculovirus, caracterizada por el proceso de melanización que le da otorga el color gris oscuro y la licuefacción de tejidos. Figura R29. Placa conteniendo larvas de R. nu infectadas con AcPOL-/Sf9POL al 5° dpi. En detalle puede observarse el aspecto melanizado de las larvas, característico de la infección avanzada por baculovirus. Con los datos de mortalidad de larvas con 1 x 105 poliedros de cada inoculo ensayado en función de los dpi, se construyó la curva que se muestra en la figura R30. En este gráfico se puede observar que la infectividad de los poliedros de la línea Sf9POL resultó similar a la de los poliedros wt. Ambos inóculos alcanzaron 100 % de mortalidad a los 7 dpi a esta dosis ensayada, confirmando que la línea es capaz de producir poliedros infectivos. 95 Resultados- Capítulo I Mortalidad (%) 100 80 60 Sf9POL/AcPOL- 40 wt 20 0 3 4 5 6 7 8 Días post infección (dpi) Figura R30. Curvas de mortalidad de larvas infectadas por vía oral con poliedros AcPOL-/Sf9 (azul), y AcMNPV (rosa). Se grafican los datos de porcentaje de muertes en función del tiempo hasta los 8 dpi. Para confirmar el fenotipo de la progenie viral presente en las larvas en cada condición, se extrajo un pequeño volumen de hemolinfa y tejidos y se los observó al microscopio óptico. Esta extracción se realizó cuando el proceso de melanización se hizo evidente (entre los 5 y los 8 dpi). Como se observa en la figura R31, la hemolinfa de las larvas infectadas con poliedros wt presentó una alta densidad de poliedros salvajes (Figura R31 A), mientras que la hemolinfa de las larvas infectadas con poliedros de la línea Sf9POL no mostró presencia de poliedros (Figura R31 B). Este análisis confirmó la condición de infección de cada larva según el inóculo recibido y demostró que la línea Sf9POL es capaz de aportar infectividad por vía oral al baculovirus AcPOL-, manteniendo su genotipo pol- que le impide formar nuevos poliedros y transmitir la infección a otros insectos susceptibles. A B Figura R31. Muestras de hemolinfa de larvas muertas por infección. A) Hemolinfa de larva infectada con poliedros AcMNPV. B) Hemolinfa de larva infectada con poliedros AcPOL-/Sf9POL. 96 Resultados-Capítulo II Capítulo II Caracterización de una mutación puntual en el gen poliedrina que genera poliedros de morfología aberrante 1. Antecedentes Para la obtención de la línea celular Sf9 transformada con poliedrina se utilizó el plásmido pXXLPOL cuya construcción fue descrita en el Capítulo I. Este vector transporta el gen de poliedrina regulado por una región de 2.640 pb río arriba del promotor mínimo de poliedrina y a su vez posee un gen de resistencia a blasticidina que permite la selección de las células transformadas. Este plásmido fue utilizado para transfectar células Sf9 y seleccionar líneas policlonales que fueron amplificadas y analizadas en su expresión de poliedrina y morfogénesis de poliedros luego de la infección con un baculovirus pol-. Cuando se utilizó el baculovirus AcGFPpol- como reportero y las células se observaron diariamente al microspio de fluorescencia, una de las líneas obtenidas mediante este procedimiento presentó cuerpos de oclusión de morfología aberrante luego de los 3 dpi. Los cuerpos refringentes de forma cúbica hallados en el interior de las mismas eran de mayor tamaño que los poliedros producidos por los baculovirus salvajes. Además, se observaban entre uno y cinco poliedros por célula. La figura R32 muestra en detalle células establemente transformadas con un clon del plásmido pXXLPOL e infectadas con el baculovirus AcGFPpol-. A B Figura R32. Fotografías al microscopio de células establemente transfectadas con un clon del plásmido pXXLPOL e infectadas con el baculovirus AcGFPpol-. Las estructuras refringentes de forma cúbica dentro del núcleo (señaladas con flechas) aparecen al infectar con el baculovirus de genotipo pol-. A) Visualización del campo bajo luz blanca. B) Visualización del mismo campo bajo luz azul. 97 Resultados-Capítulo II Para determinar si los poliedros con morfología diferente se habían originado por algún cambio en la secuencia del gen poliedrina, se procedió a secuenciar este gen del clon pXXLPOL utilizado en la construcción de estas líneas estables. Al alinear la secuencia obtenida con la del gen poliedrina salvaje, se encontró una única mutación puntual en nt 130 del gen poliedrina en el clon del plásmido pXXLPOL. Esta mutación consistió en una sustitución de una A por una G, que se traduce a un cambio aminoacídico de ácido glutámico (E) por glicina (G) en el aminoácido (aa) 44 de la proteína poliedrina (Figura R33). poliedrina pXXLPOL ..110..... ..120..... ..130..... ..140..... ..150..... CTTCGCCGAA CATGAGATCG AAGAGGCTAC CCTCGACCCC CTAGACAACT CTTCGCCGAA CATGAGATCG AAGGGGCTAC CCTCGACCCC CTAGACAACT aa 44 Poliedrina wt Poliedrina mut MPDYSYRPTIGRTYVYDNKYYKNLGAVIKNAKRKKHFAEHEIEEATLDPLDNYLVAEDPF MPDYSYRPTIGRTYVYDNKYYKNLGAVIKNAKRKKHFAEHEIEGATLDPLDNYLVAEDPF ******************************************* **************** LGPGKNQKLTLFKEIRNVKPDTMKLVVGWKGKEFYRETWTRFMEDSFPIVNDQEVMDVFL LGPGKNQKLTLFKEIRNVKPDTMKLVVGWKGKEFYRETWTRFMEDSFPIVNDQEVMDVFL ************************************************************ VVNMRPTRPNRCYKFLAQHALRCDPDYVPHDVIRIVEPSWVGSNNEYRISLAKKGGGCPI VVNMRPTRPNRCYKFLAQHALRCDPDYVPHDVIRIVEPSWVGSNNEYRISLAKKGGGCPI ************************************************************ MNLHSEYTNSFEQFIDRVIWENFYKPIVYIGTDSAEEEEILLEVSLVFKVKEFAPDAPLF MNLHSEYTNSFEQFIDRVIWENFYKPIVYIGTDSAEEEEILLEVSLVFKVKEFAPDAPLF ************************************************************ TGPAYX TGPAYX ****** Figura R33. Alineación de secuencias de poliedrina. Hallazgo de una mutación en un clon del plásmido pXXLPOL. La sustitución de A por G hallada en el nt 130 del gen en el plásmido produce un cambio del aa 44 de ácido glutámico (E) a glicina (G). 98 Resultados-Capítulo II Para comprobar que esta mutación fuera la responsable del fenotipo alterado de los poliedros, se construyó un baculovirus con la misma mutación en el gen poliedrina y se corroboró la morfología de los poliedros resultantes. 2. Construcción de un baculovirus con poliedrina mutante en el aminoácido 44: Con el objetivo de caracterizar la mutación hallada en el gen poliedrina, se construyó un baculovirus recombinante con la secuencia de poliedrina mutante, que se denominó AcPOLE44G. Para ello, se obtuvo por reacción de PCR la secuencia del gen pol mutado a partir del clon del plásmido pXXLPOL que mostró anormalidades en la morfología de los poliedros. A este plásmido se lo denominó pXXLPOLE44G. La secuencia de poliedrina mutada en el nt 130 se clonó en el vector pFastBac para la construcción de baculovirus recombinantes por el sistema Bac-toBac. Brevemente, el bácmido recombinante se obtuvo mediante transformación de bacterias DH10Bac con el vector pFastBacPOLE44G. Este bácmido fue transfectado en células Sf9 para la generación del baculovirus recombinante AcPOLE44G. Luego de ser titulado, el baculovirus AcPOLE44G se utilizó para infectar células Sf9 a una moi=1. La figura R34 muestra una imagen al microscopio de células Sf9 a los 3° dpi con el baculovirus mutante en poliedrina. 99 Resultados-Capítulo II A B 1 2 Figura R34. Visualización al microscopio de células Sf9 infectadas con el baculovirus con poliedrina mutante, AcPOLE44G. A) Los poliedros anormales refringen dentro de las células. Se muestra el detalle de una célula con un único poliedro cúbico de gran tamaño en su interior. B) Efecto citopático del baculovirus AcPOLE44G (1) en contraste con el efecto del baculovirus AcMNPV wt (2). De esta manera se confirmó que la mutación puntual en el gen poliedrina es la responsable del fenotipo anormal de poliedros. 3. Caracterización de los poliedros anormales Existen antecedentes que describen diversos efectos sobre la morfología de los cuerpos de oclusión causados por mutaciones dentro de la secuencia codificante de poliedrina (ver Tabla I3 en Introducción). Carstens et al. (1986) y Lin et al. (2000) describieron mutaciones puntuales en AcMNPV que generan enormes poliedros de forma cúbica en el núcleo de células infectadas. Estos autores demuestran que estas estructuras presentan poca a nula oclusión viral. 100 Resultados-Capítulo II Para determinar si los poliedros de morfología aberrante producidos por el baculovirus AcPOLE44G son capaces de ocluir baculovirus, se infectaron células a una moi=1 y se dejó progresar la infección hasta el 6° dpi. En ese momento se realizó la lisis de las células y se aislaron poliedros según el protocolo detallado en Materiales y Métodos. De esta manera, se obtuvo una suspensión de poliedros que se utilizaron en ensayos de Western blot e infección oral de larvas para su caracterización. 3.1 Detección de baculovirus ocluidos en poliedros mutantes Como primera estrategia de determinación de oclusión por parte de los poliedros anormales, se procedió de manera similar que con los poliedros derivados de la línea Sf9POL. El protocolo en este caso consistió en calentar a 65 °C la suspensión de poliedros en buffer cracking por 10 min y luego de una centrifugación se conservaron los sobrenadantes (S1) y se trataron nuevamente los pellets de poliedros con buffer cracking. De ese lavado se recuperaron nuevamente los sobrenadantes (S2) y se procesaron los pellets (P) mediante su disolución con Na2CO3 para liberar los baculovirus potencialmente ocluidos. La presencia de viriones ocluidos se infirió por la determinación de proteínas virales por Western blot enfrentando las muestras con un anticuerpo monoclonal contra la proteína VP39. El resultado se muestra en la figura R35. AcMNPV wt AcPOLE44G S1 S2 * P S1 S2 P * VP39 Figura R35. Detección de la proteína VP39 como prueba de oclusión de baculovirus AcPOLE44G en poliedros mutantes. La detección de la proteína baculoviral VP39 se ensayó sobre muestras de poliedros extraídos con SDS (S1), lavados 1 vez (S2) y tratados con Na2CO3 (P) para exponer su contenido por disolución de poliedrina. El asterisco muestra la presencia de baculovirus en el interior de los poliedros mutantes y adsorbidos a la superficie de los mismos. 101 Resultados-Capítulo II Para confirmar la presencia de baculovirus en el interior de los poliedros mutantes, se realizaron cortes de células infectadas con el baculovirus AcPOLE44G y se obtuvieron imágenes al microscopio electrónico. En la figura R36 se observan las fotografías obtenidas y se comparan los poliedros producidos por este baculovirus con los poliedros salvajes. Puede observarse un poliedro mutante con baculovirus en su interior y otro poliedro anormal sin baculovirus ocluidos. Esto permite afirmar que la mutación en poliedrina responsable del fenotipo genera una deficiencia en la oclusión viral, por un mecanismo desconocido. A B ODV POV POV 1 µm 1 µm C Figura R36. Imágenes de microscopía electrónica P P de transmisión de células infectadas A) y B) Poliedros anormales producidos por infección de P células Sf9 con el baculovirus AcPOLE44G. P: Poliedro. POV: Virus Preocluido. ODV: Virus ODV EF Ocluido. Aumento: 8.000X C) Poliedros producidos por infección de células Sf9 con el baculovirus AcMNPV salvaje. EF: Estructura fibrilar. Aumento: 10.000X. 102 Resultados-Capítulo II 4. Infectividad de los poliedros mutantes 4.1 Ensayo de infectividad en larvas Para probar la infectividad de los poliedros mutantes se utilizó un baculovirus reportero, al igual que para analizar la infectividad de los poliedros derivados de la línea Sf9POL. Para ello, se obtuvo una línea celular establemente transformada con el gen POL mutante en el nt 130 por la misma metodología por la cual se obtuvo la línea policlonal Sf9POL. Esta línea, denominada Sf9POLE44G, fue infectada con el baculovirus AcGFPpol- y los poliedros mutantes resultantes fueron aislados y utilizados como inóculo de infección oral. Se seleccionaron 12 larvas del tercer estadio al azar, 6 de las cuales fueron inoculadas con 1 x 105 poliedros mutantes y 6 fueron inoculadas con poliedros AcGFPpol+ como control. A los 4 dpi las larvas fueron observadas al microscopio de fluorescencia para corroborar la infectividad de los poliedros administrados. Cuatro de las 6 larvas infectadas con los poliedros AcGFPpol/Sf9POLE44G resultaron fluorescentes mientras que la totalidad de las larvas infectadas con el baculovirus control fluorescieron. La figura R37 muestra fotografías de las larvas infectadas por vía oral con baculovirus reporteros, observadas al microscopio de fluorescencia. A B Figura R37. Observación al microscopio óptico de larvas enteras infectadas por vía oral con el baculovirus AcGFPpol- ocluido por la línea Sf9POLE44G. tomadas bajo A) luz Fotografías blanca en un aumento de 10X. B) Las mismas imágenes de su izquierda, pero tomadas bajo luz azul. 103 Resultados-Capítulo II 4.2 Comparación de la infectividad de poliedros AcPOLE44G y poliedros wt Con el objetivo de comparar la infectividad de los poliedros mutantes y los poliedros AcMNPV wt, se realizó un bioensayo con larvas de R. nu del tercer estadio, que fueron seleccionadas al azar y colocadas en placas de 6 compartimientos. Se inocularon 12 larvas por inóculo: AcMNPV wt y AcPOLE44G, cada una con con 1 x 105 poliedros totales depositados sobre cubos de alimento artificial. A un tercer grupo se le administró PBS como control negativo. Se determinó el porcentaje de muertes por día por inóculo, hasta el momento en que las larvas control alcanzaron el estado de pupa. Con estos datos se construyó una curva de mortalidad que se muestra en la figura R38. M ortalidad (%) 100 80 60 AcPOLE44G 40 wt 20 0 3 4 5 6 7 8 Días post infección (dpi) Figura R38. Curvas de mortalidad de larvas infectadas por vía oral con poliedros AcPOLE44G (azul) y AcMNPV (rosa). Se grafican los datos de porcentaje de muertes en función del tiempo hasta los 8 dpi. Una dosis de 1 x 105 poliedros producidos por el baculovirus AcPOLE44G produjeron un máximo de mortalidad del 60 % hasta el final del experimento, mientras que la misma cantidad de poliedros wt mataron al 100 % de las larvas a los 7 dpi. Es posible que la menor mortalidad registrada para los poliedros mutantes se deba a la deficiencia de oclusión que presenta el baculovirus AcPOLE44G como consecuencia de una mutación puntual en el gen poliedrina. 104 Resultados-Capítulo II Cuando el proceso de melanización debida a la infección se hizo evidente, se extrajo hemolinfa de las larvas y se la observó al microscopio. Como se observa en la figura R39, la hemolinfa de las larvas infectadas con los poliedros mutantes contenía poliedros de morfología característica de la infección con el baculovirus AcPOLE44G (Figura R39 A), siendo la mayoría de mayor tamaño que los poliedros wt (Figura R39 B). A B Figura R39. Muestras de hemolinfa de larvas infectadas. A) Hemolinfa de larva infectada con poliedros AcPOLE44G. B) Hemolinfa de larva infectada con poliedros AcMNPV. Este análisis confirmó la condición de infección de cada larva según el inóculo recibido y confirmó que la mutación puntual en poliedrina del baculovirus AcPOLE44G es responsable de las alteraciones observadas en la morfología de los poliedros. 105 Discusión Discusión Discusión Desarrollo de una línea celular empaquetadora de baculovirus polEl objetivo del presente trabajo de tesis consistió en determinar si es posible complementar la deficiencia del gen poliedrina de baculovirus de genotipo pol- y fenotipo occ- con una o más copias en trans desde el genoma celular, de manera de coordinar temporal y espacialmente la expresión de adecuados niveles de poliedrina con la presencia en el núcleo de viriones preocluidos para la formación de cuerpos de oclusión. Para esto se desarrolló una línea celular en la que se insertaron diferentes secuencias río arriba del gen poliedrina para regular de manera inducible su expresión tras la infección con virus deficientes en poliedrina. La generación de una línea de insecto transformada con poliedrina fue recientemente desarrollada en el modelo BmMNPV. El grupo de Chen fue capaz de ocluir baculovirus BmMNPV recombinantes de genotipo pol- por expresión de poliedrina bajo la regulación del promotor constitutivo OpIE1 en una línea celular establemente transformada (Chen et al., 2008). La infectividad de los poliedros así obtenidos fue confirmada empíricamente por observación de signos de infección en larvas de B. mori infectadas por vía oral. En otro experimento, estos investigadores compararon la infectividad de los virus recombinantes ocluidos por la línea estable con la de los poliedros derivados del baculovirus BmMNPV salvaje y pudieron notar que la infectividad de los poliedros de la línea era significativamente menor que la de los poliedros wt. En el modelo AcMNPV, la construcción de una línea de células de insecto que exprese poliedrina bajo la regulación de su propio promotor activable por factores virales, fue propuesta con anterioridad, aunque sin éxito (Nagamine et al., 1995). Mediante cotransfección de células Sf21 con dos plásmidos, uno que llevaba el gen de poliedrina completo regulado por su promotor contenido en el fragmento EcoRI-I (Smith y Summers, 1979) y otro que confería resistencia a geneticina, estos autores desarrollaron tres líneas estables que presentaban al menos una copia del transgén. Para determinar si en dichas líneas se expresaba poliedrina, las células fueron infectadas con un baculovirus de genotipo pol-. Tras la infección, los investigadores no observaron poliedros al microscopio ni detectaron la expresión de poliedrina por Western blot con un anticuerpo anti-poliedrina. La escasa o nula expresión de poliedrina cuando esta secuencia se encontraba integrada en el genoma fue adjudicada al entorno en el que se ubicó el 106 Discusión gen en el cromosoma. Fue sugerido, además, que la expresión, independientemente del promotor que la regule, se veía interrumpida en etapas tardías de la infección debido al shutdown sobre los mecanismos celulares que pueden estar involucrados. Por lo tanto, Nagamine y colaboradores propusieron que previo a expresar proteínas en un sistema inducible por infección, habría que comprender más profundamente los mecanismos de shut-down de proteínas celulares. Sin embargo, estos autores no discuten la importancia de secuencias regulatorias adicionales a las contenidas en el fragmento por ellos utilizado. Las evidencias sugieren que, de haber existido expresión de poliedrina, ésta debió ocurrir a niveles no detectables e insuficientes para la formación de cuerpos de oclusión. Se ha descrito que las secuencias río arriba de poliedrina en AcMNPV, conocidas como secuencias pu (del inglés polyhedrin upstream) contienen elementos del tipo enhancer. Se demostró que la presencia de la región pu produce un aumento en los niveles de expresión de genes heterólogos en ensayos de transcripción transitoria y que esta actividad depende sólo de los factores virales IE1, IE2 y PE38 (Wu et al., 2008). Además de los factores virales requeridos para la transcripción a partir del promotor de poliedrina, se ha determinado que algunos factores de la célula hospedadora tienen una importante función en la transcripción de los promotores muy tardíos de AcMNPV. Por ejemplo, la proteína de unión al promotor de poliedrina (PPBP) se une a la región promotora mínima de 95 pb (Etkin et al., 1994). Esta proteína celular se une también al promotor p10 con afinidad similar (Jain y Hasnain, 1996). Las regiones homólogas hrs son los enhancers baculovirales más conocidos. Estos elementos pueden funcionar independientemente de factores virales. En el genoma se encuentran ocho regiones homólogas, que son secuencias entre 120 y 800 pb que debido a su alto contenido de A+T, ubicación simétrica y regiones de palíndromes imperfectos, se conoce que funcionan como orígenes de replicación (oris). Esta función de ori fue hallada en experimentos de replicación transitoria, en los que se sugirió que estas secuencias están involucradas en la replicación viral (Cochran y Faulkner, 1983). Se cree que hr1 actúa potenciando la activación del promotor de poliedrina mediante la unión de la proteína celular hr-BP que contribuiría a mantener bajos niveles basales de transcripción en etapas tempranas del ciclo de infección. Esta proteína celular también fue hallada en extractos nucleares de mamíferos y es por ello que hr1 es capaz de activar promotores heterólogos como el de citomegalovirus y el de Drosophila hsp70 (Viswanathan et al., 2003). A 107 Discusión medida que la infección prosigue, este factor favorece la transcripción que responde a factores inducibles del hospedador y a factores virales que se unen a sitios cercanos al hr1. Estudios previos demostraron que cuando la secuencia hr1 es colocada a una distancia aproximada de 3,7 kpb río arriba del gen poliedrina en el genoma de AcMNPV wt, aumenta la transcripción desde el promotor baculoviral muy tardío de poliedrina de manera independiente de la función de ori del hr (Habib et al., 1996). Posteriormente se analizó el efecto de la inclusión de más de una copia de hr1 sobre la expresión del promotor de poliedrina y se observó un importante aumento en los niveles de expresión de un gen reportero como consecuencia directa de un aumento en el nivel de ARN en la transcripción (Venkaiah et al., 2004). Otra secuencia regulatoria que se une a factores celulares de la familia de proteínas Sp presente a unos 450 pb río arriba del promotor de poliedrina juega también un rol importante en la transcripción a partir de este promotor. Esta región denominada AcSp, que contiene el consenso de reconocimiento de la proteína Sp1, genera in vivo un aumento de la transcripción del gen reportero luciferasa regulado por el promotor de poliedrina (Ramachandran et al., 2001). Con esta evidencia, la inclusión de una región río arriba del promotor de poliedrina que comprenda sitios de unión para factores de transcripción virales y celulares, puede brindar una regulación adecuada al gen poliedrina dentro del contexto genómico celular. Así, la ausencia de dichas secuencias regulatorias en la línea desarrollada por Nagamine y col. pudo haber contribuido en alguna medida a la baja expresión de poliedrina en ese sistema. En este trabajo, con el propósito de determinar la secuencia regulatoria óptima para conducir la transcripción de poliedrina en las líneas estables inducibles por la infección con baculovirus, se diseñaron diferentes construcciones que transportaban regiones promotoras de complejidad variable guiando la transcripción del gen reportero CAT. Los resultados de actividad enzimática al transfectar transitoriamente células Sf9 con las construcciones obtenidas mostraron que la expresión del gen reportero se activó y se mantuvo a niveles elevados y constantes a lo largo del tiempo cuando las células se transfectaron con la construcción pXXLCAT y se infectaron con un baculovirus occ- a las 4 horas post transfección. El resto de los vectores con promotores inducibles no alcanzaron niveles tan elevados de expresión, habiendo llegado a un nivel máximo de actividad de CAT a los 6 días post transfección, tras lo que decayeron. El aumento de la expresión del gen reportero observado a partir de la región XXL con respecto al observado a partir de las otras regiones promotoras menos complejas sugiere que la inclusión de la región hr1 ejerce un efecto potenciador sobre la transcripción a partir del promotor de poliedrina en 108 Discusión este sistema, resultado que concuerda con lo demostrado por Habib y colaboradores (Habib et al., 2006). La diferencia entre la región XL y la región XXL es que esta última, además de contener el fragmento XL (unas 700 pb antes del promotor mínimo de poliedrina), contiene la secuencia río arriba de poliedrina comprendida desde la posición -1.017 a la -1.537 río arriba del ATG, región en la que fue insertada la secuencia hr1. Estas 837 pb dentro de la región XXL no contienen sitios descritos de unión a proteínas celulares o virales que puedan ejercer algún efecto positivo en la transcripción a partir del promotor de poliedrina. Recientemente fue publicado un trabajo por Kumar y colaboradores en el que se realiza un minucioso análisis de las secuencias río arriba de poliedrina. Los autores sugieren la existencia de factores transcripcionales pertenecientes a la familia de los factores de heat shock y POU en las células de S. frugiperda (Kumar et al., 2009). Este trabajo, además de apoyar la hipótesis de que las proteínas de la célula hospedadora cumplen una función importante en la activación de la transcripción del promotor de poliedrina, demuestra que la región comprendida entre el -703 y -1.625 no cumple un rol regulatorio importante. Sin embargo, cuando la región entre -1.625 y -2.284 está ausente, ocurre una drástica disminución de la transcripción. Esto refuerza el hecho de que el aumento de la transcripción de CAT observado por la construcción pXXLCAT corresponde a la inserción de la región hr1 que actúa como enhancer transcripcional del sistema y que es posible alcanzar niveles elevados de actividad del promotor aún sin contar con la región comprendida entre los nt -1.625 y -2.284 río arriba del gen. Teniendo en cuenta la evidencia anteriormente enunciada y los resultados obtenidos en la transactivación de las distintas regiones regulatorias de poliedrina ensayadas en este trabajo, se escogió la región denominada XXL para ser utilizada en la transformación estable de células Sf9 con el gen poliedrina. Mediante experimentos de transfección transitoria, se ensayó la capacidad de transcripción del vector de transferencia pXXLPOL. Para inducir la expresión de poliedrina, se llevó a cabo una infección con el baculovirus AcGFPpol- que permite monitorear el curso de la infección mediante visualización de fluorescencia por microscopía. Se observó la presencia de estructuras poliédricas a los 4 dpt en aquellas células que en las que coincidieron la transfección y la infección, esta última evidenciada por la fluorescencia verde. Además fue posible detectar la presencia de la proteína poliedrina en extractos de células transfectadas e infectadas. A pesar de los altos niveles de actividad CAT obtenidos con el plásmido pcCAT en ausencia de infección, 109 Discusión no se observaron estructuras poliédricas en las células transfectadas con el plásmido pCPOL ni se detectó la proteína poliedrina en ensayos de Western blot. Estos resultados indican que poliedrina podría resultar tóxica para las células de insecto cuando se expresa constitutivamente o los niveles que se alcanzan no resultan suficientes para su detección ni para formar cuerpos de oclusión. Por otro lado, en este trabajo se demostró que la actividad del gen reportero río abajo del promotor constitutivo en la construcción pCCAT disminuye notablemente como consecuencia de la infección. Estos datos destacan las ventajas del uso del promotor de poliedrina frente al promotor constitutivo OpIE-2 para regular la expresión del gen pol en el contexto del genoma celular, durante una infección por baculovirus. En base a los resultados obtenidos en los experimentos de expresión transitoria se pudo concluir que es posible separar físicamente del genoma viral el gen poliedrina y sus secuencias regulatorias y mantener la capacidad de formar poliedros en el núcleo de las células en las que la transfección y la infección coincidieron. Así, se estableció la prueba de concepto para poder complementar en trans la deficiencia de poliedrina desde el genoma celular. Cuando se evaluó la transcripción de poliedrina a partir de las líneas estables pcPOL y Sf9POL, se comprobó la transcripción de ARNm de poliedrina sólo a partir de la línea Sf9POL infectada. No se detectó ARNm de poliedrina regulada por el promotor OpIE2 en la línea pCPOL, confirmando la ineficiencia de transcripción de poliedrina a partir del promotor constitutivo dentro de este sistema celular. Si poliedrina resulta tóxica para las células Sf9, es posible que se seleccionen aquellas células que integran la copia del gen en una región de heterocromatización que impide su transcripción. La eficiencia en la regulación de la expresión que se conoce a partir del promotor OpIE-2 como promotor temprano de baculovirus es variable. Algunos autores como Morais y Costa mostraron expresión estable en su sistema (Morais y Costa, 2003). Sin embargo, recientemente se ha buscado el reemplazo de este promotor temprano de baculovirus por otros de mayor fuerza, al comprobarse la baja expresión que se alcanza en células transformadas establemente en otros sistemas (Ivanova et al., 2007; Shishiro et al., 2009). En contraposición a los resultados obtenidos en esta tesis, Chen y colaboradores demostraron niveles de poliedrina suficientes para ocluir baculovirus en una línea celular de B. mori cuando el gen fue controlado por un promotor temprano (Chen et al., 2009). Quizás el número de copias que se integraron por el sistema mediado por el transposón elegido para dar origen a las líneas estables fue mayor que el alcanzado por la estrategia de integración con un plásmido. De todas maneras, la elección de un 110 Discusión promotor muy tardío para la expresión de poliedrina en trans resultaría ventajosa para acoplar temporalmente la presencia de la proteína con el empaquetamiento de virus en el núcleo. La visualización al microscopio de diversas líneas Sf9POL infectadas con el baculovirus AcGFPpol- reveló la presencia en el núcleo de cuerpos de oclusión desde los 3 dpi. Estos poliedros resultaron en número y de morfología similar a los poliedros salvajes en todas las líneas estables obtenidas, con excepción de una que presentó formación de estructuras cristalinas de forma cúbica de tamaño sustancialmente mayor en el interior de las células, que será discutida más adelante. El hallazgo de poliedros tras la infección con baculovirus de genotipo pol- demuestra que es posible complementar esta deficiencia desde el genoma celular, sin una replicación aparente del ADN. Diferentes autores demostraron que la expresión de los genes tardíos de baculovirus depende de la replicación de ADN y no ocurre cuando la replicación es inhibida por moléculas como afidicolina (Friesen y Miller, 1986). Las regiones hr son consideradas “bifuncionales”, ya que se han demostrado tanto propiedades potenciadoras de la transcripción como de función de origen de replicación. Como se mencionó anteriormente, la secuencia hr1 incluida en una región regulatoria presenta actividad enhancer. Sin embargo, también se descubrió su actividad de ori. Fue posible observar que plásmidos que contenían secuencias hr replican en células de insecto infectadas con AcMNPV, originando moléculas de movilidad electroforética compatibles con concatémeros que podrían indicar un mecanismo de replicación del tipo de círculo rodante (Kool et al., 1993). Así, no sólo es posible que luego de la replicación viral exista un período transitorio o una porción de moléculas de ADN viral en las que el ADN no esté unido a proteínas y pueda exponer un conjunto de promotores diferente con una activación facilitada, sino también que los genes transcriptos por estos promotores, en particular los de poliedrina y P10, sean producidos a partir de muchas más moléculas de templado que los promotores tempranos, transcriptos antes de la replicación del genoma. El hecho de que hr1 aumente la transcripción de manera independiente de la actividad de ori sugiere por otro lado un requerimiento diferencial de factores de la célula hospedadora para estas dos funciones de los elementos de hr (Habib et al., 1996). Se ha demostrado además que la infección con el nucleopoliedrovirus Bombyx mori modifica sustancialmente la cromatina celular, induciendo su relocalización marginal simultáneamente a la expansión del estroma virogénico (Nagamine et al., 2008). Nuestros resultados demuestran 111 Discusión que este fenómeno, si ocurre en AcMNPV, no impide la expresión de poliedrina a niveles compatibles con la formación de poliedros. La presencia de poliedros fue significativa en un número de células tras la infección con un baculovirus pol-, pero no fue posible obtener poliedros en la totalidad de las células infectadas, aún empleando multiplicidades de infección muy altas. Esto demuestra la heterogeneidad en el número o posición de copias insertadas, provocando que en algunas células los niveles de expresión fueran menores a los necesarios o se hallaran totalmente inactivos, hecho que puede ser superado mediante el clonado de dicha población heterogénea. Tanto el aislamiento de ADN en el interior de los poliedros obtenidos al infectar la línea Sf9POL con el baculovirus AcPOL-, como el reconocimiento de las proteínas baculovirales P74 y VP39 luego de la disolución de estos cuerpos de oclusión, son resultados compatibles con la presencia de viriones dentro de los poliedros generados por la línea estable. Sin embargo, la detección de estas estructuras que componen los ODV no confirma la oclusión de viriones enteros. El hecho que permitió afirmar que poliedrina expresada por las células de la línea Sf9POL es capaz de originar poliedros que ocluyen viriones fue la observación al microscopio electrónico de transmisión de cortes de las células Sf9POL infectadas. En estos experimentos, fue posible detectar claramente los ODV embebidos en la matriz de poliedrina. Las imágenes demuestran que el proceso de oclusión por la línea Sf9POL se desarrolla de manera similar al que ocurre en las células Sf9 infectadas con baculovirus wt (O´Reilly et al., 1994). Una vez confirmada la oclusión de baculovirus mediada por poliedrina proveniente de la línea celular Sf9POL, se analizó la infectividad por vía oral de estos poliedros de manera cualitativa. Para ello, se infectó la línea estable con el baculovirus AcGFPpol- y los poliedros aislados que contenían el virus reportero fueron administrados en la dieta de larvas de R. nu. Las larvas mostraron fluorescencia en todo su cuerpo al ser irradiadas con una fuente de luz azul, ello indica que los poliedros son capaces de disolverse en el intestino de las larvas y que la infección se dispersa de manera similar a la natural. Los niveles de expresión de GFP en las larvas infectadas con los poliedros Sf9POL/AcGFPpol- muestra la existencia de diferencias entre larvas en cuanto al grado de infección alcanzado por cada individuo ante la administración de cantidades iguales de poliedros. Estas diferencias pueden referir tanto a los estados fisiológicos variables dentro de una misma población como a la ingesta del inóculo de forma total o parcial a lo largo del experimento. Posteriormente, con el objetivo de comparar la infectividad por vía oral que presentan los poliedros derivados de la línea Sf9POL con respecto a los poliedros 112 Discusión salvajes, se realizó un bioensayo con larvas de R. nu del 2° estadio a las que se les administró una dosis de 1 x 105 poliedros AcPOL-/Sf9POL o wt por larva. Las curvas de mortalidad no mostraron diferencias de infectividad entre los poliedros de la línea Sf9POL y los poliedros wt. Por otro lado, el análisis al microscopio de la hemolinfa de larvas infectadas confirmó la ausencia de poliedros al transcurrir la infección por el virus AcPOL- ocluido en trans. El único antecedente en el desarrollo de una línea celular empaquetadora fue el publicado por el grupo de Chen y colaboradores en el año 2009. Hasta el momento, la construcción de una línea similar en AcMNPV no había sido lograda. Los resultados mostrados en este trabajo de tesis confirman que es posible obtener una línea celular Sf9 que exprese poliedrina luego de la infección viral, permitiendo la complementación de baculovirus recombinantes que carecen del gen pol en su genoma. Poliedrina expresada en trans alcanza niveles suficientes como para permitir la morfogénesis de poliedros y estos poliedros resultan infectivos para larvas por vía oral. Además, a diferencia de lo expuesto por Chen y col., los poliedros AcPOL-/Sf9POL muestran una infectividad comparable a los poliedros wt. Caracterización de una mutanción puntual en el gen poliedrina Durante el desarrollo de las líneas estables, se observó que una de las líneas transformadas con el vector pXXLPOL producía poliedros de morfología aberrante al ser infectada con el baculovirus AcGFPpol-. Para determinar el origen de estos poliedros anormales, se secuenció el vector empleado para establecer las líneas y se halló una mutación puntual en la secuencia de poliedrina. Esta mutación determinó una sustitución de ácido glutámico (E) por glicina (G) en la posición aminoacídica 44. Para confirmar que dicha mutación era responsable del fenotipo de poliedros anormales, se construyó un baculovirus que transportaba la secuencia de poliedrina mutante en lugar de la salvaje, al que se denominó AcPOLE44G. La infección con este baculovirus produjo un fenotipo igual al observado en la línea infectada; es decir, se visualizaron poliedros cúbicos de gran tamaño, indicando que la mutación puntual en poliedrina provoca un cambio en la morfología. En AcMNPV fueron descritas dos mutaciones que presentan un fenotipo similar de poliedros. Ambas son producidas por sustituciones; la primera en el aminoácido 59 (Carstens et al., 1986) y la segunda en el aminoácido 25 (Lin et al., 2000). Bravo-Patiño e Ibarra generaron, mediante mutagénesis dirigida, la sustitución de los aminoácidos Lys34, His36 y Phe37 por tres 113 Discusión triptofanos en la secuencia de poliedrina de AcMNPV de tipo salvaje (Bravo-Patiño e Ibarra, 1999). Estas sustituciones provocaron cambios significativos tanto en la morfología de los poliedros como en el proceso de oclusión y la cristalización de la proteína. La ubicación de las mutaciones dirigidas fue seleccionada para dilucidar el papel de algunos de los aminoácidos de la región variable entre especies, comprendida entre los residuos 34 a 54 (Rohrmann, 1986). Recientemente se logró cristalizar y deteminar la estructura de poliedrina en AcMNPV y se la comparó con la estructura de poliedrina de cipovirus (Ji et al., 2009). Este hecho permitió diferenciar con mayor claridad las regiones dentro de la molécula y su disposición tridimensional. La figura D1 A muestra la organización secundaria de poliedrina propuesta por Ji y colaboradores. A partir de los datos aportados por investigadores que describieron las mutantes puntuales halladas en el gen poliedrina, el grupo de Ji clasificó las mutaciones en dos clases: clase i, para las que generan masas proteicas dispersas y ausencia de oclusión (Carstens, 1987; Ribeiro et al., 2009) y clase ii, las que generan poliedros de forma cúbica y gran tamaño (Carstens et al., 1986; Lin et al., 2000). Según estos autores, las mutaciones de clase i afectan regiones de láminas β ( βC y βD), denominadas core, mientras que las de clase ii afectan zonas cercanas a la región denominada D1, correspondiente a un loop de residuos “desordenados” entre los aa 32 y 48. La mutación G25D informada por Lin y col. en 2000 se localiza en la región anterior a D1 denominada α1 y la mutación P59L informada por Carstens y col. en 1986 se localiza en el loop posterior a D1 entre βA” y B. La mutación hallada en este trabajo de tesis se localiza dentro de la región D1, al igual que las mutantes inducidas por Bravo-Patiño e Ibarra (K34W, H36W y F37W), por lo tanto, se la puede clasificar como de la clase ii. La ubicación de las mutantes mencionadas dentro de la estructura tridimensional de poliedrina se ilustra en la figura D1 B. 114 Discusión A B ! "# $ % & ' ( ) Figura D1: Estructura secundaria y terciaria de poliedrina de AcMNPV. A) Diferencias entre las estructuras secundarias de poliedrina de AcMNPV y CpGV. B) Estructura terciaria de poliedrina, con las respectivas regiones aminoacídicas delimitadas (Esquema tomado de Ji et al., 2009) y la ubicación de las mutantes de tipo ii informadas en AcMNPV hasta el momento. En los poliedros aislados a partir de la infección con el baculovirus AcPOLE44G, la detección de la proteína VP39 dio un indicio de la presencia de baculovirus ocluidos. En los ensayos de microscopía electrónica se pudo observar que algunos poliedros mutantes presentan baculovirus en su interior, mientras que otros no ocluyen viriones. Este resultado coincide con lo descrito por Carstens y colaboradores en el año 1986, los que demuestraron también por microscopía electrónica la presencia de baculovirus ocluidos en algunos poliedros de morfología anormal y ausencia de ODV dentro de otros (Carstens et al., 1986). Este hecho parece ser una 115 Discusión característica de este tipo de mutaciones, aunque resta determinar la causa de la ausencia de oclusión dentro de ciertos poliedros mutantes. Los mecanismos y las bases genéticas del proceso de oclusión se desconocen aún y la frecuencia de aparición en la naturaleza de poliedros carentes de viriones ocluidos no se ha investigado de forma sistemática. La formación de poliedros de morfología similar a la salvaje y sin viriones ocluidos se observó en células en cultivo (Goodwin y Adams, 1980) y este fenotipo no resulta poco frecuente. Esto puede deberse a la ausencia de presiones de selección en el sistema de cultivo para la formación de cuerpos de oclusión infectivos, en comparación con lo que ocurre en la naturaleza. A pesar de que el mecanismo por el que ocurre la oclusión en AcMNPV no está definido con claridad, existen indicios de que algunas proteínas de la envoltura de los baculovirus poseen una alta afinidad por poliedrina y que éstas pueden desencadenar la polimerización por sí mismas (Blissard y Rohrmann, 1990). Se ha descrito una mutante en AcMNPV que genera poliedros que no contienen viriones en su interior y al caracterizar las proteínas necesarias para la restitución se halló que tanto P26, P10 y P74 eran necesarias para que existiera oclusión (Wang et al., 2009). También la ausencia del producto del gen Ac142 genera un fenotipo similar (Mc Carthy et al., 2008). En el caso de la secuencia de poliedrina mutante E44G, la ausencia de oclusión observada en algunos poliedros de morfología aberrante confirma que en presencia de viriones normales pueden formarse cuerpos de oclusión vacíos y que la oclusión ineficiente se debería a un cambio conformacional que sufre poliedrina en su ensamblaje impidiéndole adherirse a los ODV y empaquetarlos de manera natural. Este defecto puede ser explicado a partir del descubrimiento de la estructura de poliedrina por cristalografía, que permitió inferir la existencia de ciertas regiones en la estructura de esta proteína que resultaban más vulnerables. Puntualmente, la región D1 es la secuencia menos conservada entre los baculovirus de distinto género. Esta variabilidad sugiere que la región juega un rol importante en la especificidad del empaquetamiento. Los baculovirus, a diferencia de los cipovirus, no poseen simetría icosaédrica, por lo que se requiere de flexibilidad en ciertas áreas de poliedrina que interactúan con las proteínas de la envoltura de los viriones (Ji et al., 2009). La asimetría es inevitable, ya que se requiere para ocluir los paquetes irregulares de nucleocápsides. Esta hipótesis se apoya en la observación de que las diferencias estructurales que se observan en las mutantes cercanas a esta región o dentro de la región misma (como la mutante descrita en esta tesis) interfieren con la oclusión viral. Las sustituciones que caracterizan estas mutantes darían lugar a ensamblajes de poliedrina que otorgan menos espacio físico a los virus para adherirse a la estructura cristalina. 116 Discusión Sin embargo, aún no es posible especificar los residuos que interactúan ni la identidad de las proteínas de la superficie de los viriones envueltos que están involucradas en dicha unión (Rohrmann, 2008). Los bioensayos realizados para comparar la infectividad de los poliedros mutantes con respecto a los poliedros salvajes demostraron que los poliedros derivados de la infección por el baculovirus AcPOLE44G alcanzan una infectividad máxima de 60 % aproximadamente, con la misma dosis que la administración de poliedros wt causa un 100 % de mortalidad a los 7 dpi. Esta baja infectividad de los poliedros mutantes podría deberse a la deficiencia de oclusión que presenta el baculovirus AcPOLE44G como consecuencia de la mutación puntual en el gen poliedrina, demostrada en este trabajo y que se condice con lo publicado por otros grupos que describieron mutaciones similares (Lin et al., 2000; Carstens et al., 1986). Es posible que la forma cúbica de los poliedros producidos a partir del baculovirus AcPOLE44G guarde alguna relación con la incapacidad de los viriones de ser correctamente ocluidos dentro de la matriz de poliedrina, como se mencionó anteriormente. Estos resultados contribuyen a definir aún más las regiones del gen poliedrina involucradas en la morfología de los poliedros y las interacciones moleculares entre los viriones y poliedrina durante la morfogénesis de los cuerpos de oclusión de AcMNPV. Potenciales aplicaciones de la línea Sf9POL El concepto de la producción comercial y a gran escala de proteínas en larvas de lepidóptero, principalmente de la especie Trichoplusia ni, se manifiesta como una alternativa de mejor relación costo/beneficio frente a la obtención de proteínas en biorreactores (Liu et al., 2007). Esta estrategia puede competir con la producción de proteínas en cultivos celulares, no solamente por su ventaja económica sino también porque se ha demostrado que las modificaciones postraduccionales que presentan las proteínas heterólogas resultan más representativas de la proteína nativa cuando son expresadas en el sistema larval (Andersons et al., 1991; O´Reilly et al., 1994). Sin embargo, como ya fue mencionado, la administración de baculovirus recombinantes que no poseen poliedrina en su genoma, mediante inyección intracuticular, resulta muchas veces un proceso complejo, tedioso y que ocasiona una alta mortalidad en las larvas. Éstas, al permanecer lastimadas en el sitio de inoculación, son susceptibles a nuevas infecciones, principalmente bacterianas. Una alternativa es la inoculación por vía oral, que presenta ventajas 117 Discusión en seguridad y practicidad, aunque requiere de la presencia de poliedrina en cis o en trans para la oclusión de los baculovirus recombinantes. La administración oral de baculovirus preocluidos también es posible, aunque para su aislamiento se requiere de un paso de ultracentrifugación y adsorción en algún tipo de material inerte que preserve su infectividad en el ambiente, previa a la ingesta por el insecto susceptible. En el caso de los baculovirus de genotipo pol+ utilizados como virus helper, se ha probado que existe una competencia entre los promotores de poliedrina y p10 que reduce los niveles de expresión (Chaabihi et al., 1997; Tuan et al., 2007). Otro inconveniente que presentan estos baculovirus es que carecen de la proteína P10, ya que para mantener poliedrina en su genoma, el gen pol es colocado en el locus p10 bajo el promotor de esa proteína viral. Se ha visto que mutantes sin p10 aumentan la DL50 en T. ni nueve veces con respecto a los baculovirus wt (Cheng et al., 2001). Esto, sumado a los datos recientemente aportados por Wang y col., los que afirman que la ausencia de P10 provoca una deficiencia en la oclusión de los viriones, sugiere que P10 juega un papel importante en la generación de poliedros infectivos (Wang et al., 2009). El empleo de virus helpers que aportan poliedrina en trans también presenta desventajas, ya que se deben realizar coinfecciones que también generan competencia por las maquinarias traduccionales. Otra potencial aplicación de la línea que expresa poliedrina es el desarrollo de nuevos insecticidas biológicos basados en baculovirus recombinantes. Como fue mencionado, la desventaja de esta forma de control de insectos plaga, con respecto a los insecticidas químicos, es su elevada latencia de acción (Moscardi, 1999). Con el advenimiento de las técnicas del ADN recombinante, fue posible modificar a los baculovirus para otorgarles mayor potencia y velocidad de acción (Stewart et al., 1991). La actividad de los baculovirus contra sus hospedadores naturales pudo ser mejorada mediante la interferencia con la fisiología de los insectos o la introducción de toxinas específicas (Bonning y Hammock, 1996; Inceoglu et al., 2001; Muraleedharan y Gayathri Elayidam, 2008). Los cambios en la fisiología del hospedador consisten en la introducción de genes que codifican para algunas hormonas de insectos y enzimas modificadoras o en la eliminación del gen de la ecdisona glucosiltransferasa (egt) en el genoma baculoviral. El producto del gen egt actúa durante la muda de la larva a su siguiente estadio, prolongando el tiempo de alimentación e infección. La supresión de EGT en los baculovirus modificados resulta en un aumento de un 30 % de la mortalidad de las larvas. Otra ventaja de esta modificación del genoma es el hecho de que el gen egt no es esencial para la replicación viral y puede ser reemplazado por un gen exógeno, que aumente la actividad 118 Discusión insecticida del virus recombinante (Sun et al., 2004). Un ejemplo de ello son los genes de neurotoxinas de artrópodos aisladas de escorpiones o arañas. La toxina que resulta más potente y cuyo gen se utiliza para la construcción de baculovirus recombinantes es la del escorpión Androctonus australis. Los baculovirus modificados por introducción del gen AaIT reducen en un 60 % los daños causados por las larvas infectadas en comparación con un baculovirus de tipo salvaje (Inceoglu et al., 2001). Sin embargo, el impacto ecológico de la liberación a campo de los baculovirus modificados no está suficientemente analizado y se requiere investigar con mayor precisión sobre los posibles efectos no deseados de este biopesticida. La posibilidad de generar un inóculo por vía oral para las larvas basado solamente en baculovirus de genotipo polresultaría un método con mayores beneficios a nivel ambiental, ya que las larvas infectadas no podrían propagar el virus hacia las futuras generaciones de insectos susceptibles en ausencia de poliedrina. En nuestros ensayos, las larvas de R. nu infectadas con poliedros obtenidos por infección de la línea Sf9POL con un baculovirus de genotipo pol- no presentaron cuerpos de oclusión en su hemolinfa, por lo que esta metodología permite la generación de un inóculo baculoviral no propagable horizontalmente. Por otra parte, la línea celular Sf9POL que expresa poliedrina inducida por infección viral es una herramienta útil para el estudio de la biología de los baculovirus, en particular para la caracterización de los mecanismos involucrados en la morfogénesis de los cuerpos de oclusión. La posibilidad de empaquetar baculovirus de genotipo pol- mediante la expresión de poliedrina en trans resulta ventajosa no sólo como herramienta de interés biotecnológico, sino también como punto de partida al conocimiento de los mecanismos moleculares que operan entre el virus y su hospedador. 119 Conclusiones Conclusiones Conclusiones A partir de los resultados obtenidos en este trabajo es posible extraer las siguientes conclusiones: El agregado de secuencias de reconocimiento de factores virales y celulares, como AcSp y hr1, río arriba del promotor mínimo de poliedrina, permite alcanzar los mayores niveles de expresión de un gen reportero inducidos por la infección viral. Es posible separar físicamente del genoma viral el gen poliedrina junto con sus secuencias regulatorias y mantener la capacidad de formar poliedros en una infección de células Sf9, tanto en transfecciones transitorias como en líneas establemente transformadas. Los poliedros producidos por infección de la línea Sf9POL son capaces de ocluir baculovirus de manera similar a la que ocurre en una infección de células Sf9 con baculovirus salvajes. Los poliedros derivados de la línea Sf9POL resultan infectivos por vía oral para larvas de Rachiplusia nu, en las que no se producen cuerpos de oclusión, demostrando que la estrategia de empaquetamiento desarrollada permite dotar de infectividad por vía oral a baculovirus de genotipo pol- sin propagar la infección horizontalmente. La sustitución E por G en la posición aminoacídica 44 de poliedrina determina la formación de poliedros cúbicos y de mayor tamaño, que ocluyen baculovirus en forma heterogénea. La mutación E44G se sitúa en la región D1 de poliedrina, de alta variabilidad entre especies de baculovirus, lo que aporta evidencia adicional sobre la importancia de esta región en el proceso de oclusión. Los datos aportados por este trabajo de tesis son relevantes para el estudio de la morfogénesis de los baculovirus y sus aplicaciones biotecnológicas. 120 Anexo Anexo Anexo Secuencias (717 pb): GFP for 1 1 ATG GTG AGC AAG GGC GAG GAG CTG TTC ACC GGG GTG GTG CCC ATC M V S K G E E L F T G V V P I 45 15 46 16 CTG GTC GAG CTG GAC GGC GAC GTA AAC GGC CAC AAG TTC AGC GTG L V E L D G D V N G H K F S V 90 30 91 31 TCC GGC GAG GGC GAG GGC GAT GCC ACC TAC GGC AAG CTG ACC CTG S G E G E G D A T Y G K L T L 135 45 136 46 AAG TTC ATC TGC ACC ACC GGC AAG CTG CCC GTG CCC TGG CCC ACC K F I C T T G K L P V P W P T 180 60 181 61 CTC GTG ACC ACC CTG ACC TAC GGC GTG CAG TGC TTC AGC CGC TAC L V T T L T Y G V Q C F S R Y 225 75 226 76 CCC GAC CAC ATG AAG CAG CAC GAC TTC TTC AAG TCC GCC ATG CCC P D H M K Q H D F F K S A M P 270 90 271 91 GAA GGC TAC GTC CAG GAG CGC ACC ATC TTC TTC AAG GAC GAC GGC E G Y V Q E R T I F F K D D G 315 105 316 106 AAC TAC AAG ACC CGC GCC GAG GTG AAG TTC GAG GGC GAC ACC CTG N Y K T R A E V K F E G D T L 360 120 361 121 GTG AAC CGC ATC GAG CTG AAG GGC ATC GAC TTC AAG GAG GAC GGC V N R I E L K G I D F K E D G 405 135 406 136 AAC ATC CTG GGG CAC AAG CTG GAG TAC AAC TAC AAC AGC CAC AAC N I L G H K L E Y N Y N S H N 450 150 451 151 GTC TAT ATC ATG GCC GAC AAG CAG AAG AAC GGC ATC AAG GTG AAC V Y I M A D K Q K N G I K V N 495 165 496 166 TTC AAG ATC CGC CAC AAC ATC GAG GAC GGC AGC GTG CAG CTC GCC F K I R H N I E D G S V Q L A 540 180 541 181 GAC CAC TAC CAG CAG AAC ACC CCC ATC GGC GAC GGC CCC GTG CTG D H Y Q Q N T P I G D G P V L 585 195 586 196 CTG CCC GAC AAC CAC TAC CTG AGC ACC CAG TCC GCC CTG AGC AAA L P D N H Y L S T Q S A L S K 630 210 631 211 GAC CCC AAC GAG AAG CGC GAT CAC ATG GTC CTG CTG GAG TTC GTG D P N E K R D H M V L L E F V 675 225 676 226 ACC GCC GCC GGG ATC ACT CTC GGC ATG GAC GAG CTG TAC AAG T A A G I T L G M D E L Y K GFP rev 717 121 Anexo Secuencia de poliedrina (737 pb) POL ATG 1 - ATGCCGGATTATTCATACCGTCCCACCATCGGGCGTACCTACGTGTACGACAACAAGTAC - 60 1 - M P D Y S Y R P T I G R T Y V Y D N K Y - 20 61 - TACAAAAATTTAGGTGCCGTTATCAAGAACGCTAAGCGCAAGAAGCACTTCGCCGAACAT - 120 21 - Y K N L G A V I K N A K R K K H F A E H - 40 121 - GAGATCGAAGAGGCTACCCTCGACCCCCTAGACAACTACCTAGTGGCTGAGGATCCTTTC - 180 41 - E I E E A T L D P L D N Y L V A E D P F - 60 181 - CTGGGACCCGGCAAGAACCAAAAACTCACTCTCTTCAAGGAAATCCGTAATGTTAAACCC - 240 61 - L G P G K N Q K L T L F K E I R N V K P - 80 241 - GACACGATGAAGCTTGTCGTTGGATGGAAAGGAAAAGAGTTCTACAGGGAAACTTGGACC - 300 81 - D T M K L V V G W K G K E F Y R E T W T - 100 301 - CGCTTCATGGAAGACAGCTTCCCCATTGTTAACGACCAAGAAGTGATGGATGTTTTCCTT - 360 101 - R F M E D S F P I V N D Q E V M D V F L - 120 361 - GTTGTCAACATGCGTCCCACTAGACCCAACCGTTGTTACAAATTCCTGGCCCAACACGCT - 420 121 - V V N M R P T R P N R C Y K F L A Q H A - 140 421 - CTGCGTTGCGACCCCGACTATGTACCTCATGACGTGATTAGGATCGTCGAGCCTTCATGG - 480 141 - L R C D P D Y V P H D V I R I V E P S W - 160 481 - GTGGGCAGCAACAACGAGTACCGCATCAGCCTGGCTAAGAAGGGCGGCGGCTGCCCAATA - 540 161 - V G S N N E Y R I S L A K K G G G C P I - 180 541 - ATGAACCTTCACTCTGAGTACACCAACTCGTTCGAACAGTTCATCGATCGTGTCATCTGG - 600 181 - M N L H S E Y T N S F E Q F I D R V I W - 200 601 - GAGAACTTCTACAAGCCCATCGTTTACATCGGTACCGACTCTGCTGAAGAGGAGGAAATT - 660 201 - E N F Y K P I V Y I G T D S A E E E E I - 220 661 - CTCCTTGAAGTTTCCCTGGTGTTCAAAGTAAAGGAGTTTGCACCAGACGCACCTCTGTTC - 720 221 - L L E V S L V F K V K E F A P D A P L F - 240 POL STOP 721 - ACTGGTCCGGCGTATTA - 737 241 - T G P A Y X Secuencia hr1 de AcMNPV (en negrita, sitios EcoRI) hr1FOR 1 - ATCGATGATTGACCCCAACAAAAGATTTATAATTAATCATAATCACGAACAACAACAAGT - 60 61 - CAATGAAACAAATAAAACAAGTTGTCGATAAAACATTCATAAATGACACAGCAACATACA - 120 121 - ATTCTTGCATAATAAAAATTTAAATGACATCATATTTGAGAATAACAAATGACATTATCC - 180 181 - CTCGATTGTGTTTTACAAGTAGAATTCTACCCGTAAAGCGAGTTTAGTTTTGAAAAACAA - 240 241 - ATGACATCATTTGTATAATGACATCATCCCCTGATTGTGTTTTACAAGTAGAATTCTATC - 300 301 - CGTAAAGCGAGTTCAGTTTTGAAAACAAATGAGTCATACCTAAACACGTTAATAATCTTC - 360 122 Anexo 361 - TGATATCAGCTTATGACTCAAGTTATGAGCCGTGTGCAAAACATGAGATAAGTTTATGAC - 420 421 - ATCATCCACTGATCGTGCGTTACAAGTAGAATTCTACTCGTAAAGCCAGTTCGGTTATGA - 480 481 - GCCGTGTGCAAAACATGACATCAGCTTATGACTCATACTTGATTGTGTTTTACGCGTAGA - 540 541 - ATTCTACTCGTAAAGCGAGTTCGGTTATGAGCCGTGTGCAAAACATGACATCAGCTTATG - 600 601 - AGTCATAATTAATCGTGCTGTACAAGTAGAATTCTACTCGTAAAGCGAGTTGAAGGATCA - 660 661 - TATTTAGTTGCGTTTATGAGATAAGATTGAAAAGCGTGTAAAATGTTTCCCGCGCTTGGC - 720 721 - ACAACTATTTACAATGCGGCCAAGTTATAAAAGATTCTAATCTGATATGTTTTAAAACAC - 780 781 - CTTTGCGGCCCGAGTTGTTTGCGTACGTGACTAGCGAAGAAGATGTGTGGACCGCAGAAC - 840 hr1REV 841 - AGATAGTAAAACAAAACCCTAGTATTGGAGCAATAATCGAT - 881 Secuencia del promotor de poliedrina del vector pVL1393 ORF 603 1 - TGTGTGGGTGAAGTCATGCATCTTTTAATCAAATCCCAAGATGTGTATAAACCACCAAAC - 60 61 - TGCCAAAAAATGAAAACTGTCGACAAGCTCTGTCCGTTTGCTGGCAACTGCAAGGGTCTC - 120 121 - AATCCTATTTGTAATTATTGAATAATAAAACAATTATAAATGCTAAATTTGTTTTTTATT - 180 181 - AACGATACAAACCAAACGCAACAAGAACATTTGTAGTATTATCTATAATTGAAAACGCGT - 240 241 - AGTTATAATCGCTGAGGTAATATTTAAAATCATTTTCAAATGATTCACAGTTAATTTGCG - 300 301 - ACAATATAATTTTATTTTCACATAAACTAGACGCCTTGTCGTCTTCTTCTTCGTATTCCT - 360 361 - TCTCTTTTTCATTTTTCTCCTCATAAAAATTAACATAGTTATTATCGTATCCATATATGT - 420 421 - ATCTATCGTATAGAGTAAATTTTTTGTTGTCATAAATATATATGTCTTTTTTAATGGGGT - 480 AcSp 481 - GTATAGTACCGCTGCGCATAGTTTTTCTGTAATTTACAACAGTGCTATTTTCTGGTAGTT - 540 541 - CTTCGGAGTGTGTTGCTTTAATTATTAAATTTATATAATCAATGAATTTGGGATCGTCGG - 600 POLSeqFOR 601 - TTTTGTACAATATGTTGCCGGCATAGTACGCAGCTTCTTCTAGTTCAATTACACCATTTT - 660 NaeI 661 - TTAGCAGCACCGGATTAACATAACTTTCCAAAATGTTGTACGAACCGTTAAACAAAAACA - 720 721 - GTTCACCTCCCTTTTCTATACTATTGTCTGCGAGCAGTTGTTTGTTGTTAAAAATAACAG - 780 781 - CCATTGTAATGAGACGCACAAACTAATATCACAAACTGGAAATGTCTATCAATATATAGT - 840 ORF 630 PHEcoRV 841 - TGCTGATATCATGGAGATAATTAAAATGATAACCATCTCGCAAATAAATAAGTATTTTAC - 900 EcoRV 901 - TGTTTTCGTAACAGTTTTGTAATAAAAAAACCTATAAATATTCCGGATTATTCATACCGT - 960 BglII 961 - CCCACCATCGGGCGCGGATCCCGGGTACCTTCTAGAATTCCGGAGCGGCCGCTGCAGATC - 1020 BamHI POLSeqREV 1021 - TGATCCTTTCCTGGGACCCGGCAAGAACCAAAAACTCACTCTCTTCAAGGAAATCCGTAA - 1080 1081 - TGTTAAACCCGACACGATGAAGCTTGTCGTTGGATGGAAAGGAAAAGAGTTCTACAGGGA - 1140 1141 - AACTTGGACCCGCTTCATGGAAGACAGCTTCCCCATTGTTAACGACCAAGAAGTG - 1195 121 Bibliografía Bibliografía Bibliografía Abe, T., H. Hemmi, et al. (2005). "Involvement of the Toll-like receptor 9 signaling pathway in the induction of innate immunity by baculovirus." J Virol 79(5): 2847-58. Adams, J.R. y J.T. McClintock (1991) “Nuclear polyhedrosis viruses of insects”. En: “Atlas of Invertebrate Viruses”.(J. R. Adams y J. R. Bonami, eds.). CRC Press, Boca Raton, Florida, p. 87 Ahmad, S., M. Bassiri, et al. (1993). "Immunological characterization of the VSV nucleocapsid (N) protein expressed by recombinant baculovirus in Spodoptera exigua larva: use in differential diagnosis between vaccinated and infected animals." Virology 192(1): 207-16. Andersons, D., A. Engstrom, et al. (1991). "Biologically active and amidated cecropin produced in a baculovirus expression system from a fusion construct containing the antibody-binding part of protein A." Biochem J 280 ( Pt 1): 219-24. Anduleit, K., G. Sutton, et al. (2005). "Crystal lattice as biological phenotype for insect viruses." Protein Sci 14(10): 2741-3. Arretz V.P., C.L. Lamborot et al. (1985) “Evaluación del parasitismo sobre los estados inmaduros de la cuncunilla verde del frijol Rachiplusia nu Guenée en praderas de alfalfa”. Revista Chilena de Entomología. 12: 209-215. Ayres, M. D., S. C. Howard, et al. (1994). "The complete DNA sequence of Autographa californica nuclear polyhedrosis virus." Virology 202(2): 586-605. Bassemir, U., H. G. Miltenburger, et al. (1983). "Morphogenesis of nuclear polyhedrosis virus from Autographa californica in a cell line from Mamestra brassicae (cabbage moth). Further aspects on baculovirus assembly." Cell Tissue Res 228(3): 587-95. Belyaev, A. S. y P. Roy (1993). "Development of baculovirus triple and quadruple expression vectors: coexpression of three or four bluetongue virus proteins and the synthesis of bluetongue virus-like particles in insect cells." Nucleic Acids Res 21(5): 1219-23. Bigi, F., O. Taboga, et al. (1999). "Expression of the Mycobacterium bovis P36 gene in Mycobacterium smegmatis and the baculovirus/insect cell system." Braz J Med Biol Res 32(1): 29-37. Birnboim, H. C. y J. Doly (1979). “A rapid alkaline extraction procedure for screening recombinant plasmid DNA”. Nucleic Acids Res. 7:1513-1518. Black, B. C., L. A. Brennan, et al. (1997). "Commercialization of baculoviral insecticides", p. 341-387. En: "The baculoviruses" (L. K. Miller ,ed.). Plenum Press, New York, N.Y. Blissard, G. W. (1996). "Baculovirus--insect cell interactions." Cytotechnology 20(1-3): 73-93. Blissard, G. W. y G. F. Rohrmann (1990). "Baculovirus diversity and molecular biology." Annu Rev Entomol 35: 127-55. Blissard, G. W. y J. R. Wenz (1992). "Baculovirus gp64 envelope glycoprotein is sufficient to mediate pHdependent membrane fusion." J Virol 66(11): 6829-35. 124 Bibliografía Blissard, G. W., P. H. Kogan, et al. (1992). "A synthetic early promoter from a baculovirus: roles of the TATA box and conserved start site CAGT sequence in basal levels of transcription." Virology 190(2): 783-93. Bonning, B.C. y B.D. Hammock (1996). “Development of recombinant baculoviruses for insect control”. Annual Review of Entomology, 41: 191- 210. Boublik, Y., P. Di Bonito, et al. (1995). "Eukaryotic virus display: engineering the major surface glycoprotein of the Autographa californica nuclear polyhedrosis virus (AcNPV) for the presentation of foreign proteins on the virus surface." Biotechnology (N Y) 13(10): 1079-84. Braunagel, S. C. y M. D. Summers (2007). "Molecular biology of the baculovirus occlusion-derived virus envelope." Curr Drug Targets 8(10): 1084-95. Braunagel, S. C., R. Parr, et al. (1998). "Autographa californica nucleopolyhedrovirus infection results in Sf9 cell cycle arrest at G2/M phase." Virology 244(1): 195-211. Braunagel, S. C., W. K. Russell, et al. (2003). "Determination of the protein composition of the occlusionderived virus of Autographa californica nucleopolyhedrovirus." Proc Natl Acad Sci U S A 100(17): 9797-802. Bravo-Patiño, A. y J. E. Ibarra. (2000). “Site-directed mutagenesis of Autographa californica nucleopolyhedrovirus (AcNPV) polyhedron: Effect on polyhedron structure”. Arc Virolog 145: 827834. Carbonell, L. F. y L. K. Miller (1987). "Baculovirus interaction with nontarget organisms: a virus-borne reporter gene is not expressed in two mammalian cell lines." Appl Environ Microbiol 53(7): 14127. Carpentier, D.C.J., C.M. Griffiths et al. (2008). “The baculovirus P10 protein of Autographa californica nucleopolyhedrovirus forms two distinct cytoskeletal-like structures and associates with polyhedral occlusion bodies during infection”. Virology 371:278–291 Carson, D. D., L. A. Guarino, et al. (1988). "Functional mapping of an AcNPV immediately early gene which augments expression of the IE-1 trans-activated 39K gene." Virology 162(2): 444-51. Carstens, E. B. (1982). "Mapping the Mutation Site of an Autographa californica Nuclear Polyhedrosis Virus Polyhedron Morphology Mutant." J Virol 43(3): 809-818. Carstens, E. B., G. V. Williams, et al. (1992). "Analysis of polyhedra morphology mutants of Autographa californica nuclear polyhedrosis virus: molecular and ultrastructural features." J Gen Virol 73 ( Pt 6): 1471-9. Cha, H. J., N. G. Dalal, et al. (1999). "Insect larval expression process is optimized by generating fusions with green fluorescent protein." Biotechnol Bioeng 65(3): 316-24. Chaabihi, H., C. Cetre, et al. (1997). "A new vector for efficient generation of p10-single-late-promoter recombinant baculoviruses." J Virol Methods 63(1-2): 1-7. Charlton, C. A. y L. E. Volkman (1991). "Sequential rearrangement and nuclear polymerization of actin in baculovirus-infected Spodoptera frugiperda cells." J Virol 65(3): 1219-27. 125 Bibliografía Chatterji, U., R. Ahmad, et al. (1996). "A recombination-efficient baculovirus vector for simultaneous expression of multiple genes." Gene 171(2): 209-13. Chen, L., W. Shen, et al. (2009). "The transgenic BmN cells with polyhedrin gene: a potential way to improve the recombinant baculovirus infection per os to insect larvae." Appl Biochem Biotechnol 158(2): 277-84. Cheng, X. W., G. R. Carner, et al. (1998). "Polyhedrin sequence determines the tetrahedral shape of occlusion bodies in Thysanoplusia orichalcea single-nucleocapsid nucleopolyhedrovirus." J Gen Virol 79 ( Pt 10): 2549-56. Cheng, X., P. Krell, et al. (2001). "P34.8 (GP37) is not essential for baculovirus replication." J Gen Virol 82(Pt 2): 299-305. Clarke, T. E. y R. J. Clem (2002). "Lack of involvement of haemocytes in the establishment and spread of infection in Spodoptera frugiperda larvae infected with the baculovirus Autographa californica M nucleopolyhedrovirus by intrahaemocoelic injection." J Gen Virol 83(Pt 7): 1565-72. Cochran, M. A. y P. Faulkner (1983). "Location of Homologous DNA Sequences Interspersed at Five Regions in the Baculovirus AcMNPV Genome." J Virol 45(3): 961-970. Cory, J.S., M.L. Hirst, et al. (1994) “Field trial of a genetically improved baculovirus insecticide” Nature 370:138–140. Coulibaly, F., E. Chiu, et al. (2007). "The molecular organization of cypovirus polyhedra." Nature 446(7131): 97-101. Coulibaly, F., E. Chiu, et al. (2009). "The atomic structure of baculovirus polyhedra reveals the independent emergence of infectious crystals in DNA and RNA viruses." Proc Natl Acad Sci USA. Crouch, E. A. y A. L. Passarelli (2002). "Genetic requirements for homologous recombination in Autographa californica nucleopolyhedrovirus." J Virol 76(18): 9323-34. Derksen, A. C. y R. R. Granados (1988). "Alteration of a lepidopteran peritrophic membrane by baculoviruses and enhancement of viral infectivity." Virology 167(1): 242-50. Duncan, R., K. L. Chung, et al. (1983). "Analysis of a mutant of Autographa california nuclear polyhedrosis virus with a defect in the morphogenesis of the occlusion body macromolecular lattice." J Gen Virol 64 (Pt 7): 1531-42. Etkin, E., L. Carp-Weiss, et al. (1994). "Spodoptera frugiperda Sf-9 cells nuclear factor binds to a specific sequence on the baculovirus polyhedrin promoter." Virus Res 31(3): 343-56. Farrell, P. J., M. Lu, et al. (1998). "High-level expression of secreted glycoproteins in transformed lepidopteran insect cells using a novel expression vector." Biotechnol Bioeng 60(6): 656-63. Faulkner, P., E. B. Carstens, et al. (1997). “Analysis of p74, a PDV envelope protein of Autographa californica nucleopolyhedrovirus required for occlusion body infectivity in vivo”. J Gen Virol 78: 3091-3100. Federici B. A., “Baculovirus pathogenesis” (1997). En: “The Baculovirus” (K. Miller, Ed.). Plenum, New York, p. 33–59.L. 126 Bibliografía Fraser, M. J. (1986). “Ultrastructural observations of virion maturation in Autographa californica nuclear polyhedrosis virus-infected Spodoptera frugiperda cell cultures”. J Ultrastruct Mol Struct Res 95:189-195 Friesen, P. D., (1997). “Regulation of baculovirus early gene expression” En: “The baculoviruses” (L. K. Miller, ed), Plenum, New York, 141. Germain, D., T. Vernet, et al. (1992). "Expression of the Saccharomyces cerevisiae Kex2p endoprotease in inset cells. Evidence for a carboxy-terminal autoprocessing event." Eur J Biochem 204(1): 121-6. Ghosh, S., M. K. Parvez, et al. (2002). "Baculovirus as mammalian cell expression vector for gene therapy: an emerging strategy." Mol Ther 6(1): 5-11. Goodwin, R.H. y J.R. Adams. (1980) “Nutrient factors influencing viral replication in serum-free insect cell line culture”. En: E. Kurstak, K. Maramorosch and A. Dübendorfer editores, Invertebrate Systems In Vitro, Elsevier, Amsterdam pp. 493–509. Granados, R. R. (1978). "Early events in the infection of Hiliothis zea midgut cells by a baculovirus." Virology 90(1): 170-4. Granados, R. R. y K. A. Williams (1986). “In vivo infection and replication of baculoviruses” En: “The Biology of Baculoviruses”, Vol I, Biological Properties and Molecular Biology. (R.R. Granados y B. A. Federici, eds.). CRC Press, Boca Raton, Florida, p. 89-108. Gretch, D. G., S. L. Sturley, et al. (1991). "Baculovirus-mediated expression of human apolipoprotein E in Manduca sexta larvae generates particles that bind to the low density lipoprotein receptor." Proc Natl Acad Sci U S A 88(19): 8530-3. Grula, M. A., P. L. Buller, et al. (1981). "alpha-Amanitin-Resistant Viral RNA Synthesis in Nuclei Isolated from Nuclear Polyhedrosis Virus-Infected Heliothis zea Larvae and Spodoptera frugiperda Cells." J Virol 38(3): 916-921. Guarino, L. A. y M. D. Summers (1986). "Functional mapping of a trans-activating gene required for expression of a baculovirus delayed-early gene." J Virol 57(2): 563-71. Guarino, L. A. y M. D. Summers (1987). "Nucleotide Sequence and Temporal Expression of a Baculovirus Regulatory Gene." J Virol 61(7): 2091-2099. Guarino, L. A. y M. Smith (1992). "Regulation of delayed-early gene transcription by dual TATA boxes." J Virol 66(6): 3733-9. Guarino, L. A. y W. Dong (1991). "Expression of an enhancer-binding protein in insect cells transfected with the Autographa californica nuclear polyhedrosis virus IE1 gene." J Virol 65(7): 3676-80. Guarino, L. A., B. Xu, et al. (1998). "A virus-encoded RNA polymerase purified from baculovirus-infected cells." J Virol 72(10): 7985-91. Guarino, L. A., M. A. Gonzalez, et al. (1986). "Complete Sequence and Enhancer Function of the Homologous DNA Regions of Autographa californica Nuclear Polyhedrosis Virus." J Virol 60(1): 224-229. Habib, S. y S. E. Hasnain (1996). "A 38-kDa host factor interacts with functionally important motifs within the Autographa californica multinucleocapsid nuclear polyhedrosis virus homologous region (hr1) DNA sequence." J Biol Chem 271(45): 28250-8. 127 Bibliografía Habib, S., S. Pandey, et al. (1996). "Bifunctionality of the AcMNPV homologous region sequence (hr1): enhancer and ori functions have different sequence requirements." DNA Cell Biol 15(9): 737-47. Hamblin, M., N. A. Van Beek, et al. (1990). "Co-Occlusion and Persistence of a Baculovirus Mutant Lacking the Polyhedrin Gene." Appl Environ Microbiol 56(10): 3057-3062. Hanahan, D. H. (1985). “Techniques for transformation of E. coli”. En “DNA Cloning: A Practical Approach” vol. I, pp. 109-136. Editor: D. M. Glover. Oxford: IRL Press. Harrap, K. A. (1972). "The structure of nuclear polyhedrosis viruses. 3. Virus assembly." Virology 50(1): 133-9. Hasnain, S. E., A. Jain, et al. (1997). "Involvement of host factors in transcription from baculovirus very late promoters -- a review." Gene 190(1): 113-8. Hasnain, S. E., S. Habib, et al. (1996). "Host factor with single-stranded DNA-binding activity involved in transcription from baculovirus polyhedrin promoter." Methods Enzymol 274: 20-32. Hefferon, K. L., A. G. Oomens, et al. (1999). "Host cell receptor binding by baculovirus GP64 and kinetics of virion entry." Virology 258(2): 455-68. Hegedus, D. D., T. A. Pfeifer, et al. (1998). "A series of broad host range shuttle vectors for constitutive and inducible expression of heterologous proteins in insect cell lines." Gene 207(2): 241-9. Heldens, J. G., H. A. Kester, et al. (1997). "Generation of a p10-based baculovirus expression vector in yeast with infectivity for insect larvae and insect cells." J Virol Methods 68(1): 57-63. Hellers, M., H. Gunne, et al. (1991). "Expression of post-translational processing of preprocecropin A using a baculovirus vector." Eur J Biochem 199(2): 435-9. Herniou, E. A., J. A. Olszewski, et al. (2003). "The genome sequence and evolution of baculoviruses." Annu Rev Entomol 48: 211-34. Hofmann, C., V. Sandig, et al. (1995). "Efficient gene transfer into human hepatocytes by baculovirus vectors." Proc Natl Acad Sci U S A 92(22): 10099-103. Hohmann, A. W. y P. Faulkner (1983). “Monoclonal antibodies to baculovirus structural proteins: determination of specificities by western blot analysis”. Virology 125:432-444. Hollister, J. R. y D. L. Jarvis (2001). "Engineering lepidopteran insect cells for sialoglycoprotein production by genetic transformation with mammalian beta 1,4-galactosyltransferase and alpha 2,6sialyltransferase genes." Glycobiology 11(1): 1-9. Horton, H. M. y J. P. Burand (1993). "Saturable attachment sites for polyhedron-derived baculovirus on insect cells and evidence for entry via direct membrane fusion." J Virol 67(4): 1860-8. Hu, Z., T. Luijckx, et al. (1999). "Specificity of polyhedrin in the generation of baculovirus occlusion bodies." J Gen Virol 80 ( Pt 4): 1045-53. Iatrou, K., R. G. Meidinger, et al. (1989). "Recombinant baculoviruses as vectors for identifying proteins encoded by intron-containing members of complex multigene families." Proc Natl Acad Sci U S A 86(23): 9129-33. 128 Bibliografía Ikeda, M. y M. Kobayashi (1999). "Cell-cycle perturbation in Sf9 cells infected with Autographa californica nucleopolyhedrovirus." Virology 258(1): 176-88. Inceoglu, A. B., S. G. Kamita et al. (2001).”Recombinant baculoviruses for insect control”. Pest Management Science, 57: 981 - 7. Ivanova, M. M., K. A. Mattingly, et al. (2007). "Estrogen receptor beta yield from baculovirus lytic infection is higher than from stably transformed Sf21 cells." Appl Microbiol Biotechnol 74(6): 1256-63. Jain, A. y S. E. Hasnain (1996). "A 30-kDa host protein binds to two very-late baculovirus promoters." Eur J Biochem 239(2): 384-90. Jarvis, D. L. (1997). “Baculovirus Expression Vectors”. En: “The baculoviruses”. (L. D. Miller, ed.), Plenum Press, New York. p. 389-431. Jarvis, D. L. y L. A. Guarino (1995). "Continuous foreign gene expression in transformed lepidopteran insect cells." Methods Mol Biol 39: 187-202. Jarvis, D. L., D. A. Bohlmeyer, et al. (1991). "Requirements for nuclear localization and supramolecular assembly of a baculovirus polyhedrin protein." Virology 185(2): 795-810. Jarvis, D. L., J. A. Fleming, et al. (1990). "Use of early baculovirus promoters for continuous expression and efficient processing of foreign gene products in stably transformed lepidopteran cells." Biotechnology (N Y) 8(10): 950-5. Je, Y. H., J. H. Chang, et al. (2001). "A defective viral genome maintained in Escherichia coli for generation of baculovirus expression vectors”. Biotechnol Lett 23:575-582. Ji, X., G. Sutton, et al (2010). “How baculovirus polyhedra fit square pegs into round holes to robustly package viruses” The EMBO Journal 29:505 – 514. Jinn, T. R., S. S. Kao, et al. (2005). "Coral red fluorescence protein as genetic modified baculovirus tracer." J Biotechnol 119(3): 255-9. Jinn, T. R., S. S.Kao, et al. (2009). “Aerosol infectivity of a Baculovirus to Trichoplusia ni larvae: An alternative larval inoculation strategy for recombinant protein production”. Biotechnol Prog 25(2):384-9. Joyce, K. A., A. E. Atkinson, et al. (1993). "Synthesis of functional GABAA receptors in stable insect cell lines." FEBS Lett 335(1): 61-4. Kalmakoff, J. y V. Ward (2003). “Baculoviruses”. Universidad de Otago. Departmento de Microbiología. Katsuma, S., Y. Noguchi, et al. (1999). "Molecular characterization of baculovirus Bombyx mori nucleopolyhedrovirus polyhedron mutants." Arch. Virol. 144(7): 1275-85. Keith, M. B., P. J. Farrell, et al. (1999). "Screening of transformed insect cell lines for recombinant protein production." Biotechnol Prog 15(6): 1046-52. Kempf, J., L. A. Snook, et al. (2002). "Expression of the human mu opioid receptor in a stable Sf9 cell line." J Biotechnol 95(2): 181-7. 129 Bibliografía Kitts, P. A. y R. D. Possee (1993). "A method for producing recombinant baculovirus expression vectors at high frequency." Biotechniques 14(5): 810-7. Kitts, P. A., M. D. Ayres, et al. (1990). "Linearization of baculovirus DNA enhances the recovery of recombinant virus expression vectors." Nucleic Acids Res 18(19): 5667-72. Kleymann, G., F. Boege, et al. (1993). “Human beta 2-adrenergic receptor produced in stably transformed insect cells is functionally coupled via endogenous GTP-binding protein to adenylyl cyclase”. Eur. J Biochem 213:797–804. Kool, M., C. H. Ahrens, et al. (1994). "Identification of genes involved in DNA replication of the Autographa californica baculovirus." Proc Natl Acad Sci U S A 91(23): 11212-6. Kool, M., C. H. Ahrens, et al. (1995). "Replication of baculovirus DNA." J Gen Virol 76 ( Pt 9): 2103-18. Kool, M., J. T. Voeten, et al. (1994). "Functional mapping of regions of the Autographa californica nuclear polyhedrosis viral genome required for DNA replication." Virology 198(2): 680-9. Kost, T. A. y J. P. Condreay (2002). "Recombinant baculoviruses as mammalian cell gene-delivery vectors." Trends Biotechnol 20(4): 173-80. Kost, T. A., J. P. Condreay, et al. (2005). "Baculovirus as versatile vectors for protein expression in insect and mammalian cells." Nat Biotechnol 23(5): 567-75. Kozak, M. (1987). “An analysis of 5′ noncoding sequences from 699 vertebrate messenger RNAs”. Nucl Acids Res 15: 8125–8132. Kumar, M. S., A. Ramachandran, et al. (2009). "Octamer and heat shock elements regulate transcription from the AcMNPV polyhedrin gene promoter." Arch Virol 154(3): 445-56. Kunimi, Y. y J. R. Fuxa (1996). "Volumes ingested by four species of noctuids with reference to peroral droplet bioassay of baculoviruses." J Invertebr Pathol 68(3): 310-1. Kuroda, K., A. Gröner, et al. (1989). "Synthesis of biologically active influenza virus hemagglutinin in insect larvae". J Virol 63(4):1677–1685. Kyte, J. y R. F. Doolittle (1982). "A simple method for displaying the hydropathic character of a protein." J Mol Biol 157(1): 105-32. Lacey, L.A, R. Frutos, et al. (2001). "Insect pathogens as biological control agents: do they have a future?" Biological control. 21: 230-248. Lee, H. y P. J. Krell (1994). "Reiterated DNA fragments in defective genomes of Autographa californica nuclear polyhedrosis virus are competent for AcMNPV-dependent DNA replication." Virology 202(1): 418-29. Lepore, L. S., P. R. Roelvink, et al. (1996). "Enhancin, the granulosis virus protein that facilitates nucleopolyhedrovirus (NPV) infections, is a metalloprotease." J Invertebr Pathol 68(2): 131-40. Lin, G. Y., J. Zhong, et al. (2000). "Abnormal formation of polyhedra resulting from a single mutation in the polyhedrin gene of Autographa californica multicapsid nucleopolyhedrovirus." J Invertebr Pathol 76(1): 13-9. 130 Bibliografía Lo, H. R., C. C. Chou, et al. (2002). "Novel baculovirus DNA elements strongly stimulate activities of exogenous and endogenous promoters." J Biol Chem 277(7): 5256-64. López, M. G., A. Peralta, et al. (2005). "High-level expression of recombinant 3AB1 non-structural protein from FMDV in insect larvae." J Virol Methods 124(1-2): 221-4. Loustau M.N., L. Romero, et al. (2008) “Expression and purification of horseradish peroxidase in insect larvae” Process Biochem 43:103-107. Lu, A. y L. K. Miller (1995). "The roles of eighteen baculovirus late expression factor genes in transcription and DNA replication." J Virol 69(2): 975-82. Luckow, V. A., S. C. Lee, et al. (1993). "Efficient generation of infectious recombinant baculoviruses by sitespecific transposon-mediated insertion of foreign genes into a baculovirus genome propagated in Escherichia coli." J Virol 67(8): 4566-79. Lung, O., M. Westenberg, et al. (2002). "Pseudotyping Autographa californica multicapsid nucleopolyhedrovirus (AcMNPV): F proteins from group II NPVs are functionally analogous to AcMNPV GP64." J Virol 76(11): 5729-36. Maeda, S., T. Kawai, et al. (1985). "Production of human alpha-interferon in silkworm using a baculovirus vector." Nature 315(6020): 592-4. Maranga, L., P. E. Cruz, et al. (2002). "Production of core and virus-like particles with baculovirus infected insect cells." Adv Biochem Eng Biotechnol 74: 183-206. Maranga, L., T. F. Brazao, et al. (2003). "Virus-like particle production at low multiplicities of infection with the baculovirus insect cell system." Biotechnol Bioeng 84(2): 245-53. Martignoni, M. E. y P. J. Iwai (1986). “A Catalog of Viral Diseases of Insects, Mites, and Ticks”. USDA Forest Service PNW-195. McCarroll, L. y L. A. King (1997). "Stable insect cell cultures for recombinant protein production." Curr Opin Biotechnol 8(5): 590-4. McCarthy W.J., R.A. DiCapua (1979). “Characterization of solubilized proteins from tissue culture and host-derived nuclear polyhedra of Lymantria dispar and Autographa californica”. Intervirology 11: 174–181. McCarthy, C. B., X. Dai, et al. (2008). “Autographa californica multiple nucleopolyhedrovirus ac142, a core gene that is essential for BV production and ODV envelopment”. Virology 372:325-339. McIntosh, A. H., J. J. Grasela, et al. (2005). "AcMNPV in permissive, semipermissive, and nonpermissive cell lines from Arthropoda." In Vitro Cell Dev Biol Anim 41(8-9): 298-304. Medin, J. A., L. Hunt, et al. (1990). "Efficient, low-cost protein factories: expression of human adenosine deaminase in baculovirus-infected insect larvae." Proc Natl Acad Sci U S A 87(7): 2760-4. Merryweather, A. T., U. Weyer, et al. (1990). "Construction of genetically engineered baculovirus insecticides containing the Bacillus thuringiensis subsp. kurstaki HD-73 delta endotoxin." J Gen Virol 71 ( Pt 7): 1535-44. 131 Bibliografía Millonig, G. (1961). “A modified procedure for lead staining of thin sections“. J Biophys Biochem Cytol 11: 736. Miyajima, A., J. Schreurs, et al. (1987). "Use of the silkworm, Bombyx mori, and an insect baculovirus vector for high-level expression and secretion of biologically active mouse interleukin-3." Gene 58(2-3): 273-81. Monsma, S. A., A. G. Oomens, et al. (1996). "The GP64 envelope fusion protein is an essential baculovirus protein required for cell-to-cell transmission of infection." J Virol 70(7): 4607-16. Morais, V. A. y J. Costa (2003). "Stable expression of recombinant human alpha3/4 fucosyltransferase III in Spodoptera frugiperda Sf9 cells." J Biotechnol 106(1): 69-75. Moscardi, F. (1999). "Assessment of the application of baculoviruses for control of Lepidoptera." Annu Rev Entomol 44: 257-89. Muneta, Y., H. K. Zhao, et al. (2003). "Large-scale production of porcine mature interleukin-18 (IL-18) in silkworms using a hybrid baculovirus expression system." J Vet Med Sci 65(2): 219-23. Muraleedharan, D. y Gayathri Elayidam, U. (2008). “Prospect and Promises of Endocrine Biopesticides”. Journal of Biopesticides. 1: 06 – 11 Murphy, F.A., C.M. Fauquet, et al. (1995). “Virus taxonomy”. Archives of Virology Springer-Verlag, Vienna. Nagamine, T., M. Kurihara, et al. (1995). "A baculovirus polyhedrin gene introduced into stably transformed cells is not expressed effectively." J Invertebr Pathol 65(1): 70-2. Nagamine, T., Y. Kawasaki, et al. (2008). "Nuclear marginalization of host cell chromatin associated with expansion of two discrete virus-induced subnuclear compartments during baculovirus infection." J Virol 82(13): 6409-18. Nagaya, H., T. Kanaya, et al. (2004). "Establishment of a large-scale purification procedure for purified recombinant bovine interferon-tau produced by a silkworm-baculovirus gene expression system." J Vet Med Sci 66(11): 1395-401. Oker-Blom, C., K. J. Airenne, et al. (2003). "Baculovirus display strategies: Emerging tools for eukaryotic libraries and gene delivery." Brief Funct Genomic Proteomic 2(3): 244-53. Olson, V. A., J. A. Wetter, et al. (2002). "Baculovirus transregulator IE1 requires a dimeric nuclear localization element for nuclear import and promoter activation." J Virol 76(18): 9505-15. Ooi, B. G., C. Rankin, et al. (1989). "Downstream sequences augment transcription from the essential initiation site of a baculovirus polyhedrin gene." J Mol Biol 210(4): 721-36. Oppenheimer, D. I. y L. E. Volkman (1995). "Proteolysis of p6.9 induced by cytochalasin D in Autographa californica M nuclear polyhedrosis virus-infected cells." Virology 207(1): 1-11. O'Reilly, D.R., L.K. Millery, et al. (1994) “Baculovirus expression vectors: a laboratory manual”. W. H. Freeman and Co., New York. Patmanidi, A. L., R. D. Possee, et al. (2003). "Formation of P10 tubular structures during AcMNPV infection depends on the integrity of host-cell microtubules." Virology 317(2): 308-20. 132 Bibliografía Pearson, M. N., R. L. Russell, et al. (2001). "Characterization of a baculovirus-encoded protein that is associated with infected-cell membranes and budded virions." Virology 291(1): 22-31. Peralta, A., P. Molinari, et al. (2007). "A chimeric baculovirus displaying bovine herpesvirus-1 (BHV-1) glycoprotein D on its surface and their immunological properties". Appl Microbiol Biotechnol75:407-14. Petry, H., C. Goldmann, et al. (2003). "The use of virus-like particles for gene transfer." Curr Opin Mol Ther 5(5): 524-8. Pham, M. Q., S. Naggie, et al. (1999). "Human interleukin-2 production in insect (Trichoplusia ni) larvae: effects and partial control of proteolysis." Biotechnol Bioeng 62(2): 175-82. Possee, R. D. (1997). "Baculoviruses as expression vectors." Curr Opin Biotechnol 8(5): 569-72. Pullen, S. S. y P. D. Friesen (1995). "Early transcription of the ie-1 transregulator gene of Autographa californica nuclear polyhedrosis virus is regulated by DNA sequences within its 5' noncoding leader region." J Virol 69(1): 156-65. Pullen, S. S. y P. D. Friesen (1995). "The CAGT motif functions as an initiator element during early transcription of the baculovirus transregulator ie-1." J Virol 69(6): 3575-83. Ramachandran, A., A. Jain, et al. (2001a). "Novel Sp family-like transcription factors are present in adult insect cells and are involved in transcription from the polyhedrin gene initiator promoter." J Biol Chem 276(26): 23440-9. Ramachandran, A., M. D Bashyam, et al. (2001b) “The bountiful and baffling baculovirus: the story of polyhedrin transcription”. Curr Sci 81, 998-1010. Rapp, J. C., J. A. Wilson, et al. (1998). "Nineteen baculovirus open reading frames, including LEF-12, support late gene expression." J Virol 72(12): 10197-206. Reed, L.J. y H. Muench (1938). "A simple method of estimating fifty percent endpoints". The American Journal of Hygiene 27: 493–497. Reis, U., B. Blum, et al. (1992). "Antibody production in silkworm cells and silkworm larvae infected with a dual recombinant Bombyx mori nuclear polyhedrosis virus." Biotechnology (N Y) 10(8): 910-2. Ribeiro, B. M., A. P. Generino, et al. (2009). "Characterization of a new Autographa californica multiple nucleopolyhedrovirus (AcMNPV) polyhedra mutant." Virus Res 140(1-2): 1-7. Riekel, C., M. Burghammer, et al. (2005). "Protein crystallography microdiffraction." Curr Opin Struct Biol 15(5): 556-62. Rohrmann, G. F. (2008). “Baculovirus Molecular Biology”. National Library of Medicine (US) National Center for Biotechnology Information. Bethesda, MD. Rose, R. C., W. Bonnez, et al. (1993). "Expression of human papillomavirus type 11 L1 protein in insect cells: in vivo and in vitro assembly of viruslike particles." J Virol 67(4): 1936-44. Shishido, T., N. Kurata, et al. (2009). "A high-level expression vector containing selectable marker for continuous production of recombinant protein in insect cells." Biotechnol Lett 31(5): 623-7. 133 Bibliografía Slack J.M., J. Kuzio, et al. (1995). “Characterization of v-cath, a cathepsin L-like proteinase expressed by the baculovirus Autographa californica multiple nuclear polyhedrosis virus”. J Gen Virol 76: 1091–1098. Slack, J. y B. M. Arif (2007). "The baculoviruses occlusion-derived virus: virion structure and function." Adv Virus Res 69: 99-165. Smith, G. E. y M. D. Summers (1979). “Restriction Maps of Five Autographa californica MNPV Variants, Trichoplusia ni MNPV, and Galleria mellonella MNPV DNAs with Endonucleases SmaI, KpnI, BamHI, Sacl, XhoI, and EcoRI”. J Virol 30: 828-838. Srinivas, V. R., K. Bachhawat-Sikder, et al. (2001). "Expression of winged bean basic agglutinin in Spodoptera frugiperda insect cell expression system." Biosci Rep 21(3): 361-7. Stewart, L. M., M. Hirst, et al. (1991). "Construction of an improved baculovirus insecticide containing an insect-specific toxin gene." Nature 352(6330): 85-8. Sun, X.L., H.L. Wang, et al. (2004). “Biological activity and field efficacy of a genetically modified Helicoverpa armigera single-nucleocapsid nucleopolyhedrovirus expressing an insect-selective toxin from a chimeric promoter” Biol Control 29: 124–137 Szewczyk, B., L. Hoyos-Carvajal, et al. (2006). "Baculoviruses-- re-emerging biopesticides." Biotechnol Adv 24(2): 143-60. Theilmann, D. A. y S. Stewart (1992). "Molecular analysis of the trans-activating IE-2 gene of Orgyia pseudotsugata multicapsid nuclear polyhedrosis virus." Virology 187(1): 84-96. Theilmann, DA, G. W. Blissard, et al. (2005) “Baculoviridae” En: “Virus Taxonomy – Eighth Report of the International Committee on Taxonomy of Viruses” (Fauquet, C. M, Mayo, M.A, Maniloff, J, Desselberger, U, Ball, L.A., eds.). Springer, New York, p. 1129-1185 Tian, C. H., X. D. Tang, et al. (2009). "Bombyx mori nucleopolyhedrovirus ORF51 encodes a budded virus envelope associated protein." Virus Genes 38(1): 171-7. Tinsley, T. W. y D. C. Kelly (1985). “Taxonomy and nomenclature of insect pathogenic viruses”. En: Maramorosch, K. y Shermann, K. E. “Viral Insecticides for biological control”. Academic Press, New York, p. 3-25. Todd, J. W., A. L. Passarelli, et al. (1996). "Factors regulating baculovirus late and very late gene expression in transient-expression assays." J Virol 70(4): 2307-17. Trudeau, D., J. O. Washburn, et al. (2001). "Central role of hemocytes in Autographa californica M nucleopolyhedrovirus pathogenesis in Heliothis virescens and Helicoverpa zea." J Virol 75(2): 9961003. Tuan, S. J., R. F. Hou et al. (2007). “High level production of polyhedra in a scorpion toxincontaining recombinant baculovirus for better control of insect pests”. Botanical Studies (2007) 48: 273-281. Venkaiah, B., P. Viswanathan, et al. (2004). "An additional copy of the homologous region (hr1) sequence in the Autographa californica multinucleocapsid polyhedrosis virus genome promotes yperexpression of foreign genes." Biochemistry 43(25): 8143-51. 134 Bibliografía Viswanathan, P., B. Venkaiah, et al. (2003). "The homologous region sequence (hr1) of Autographa californica multinucleocapsid polyhedrosis virus can enhance transcription from non-baculoviral promoters in mammalian cells." J Biol Chem 278(52): 52564-71. Volkman, L. E. y P. A. Goldsmith (1985). "Mechanism of neutralization of budded Autographa californica nuclear polyhedrosis virus by a monoclonal antibody: Inhibition of entry by adsorptive endocytosis." Virology 143(1): 185-95. Wang P. y R.R. Granados (1997).”An intestinal mucin is the target substrate for a baculovirus enhancing”. Proc Natl Acad Sci USA 94(13): 6977–82. Wang, L., Z. Tamer, et al. (2009). “Characterization of a virion occlusion-defective Autographa californica multiple nucleopolyhedrovirus mutant lacking the p26, p10 and p74 genes”. J Gen Virol 90: 16411648. Westenberg, M., F. Veenman, et al. (2004). "Functional analysis of the putative fusion domain of the baculovirus envelope fusion protein F." J Virol 78(13): 6946-54. Westenberg, M., H. Wang, et al. (2002). "Furin is involved in baculovirus envelope fusion protein activation." J Virol 76(1): 178-84. Weyer, U. y R. D. Possee (1989). "Analysis of the promoter of the Autographa californica nuclear polyhedrosis virus p10 gene." J Gen Virol 70 ( Pt 1): 203-8. Whitt, M. A. y J. S. Manning (1988). "A phosphorylated 34-kDa protein and a subpopulation of polyhedrin are thiol linked to the carbohydrate layer surrounding a baculovirus occlusion body." Virology 163(1): 33-42. Williams G.V. et al. (1989) “A cytopathological investigation of Autographa californica nuclear polyhedrosis virus p10 gene function using insertion/deletion mutants”. J Gen Virol 70: 187–202. Woo, S. D. y J. Y. Ahn. (2006). “Influence of polyhedrin and host cell on the polyhedra morphology of Autographa californica nucleopolyhedrovirus”. App Ent and Zool 41:435-443. Woo, S. D., W. J. Kim, et al. (1998). "The morphology of the polyhedra of a host range-expanded recombinant baculovirus and its parents." Arch Virol 143(6): 1209-14. Wood, H. A., K. M.Trotter et al. (1993). “Peros infectivity of preoccluded virions from polyhedrin-minus recombinant baculoviruses”. J Invertebr Pathol 62: 64–67. Wu, C. P., J. Y. Wang, et al. (2008). "Identification of baculoviral factors required for the activation of enhancer-like polyhedrin upstream (pu) sequence." Virus Res 138(1-2): 7-16. Wu, T. Y., L. Liono, et al. (2000). "Expression of highly controllable genes in insect cells using a modified tetracycline-regulated gene expression system." J Biotechnol 80(1): 75-83. Wu, Y., G. Liu, et al. (1999). "Replication, integration, and packaging of plasmid DNA following cotransfection with baculovirus viral DNA." J Virol 73(7): 5473-80. Xu H., Z.Yang, et al. (2008). ”Bombyx mori nucleopolyhedrovirus ORF56 encodes an occlusion-derived virus protein and is not essential for budded virus production”. J Gen Virol 89: 1212–1219. 135 Bibliografía Yang, S. y L. K. Miller (1999). "Activation of baculovirus very late promoters by interaction with very late factor 1." J Virol 73(4): 3404-9. Yu, X., L. Jin, et al. (2008). "3.88 A structure of cytoplasmic polyhedrosis virus by cryo-electron microscopy." Nature 453(7193): 415-9. 136