Subido por
Christopher Job Buitrón Ramírez
Criptorquidia: Etiología, Epidemiología y Diagnóstico
Anuncio
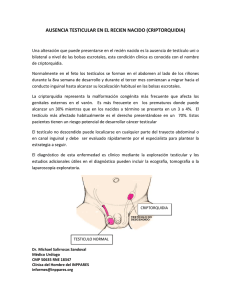
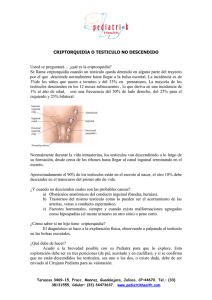
UNIVERSIDAD CENTRAL DEL ECUADOR CIRUGIA PEDIATRICA DR. EDUARDO VILLACIS TEMA: CRIPTORQUIDEA BUITRON RAMIREZ CHRISTOPHER JOB Introducción La criptorquidia es una condición en la que al menos un testículo no se encuentra en el escroto. Es la malformación congénita más común de los genitales masculinos, y afecta al 3% de los bebés varones nacidos a término y al 30% de los prematuros. Los testículos suelen descender durante la séptima semana de gestación. Sin embargo, en alrededor del 80% de los casos, los testículos en esta situación sí acaban descendiendo al tercer mes de vida después del nacimiento, lo que reduce la incidencia real de la condición al 1%. Si un testículo no ha descendido a los seis meses de edad, es poco probable que lo haga por sí solo y se debería considerar una cirugía para corregirlo. Etiología Para que los testículos desciendan de manera normal, es necesario que el eje hipotalámico-pituitariogonadal funcione correctamente. El peso al nacer es el principal factor de riesgo para la criptorquidia, seguido de los antecedentes familiares. La ausencia de un testículo en el apéndice puede estar relacionada con la criptorquidia, especialmente si se encuentra cerca del anillo externo. Aunque no se conoce bien el papel exacto del apéndice testicular en el descenso del testículo, se cree que puede ser un factor. En los bebés a término, a menudo es difícil determinar la causa de la criptorquidia, lo que la convierte en una malformación congénita idiopática, es decir, sin causa conocida. Se piensa que la genética y los factores maternos y ambientales pueden afectar a las hormonas y cambios físicos que influyen en el desarrollo y descenso testicular. Epidemiologia La criptorquidia es una condición relativamente poco común, aunque su prevalencia varía según la edad y la localización geográfica. En general, alrededor del 3% de los recién nacidos a término tienen criptorquidia, y esta cifra disminuye a aproximadamente el 1% en bebés de seis meses a un año. En los neonatos varones prematuros, la prevalencia es del 30%. La criptorquidia también parece ser más común en los hermanos de niños con testículos no descendidos, con una prevalencia del 7%. En los Estados Unidos, la prevalencia de la criptorquidia varía desde el 3% al nacer hasta el 1% desde un año hasta la edad adulta. A nivel internacional, la prevalencia puede variar desde el 4% al 5% al nacer, entre el 1% y el 1,5% a los tres meses, y entre el 1% y el 2,5% a los nueve meses. La criptorquidia también puede ser más común en los padres y hermanos de personas con criptorquidia, con una prevalencia estimada del 1,5% al 4% y del 6%, respectivamente. La heredabilidad en parientes varones de primer grado se estima en aproximadamente el 0,5% al 1%. Además, se ha sugerido una posible asociación entre la criptorquidia y el autismo. Factores de riesgo Los siguientes factores pueden aumentar el riesgo de criptorquidia: ▪ Prematuridad ▪ Talla baja para la edad gestacional ▪ La obesidad materna y la diabetes durante el embarazo ▪ El consumo de alcohol durante el embarazo (especialmente más de cinco bebidas a la semana, lo que aumenta el riesgo 3 veces) ▪ El tabaquismo durante el embarazo ▪ Antecedentes familiares de criptorquidia ▪ El uso de cosméticos que contengan ftalato (un químico utilizado como plastificante) ▪ La preeclampsia (cuanto más grave, mayor es el riesgo de criptorquidia) ▪ Algunos síndromes de malformación congénita, como el síndrome de Down, el síndrome de Prader-Willi y el síndrome de Noonan, Prune-Belly. ▪ El síndrome del conducto mulleriano persistente ▪ La fertilización in vitro (FIV). Fisiopatología Embriología El desarrollo de los testículos durante el embarazo incluye el proceso de descenso desde su ubicación intraabdominal original en la cresta urogenital hacia el escroto a través de varias etapas. Durante la primera fase del descenso, los ligamentos craneal y genito-inguinal (también conocido como gubernaculum) controlan la posición del testículo. La hormona antimülleriana y los andrógenos producidos por las células de Sertoli y Leydig, respectivamente, también juegan un papel en el descenso del testículo. Un divertículo de la membrana peritoneal llamado proceso vaginalis se extiende a través del gubernaculum y conecta el testículo con el futuro anillo inguinal. A medida que el embarazo avanza, el testículo desciende rápidamente a través del canal inguinal y luego más lentamente hacia el escroto. Una vez que el testículo alcanza el escroto, el proceso vaginal se oblitera y el bulbo gubernacular se involuciona y se ancla al interior del escroto. Estos procesos son importantes para prevenir la hernia inguinal y la torsión extra vaginal del testículo. El gen SRY en el cromosoma Y es responsable de la diferenciación de la gónada indiferente en un testículo aproximadamente 6 semanas después de la concepción. Las células de Sertoli producen la hormona antimülleriana (AMH) que lleva a la regresión de los órganos genitales femeninos. Las células de Leydig comienzan a producir testosterona alrededor de las 9 semanas de gestación, lo que promueve el desarrollo del conducto wolffiano y el testículo se organiza como un órgano separado con sus túbulos seminíferos rodeados de vasos y encapsulados por la túnica albugínea. Los testículos permanecen en posición retroperitoneal hasta las 28 semanas de gestación, momento en el que comienzan a descender hacia el escroto. La mayoría de los testículos han completado su descenso al escroto a las 40 semanas de gestación. Figura 1. Las etapas embriológicas del descenso testicular. Tomado de: https://www.ncbi.nlm.nih.gov/books/NBK279106/bin/cryptorchid-hypospad-Image001.jpg Teorías Existen varias teorías sobre la fisiopatología de la criptorquidia. Una de estas teorías se basa en anomalías en la estructura llamada gubernáculum, que es una estructura que conecta la parte inferior de la túnica vaginal con la base del escroto y se cree que ayuda en el descenso testicular. Otra teoría se basa en la disminución de las presiones intraabdominales, que se ha observado en pacientes con síndrome del vientre de ciruela pasa y gastrosquisis. También se ha sugerido que la criptorquidia puede ser causada por anomalías intrínsecas testiculares o epididimarias y anomalías en el eje hipotalámico-pituitario-gonadal. Sin embargo, aún no se comprende completamente la fisiopatología de la criptorquidia. El gubernaculum es una estructura que conecta la parte inferior de la túnica vaginal con la base del escroto y se cree que juega un papel en el descenso testicular. Se ha sugerido que ciertas anomalías en el gubernaculum pueden contribuir a la aparición de criptorquidia. El gubernaculum se cree que ayuda a ensanchar el canal inguinal y guía el testículo hacia el escroto. Se ha sugerido que anomalías en el tejido del testículo o en el epidídimo (un conducto cerca del testículo que almacena y transporta espermatozoides) pueden contribuir a la criptorquidia. Estudios han demostrado que el tejido germinal del testículo maldescendido puede ser anormal histológicamente. La infertilidad a menudo se asocia con la criptorquidia y el riesgo de infertilidad aumenta con el grado de maldescendencia. Además, en aproximadamente el 23-86% de los testículos maldescendidos se han encontrado anomalías en el epidídimo. Los estudios han mostrado un mayor grado de anomalías en el epidídimo en los testículos intraabdominales en comparación con los casos leves de criptorquidia. Un estudio informó una incidencia del 8% de disociación completa del testículo en individuos con criptorquidia. Clasificación La criptorquidia se puede clasificar de acuerdo con diferentes factores, como su etiología (congénita o adquirida), la localización del testículo (unilateral o bilateral), su palpabilidad (palpable o no palpable) y su posible asociación con otras anomalías urológicas o síndromes. La criptorquidia congénita, que es la forma más común, se debe a un mal descenso testicular durante el desarrollo fetal. Por otro lado, la criptorquidia adquirida se refiere a un testículo que se encontraba en una posición normal al nacer, pero que luego se sale del escroto con el paso del tiempo. La localización del testículo puede ser unilateral o bilateral, y puede ser palpable o no palpable. En el caso de no ser palpable, el testículo puede estar ubicado en el canal inguinal, en la región abdominal o ausente. La criptorquidia también puede presentarse aislada o estar asociada con otras anomalías urológicas o síndromes. ▪ ▪ ▪ ▪ Etiología: congénita (98% de los casos) o adquirida (2% de los casos) Localización: unilateral (leve predominio del lado izquierdo) o bilateral (hasta en un 10% de los casos). Palpación: o Palpables (70%): incluyen testes inguinales (canalículo); testes ectópicos. o No palpables (30%): incluyen testes inguinales (preescrotal, frecuencia de un 30%), testículos intraabdominales (ectópicos, frecuencia de 55-60%). Asociación: hipospadias, defectos del tubo neural, parálisis cerebral o formando parte de síndromes mencionados en los factores de riesgo. Diagnostico En casos en que un testículo no puede ser sentido durante un examen físico, es más difícil determinar si está presente o no y ubicar su posición. Esto suele ocurrir en aproximadamente el 30% de los casos de criptorquidia. La utilización de ultrasonido para localizar estos testículos no palpables tiene una sensibilidad y especificidad del 45% y 78%, respectivamente. Los estudios también muestran que, en los niños con un testículo no palpable y un resultado negativo en la ecografía, alrededor del 49% finalmente se demuestra que tienen un testículo intraabdominal. Sin embargo, en manos de un proveedor experimentado, más del 70% de los testículos con la patología son palpables durante el examen físico y no necesitan pruebas de imagen adicionales. El cariotipo es un análisis de los cromosomas que se realiza para confirmar o descartar el hipogonadismo primario disgenético, un trastorno en el que los testículos no producen suficientes hormonas sexuales masculinas. Los niveles hormonales como las gonadotropinas y la sustancia inhibidora mulleriana pueden ayudar a confirmar que los testículos son hormonalmente funcionales y deben ser conservados. También se puede realizar una estimulación con gonadotropina coriónica humana para aumentar el nivel de testosterona. En algunos casos, es necesario realizar pruebas adicionales para detectar condiciones intersexuales. Estas pruebas son importantes para determinar el mejor tratamiento para cada caso individual. Tratamiento Los proveedores de atención médica no deben utilizar la terapia hormonal para intentar hacer que los testículos desciendan, ya que hay poca evidencia de que esto sea efectivo a largo plazo y las tasas de respuesta son bajas. Sin embargo, las Pautas de la Asociación Americana de Pediatría recomiendan el uso de hormonas en casos de criptorquidia asociada con el síndrome de Prader-Willi. Esto se debe a que un ensayo terapéutico con gonadotropina coriónica humana (HCG) antes de la cirugía puede ayudar a evitar la anestesia general en bebés con tono muscular bajo y alto riesgo de problemas respiratorios. La gonadotropina coriónica humana (HCG) es una hormona comúnmente utilizada para tratar la criptorquidia. Se administran una serie de inyecciones de HCG y se evalúa de nuevo el estado del testículo no descendido. La tasa de éxito de este tratamiento se informa como estar entre el 5% y el 50%. Además, el tratamiento hormonal puede confirmar la capacidad de respuesta de las células de Leydig y estimular el crecimiento adicional de un pene pequeño al aumentar los niveles de testosterona. El costo del tratamiento hormonal es menor que el de la cirugía y las complicaciones son mínimas. Sin embargo, un metaanálisis reciente de siete ensayos clínicos aleatorios concluyó que la terapia hormonal no es más efectiva que un placebo. Cirugía La cirugía se recomienda para tratar la criptorquidia en niños entre las edades de 6 y 18 meses, según las Pautas de la Asociación Estadounidense de Urología (AUA). Muchos expertos creen que la cirugía temprana, cerca de los seis meses de edad, es la mejor opción para optimizar el crecimiento testicular y la fertilidad. En los bebés prematuros, se utiliza la edad corregida para determinar cuándo es el momento óptimo para la cirugía. Cuanto más tiempo se deje sin tratar la criptorquidia, mayor será la pérdida de células germinales y la disminución de la fertilidad, por lo que la cirugía temprana es el tratamiento estándar. Los pacientes con criptorquidia bilateral que reciben cirugía como adultos casi siempre son infértiles y azoospérmicos, pero hay algunos informes aislados de embarazos logrados a través de la reproducción asistida en este grupo. Para los testículos adquiridos (que fueron normales antes del diagnóstico) o atrapados (después de la reparación de una hernia) que no han descendido, se recomienda la cirugía poco después del diagnóstico. En los casos de testículos retráctiles, se recomienda realizar un examen físico anual debido al riesgo de que un testículo retráctil se convierta en un testículo no descendido adquirido, que se informa en un rango del 2% al 50%. En testículos palpables que no han descendido, se recomienda una orquiopexia inguinal o escrotal. Esto se realiza mediante una incisión en el escroto, la ingle o el borde alto del escroto. Se pueden utilizar varios tipos de retractores dependiendo del tamaño de la incisión. Las incisiones inguinales pueden ser muy pequeñas, mientras que las incisiones escrotales pueden ser más grandes, ya que a menudo se cicatrizan de manera oculta. El testículo puede abordarse primero o el cordón primero. La parte más difícil de la cirugía es separar el saco de la hernia del conducto y los vasos testiculares. Una vez que se ha completado el procedimiento, el testículo se suele colocar y asegurar en el escroto de diferentes maneras, como en una bolsa sub-dartos, mediante suturas absorbibles o no absorbibles, o simplemente cerrando el pasaje en la ingle. En testículos no palpables que se evalúan bajo anestesia, se recomienda la laparoscopia exploratoria. Si se encuentra un testículo durante la laparoscopia exploratoria, hay varias opciones disponibles para tratarlo. La orquiopexia laparoscópica preservando los vasos implica diseccionar el testículo de un pedículo triangular que contiene los vasos gonadales y el vas. La orquiopexia laparoscópica de Fowler Stevens de una etapa implica dividir los vasos gonadales y diseccionar el testículo de un pedículo del conducto en una sola etapa. La orquiopexia laparoscópica de Fowler Stevens en dos etapas involucra dividir los vasos con clips y posponer la disección del testículo durante seis meses para permitir el desarrollo óptimo de las colaterales. La tracción-orquidopexia laparoscópica de dos etapas es una alternativa a la orquidopexia Fowler Stevens de dos etapas que implica fijar el testículo intrabdominal a un punto cerca de la columna ilíaca superior anterior contralateral, lo que proporciona tracción. El testículo se deja allí durante tres meses, después de lo cual se realiza una orquidopexia subdartos ipsilateral asistida por laparoscopia. Esta técnica permite reubicar un testículo intraabdominal en el escroto sin necesidad de sacrificar los vasos testiculares principales y tiene una tasa de éxito muy alta con la preservación de la vasculatura testicular sin atrofia. El éxito general con esta técnica es del 84% al 100%.` Complicaciones La orquiopexia se asocia con dos complicaciones principales en el testículo: atrofia y ascenso testicular. Estas ocurren aproximadamente en el 1% de los casos de orquiopexia en testículos palpables y en alrededor del 5% de las orquiopexias laparoscópicas. En las orquiopexias de FowlerStephens, que implican dividir los vasos, la tasa de atrofia testicular es de alrededor del 20% al 30% (siendo peor para el procedimiento de una sola etapa). Una de las complicaciones más graves de la orquiopexia es la pérdida del testículo debido a la sobreesqueletización del cordón espermático. Pronostico Cuando la criptorquidia se diagnostica y trata de manera adecuada, el pronóstico es generalmente excelente. Aunque el riesgo de cáncer testicular y la infertilidad aumentan ligeramente en comparación con la población general, un estudio reciente realizado en Dinamarca con más de 6.000 hombres encontró que los hombres con antecedentes de criptorquidia tenían una hipofunción testicular, un volumen testicular reducido (3,5 cc), una reducción del 28% en la concentración de espermatozoides y una disminución en la función de las células de Leydig en comparación con los hombres sin criptorquidia. Referencias bibliográficas 1. Hutson JM. Cryptorchidism and Hypospadias. En: Endotext [Internet]. MDText.com; 2022. 2. Evaluation and treatment of cryptorchidism (2018) - American urological association [Internet]. Auanet.org. [citado el 6 de enero de 2023]. Disponible en: https://www.auanet.org/guidelines-andquality/guidelines/cryptorchidism-guideline 3. Wei Y, Wang Y, Tang X, Liu B, Shen L, Long C, et al. Efficacy and safety of human chorionic gonadotropin for treatment of cryptorchidism: A meta-analysis of randomised controlled trials. J Paediatr Child Health [Internet]. 2018 [citado el 6 de enero de 2023];54(8):900–6. Disponible en: https://pubmed.ncbi.nlm.nih.gov/29655188/ 4. Elamo HP, Virtanen HE, Toppari J. Genetics of cryptorchidism and testicular regression. Best Pract Res Clin Endocrinol Metab [Internet]. 2022;36(1):101619. Disponible en: https://www.sciencedirect.com/science/article/pii/S1521690X22000069 5. Loebenstein M, Thorup J, Cortes D, Clasen-Linde E, Hutson JM, Li R. Cryptorchidism, gonocyte development, and the risks of germ cell malignancy and infertility: A systematic review. J Pediatr Surg [Internet]. 2020 [citado el 6 de enero de 2023];55(7):1201–10. Disponible en: https://read.qxmd.com/read/31327540/cryptorchidism-gonocyte-development-and-the-risks-ofgerm-cell-malignancy-and-infertility-a-systematic-review 6. Anand S, Krishnan N, Pogorelić Z. Utility of laparoscopic approach of orchiopexy for palpable cryptorchidism: A systematic review and meta-analysis. Children (Basel) [Internet]. 2021 [citado el 6 de enero de 2023];8(8):677. Disponible en: https://read.qxmd.com/read/34438568/utility-oflaparoscopic-approach-of-orchiopexy-for-palpable-cryptorchidism-a-systematic-review-and-metaanalysis
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados