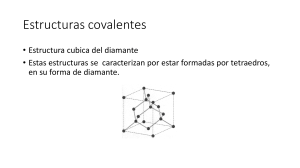
Generalidades, Principios y Características de los Minerales Marco Antonio Márquez Godoy Universidad Nacional de Colombia Grupo de Mineralogía Aplicada Programa Introducción a la mineralogía Sistemas cristalinos Principios de formación de estructuras cristalinas Visualización de estructuras cristalinas Defectos en las estructuras cristalinas Introducción Definición de mineral Sólido. Homogéneo. Carácter y origen inorgánico. Formado por un proceso natural. Composición química definida pero no fija. Estructura interna ordenada (patrón definido). Los minerales se pueden presentar como… Cristalinos/amorfos/semicristalinos Policristalino/monocristalino Polifásico/monofásico Agregados/granos separados Diversos hábitos Películas gruesas y delgadas Acicular Botrioidal Poroso/denso Etc. Algunas definiciones de interés Isoestructuralismo Polimorfismo Politipismo Seudomorfismo Mineraloide Isoestructuralismo Isoestructuralismo Llamados también isomorfos o isotipos. Estructura cristalina similar, composición química diferente. Halita – periclasa, fluorita estishovita – rutilo, etc. – uraninita, Los patrones de rayos X muestran patrones análogos, con diferentes espaciamientos (d [Å]) e intensidades. Propiedades diferentes, dimensiones de celda unitaria diferentes, etc. Isoestructuralismo Grupos espaciales idénticos. Minerales con estructura tipo halita son F4/m 3 2/m: Silvita (KCl), periclasa (MgO), galena (PbS), osbornita (TiN), etc. Rutilo y estishovita P42/m 2/n 2/m. Deben tener el mismo número de cationes y el mismo número de aniones. Series de solución sólida parcial o total. Isoestructuralismo Solución sólida total: Olivinos (Fo-Fa) Plagioclasas (Ab-An), etc Au-Ag substitución iónica. A veces calculable por DRX. Solución sólida parcial. Casi todos los minerales. Esfalerita (Zn,Fe)S Galena (Pb, Ag)S Dopaje de cerámicos cambio en las propiedades físicas (color, eléctricas, mecánicas, etc.) Grupos Isoestructurales Calcita Barita Calcita (CaCO3) Magnesita (MgCO3) Siderita (FeCO3) Rodocrosita (MnCO3) Smithsonita (ZnCO3) Barita (BaSO4) Celestita (SrSO4) Anglesita (PbSO4) Alunita Alunita (KAl2(SO4)3(OH)2) Jarosita (KFe2(SO4)3(OH)2) Hidroniojarosita (H3OFe2(SO4)3(OH)2) Etc. Polimorfismo Definiciones Habilidad de un compuesto químico para cristalizar con más de una estructura cristalina POLIMORFISMO. Composición idéntica con estructura cristalina diferente. Materiales que existen en más de una forma cristalográfica POLIMORFOS O ALÓTROPOS. Transición acompañada por cambio de volumen. GRUPO POLIMÓRFICO set de minerales que tienes las misma composición química y diferentes estructuras cristalinas. Se forman debido a que la mayoría de las estructuras cristalinas representan una colección de compromisos que equilibran requerimientos en conflicto relacionados a: Atracción y repulsión de cationes y aniones Ajuste de cationes en sus sitios de coordinación Requerimientos geométricos relacionados al tipo de enlace químico (covalencia, ionicidad, etc.) COMPROMISO MENOR GASTO EN ENERGÍA PARA MANTENER UN ARREGLO ESPECÍFICO DE ÁTOMOS Tipos Transformaciones polimórficas pueden ser clasificadas en cuatro tipos, dependiendo de los tipos de cambio que ocurren en el cristal: Displasiva Reconstructiva Orden – desorden Politipismo Generalidades Números de coordinación y átomos de primer orden frecuentemente semejantes. Diferencias en el segundo orden o en los modelos de apilamiento. También puede ser clasificadas de acuerdo a la velocidad de la transformación. Transformación displasiva Clase menos drástica No requiere cambios en los átomos de primera coordinación. El cambio de energía Cambio en la segunda coordinación de la estructura. Distorsión de la estructura sin romper los enlaces o cambiar la estructura básica. Sólo desplazamiento de los átomos. Ocurre rápidamente. Denominada también transformación alta-baja geología. Forma inicial forma abierta. Energía estructural del sistema rebajada distancia entre los enlaces secundarios es decrecida. Estructura distorsionada (producto): Forma de baja T. Forma de menor energía estructural. Transformación displasiva Características: El sólido de alta T: Siempre la forma abierta. Tiene siempre un volumen específico mayor. Mayor capacidad calorífica y mayor entropía. Más alta simetría. El material de baja T: Derivado de la estructura de alta T. Comúnmente resultan maclas. Transformación Displasiva Transformación Reconstructiva Cambios en la coordinación secundaria alterando completamente las relaciones estructurales. Enlaces interatómicos precisan ser rotos. La energía requerida para este rompimiento es recuperada cuando la nueva estructura es formada. Mayor requerimiento de energía de activación. Transformaciones en consecuencia son frecuentemente lentas. Algunas formas de alta T pueden ser enfriadas sin revertir en una forma más estable termodinámicamente. Geotermómetros cualitativos. Transformación Reconstructiva Toma lugar de varias formas: Nucleación de una nueva fase. Transformación en estado sólido. Alta presión de vapor vaporización y condensación como una forma más estable. Transformaciones aceleradas mediante la presencia de un líquido mayor solubilidad de la forma inestable viaje en solución precipitación como una forma más estable. Manofactura de refractarios de sílica calcareo como fundente a alta T disolución del Qz y precipitación como tridimita producto deseable cambio de volumen menor de la fase altabaja que el Qz. Transformación reconstructiva acelerada mediante adición de energía mecánica. Transformación Reconstructiva Transformación Reconstructiva Transformación Displasiva Polimorfismo Displasivo Politipismo Tipo especial de polimorfismo. Dos polimorfos que sólo difieren en la forma como se apilan capas bidimensionales idénticas. Dimensiones de la celda unitaria idénticas las direcciones paralelas a las capas constituyentes entre los politipos. Espaciamiento atómico entre las capas diferentes múltiplos o submúltiplos. Conocido en pirrotita, bornita, micas, minerales de las arcillas, SiC, etc. Vectores de desplazamiento Capas Bloques unitarios Tipos de apilamiento Polimorfismo de orden-desorden La estructura permanece más o menos lo mismo. El cambio se da a nivel de la distribución de los cationes dentro de los sitios estructurales. La estructura se considera DESORDENADA si dos cationes ocupan aleatoriamente dos sitios cristalinos determinados. Se considera ORDENADA si los cationes ocupan sitios específicos en la estructura cristalina. Común en: Grupo de los feldespatos Minerales del grupo de las arcillas Las propiedades físicas y químicas pueden cambiar. Grado de orden/desorden. Grupos Polimórficos SiO2: Pirita Marcasita Goethita Lepidocrocita CaCO3: Calcita Aragonito Fe2O3 Esfalerita Wurtzita KAlSi3O8: Hematita Maghemita ZnS: FeOOH FeS2: Cuarzo y Tridimita y Cristobalita Coesita Estishovita Sanidina Ortoclasa Microclina Fe1-XS Pirrotita Hx Pirrotita Mon Seudomorfismo Definición Seudomorfo (falsa forma): Mineral resultante de un proceso de sustitución en el cual la apariencia y dimensiones permanecen constantes, pero el mineral original es reemplazado por otro. Compuestos donde la forma externa no está relacionada con el orden interno a nivel de los átomos. Tipos Paramorfo (también llamado alomorfo) Mineral cambiado únicamente a nivel de la estructura cristalina. Seudomorfismo donde el mineral que reemplaza es un polimorfo. i.e. aragonito calcita. Seudomorfo por infiltración Seudomorfo en el cual un mineral es reemplazado por otro, mediante los siguientes mecanismos: Sustitución con cambio químico total o parcial Oxidación a nivel iónico (Fe2+ Fe3+, S2- S0 S6+, etc.) Salida de algunos elementos y permanencia de otros Combinación de algunos de los anteriores Seudomorfo por incrustación Producto de un proceso en el cual un mineral es cubierto por otro y el mineral encapsulado se disuelve. Algunas veces otro mineral rellena el espacio previamente disuelto. Limonita como seudomorfo de pirita Calcocita como seudomorfo de pirita Hematita como seudomorfo de almandino Hematita como seudomorfo de marcasita Malaquita como seudomorfo de cuprita Goethita como seudomorfo de siderita Anglesita como seudomorfo de galena Mineraloides Definición Compuestos que no cumplen a cabalidad la definición de mineral. Sustancia que se asemeja a un mineral pero no demuestra: Cristalinidad minerales o materiales que carecen de una estructura cristalina a gran escala. Poseen composición química que está fuera de los rangos aceptados para minerales específicos. Incluyen: Pueden tener organización en el corto alcance (~10-100Å) pero carecen de ella a largo alcance. Materiales amorfos Vidrios Mezclas de minerales, materiales de baja cristalinidad, amorfos, etc. Ejemplos: limonita, bauxita, ópalo (SiO2.NH2O), arsenato de Fe, vidrio volcánico (obsidiana), escorias, clinker, etc. Estructura cristalina vs amorfa CRISTALINO AMORFO Principios sobre la formación de estructuras cristalinas Materiales cristalinos 90% de los elementos químicos y compuestos inorgánicos son sólidos a condiciones normales de T y P. Cuando aparece un sólido que es generado en una reacción química este proceso depende de la energía reticular del cristal. La estructura interna de todo material cristalino presenta un arreglo coordinado de átomos. Modelos altamente repetitivos y ordenados. Materiales amorfos y vítreos coordinación sólo con el átomo más próximo. Principios o Reglas de Pauling Regla 1. Poliedros de coordinación. Un poliedro de coordinación de aniones es formado alrededor de cada catión, siendo la distancia catión-anión determinada por la suma de los radios y el número de coordinación del catión por la razón de los radios Número de coordinación: Número de aniones que se acomodan alrededor de un catión o viceversa Regla 1. Poliedros de coordinación Número de Coordinación Otras coordinaciones Regla 2. Principio de valencia electrostática En una estructura de coordinación estable, la fuerza total de los enlaces de valencia que alcanza un anión a partir de todos los cationes vecinos es igual a la carga del anión o viceversa. Regla 3. Compartición de elementos poliédricos. I La existencia de bordes y particularmente de caras comunes a dos poliedros decrece la estabilidad de las estructuras iónicas. 4. CATIÓN (φ)de– elementos CARGA – Regla Regla 4. Compartición COMPARTICIÓN poliédricos. II En un cristal que contiene diferentes cationes, los que poseen gran valencia y pequeño número de coordinación, tienden a no compartir ciertos elementos poliédricos (bordes y caras) con otros Cationes altamente cargados distribuídos tan lejos como sea posible en una estructura cristalina Regla 5. Principio de parsimonia El número de clases de constituyentes esencialmente diferentes en una estructura cristalina es pequeño Usualmente no más de dos o tres poliedros de coordinación diferentes en una estructura cristalina El número de diferentes sitios cristalográficos es pequeño Pequeños números enteros para aniones y cationes en las fórmulas químicas Regla 5. Principio de Parsimonia Feldespato Piroxeno Espinelas Kaolinita NC en materiales con enlaces covalentes El NC en los sólidos covalentes depende del número de pares electrónicos compartidos NC = 8 - V, donde NC es el número de coordinación, V el número de electrones de valencia Si 1s2 2s2 2p6 3p2 y C 1s2 2s2 2p2 4 ecompartidos o de valencia SiC NC = 8 - 4 = 4 Cuatro enlaces NC en materiales con enlaces covalentes -SiC Modelos de visualización de las estructuras cristalinas Introducción Las estructuras cristalinas son sólo características del estado sólido y se destruyen o cambian cuando el material es disuelto, fundido o sublimado. Tres tipos de visualización de las estructuras: Estructuras de armazón poliedral mayoría de los minerales. Estructuras simétricamente empacadas Metales Estructuras moleculares poco importantes. ESTRUCTURAS EN ARMAZONES DE POLIEDROS Qué es y porqué poliedros? POLIEDRO: Forma geométrica limitada por caras. Usualmente mediante ellos se suelen representar la(s) forma(s) en las que se encuentran relacionados cationes y aniones (Regla I de Pauli), así como su disposición y relación en la estructura cristalina. Catión en el centro del poliedro y aniones representados por sus puntas. Armazones poliedrales tipos de armazón en las estructuras cristalinas Tres Armazones primarios Armazones secundarios Armazones terciarios Formas de representación gráfica de los poliedros Armazones poliedrales ARMAZONES PRIMARIOS ARMAZONES SECUNDARIOS Columna vertebral de la estructura cristalina. Aniones no compartidos cargas negativas enlaces con otros cationes (poliedros) ARMAZÓN TERCIARIO: Cationes con coordinación irregular ocupando espacios disponibles entre los armazones primarios y los secundarios Ejemplo Moscovita KAl2(OH,F)2Si3AlO10 ARMAZÓN PRIMARIO Si3AlO10 o (Si3AlO10)5- tetraedros de Si4+ y Al3+ exceso de carga negativa neutralizada por otros cationes. ARMAZÓN SECUNDARIO Al2(OH,F)2 AlO4(OH,F)2 Al3+ CN=6 dos de los aniones hidroxilos. La parte final de la fórmula corresponde al ARMAZÓN TERCIARIO K+ Estructura cristalina Estructura cristalina Estructura de filosilicatos Armazones poliedrales En todos los minerales de armazones de poliedros existen los armazones primarios, pero los secundarios o los terciarios pueden estar ausentes Estructuras simétricamente empacadas Introducción Todas las estructuras pueden ser construidas mediante apilamiento simétrico de capas simétricas de átomos o iones. La cercanía de los átomos es menos importante que la simetría de las capas. Categorías Dos categorías: Átomos neutros nativos minerales Metales, etc. Cationes/aniones resto de los minerales el Simetría de las capas aniones Hexagonal Tetragonal Capas simétricas Estructura tipo ABC = FCC = CCP http://departments.kings.edu/chemlab/animation/clospack.html Estructura tipo AB = HCP http://departments.kings.edu/chemlab/animation/clospack.html Estructura AB vs ABC http://commons.wikimedia.org/wiki/File:Empilement_compact.svg HCP vs FCC (CCP) http://www.uwgb.edu/DutchS/Petrology/close_packing.htm ABC http://www.gly.uga.edu/schroeder/geol3010/3010lecture13.html AB Intersticios entre capas cationes Espacio Tetraedral Espacio Octaedral Espacio Cúbico Espacios o intersticios donde se acomodan cationes u otros átomos http://departments.kings.edu/chemlab/animation/clospack.html Intersticios http://www.uwgb.edu/DutchS/Petrology/close_packing.htm Intersticios en estructura AB y ABC AB = HCP ABC = CCP http://fr.wikipedia.org/wiki/Fichier:Sites_interstitiels_cubique_a_faces_centrees.svg Nomenclatura Capas de simetría hexagonal Primera letra A Tipos: A, AB, ABC, AD, ADE, ADEF, AABB y AABBCC. Capas de simetría tetragonal Primera capa es S. Tipos: S, SD, SDEF, SE, SEDF y SSDD. Estructuras Moleculares Más que una forma de visualización es un tipo de estructura que se presenta en pocos minerales Muy común en otros sólidos como los polímeros Consiste en moléculas unidas entre sí por enlaces residuales débiles (van der Waals) Enlaces fácilmente destruibles bajo punto de fusión, etc. Moléculas de H2O Ejemplo Realgar Imperfecciones en los minerales Introducción ESTRUCTURAS IDEALES Nada es perfecto. No existe material cristalino que no tenga al menos un pequeño defecto Algunas propiedades son marcadamente dependientes de pequeñas desviaciones de las estructuras ideales Los minerales con estructura cristalina perfecta tendrán sus átomos en reposo sólo en el punto cero de oscilación a temperatura en el cero absoluto (0oK) estructura sin imperfecciones reevaluado Introducción Imperfecciones pueden ocurrir: En el átomo: En la estructura cristalina: Agujeros electrónicos. Sustitución, átomos instersticiales, sitios vacantes, dislocaciones, superficies de cristales, límites entre cristales, etc. Clasificación según dos tipos principales: Químicas Físicas Imperfecciones químicas Introducción. Ningún material puede ser preparado sin tener ningún grado de impurezas químicas. Iones en solución sólida en el material resultante alteran la regularidad estructural. Hasta los minerales preparados en laboratorio bajo estrictas normas de calidad tienen niveles mínimos de impurezas. Solución sólida Dos tipos: Solución sólida sustitucional Solución sólida intersticial Solución sólida sustitucional Sustitución de un ión por otro común en los minerales Varios factores determinan la extensión de la sustitución: Tamaño DEPENDE DE LO ABIERTA QUE SEA LA ESTRUCTURA Valencia SUSTITUCIÓN ACOPLADA Afinidad química Tipo de estructura cristalina Mecanismos de sustitución acoplada En diferentes sitios cristalinos En el mismo sitio cristalino En periclasa (MgO) puede ocurrir sustitución Mg+2 Li+, si ocurre simultáneamente otra sustitución Mg+2 Fe+3 Desbalanceada Ca+2 y Al+3 en anortita (CaAl2Si2O8) puede ser substituído por el par Na+ y Si+4 Sitios vagos o intersticiales cristales defectuosos. Zirconia (ZrO2) Zr+4 Mg+2 +•O2 Iones adsorbidos Zeolitas Si4+ Al+3 + M+ Montmorillonita Al+3 Fe+2 ± Mg+2 Solución sólida sustitucional Si se viola una o más de las reglas sólo es posible solución sólida parcial Solución sólida total Solución sólida parcial Espinelas, plagioclasas, olivinos, etc. Periclasa (MgO) Fe+2 Mg+2 Corindón (Al2O3) Cr+3 Al+3 rubí Micas sintéticas F- OHTODOS LOS MINERALES Los factores más importantes son tamaño y valencia Solución sólida intersticial Algunas veces más estable para los átomos más pequeños acomodarse en los intersticios Importante en aceros C disuelto en -Fe También H, B y N Poco estudiada pero muy común Depende de los mismos factores con excepción de la estructura Efectos de los defectos intersticiales Los átomos intersticiales modifican física y químicamente los materiales. Los átomos intersticiales de carbón tienen un papel crucial en las propiedades y procesamiento de los aceros, en particular de los aceros al carbón. Los espacios intersticiales pueden ser usados por ejemplo para el almacenamiento de hidrógeno en metales. http://en.wikipedia.org/wiki/Interstitial_defect#cite_note-3 La amorfización de semiconductores tales como el Si durante la irradiación con iones es usaulmente explicada mediante la acumulación de una alta concentración de átmos en los intersticios llevando al colapso de la estructura la cual se vuelve inestable. La acumulación de grandes cantidades de átomos interticiales en un sólido cae en una significante acumulación de energía, la cual una vez se libera puede generar accidentes severos en ciertos tipos de reactores nucleares (Wigner effect). Esta alta energía puede ser liberada por annealing. Al menos en las estrucuras FCC los átomos intersticiales tienen un gran efecto diaelastic de ablandamiento. Ha sido propuesto que los intersticios están relacionados al inicio de la fusión y la transición vítrea. Átomo de C intersticial en la estructura del -Fe Posibilidades de acuerdo a la estructura preexistente En estructuras fcc (MgO) sitios intersticiales disponibles sólo tetraedrales. En TiO2 sitios disponibles octaedrales. En estructuras tipo fluorita intersticios disponibles cúbicos. Zeolitas grandes posiciones intersticiales. Aumento en la facilidad para formar soluciones sólidas intersticiales: Zeolitas>ThO2>TiO2>MgO. Sólidos no estequiométricos Minerales que no presentan composición química fija una Wustita Fe1-XO Pirrotita Fe1-XS Maquinawita Fe1+XS Prácticamente todos los minerales son NO ESTEQUIOMÉTRICOS Imperfecciones físicas Los cristales casi nunca presentan arreglos atómicos perfectos Los defectos físicos existen en los materiales independientemente de impurezas químicas Las imperfecciones existen y son importantes debido a la influencia que ellas tienen sobre las propiedades de los materiales cristalinos Clases de imperfecciones físicas Las imperfecciones pueden ser divididas en tres grupos principales: Defectos puntuales imperfecciones cerodimensionales. Defectos lineales o dislocaciones imperfecciones unidimensionales. Defectos planares imperfecciones bidimensionales. Sólidos no cristalinos imperfección tridimensional. Defectos puntuales Debido a átomos en exceso o ausencia de átomos Los defectos puntuales son localizados aleatoriamente Efecto térmico Tipos: Intersticialidad o Frenkel Átomos en exceso Defecto Schottky vacío Defectos puntuales Defectos puntuales http://sites.google.com/site/polymorphismmyhomepage/investigating-material-failures Posibilidades Imperfecciones lineales o dislocaciones Dislocación de borde Dislocación de tornillo Dislocación mezclada Dislocación de borde Dislocación de borde Dislocación de tornillo Dislocación mezclada Defectos planares - Imperfección bidimensional Superficies de frontera de los materiales Interrupción del arreglo de apilamiento atómico del cristal. Pueden ser organizadas con crecimiento dictado por las leyes de la cristalografía maclas Orientadas crecimiento bajo presión direccionada rocas metamórficas Aleatorias intercrecimiento entre granos o granos independientes LA MÁS COMÚN MACLAS O CRISTALES GEMELOS Intercrecimiento de dos o más cristales idénticos, de tal forma que los individuos, sobre uno y otro lado de una cara común, sean simétricamente relacionados, por operaciones no presentes con la misma orientación, en la clase cristalina de los individuos MACLAS O CRISTALES GEMELOS Los elementos en cristales geminados deben tener: Reflexión a un plano común Orientaciones cristalográficas diferentes uno con respecto al otro Caras cristalográficamente equivalentes PRODUCTO PLANO DE COMPOSICIÓN Eje de rotación EJE DE MACLA Centrosimétricos tienen eje y plano Principales tipos de maclas MACLAS SIMPLES Dos cristales MACLAS DE CONTACTO: Unión de las parte mediante un plano regular de composición MACLAS DE PENETRACIÓN: Se penetran entre sí Unidas según una superficie de composición irregular MACLAS MÚLTIPLES Tres o más cristales MACLA POLISINTÉTICA Planos de composición paralelos MACLA CÍCLICA Planos de composición NO paralelos Maclas de Contacto Principales tipos de maclas MACLAS SIMPLES Dos cristales MACLAS DE CONTACTO: Unión de las parte mediante un plano regular de composición MACLAS DE PENETRACIÓN: Se penetran entre sí Unidas según una superficie de composición irregular MACLAS MÚLTIPLES Tres o más cristales MACLA POLISINTÉTICA Planos de composición paralelos MACLA CÍCLICA Planos de composición NO paralelos Maclas de Penetración Principales tipos de maclas MACLAS SIMPLES Dos cristales MACLAS DE CONTACTO: Unión de las parte mediante un plano regular de composición MACLAS DE PENETRACIÓN: Se penetran entre sí Unidas según una superficie de composición irregular MACLAS MÚLTIPLES Tres o más cristales MACLA POLISINTÉTICA Planos de composición paralelos MACLA CÍCLICA Planos de composición NO paralelos MACLAS COMPUESTAS Pirita - Macla Cómo se pueden formar? Tres formas: Crecimiento Transformación Deformación por deslizamiento SUPERFICIES Límite de grano http://sites.google.com/site/danamaterials/imperfections Sólidos no Cristalinos (defecto tridimensional) Estructura cristalina vs vítrea Resumen y otras variaciones a) Impureza instersticial b) Dislocación de borde c) Átomo intersticial d) Vacancia e) Exsolución f) Vacancia tipo dislocación g) Intersticial tipo dislocación h) Defecto Sustitucional Premisa fundamental Cada mineral realmente corresponde a un número no definido de posibilidades estructurales y químicas que se genera dentro de un rango establecido, con base en las condiciones a las cuales se forma No hay dos minerales iguales, especialmente si ellos se generaron en condiciones distintas