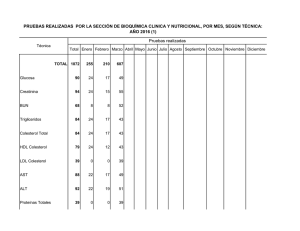
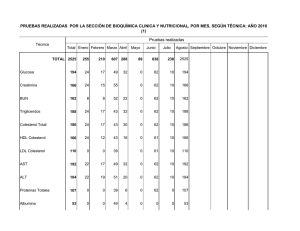
manual de practicas de laboratorio de bioquimica booksmedicos.org
Anuncio

SERGI SÁNCHEZ ENRÍQUEZ SERGIO LUIS JAVIER FLORES ALVARADO CARMEN MAGDALENA GURROLA DÍAZ PATRICIA HEREDIA CHÁVEZ PATRICI Manual de prácticas de laboratorio de TERCERA EDICIÓN TERCERA EDICIÓN Sergio Sánchez Enríquez, MD, PhD Médico Cirujano y Partero Especialidad en Ortopedia y Traumatología Maestría en Farmacología Doctorado en Biología Molecular en Medicina Miembro del Sistema Nacional de Investigadores (SNI-I) Perfil PROMEP Presidente de la Asociación Mexicana de Egresados de Ciencias de la Salud (AMECIS, A. C.) Laboratorio de Bioquímica, Departamento de Biología Molecular y Genómica Profesor Docente Titular, CUCS, Universidad de Guadalajara ERRNVPHGLFRVRUJ MÉXICO • BOGOTÁ • BUENOS AIRES • CARACAS • GUATEMALA MADRID • NUEVA YORK • SAN JUAN • SANTIAGO • SAO PAULO AUCKLAND • LONDRES • MILÁN • MONTREAL • NUEVA DELHI SAN FRANCISCO • SIDNEY • SINGAPUR • ST. LOUIS • TORONTO Director editorial: Javier de León Fraga Editor de desarrollo: Héctor F. Guerrero Aguilar Supervisora de producción: Ángela Salas Cañada NOTA La medicina es una ciencia en constante desarrollo. Conforme surjan nuevos conocimientos, se requerirán cambios de la terapéutica. El(los) autor(es) y los editores se han esforzado para que los cuadros de dosificación medicamentosa sean precisos y acordes con lo establecido en la fecha de publicación. Sin embargo, ante los posibles errores humanos y cambios en la medicina, ni los editores ni cualquier otra persona que haya participado en la preparación de la obra garantizan que la información contenida en ella sea precisa o completa, tampoco son responsables de errores u omisiones, ni de los resultados que con dicha información se obtengan. Convendría recurrir a otras fuentes de datos, por ejemplo, y de manera particular, habrá que consultar la hoja informativa que se adjunta con cada medicamento, para tener certeza de que la información de esta obra es precisa y no se han introducido cambios en la dosis recomendada o en las contraindicaciones para su administración. Esto es de particular importancia con respecto a fármacos nuevos o de uso no frecuente. También deberá consultarse a los laboratorios para recabar información sobre los valores normales. TERCERA EDICIÓN Prohibida la reproducción total o parcial de esta obra, por cualquier medio, sin autorización escrita del editor. DERECHOS RESERVADOS © 2014, respecto a la tercera edición, por McGRAW-HILL INTERAMERICANA EDITORES, S. A. de C. V. Prolongación Paseo de la Reforma 1015, Torre A, Piso 17, Col. Desarrollo Santa Fe, Delegación Álvaro Obregón C. P. 01376, México, D. F. Miembro de la Cámara Nacional de la Industria Editorial Mexicana, Reg. No. 736 ISBN: 978-1-4562-2012-9 ACH 04/14 1234567890 2356789014 Impreso en México Printed in Mexico Colaboradores PEDRO GARZÓN DE LA MORA LUIS HUACUJA RUIZ Médico Cirujano y Partero, Universidad de Guadalajara (U de G) Doctorado en Ciencias Biomédicas, U de G Profesor Investigador Titular, CUCS, U de G Licenciatura en Biología, Maestría en Biología Molecular, UNAM Doctor en Ciencias, U de G Profesor Investigador Titular A, Instituto de Enfermedades Crónico-Degenerativas. CUCS, U de G MERCEDES GONZÁLEZ HITA Químico Farmacobiólogo, Universidad Nacional Autónoma de México (UNAM) Maestría en Nutrición y Metabolismo, Massachusetts Institute of Technology Doctorado en Bioquímica, Massachusetts Institute of Technology Profesora perfil PROMEP Cuerpo Académico de Estudio Multidisciplinario de Enfermedades Crónico Degenerativas, UDG-CA-533 Profesora Investigadora Titular C de Bioquímica, CUCS, U de G Perfil PROMEP MARÍA DE LOURDES ISAAC VIRGEN Doctora en Ciencias. Maestría en Nutrición Química Farmacobióloga, Médica en Veterinaria y Zootecnista, U de G Profesora Investigadora Titular C, Departamento de Biología Molecular y Genómica, División de Ciencias Básicas. CUCS, U de G Perfil PROMEP Miembro del Sistema Nacional de Investigadores (SNI-1) IRMA NOEMÍ LÚA RAMÍREZ Química Farmacobióloga, Universidad de Guadalajara (U de G) Académica del Departamento de Biología Molecular y Genómica, Laboratorio de Bioquímica. CUCS, U de G Maestría en Metodología de la Enseñanza, U de G CARMEN MAGDALENA GURROLA DÍAZ Química Farmacobióloga, Maestría en Ciencias Biomédicas, Especialidad en Genética Humana, Universidad de Guadalajara (U de G) Doctora en Ciencias, Universidad Ruprecht-Karls de Heidelberg, Alemania Profesora Investigadora Titular B, Instituto de Enfermedades Crónico-Degenerativas, CUCS, U de G BEATRIZ TERESITA MARTÍN MÁRQUEZ Química Farmacobióloga, Universidad de Guadalajara (U de G) Profesora Investigadora Asociada B. CUCS, U de G Maestría en Ciencias Biomédicas con Orientación en Inmunología, U de G PATRICIA HEREDIA CHÁVEZ Química Farmacobióloga, Universidad de Guadalajara (U de G) Especialidad de Docencia en el Área de Bioquímica, Universidad Autónoma de Aguascalientes Especialidad en Docencia Universitaria, Universidad del Valle de Atemajac Maestría en Investigación en Ciencias de la Educación, U de G Académica del Departamento de Biología Molecular y Genómica, Laboratorio de Bioquímica. CUCS, U de G MARTHA LETICIA ORNELAS ARANA Médica Cirujana y Partera, Universidad de Guadalajara (U de G) Doctorado en Genética Humana Miembro del Cuerpo Académico de Enfermedades Metabólicas CA-27, U de G Profesor Docente Asociado B Perfil PROMEP v vi Colaboradores GUILLERMO PÉREZ GARCÍA Médico Cirujano y Partero, Universidad de Guadalajara (U de G) Doctorado en Genética Humana Jefe del Laboratorio de Bioquímica. CUCS, U de G Miembro del Cuerpo Académico de Enfermedades Metabólicas CA-27, U de G Profesor docente titular C Perfil PROMEP IRMA RAMOS RODRÍGUEZ Química Farmacobióloga, Universidad de Guadalajara (U de G) Licenciada en Nutrición, U de G Doctora en Ciencias de la Salud en el Trabajo, U de G Académica del Departamento de Biología Molecular y Genómica. Laboratorio de Bioquímica, CUCS, U de G MERCEDES ROMERO GÓMEZ Química Farmacobióloga, Universidad de Guadalajara (U de G) Académica del Departamento de Biología Molecular y Genómica. Laboratorio de Bioquímica. CUCS, U de G Miembro del Cuerpo Académico de Enfermedades Metabólicas CA-27, U de G MARÍA ROSALBA RUIZ MEJÍA Cirujana Dentista, Universidad de Guadalajara (U de G) Maestría en Salud Pública, U de G Profesora perfil PROMEP Coordinadora de Docencia del Departamento de Biología Molecular y Genómica Profesora Docente Titular. CUCS, U de G SONIA URIBE LUNA Profesora Investigadora. Departamento de Clínicas Quirúrgicas, Instituto de Oftalmología y Ciencias Visuales. CUCS, U de G Doctora en Ciencias con especialidad en Microbiología, Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional (IPN) Perfil PROMEP Acerca de los autores El doctor Sergio Sánchez Enríquez es médico cirujano y partero. Cuenta con una especialidad en ortopedia y traumatología, una maestría en farmacología y un doctorado en biología molecular en medicina, todos ellos por la Universidad de Guadalajara (U de G). Entre los cursos que ha impartido se cuentan los de fisiología humana, farmacología humana, terapéutica farmacológica, bioquímica y bioquímica clínica. Actualmente es Profesor Investigador Titular “C”, en el Centro Universitario de Ciencias de la Salud (CUCS), U de G. Tiene Perfil PROMEP y es miembro del Sistema Nacional de Investigadores (SNI-I). Responsable del Cuerpo Académico consolidado UDGCA-533 de Estudio multidisciplinario de las Enfermedades Crónico-Degenerativas. El doctor Luis Javier Flores Alvarado es médico, cirujano y partero, por la Facultad de Medicina de la U de G. Tiene una maestría en Ciencias, con especialidad en biología celular, por el Centro de Investigaciones y Estudios Avanzados. Es Profesor Investigador Titular “C”, en el CUCS, U de G. Posee perfil PROMEP y es miembro del Sistema Nacional de Investigadores (SNI-I). Ha tomado cursos de farmacología molecular, errores innatos del metabolismo y métodos diagnósticos de las enfermedades por atesoramiento de glucógeno. Entre los cursos que ha impartido se cuentan los de bioquímica avanzada y fisiopatología molecular para estudiantes del doctorado en Farmacología. Es profesor del curso de Estructura y función celular. La doctora Carmen Magdalena Gurrola Díaz es Química Farmacobióloga y tiene maestría en Ciencias Biomédicas, con especialidad en Genética Humana, por la U de G. Tiene doctorado en Ciencias, por la Universidad Ruprecht-Karls de Heidelberg, Alemania. Actualmente es Profesora Investigadora Titular “C”, en el CUCS, U de G. Tiene perfil PROMEP y es miembro del Sistema Nacional de Investigadores (SNI-I), así como del Instituto de Enfermedades Crónico-Degenerativas. La doctora Patricia Heredia Chávez es Química Farmacobióloga por la U de G. Tiene especialidad de Docencia en el área de Bioquímica, por la Universidad Autónoma de Aguascalientes, y especialidad en Docencia Universitaria por la Universidad del Valle de Atemajac. Tiene también Maestría en Investigación en Ciencias de la Educación, por la U de G. vii Contenido Colaboradores . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . v Práctica 5. Regulación no específica de la actividad enzimática . . . . . . . . . . . . . . . . . . . . . . 35 Acerca de los autores . . . . . . . . . . . . . . . . . . . . . . . . . . vii Prólogo. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . x Presentación del manual. . . . . . . . . . . . . . . . . . . . . . . . 1 Guía del estudiante. . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 Diagrama de flujo para la elaboración del caso integrador . . . . . . . . . . . . . . . . . . . . . . . . . 3 Normas de seguridad en el laboratorio. . . . . . . . . . . . . 4 Acciones que se deben tomar en caso de accidente . . . . . . . . . . . . . . . . . . . . . . . . . . . . Recomendaciones para tener éxito en las prácticas . . . . . . . . . . . . . . . . . . . . . . . . . . 5 Práctica 1. Normas de bioseguridad y manejo de muestras biológicas, material, equipo y procedimientos. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 • Irma Noemí Lúa Ramírez • Carmen Magdalena Gurrola Díaz • Patricia Heredia Chávez • Sergio Sánchez Enríquez Práctica 6. Metabolismo de carbohidratos. . . . . . . . . . 47 • Sergio Sánchez Enríquez • Mercedes Elvira González Hita • Luis Javier Flores Alvarado Práctica 7. Metabolismo de lípidos . . . . . . . . . . . . . . . 57 • Patricia Heredia Chávez • Irma Ramos Rodríguez • Mercedes Elvira González Hita • Sergio Sánchez Enríquez 4 Práctica 8. Metabolismo de compuestos nitrogenados . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 67 • Irma Noemí Lúa Ramírez • María Rosalba Ruiz Mejía • Beatriz Teresita Martín Márquez • Luis Javier Flores Alvarado • Sergio Sánchez Enríquez • Mercedes Romero Gómez • María de Lourdes Isaac • Virgen Luis Huacuja Ruiz • Irma Ramos Rodríguez • Martha Leticia Ornelas Arana • Guillermo Pérez García Práctica 9. Extracción de DNA de células vegetales . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 73 • Sonia Uribe Luna • Irma Noemí Lúa Ramírez • María Rosalba Ruiz Mejía • Mercedes Romero Gómez • Sergio Sánchez Enríquez Práctica 2. Agua y soluciones. . . . . . . . . . . . . . . . . . . . 15 • Mercedes Romero Gómez • María de Lourdes Isaac Virgen • Luis Huacuja Ruiz • Irma Ramos Rodríguez • Sergio Sánchez Enríquez Apéndices 1. Definición de prefijos, unidades y constantes físicas . . . . . . . . . . . . . . . . . . . . . . . . . 77 Práctica 3. pH y amortiguadores . . . . . . . . . . . . . . . . . 21 • Sonia Uribe Luna • Sonia Uribe Luna • Patricia Heredia Chávez • Sergio Sánchez Enríquez • Pedro Garzón de la Mora 2. Constantes biológicas . . . . . . . . . . . . . . . . . . . . . . . 79 • Mercedes Romero Gómez 3. Determinación del gasto energético diario (GED). . . 81 • Sergio Sánchez Enríquez • Patricia Heredia Chávez Práctica 4. Aminoácidos y proteínas . . . . . . . . . . . . . . 29 • Carmen Magdalena Gurrola Díaz • María de Lourdes Isaac Virgen • Sergio Sánchez Enríquez 4. Historia clínica . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87 • Sergio Sánchez Enríquez ix Prólogo La Universidad de Guadalajara, y en particular el Centro Universitario de Ciencias de la Salud, han hecho un enorme esfuerzo para que los alumnos involucrados en el proceso de enseñanza-aprendizaje relacionado con las ciencias básicas impartidas, tengan en sus manos las herramientas necesarias para entender y comprender una de las materias más importantes en su formación: la Bioquímica. Este Manual de prácticas de Laboratorio de bioquímica conducirá a nuestros alumnos al interior de la mayor parte de conceptos de bioquímica en sus aspectos fundamentales. Así, es evidente que este manual complementará los conocimientos que serán impartidos en el aula de manera teórica, fundamentados en la experiencia de maestros de bioquímica que han impartido dicha asignatura por muchos años. La metodología utilizada y fundamentada en este Manual de prácticas permite de manera sencilla, pero al mismo tiempo científica y validable, que el alumno navegue por experimentos y reacciones que sin duda alguna lo llevarán a preguntarse de qué manera podrá aplicar estos conocimientos, obtenidos en un salón de laboratorio, más tarde en su carrera profesional. De tal manera, estudiantes de las carreras de medicina, odontología, nutrición, enfermería, cultura física y del deporte, y técnicos superiores en radiología e imagen, encontrarán en este Manual de prácticas un recurso didáctico y aplicativo importante para el desarrollo de un ejercicio intelectual que encontrará su nicho de aplicabilidad no sólo durante su estancia en nuestro Centro Universitario de Ciencias de la Salud, sino tal vez más allá de su entorno. Los autores de este manual de prácticas, pertenecientes a la Academia de Bioquímica, han hecho un esfuerzo honesto y auténtico para que nuestros alumnos de Bioquímica “aprendan a no temerle” más al proceso de aprendizaje de la Bioquímica. Que aprendan a entender que los procesos metabólicos, y que las reacciones interiorizadas en cada célula de nuestro cuerpo, son más luminosas y fáciles de entender de lo que aparentan. Dr. en C. Juan Armendáriz Borunda x Presentación del manual El presente Manual de prácticas de bioquímica se ha diseñado para realizar actividades en el laboratorio y extra-aula con el fin de que cada uno de los estudiantes de Ciencias de la Salud fortalezca o adquiera nuevas habilidades y conocimientos de Bioquímica con experiencias propias o cercanas a ellos. En el Manual de prácticas se contemplan tres aspectos a desarrollar: res o diabetes. A lo largo del curso práctico se evalúan parámetros antropométricos y bioquímicos que presentan una correlación integral. El análisis y la interpretación de estos datos en su conjunto representan el Caso integrador del Programa por Competencias de Bioquímica. Por ello, los esfuerzos de profesores y estudiantes deben encaminarse a la recolección, el análisis de los datos y la interpretación de los resultados, para concluir con el Seminario de Integración Metabólica. Teniendo como meta la elaboración del Caso integrador que refleje el aprendizaje obtenido, se invita a los estudiantes a participar y cooperar en el desarrollo de cada una de las prácticas. En la Guía del estudiante de este manual se encuentran la programación y las condiciones en que el alumno debe asistir a su toma de muestra. Esta experiencia permite al participante y a sus compañeros contar con el material biológico apropiado para la realización de las prácticas. El estudiante tiene la vivencia de ser un paciente, lo que le permite identificar y valorar los obstáculos que podrían afectar el éxito de un diagnóstico. Esta actividad también permite sensibilizar al estudiante para que desarrolle habilidades, al solicitar que un paciente se incorpore a un régimen nutricional y modifique su actividad física, sus actitudes o sus hábitos nocivos. Al concluir la asignatura de Bioquímica, el estudiante tendrá las bases para continuar con su programa formativo y habrá adquirido nuevas actitudes y valores requeridos en un profesional de Ciencias de la Salud. Los profesores, los técnicos, los instructores y el personal administrativo de la Academia de Bioquímica dan la bienvenida a los estudiantes y les ofrecen su mejor disposición para que tengan una productiva estancia en el laboratorio de Bioquímica. • Empleo de equipo e introducción a los conceptos básicos del laboratorio de Bioquímica. • Ejecución de experimentos que manifiestan las propiedades estructurales y químicas del agua y diferentes biomoléculas. • Fundamentos del análisis bioquímico, su aplicación en la clínica e integración metabólica. Las prácticas se desarrollan en concordancia con el programa de estudios por competencias, teniendo como eje conceptual la relación del hombre con su medio nutricio. Por ello, en la programación de las prácticas se ha considerado que cada una debe representar la actividad integradora de cada unidad. Con el fin de reforzar los conocimientos adquiridos, en cada práctica se incluyen actividades de aprendizaje, en las que el estudiante debe realizar una investigación bibliográfica que sustente la respuesta dada a la actividad correspondiente. Con el fin de evitar un aprendizaje fragmentado de la bioquímica y facilitar la integración del metabolismo de los nutrientes, las muestras biológicas deben obtenerse de los alumnos, bajo condiciones específicas. Para ello, se requiere la participación de estudiantes que presenten sobrepeso, presión arterial elevada, antecedentes familiares relacionados con enfermedades cardiovascula- 1 Guía del estudiante 3. En la Práctica núm. 6 se tomará sangre en ayuno de A continuación se describe el proceso para desarrollar el ejercicio de la integración metabólica. Asimismo, para una mejor comprensión, se acompaña de un diagrama de flujo. 12 horas, así como a los 30 y 90 min después de un desayuno habitual, a los tres estudiantes con predisposición de desarrollar diabetes mellitus. La sangre se centrifugará para la obtención de plasmasuero. La determinación de la glucosa deberá realizarse dentro de los 90 min de haberse tomado la muestra, por lo que se recomienda que se extraiga la muestra de sangre y tome su desayuno antes de iniciar con la explicación de la práctica. En caso de que no se hubiese logrado determinar la glucosa posprandial en la sesión de la Práctica núm. 6, determinarla en la Práctica núm. 7. Si la glucemia posprandial está por arriba de 160 mgdl, se recomendará al estudiante repetir su análisis en un laboratorio particular y solicitar una consulta médica. A partir de esta fecha, los estudiantes en estudio iniciarán una dieta, indicada por un nutriólogo de la Unidad de Síndrome Metabólico del Laboratorio de Bioquímica (Departamento de Bioquímica y Genómica del CUCS), y 30 min de actividad física diaria (caminata). En otra ciudad: 1. El estudiante realizará como actividades prelimina- res lo siguiente: a) El llenado de las actividades extra-aula, que se encuentra en la Práctica núm. 6 (Metabolismo de carbohidratos) y deberá completarse dos semanas antes de su realización. El registro tendrá la siguiente información: • • • • • • • • Edad Peso Estatura Índice de masa corporal (IMC) Diámetro de cintura Porcentaje de grasa por bioimpedancia Presión arterial Factores de riesgo para diabetes mellitus tipo 2 Con excepción de la presión arterial y el porcentaje de grasa, los cuales se determinarán durante la Práctica núm. 6, todos los demás datos serán obtenidos por el estudiante. Nota: la forma apropiada para obtener cada uno de los datos se indica en la Práctica núm. 6. 4. En la Práctica núm. 7 se tomarán muestras de sangre (ayuno de 12 horas) a los estudiantes sometidos a dieta y actividad física para la obtención de plasma suero. Se determinarán colesterol, triacilgliceroles y c-HDL de las muestras. Se integrarán los resultados de esta práctica con los de la glucemia determinada en la Práctica núm. 6, para determinar si el estudiante presenta síndrome metabólico o está en riesgo de padecerlo. b) El estudiante también llenará la información so- bre sus antecedentes familiares de padecer diabetes mellitus. Los datos provendrán de al menos tres familiares directos entre 18 y 55 años de edad, en el siguiente orden de prioridad: padre, madre, hermanos, abuelos y tíos. La información será recabada para completar el registro localizado en la Actividad extra-aula de la Práctica núm. 6. 5. En la Práctica núm. 8 se determinarán los compues- tos nitrogenados de las muestras. Se compararán los resultados para conocer si existe una relación entre los valores encontrados en las prácticas previas. 2. El profesor revisará la información solicitada en el punto anterior dos semanas antes de realizar la Práctica núm. 6 y seleccionará a tres estudiantes, entre 18 y 35 años, que presenten factores de riesgo de diabetes mellitus. 6. Se recopilarán todos los datos para llevar a cabo un análisis de los mismos y presentarlos en el Seminario de Integración Metabólica. 2 Diagrama de flujo para la elaboración del caso integrador Actividad extra-aula 1 a. Llenar la información clínica y antropométrica del estudiante, siguiendo las instrucciones de la Práctica núm. 6. b. Incluir la información de los antecedentes familiares. Actividad preliminar para la Práctica núm. 6 2 a. Determinar el porcentaje de grasa empleando la báscula de bioimpedancia. b. Determinar el IMC. c. Determinar el riesgo de desarrollar diabetes mellitus tipo 2. d. Determinar la predisposición al desarrollo del síndrome metabólico. e. El profesor seleccionará con dos semanas de anticipación a tres estudiantes con predisposición a desarrollar síndrome metabólico y les dará indicaciones para la toma de muestras. Actividad de la Práctica núm. 6 3 a. Obtener suero o plasma en ayuno de 12 horas. b. Inmediatamente después de la toma de muestra el estudiante ingerirá su desayuno habitual. c. Determinar glucosa basal y posprandial a los 30 y 90 min. Si los valores a los 90 min se encuentran por arriba de 160 mgdl, realizar recomendaciones al estudiante. d. Iniciar una dieta adecuada recomendada por un nutriólogo y 30 min de caminata diaria. Mantener dieta y ejercicio por 15 días. Actividad de la Práctica núm. 7 4 a. Obtener muestra de sangre en ayuno de 12 horas de los estudiantes que se encuentren bajo una dieta balanceada y ejercicio. b. Determinar glucosa, lípidos y triacilgliceroles. Actividad de la Práctica núm. 8 5 a. Determinar la concentración de los compuestos nitrogenados de las muestras basales, posprandiales y después de dieta y ejercicio. b. Recabar la información de todos los datos obtenidos. Seminario de Integración Metabólica Presentación del CASO INTEGRADOR. 6 Normas de seguridad en el laboratorio El funcionamiento correcto del laboratorio está sujeto al cumplimiento de las siguientes normas: 11. Evitar agregar agua sobre ácidos para prevenir que- maduras por proyección. Para diluir cualquier ácido, se vierte el ácido sobre el agua y nunca agua sobre ácido. Emplear baño de hielo o baño de agua fría para preparar soluciones diluidas de ácidos. 1. El alumno ingresará al laboratorio con bata, la cual debe ser blanca y de manga larga. Es indispensable portar la bata abotonada y guardar el comportamiento apropiado durante la estancia en el laboratorio. 12. Mantener los frascos de reactivos tapados para evitar 2. El alumno se familiarizará con los sitios en donde se 13. Depositar en los recipientes apropiados las puntillas derrames. encuentran localizadas las regaderas, extinguidores, botes de basura, caja para material punzocortante, bolsa roja para desecho de material biológico, etc. El material punzocortante y desechos biológicos deberán depositarse en los contenedores correspondientes. y lavar las pipetas inmediatamente. 14. Utilizar guantes desechables cuando se manejen muestras biológicas. Considerar que cualquier material biológico es potencialmente infeccioso aun cuando proceda de personas aparentemente sanas. 3. En ningún momento se permitirá la aplicación de 15. Lavarse las manos con agua y jabón antes de salir del cosméticos, fumar yo ingerir alimentos dentro del laboratorio. laboratorio. 16. Reportar inmediatamente al profesor del laboratorio 4. Tomar la postura más cómoda para trabajar correc- cualquier accidente o lesión que suceda para que se tomen las medidas apropiadas. tamente con el fin de tener el control y precisión de los movimientos durante el uso de materiales, equipos y reactivos. Acciones a tomar en caso de accidente 5. Limpiar las mesas de trabajo antes y después de cada práctica, así también durante la práctica si se ha derramado algún reactivo o muestra biológica. 1. En caso de que exista contacto de ácidos o bases con 6. Para evitar quemaduras, se deberán apagar mecheros la piel, ojos o boca. Se recomienda enjuagar el área con abundante agua con el propósito de disminuir su acción por dilución; para ello en el laboratorio existen las tarjas, regaderas especiales y lavaojos. yo planchas calientes cuando éstos no se utilicen. Así también, se deberán emplear gradillas o pinzas para sostener o transportar tubos calientes. 7. Mantener las sustancias químicas inflamables aleja- 2. En caso necesario llamar inmediatamente a los telé- das de fuego, planchas calientes, o ambos. fonos de urgencias en Guadalajara: 066; Cruz Roja (3613-1550, 3614-2707 y 3614-5600); Cruz Verde (3614-5252, 3613-1572, 3812-5143 y 3643-7190). 8. No se deberá olfatear yo probar reactivos o solu- ciones. No se debe mirar nunca el interior de un tubo de ensayo que se esté calentando, ni apuntar hacia alguna persona porque el contenido podría proyectarse en cualquier momento. La misma precaución debe tomarse cuando se mezclen reactivos o se agiten vigorosamente los tubos. En otra ciudad: 9. Utilizar guantes de látex y gafas de seguridad cuando se manejen ácidos, hielo seco o sustancias desconocidas. 3. En caso de ingestión de corrosivos NUNCA provo- car vómito. Si existe ingestión de ácidos hacer beber inmediatamente una solución de bicarbonato de sodio (2 cucharadas soperas en 2 vasos de agua); en 10. Utilizar pipetores o perilla de goma para la medición de los líquidos corrosivos, ácidos, bases, sustancias volátiles, venenos, entre otros. No aspirar con la boca. 4 caso de ingestión de soluciones cáusticas (hidróxido de sodio o de potasio) ingerir una cucharada de vinagre o 25 ml de jugo de limón en agua. 4. Al ingerir otras sustancias químicas hacer vomitar a la persona accidentada. Vigilar que exista una ventilación adecuada y mantener las vías aéreas permeables mientras se traslada al hospital. 5. Si hay derramamiento de un ácido, neutralizar agre- gando bicarbonato de sodio y en caso de bases agregar ácido acético (vinagre). NUNCA tratar de adicionar agua. Emplear bata, guantes y gafas durante la limpieza. 2. Los útiles y objetos personales deberán ser colocados en la parte inferior de las mesas de trabajo. 3. El material con el que se trabajará deberá estar per- fectamente limpio antes y después de la práctica. 4. Antes de preparar las mezclas de reacción etiquetará apropiadamente cada uno de los tubos con marcador indeleble. 5. Por ningún motivo alterar el orden de adición de reactivos en la práctica. 6. Utilizar agua destilada en todos los experimentos en los que se solicite agregar agua. 7. Mantener los frascos de reactivos tapados para evitar Recomendaciones para tener éxito en las prácticas 1. El alumno leerá la práctica completa y la discutirá con el profesor antes de la realización de la misma. contaminación yo vaporización de los mismos. 8. Utilizar sólo la cantidad requerida de reactivos para evitar el desperdicio de los mismos. 9. Procurar no regresar excedentes de reactivo al frasco de donde se extrajo el mismo. Práctica Normas de bioseguridad y manejo de muestras biológicas, material, equipo y procedimientos • Mercedes Romero Gómez • María de Lourdes Isaac Virgen • Luis Huacuja Ruiz Normas de bioseguridad general a) Mantener el lugar de trabajo en condiciones higiéni- cas y aseadas. b) Evitar maquillarse, fumar, comer o beber en el sitio de trabajo. c) No guardar alimentos en los equipos donde se refri- geran sustancias contaminantes o químicas. • Irma Ramos Rodríguez • Martha Leticia Ornelas Arana • Guillermo Pérez García n) Evitar el cambio de los elementos punzocortantes de un recipiente a otro. o) Evitar el reciclaje de material contaminado, como agujas, jeringas u hojas de bisturí. p) Desinfectar y limpiar las superficies y los equipos de trabajo, en caso de contaminación. q) En caso de que se rompa material de vidrio contami- d) Manejar a todo paciente como si pudiera estar in- fectado. e) Lavarse con cuidado las manos antes y después de f) g) h) i) j) k) l) m) cada procedimiento. Utilizar de forma sistemática guantes plásticos o de látex en procedimientos en que se manipulan sustancias biológicas, se maneja instrumental o equipo contaminado en la atención de los pacientes, o en ambas situaciones. Abstenerse de tocar con las manos enguantadas alguna parte del cuerpo y de manipular objetos diferentes a los requeridos durante el procedimiento. Emplear mascarilla y protectores oculares durante procedimientos que puedan generar salpicaduras, gotitas aerosoles de sangre u otros líquidos corporales. Usar bata durante la estancia en el laboratorio. Mantener los elementos de protección personal en condiciones óptimas de aseo, en un lugar seguro y de fácil acceso. Si se tienen lesiones exudativas o dermatitis serosas, evitar la atención directa de pacientes hasta que éstas hayan desaparecido. Utilizar las técnicas correctas en la realización de todo procedimiento. Manejar con estricta precaución los elementos punzocortantes y desecharlos en los recipientes indicados, a prueba de perforaciones. 1 r) s) t) u) v) w) nado con sangre u otro líquido corporal, recoger los trozos con escoba y recogedor (nunca con las manos) y depositarlos en el contenedor para punzocortantes. Los recipientes para transporte de muestras deben ser de material irrompible y contar con cierre hermético (tapón de rosca). Manipular, transportar y enviar las muestras en recipientes seguros, con tapa y rotulación adecuada. A su vez, transportar las gradillas en recipientes herméticos, de plástico o acrílico, que retengan fugas o derrames accidentales. Además, deben ofrecer facilidad de lavado. Restringir el ingreso a las áreas de alto riesgo biológico a personal no autorizado, a quien no utilice los elementos de protección personal y a los niños. Disponer el material patógeno en bolsas resistentes, de color rojo, que se identifiquen con el símbolo de riesgo biológico. Las personas sometidas a tratamiento con inmunodepresores no deben trabajar en áreas de riesgo biológico. Medidas generales de protección a) Lavarse las manos con frecuencia y al quitarse los guantes. b) Usar guantes cuando se manejen líquidos biológicos. c) Establecer y respetar áreas sucias y áreas limpias. 8 Manual de prácticas de laboratorio de bioquímica d) No tocar las áreas sin contaminación con guantes e) f) g) h) i) j) contaminados. Utilizar el pipetor para aspirar sustancias corrosivas a través de la pipeta. Ingresar sin maquillaje al laboratorio. Es riesgoso consumir alimentos o masticar chicle en las áreas de trabajo. No fumar en las áreas de trabajo. No tapar de nuevo las agujas. Depositar los objetos punzocortantes en los contenedores adecuados. Lavado de manos El lavado de manos es el método más eficaz para prevenir y evitar infecciones. Debe realizarse: a) Cuando exista contaminación de sangre o líquidos corporales. b) Después de completar la práctica y antes de abando- nar el área de trabajo. c) Cuando se hayan quitado los guantes. d) Antes de comer, beber, aplicarse maquillaje, cambiar- se lentes de contacto. e) Antes y después de ir al baño. Método del lavado de manos a) Abrir la llave del agua. b) Usar una cantidad generosa de jabón no abrasivo. c) Tallar bien todas las superficies de las manos, cuando d) e) f) g) h) i) j) menos durante 10 segundos. Limpiar bien abajo y alrededor de las uñas. Enjuagar con las manos hacia abajo. Evitar las salpicaduras. Secarse bien con toallas de papel. Cerrar la llave utilizando una toalla de papel. Tirar la toalla en un cesto con bolsa negra. Utilizar una crema para evitar resequedad o irritación. Medidas de seguridad para el manejo de muestras biológicas Introducción Las medidas de seguridad son muy importantes para la persona que toma muestras biológicas, porque su manejo conlleva el riesgo de transmisión de una gran cantidad de infecciones, como hepatitis y VIH, por mencionar algunas. Por este motivo, se debe considerar que todo paciente al que se le tome una muestra biológica puede estar infectado. Las normas deben aplicarse para todos los pacientes, sin importar el diagnóstico. Las medidas que se tomen deben permitir que el personal trabaje en un entorno físico seguro, y que éste conozca los riesgos y las medidas de protección adecua- das, según las normas oficiales mexicanas NOM-017STPS-2008 (equipo de protección personal) y NOM087-ECOL-SSA1-2002 [manejo de residuos peligrosos biológico-infecciosos (RPBI]). Equipo de protección a) Bata. Que sea de manga larga y algodón; mantenerla cerrada para protegerse de salpicaduras. b) Guantes. Usarlos durante la práctica; deben ajustarse bien. En caso de que se rompan, reemplazarlos con unos nuevos. c) Cubrebocas. Utilizarlo en áreas donde se produzcan salpicaduras o aerosoles. d) Lentes de seguridad. Usarlos en áreas donde se produzcan salpicaduras o aerosoles. Limpieza del área y el material de trabajo a) El área y el material de trabajo deben mantenerse limpios y libres de contaminantes. b) El material de desecho debe colocarse en los conte- nedores especiales. c) En caso de derrames de líquidos biológicos, debe ab- sorberse el derrame con toallas de papel y desecharse en el contenedor adecuado. d) Desinfectar el sitio del derrame con una solución de hipoclorito de sodio a 5% en dilución 1:10; dejar 30 minutos, absorber con toallas de papel y lavar con agua para quitar el olor. Obtención y manejo de muestras biológicas Introducción En las prácticas del laboratorio de bioquímica se realizan algunas pruebas analíticas en muestras de sangre, orina, o ambas. Estas pruebas se realizan con el fin de desarrollar habilidades formativas y aplicar los conocimientos teóricos en el laboratorio. Es importante saber cómo obtener y manejar las muestras biológicas para llegar a resultados confiables, además de conocer las medidas de seguridad que deben poner en práctica las personas que obtienen las muestras y de las que se obtienen éstas. También es importante conocer el aspecto ético en la toma de una muestra biológica. Aspectos éticos Debe informarse a la persona que se planea obtener una muestra, el tipo de ésta, las pruebas que se realizan con ellas, y los resultados esperados y obtenidos. Práctica 1. Normas de bioseguridad y manejo de muestras biológicas, material, equipo y procedimientos Es importante obtener el consentimiento de esta persona. El tipo de consentimiento puede ser verbal o escrito, de acuerdo con los objetivos. En caso de que se pretenda conocer el estado de salud, puede ser verbal. Si es con fines de investigación, el consentimiento debe exponerse por escrito, indicando el procedimiento y las repercusiones que puede tener para su persona (sobre todo si es una muestra para análisis del DNA o identificación de VIH), y la hoja de aceptación debe tener firma de consentimiento. A B C D E F 9 Toma de sangre Composición de la sangre El corazón y los vasos sanguíneos de un adulto contienen casi 5 litros de sangre. Ésta se compone de células suspendidas en un líquido llamado plasma. El color de la sangre se debe a los eritrocitos (glóbulos rojos), que contienen el pigmento hemo; también hay leucocitos (glóbulos blancos) y trombocitos (plaquetas). Suero y plasma Cuando se extrae sangre y se deja reposar en un recipiente de vidrio por algunos minutos, ésta se coagula, debido a la precipitación de una proteína plasmática a la que se le denomina fibrinógeno, que forma hebras de fibrina insoluble. Las células sanguíneas quedan atrapadas en una red de fibrina que poco a poco se contrae y libera un líquido llamado suero. Éste no contiene fibrinógeno ni algunos factores de la coagulación, porque se han consumido durante la formación del coágulo. El plasma, a diferencia del suero, sí contiene factores de coagulación; es posible obtener plasma, si el tubo donde se recolecta la sangre tiene un anticoagulante. Obtención de sangre Cuando se requiere una cantidad pequeña de sangre, puede obtenerse puncionando la piel del dedo o el lóbulo de la oreja con un instrumento cortante (lanceta). En lactantes, se puede obtener del talón. En primer lugar, se limpia la piel con alcohol (etanol a 95% v/v) y se deja secar. Se inserta una lanceta o aguja estéril en la piel, a 1 o 2 mm de profundidad. La primera gota de sangre que sale de la herida se limpia con torunda de algodón. Las gotas siguientes se recogen con un portaobjetos para frotis, con una pipeta o con algún otro recipiente para pruebas. Debe obtenerse una cantidad de sangre mayor de 0.5 ml por venopunción. Por lo general, se prefiere sangre venosa para la mayor parte de exámenes, y es recomendable obtener una mayor cantidad, en caso de que se necesite repetir la prueba. Es común que se emplee una vena del brazo: se aplica un torniquete para bloquear la circulación venosa, se selecciona alguna vena adecuada por su calibre y prominencia y se limpia la piel con alcohol. Una Figura 1-1. Técnica para la extracción de sangre de vena periférica. A, colocación del torniquete. B, antisepsia previa a la venopunción. C, venopunción y adaptador vacutainer. D, extracción de la sangre con tubo vacutainer. E, retiro de la aguja. F, depósito de la muestra de sangre en tubos con anticoagulantes. vez que el alcohol se ha evaporado, se introduce una aguja afilada, adaptada a una jeringa de tamaño adecuado y estéril; enseguida se tira del émbolo de la jeringa para que la sangre penetre en ésta. En cuanto se ha obtenido una cantidad suficiente, se libera la presión ejercida sobre el brazo y se extrae la aguja. Se aplica una torunda de algodón estéril en el sitio de la punción y se ejerce presión firme durante medio minuto para evitar escurrimiento de la sangre en los tejidos circunvecinos. Debe quitarse la aguja de la jeringa antes de distribuir la sangre en los tubos de ensayo (figura 1-1). Anticoagulantes Si se necesita suero, puede verterse la sangre en el interior de un tubo de ensayo esterilizado. Si se necesita sangre total o plasma, debe emplearse algún anticoagulante; el más común para la mayor parte de exámenes es el EDTA (ácido etilen-diamino-tetra-acético). El citrato de sodio a 3.8% también es un anticoagulante. La heparina es un anticoagulante antitrombocítico que se usa en pruebas en que no se desea la eliminación de iones calcio. 10 Manual de prácticas de laboratorio de bioquímica Toma de muestra de orina para cultivos deben obtenerse por sondeo o aspiración suprapúbica con aguja. Varones Casi siempre, resulta sencillo obtener una muestra de orina limpia a mitad de la micción. De manera sistemática, pueden proporcionarse instrucciones por escrito o colocarse en la pared del laboratorio. El procedimiento debe ser el siguiente: 1. Retracción del prepucio (fuente usual de contamina- ción de la muestra) y aseo del meato con cloruro de benzalconio o hexaclorofeno. 2. Eliminar la primera parte del chorro (15 a 30 ml). 3. Reunir la siguiente porción (de 50 a 100 ml) en un recipiente estéril para muestras, que se debe tapar de inmediato. 4. Vaciar por completo la vejiga en el sanitario. Enseguida se preparará una parte de la muestra para exámenes macroscópico y microscópico; el resto se guarda en un recipiente estéril para cultivos posteriores, si son necesarios. Mujeres Es casi imposible obtener, sin ayuda, una muestra limpia, satisfactoria, a mitad de la micción. Si la paciente no está preparada, su orina no resulta útil, a menos que sea por completo normal. El mejor método para reunir una muestra limpia a mitad de la micción en mujeres es el siguiente: 1. Colocar a la paciente en la mesa de exploración, en posición de litotomía. 2. Asear la vulva y el meato uretral con cloruro de ben- zalconio o hexaclorofeno. 3. Separar los labios y pedir a la paciente que inicie la micción en un recipiente que se conserva cerca de la vulva; una vez que se han eliminado los primeros 10 a 20 ml de orina, reunir los siguientes 50 a 100 ml en un recipiente estéril, que se tapa de inmediato. 4. A continuación, permitir que la paciente vacíe por completo la vejiga. Como esta técnica exige gran esfuerzo, es aceptable pedir a la paciente que obtenga en el sanitario una muestra inicial en un recipiente no estéril. Si los resultados del análisis general son normales, no está indicado hacer más estudios; en caso contrario, hay que obtener una muestra de orina con una técnica más exacta. Medidas a seguir en caso de exposición a líquidos biológicos Cuando haya exposición a líquidos biológicos (punciones con aguja contaminada, salpicadura de mucosas, etc.) se debe avisar al profesor, al técnico responsable del grupo, o a ambos. a) Lavar el área afectada con agua abundante. b) Realizar los siguientes exámenes, tanto a la muestra contaminada como a la persona afectada: • Antígenos de superficie contra virus de la hepatitis B. • Anticuerpos contra VIH. • Anticuerpos contra virus de la hepatitis C. Material, equipo y procedimientos Introducción La aplicación de algunos de los conocimientos teóricos obtenidos en el salón de clases se logra mediante prácticas de laboratorio en que se requiere familiaridad con la utilidad y el manejo apropiados del equipo de laboratorio, como espectrofotómetro, centrífuga, potenciómetro, baños de temperatura constante, placa caliente, agitador magnético, material de vidrio, etc. Asimismo, el estudiante debe emplear el vocabulario apropiado y los conceptos de uso común en el laboratorio. En la figura 1-2 se muestran algunos de los materiales y equipos más utilizados en el laboratorio. Objetivo general Manejar adecuadamente el material y equipo de laboratorio. Objetivos específicos Identificar los materiales y equipos de uso común en el laboratorio. Utilizar de manera apropiada algunos de los equipos de laboratorio. Materiales y equipo Niños Obtener muestras satisfactorias de orina en niños pequeños puede representar un desafío. La orina para otros análisis, como cultivos bacterianos, puede obtenerse de niños y niñas al cubrir el meato uretral aseado con una bolsa de plástico; por lo general, las muestras de orina • • • • • Vasos de precipitado Matraz Erlenmeyer Matraces aforados de diferentes capacidades Pipetas graduadas de 1, 5 y 10 ml Micropipetas con puntas Práctica 1. Normas de bioseguridad y manejo de muestras biológicas, material, equipo y procedimientos Figura 1-2. Materiales y equipo de uso frecuente en el laboratorio de bioquímica. A, tubos de ensayo de diferentes capacidades y gradilla. B, matraz aforado. C, matraz Erlenmeyer. D, probetas de diferente volumen. E, placa caliente. F, agitador eléctrico (vórtex). A D • • • • • • • • • • • • • Probetas Buretas Embudos Tubos de ensayo 13 × 100 Gradillas Pinzas para tubos Balanza granataria Plato caliente Agitador magnético Vórtex Espectrofotómetro Báscula de bioimpedancia Centrífuga Centrifugación La centrifugación es un método empleado para separar partículas con base en la velocidad de sedimentación de cada una de ellas, como resultado de la fuerza centrífuga a la que se les somete. Fundamento Una esfera de masa m y de volumen específico V, que cae a través de un medio viscoso de densidad ρ, bajo la influencia de un campo gravitacional, alcanza una velocidad terminal νt. En analogía a la caída libre de una esfera en un campo gravitacional, una molécula (de masa m y volumen específico parcial V) que sedimenta a través de un medio viscoso en un campo sometido a la fuerza centrífuga, alcanza también una velocidad νt. De aquí se deduce que la aceleración centrífuga ω2x reemplaza la aceleración gravitacional g. Al cociente de νtω2x, que re- B 11 C E F presenta la velocidad por unidad de aceleración angular, se le denomina coeficiente de sedimentación y se le simboliza con s. Su dimensión es (cm · s−2)(cm · s−2) ≡ s. Una unidad conveniente para s es el Svedberg, llamada así en honor de T. Svedberg, quien fue el precursor en las investigaciones sobre sedimentación de partículas por ultracentrifugación. Un Svedberg se define como 10–13 s. La velocidad y el tiempo con el que se somete una muestra a centrifugación para separar sus componentes depende de la distancia que recorren las partículas, además de la viscosidad del medio. Esta distancia se relaciona con la forma y el tamaño del rotor; por ello, en las centrífugas suelen seleccionarse las revoluciones por minuto (rpm). Debido a que la aceleración angular es diferente a la lineal, se debe realizar la conversión de una forma a la otra de acuerdo con la siguiente ecuación: Vs = ω2 · ref · s Vs = velocidad de sedimentación (cm · s−1) ω = velocidad angular (radianes · s−1) r = radio efectivo (cm) s = coeficiente de sedimentación S (Svedberg = 10−13 s) S= Mr (1 − V · ρ) f Mr = masa molecular relativa V = volumen específico parcial de la partícula (cm3 × g–1) ρ = densidad de la solución (g × cm–3) f = coeficiente friccional 12 Manual de prácticas de laboratorio de bioquímica Centrífuga El equipo empleado para realizar la centrifugación es la centrífuga. Está compuesta por un motor eléctrico unido a un dispositivo que gira a gran velocidad alrededor de un eje vertical, el rotor o corona; provoca el aumento de atracción gravitacional en el fondo del tubo que contiene la muestra. El resultado de toda centrifugación es la separación de dos fases: una insoluble, el residuo o precipitado, y una líquida, el sobrenadante. El uso adecuado de la centrífuga requiere el seguimiento de estas acciones: Cuadro 1-1. Características del espectro UV y la luz visible. Nombre de la longitud de onda Muestra absorbida Región espectral absorbida en nm Verde azuloso Rojo Visible 620 a 700 Azul verdoso Anaranjado Visible 600 a 620 Azul Amarillo Visible 575 a 600 Violeta Verde amarillento Visible 555 a 575 Púrpura Verde Visible 505 a 555 Rojo Verde azuloso Visible 495 a 505 Anaranjado Azul verdoso Visible 475 a 495 Amarillo Azul Visible 430 a 475 Verde amarillento Violeta Visible 380 a 430 — No visible UV 220 a 380 — No visible UV lejana 180 a 220 Color de la luz 1. En la centrífuga, los tubos deben colocarse por pares, uno frente al otro, de acuerdo con su peso. 2. Aumentar la velocidad poco a poco, hasta que se al- cance la velocidad requerida, para no forzar el motor. 3. Permitir que el rotor de la centrífuga se detenga por su propia inercia, sin tratar de detenerlo con las manos. 4. Levantar la tapa de la centrífuga hasta que el rotor quede inmóvil por completo. 5. En caso de ruptura de un tubo dentro de la centrífuga, debe hacerse un aseo completo de inmediato, empleando desinfectantes como cloro y benzal. Debido a la enorme fuerza que puede alcanzar el rotor, el mal uso de la centrífuga representa un peligro, si no se utiliza de manera apropiada. En la figura 1-3 se muestra una centrífuga clínica. Espectrofotometría La base de la colorimetría y la espectrofotometría es que muchas sustancias tienen color propio, o pueden dar lugar a productos finales de color en ciertas reacciones químicas. Hay una relación entre la intensidad del color y la concentración del producto. Es preciso conocer las leyes físicas en que se basan los instrumentos de medición. Espectrofotómetro A B Figura 1-3. A, centrífuga analítica desde su aspecto externo. B, rotor y sitios de inserción de los tubos (la flecha indica la forma correcta de colocar los pares de tubos). Se trata de un aparato que sirve para medir la intensidad de la luz absorbida por una solución en un estrecho intervalo de longitudes de onda del espectro UV visible. Cuanta mayor intensidad de color de una solución, mayor es la absorción de la luz; por tanto, esa absorción puede utilizarse como medida directa de la intensidad de color. La relación entre la concentración de una sustancia y la absorción se basa en la ley de Beer-Lambert, que enuncia que la concentración de una sustancia es directamente proporcional a la cantidad de luz absorbida e inversamente proporcional al logaritmo de la luz transmitida (cuadro 1-1). Un espectrofotómetro es un dispositivo que posee una fuente de radiación que se puede dirigir hacia una muestra. Se espera que ésta absorba parte de la radiación, que se detecta enseguida mediante un circuito que produce una señal reproducible. Práctica 1. Normas de bioseguridad y manejo de muestras biológicas, material, equipo y procedimientos 13 Los componentes de un espectrofotómetro son los siguientes: 1. 2. 3. 4. 5. Fuente de luz. Filtro. Cubeta con la muestra. Célula fotoeléctrica. Amplificador y medidor. La fuente de luz aplica una gran intensidad sobre una superficie limitada. Algunas muestras deben manejarse con luz ultravioleta o infrarroja; para ello, se utilizan lámparas con características especiales. El filtro es un dispositivo que tiene la función de permitir el paso de luz de una longitud de onda específica. No debe absorber cantidades apreciables de la luz en una longitud de onda determinada, que debe ser de un color complementario al de la muestra. Las cubetas o celdas analíticas suelen ser tubos redondos o rectangulares de espesor constante, de diversos materiales, como vidrio, cuarzo o plástico. Una muestra puede presentar una absorbancia de cero: no absorbe la radiación incidente y, por tanto, transmite 100% de esa radiación. La situación opuesta se tiene con un cuerpo opaco a un intervalo determinado del espectro electromagnético; en este caso, la transmisión es nula y la absorción es completa. La determinación cuantitativa de una sustancia depende de la relación entre la cantidad de radiación absorbida por la muestra problema y la absorbancia de una sustancia de referencia, con una concentración conocida. Los espectrofotómetros permiten efectuar la comparación entre la señal obtenida por una mezcla que no contiene la sustancia en estudio y otra que sí la tiene, para obtener la señal de esa diferencia. En la figura 1-4 se muestra un espectrofotómetro de luz visible. Bioimpedanciometría Fundamento Sin entrar en los detalles físicos y matemáticos, que están más allá del alcance de esta obra, la ley fundamental de la electricidad que relaciona la impedancia con la intensidad y el voltaje es la ley de Ohm: impedancia = voltaje/ intensidad. Cuando la corriente eléctrica alterna circula por un medio, la impedancia depende en parte de la facilidad de éste para conducir la corriente, y es proporcional a la resistividad o mala conductividad del medio. Si, además, el circuito eléctrico contiene condensadores (sistemas de placas separadas por un medio aislante, donde se acumula una carga eléctrica que se libera cuando el sistema se satura), la impedancia también depende del número de condensadores que tenga que atravesar la corriente y de la facilidad de carga y descarga de éstos (capacidad). Al componente de la impedancia (Z) que se debe a la A B Figura 1-4. A, espectrofotómetro de luz visible. B, botón selector de longitud de onda del espectrofotómetro. mala conductividad del medio se le denomina resistencia (R); el componente que se debe a la acción de los condensadores recibe el nombre de reactancia capacitiva (Xc); en adelante aquí se le denomina tan sólo reactancia. La ecuación que las relaciona es: (Z)2 = (R)2 + (Xc)2 La bioimpedancia representa la oposición de un medio biológico al paso de una corriente alterna, y también cuenta con los componentes de resistencia y reactancia ya expuestos. La resistencia está condicionada por la resistividad de los diferentes tejidos a la conducción de la corriente eléctrica: los tejidos graso y óseo son malos conductores y la corriente circula mejor por los fluidos intra y extracelulares, que son soluciones electrolíticas. La reactancia se debe al efecto aislante de las membranas celulares, que se comportan como condensadores que se cargan y descargan al paso de la corriente. En la figura 1-5 se muestra una báscula de bioimpedancia. Actividades de aprendizaje 1. Leer completas las NOM-017-STPS-2008 y NOM- 087-ECOL-SSA1-2002. 2. Investigar cuál es el símbolo de RPBI. 3. Investigar cuáles son las partes de una centrífuga. 4. Investigar la clasificación de los materiales de vidrio utilizados en el laboratorio de bioquímica. 14 Manual de prácticas de laboratorio de bioquímica Conclusiones Figura 1-5. Báscula de bioimpedancia. Se utiliza para obtener el porcentaje de grasa corporal. 5. Investigar qué otros métodos se utilizan para cuanti- ficar el porcentaje y la distribución de grasa corporal. 6. Investigar el espectro completo de la luz (ultravioleta, visible e infrarroja). 7. Investigar los daños que genera la exposición a luz ultravioleta. 8. Investigar si la luz ultravioleta se utiliza para el trata- miento de algunas enfermedades. Discusión Bibliografía William RD. Exámenes urológicos de laboratorio. En: Tanagho EA, McAninch JW. Urología general de Smith, 10a ed. Editorial El Manual Moderno, 1993:51-63. WoodLiff HJ, Herrmann RP. Hematología clínica, 1a ed. Editorial El Manual Moderno, 1981. Práctica 2 Agua y soluciones • Irma Ramos Rodríguez • Sergio Sánchez Enríquez • Mercedes Romero Gómez • María de Lourdes Isaac Virgen • Luis Huacuja Ruiz Introducción Agua Las propiedades fisicoquímicas del agua dependen de su carácter bipolar y de su capacidad para formar puentes de hidrógeno, lo que le confiere propiedades únicas. Soluciones homogéneas Una solución es una mezcla con aspecto homogéneo, formada por uno o más solutos y un solvente; cualesquiera de ellos puede estar en alguno de los tres estados de la materia. El soluto es la sustancia que se disuelve o dispersa por vía molecular en otra, y el solvente es el compuesto más abundante. En una solución, el soluto y el solvente pueden encontrarse como moléculas o como iones. Por ejemplo, cuando la sacarosa (azúcar común) se disuelve en agua, la molécula se incorpora por completo en la solución (no H O disociada); por el contrario, cuando el cloruro de sodio (sal de mesa) se disuelve en agua, se disocia en iones sodio y cloro. En cualquier caso, las moléculas o iones están rodeadas por moléculas de agua (hidratadas), que las mantienen separadas entre sí, como se representa en la figura 2-1. Las propiedades del soluto y el solvente, como la polaridad y el carácter iónico, afectan la solubilidad. Los factores que afectan la velocidad de disolución son: 1. 2. 3. 4. 5. Tamaño de la partícula. Cantidad de soluto. Agitación. Temperatura. pH. A la relación entre las cantidades de soluto y solvente se le denomina concentración. Una solución puede ser no saturada, saturada o supersaturada, de acuerdo con la capacidad del solvente para solvatar al soluto. H H O H Na + H H H O H O H H O H H H O C1 – H O H O O H O H H H H H B O H H C12 H22 O11 H H H A O O O H H H O H Figura 2-1. Representación de la capacidad de solvatación del agua (hidratación). A, molécula de cloruro de sodio disociada en iones sodio y cloro hidratados. B, hidratación de una molécula de carbohidratos. 16 Manual de prácticas de laboratorio de bioquímica Existen varias formas de expresar la concentración de una solución; las de uso más frecuente son porcentual, molar y normal. A continuación se describe la forma de calcular cada una de ellas: 1. Porcentual (%). Representa la proporción del soluto que se encuentra en una solución utilizando la base 100 expresada en gramos o en mililitros. Existen cuatro diferentes formas para referirse a la concentración porcentual: • Porcentaje en peso (% pp). Cantidad de g de soluto en 100 g de solución. • Porcentaje en volumen (% vv). Número de mililitros de soluto en 100 ml de solución. • Porcentaje en peso-volumen (% pv). Cantidad de gramos de soluto en 100 ml de solución. • Porcentaje en moles (% mol). Número de moles de soluto disueltos en 100 ml de solución. En ciencias de la salud, las más utilizadas son las soluciones porcentuales pv (p. ej., ¿cuántos gramos de NaCl se requieren para preparar 250 ml de solución salina a 1%?). La resolución de este problema es sencilla, si se parte de la base de que por cada 100 ml de solución se requiere 1 g de NaCl (1%), de acuerdo con el planteamiento de la siguiente regla de tres: 1g 100 ml = x 250 ml x = 2.5 g 2. Molar (M). Cantidad de moles de soluto en un litro de solución. M= Moles de soluto Litro de solución Mol se define como el peso molecular de una sustancia expresado en gramos. En el ámbito experimental, este número es igual a 6.022 × 1023 moléculas (número de Avogadro). La masa molecular o peso molecular (PM) de una sustancia es la suma de los pesos atómicos de cada uno de sus componentes; por ejemplo, el PM del ácido sulfúrico (H2SO4) es de 98 gmol, como se describe en el cuadro 2-1. Para preparar soluciones molares se tiene que hacer el cálculo matemático, que es diferente si el soluto es un sólido o un líquido. En el primer caso, como cuando se usa NaOH o NaCl, la pureza es casi de 100% y no se tiene que convertir de gramos a mililitros con la fórmula de la densidad (ρ = mv). Por tanto, para saber, por ejemplo, cuántos gramos de NaOH se requieren para preparar 300 ml de una solución de esta sustancia a 0.2 M, si el peso molecular del NaOH es 40 g, se utiliza, en primer lugar, una regla de tres, para corregir la molaridad (de 1 M a 0.2 M): Cuadro 2-1. Procedimiento para calcular el peso molecular. Átomo Hidrógeno (H) Peso Número de atómico átomos en la (PA) molécula (NAM) PA × NAM 1 2 2 Azufre (S) 32 1 32 Oxígeno (O) 16 4 64 Peso molecular (PM) 98 40 g 1M x 0.2 M = x=8g Por tanto, se necesitan 8 g de NaOH para preparar 1 litro de solución; sin embargo, el volumen que se desea obtener es de 300 ml, de modo que se aplica una segunda regla de tres para corregir el volumen: 8g 1L = x 0.3 L x = 2.4 g Con esto se sabe la cantidad de gramos necesarios para preparar la solución solicitada. Otra opción consiste en utilizar el análisis bidimensional modificado, utilizando la siguiente ecuación: g = PM × M × V g PM M V = gramos de soluto = peso molecular del soluto, en gramos = molaridad = volumen, en litros. Al sustituir los valores conocidos, se obtiene: g = 40 × 0.2 × 0.3 g=8 Con esto se obtiene un resultado igual que con el procedimiento anterior. Un caso diferente resulta si el soluto que se va a utilizar es líquido y, en especial, un ácido que nunca tiene 100% de pureza. Para esto, puede utilizarse cualesquiera de los procedimiento realizados, pero debe agregarse la fórmula de densidad para corregir de gramos a mililitros y una regla de tres adicional para corregir la pureza. Otra opción consiste en utilizar el análisis bidimensional, modificando la ecuación de la siguiente manera: Práctica 2. Agua y soluciones ml = PM × M × V ml = m v=ρ Al sustituir por sus valores, se debe considerar que la densidad del H2SO4 es de 1.88 gml. V= 98 × 0.3 × 0.4 Nota: cuando se prepara una solución de ácido, nunca se debe poner primero el ácido y luego el agua, porque se produce una reacción exotérmica que puede proyectar el ácido y quemar. Vale la pena recordar el aforismo “Nunca le des de beber a un ácido”. Para preparar de manera correcta esta solución se coloca primero un poco de agua, después se deposita el ácido, que debe descender por las paredes del matraz, y luego se vierte agua, una vez más, hasta alcanzar el volumen deseado. 3. Normal (N). Cantidad de equivalentes químicos de soluto en un litro de solución: El equivalente químico (eq) se define como la capacidad de reacción de un átomo, ion o molécula. Por ejemplo, al colocar H2SO4 en solución acuosa, la molécula se disocia en dos hidrogeniones (H+) y un ion sulfato (SO42−) como se muestra en la siguiente reacción: H2SO4 g H+ + H+ + SO42− En este ejemplo, el equivalente químico en gramos se obtiene al dividir el peso molecular del ácido entre el número de hidrogeniones sustituibles (2), como se muestra en la siguiente ecuación: Eq gramo = PM (98 g ∙ mol) Hidrogeniones sustituibles (2) Eq gramo = 49 g de H2SO4 Debido a que el H2SO4 se encuentra en estado líquido, es necesario convertir los gramos del mismo a unidades de volumen (ml). Para este fin se usa la fórmula de la densidad: ρ= ρ = densidad m = masa en gramos m v 1.88 gml Este volumen sería el correcto si el ácido estuviera a 100% de pureza, pero como se encuentra a 98%, se debe hacer la corrección utilizando una regla de tres: 26.06 ml x = 98% 100% x = 26.6 ml Este volumen sería adecuado para preparar una solución a 1 N; si se solicitara una a 0.1 N, habría que corregir con una regla de tres, de la siguiente manera: 26.6 ml x = 1N 0.1 N x = 2.66 ml Equivalente químico del soluto Litro de solución 49 g Volumen = 26.06 ml 1.71 × 0.85 ml = 8.11 N= que se despeja de la siguiente manera: ρ × Proporción de pureza Por ejemplo, si se quiere saber cuántos mililitros de la solución stock de H3PO4, con densidad de 1.71 gml y pureza del 85%, hay que extraer para preparar 400 ml de solución de H3PO4 al 0.3 M, se sigue este procedimiento: 17 Estos 2.66 ml serían correctos si se necesita un litro; sin embargo, si se solicitan 500 ml, habría que realizar una última regla de tres: 2.66 ml x = 1L 0.5 L x = 1.33 ml Otra opción consiste en realizar un análisis bidimensional modificado, que integre todas estas variables en una sola ecuación. Si se continúa con el mismo caso (preparar 0.5 l de una solución de H2SO4 a 0.1 N, para una pureza de 98%, con densidad de 1.88 gml, y considerando el equivalente químico de H2SO4 = 49 g), se utiliza la siguiente ecuación: v= Eq × N × V ρ × Proporción de pureza donde V es el volumen en litros. Al sustituir las variables por su valor, se obtiene: v= 49 g × 0.1 N × 0.5 L 1.88 gml × 0.98 v = 1.33 ml Como puede observarse, se obtiene el mismo resultado con cualquiera de los dos procedimientos. Por ello, el estudiante tiene la libertad de utilizar el que más domine. 18 Manual de prácticas de laboratorio de bioquímica Propiedades de las soluciones Las propiedades físicas de las soluciones se dividen en tres categorías: constitutivas, aditivas y coligativas. Propiedades constitutivas. Son las que dependen de manera exclusiva de la naturaleza de las moléculas que la forman. Son propiedades constitutivas los caracteres ácido, básico, oxidante, reductor, radiactivo, dulce, insípido, colorido, etcétera. Propiedades aditivas. Son las que dependen de la suma de las propiedades correspondientes a los constituyentes de la solución. La única propiedad rigurosamente aditiva es el peso molecular. Propiedades coligativas. Son las que dependen del número de moléculas por unidad de volumen (la concentración del soluto). Algunos ejemplos son: punto de fusión, punto de ebullición, presión de vapor, presión osmótica y presión oncótica. Estas propiedades tienen un papel relevante en las soluciones biológicas. traer del stock para preparar la nueva solución, más diluida? Al sustituir las variables de la ecuación anterior con sus valores, se tiene: V1 = V1 = 0.125 L = 125 ml Por tanto, se deben medir 125 ml de la solución 2 N de H2SO4, depositarla en un matraz volumétrico de 500 ml y completar en volumen a la marca de aforo. Objetivo general Realizar cálculos para la preparación de soluciones porcentuales, molares y normales. Realizar una curva de una solución de fenolftaleína utilizando el espectrofotómetro. Diluciones Materiales y equipo En el laboratorio, a menudo es necesario preparar soluciones de trabajo diluidas a partir de reactivos u otras concentradas. A una misma cantidad de soluto y diferentes cantidades de solvente, la concentración de la solución es diferente. Cuando la concentración se expresa sobre una escala volumétrica, la cantidad de soluto presente en un volumen de solución es igual al producto de la concentración por el volumen: Cantidad de soluto = Volumen × Concentración Al diluir una solución, aumenta el volumen y se reduce la concentración, si se tiene la misma cantidad de soluto. La relación que existe cuando se preparan dos soluciones con diferente concentración, utilizando la misma cantidad de soluto, es: V1 × C 1 = V 2 × C 2 V1 V2 C1 C2 0.5 L × 0.5 N 2N = volumen inicial = volumen final = concentración inicial = concentración final Matraz aforado de 100 ml Tubos de ensayo de 13 × 100 Gradilla para tubos Pipetas serológicas de 1, 5 y 10 ml Probeta de 100 ml Vasos de precipitado de 250 ml Espectrofotómetro Soluciones y reactivos • Agua destilada • Solución de fenolftaleína a 0.5% • Solución de etanol a 50% Desarrollo experimental Experimento 1 Manejo de concentraciones por espectrofotometría Fundamento Si se conocen tres valores entre la solución conocida y la que se desea preparar se puede calcular el cuarto parámetro, respetando las mismas unidades para el volumen (ml, L, etc.) y para la concentración (molar, normal). Al sustituir en la ecuación anterior, se tiene: V1 = • • • • • • • V2 × C2 C1 Por ejemplo, si se desea preparar 500 ml de una solución de H2SO4 a 0.5 N, a partir de una solución stock que se encuentra a 2 N, ¿qué volumen se necesita ex- La fenolftaleína con PM de 318.33, en solución alcohólica a 50% y pH de 11.5, se ioniza y produce color violeta (véase la figura 2-2). Procedimiento A partir de una solución almacenada (A) de fenolftaleína a 0.5%, hacer las siguientes diluciones: 1. Tomar una alícuota de 1 ml y aforar a 100 ml, con la solución de alcohol a 50% y pH de 11.5 (B), etiquetar seis tubos de ensayo de 13 × 100 (cuadro 2-2). 2. Leer el espectrofotómetro a una longitud de onda de 530 nm, ajustando a cero con el blanco. Al graficar 19 Práctica 2. Agua y soluciones O OH OH O OH OH H2O + C C C H 3O + O C C OH O- C O I Forma seudo o normal (incolora) O O II Forma ionogénica (roja) III Ion (rojo) Figura 2-2. Fórmula. Reacciones químicas de la fenolftaleína. los valores de densidad óptica (DO), se obtiene una línea recta, lo que indica que la DO es directamente proporcional a la concentración (DO ∝ C). 3. Graficar los valores obtenidos en la práctica (DO versus concentraciones) en papel milimétrico (cuadro 2-3). Actividades de aprendizaje Realizar los cálculos para la preparación de las siguientes soluciones: 1. Preparar 250 ml de una solución de cloruro de sodio a 0.9% (pv). Describir los cálculos para conocer la cantidad de cloruro de sodio que debe pesarse, para aforarla al volumen deseado. 2. Preparar 500 ml de una solución de ácido fosfórico (H3PO4) a 0.1 M, tomando como base los siguientes datos: Fenolftaleína 1 0.5 4.5 2 1 3 Describir los cálculos hechos para conocer el volumen del ácido fosfórico concentrado que se utilizó para preparar 500 ml de esa solución. 3. Preparar 500 ml de una solución de NaOH a 0.1 M, con peso molecular de 40. Describir los cálculos para saber cuántos gramos se deben tener de NaOH. 4. Preparar dos soluciones: una de HCl y otra de NaOH a 0.01 N. Se necesitan 1 000 ml de cada una. El PM del HCl es de 36.5 y su densidad a 20°C es de 1.060 gml. El PM del NaOH es de 40. Describir los cálculos para conocer las cantidades de solutos (HCl y NaOH) que hay que utilizar. 5. Investigar en el libro de texto de qué manera se puede convertir una solución porcentual a solución osmolar. Cuadro 2-3. DO esperada para una concentración determinada de fenolftaleína. Cuadro 2-2. Diluciones de fenolftaleína y su concentración. Núm. de tubo a) Peso molecular (PM) del ácido fosfórico: 98 gmol. b) Pureza de 85%. c) Densidad de 1.71 gcm3. Etanol a 50%, Concentración pH 11.5 (ml) (mg/tubo) DO (530 nm) Núm. de tubo Esperado 2.5 1 0.160 2.5 4.0 5 2 0.296 5 1.5 3.5 7.5 3 0.377 7.5 4 2 3 10 4 0.527 10 5 2.5 2.5 12.5 5 0.655 12.5 6 3 2 blanco 6 0.0 Blanco Experimental Concentración (mg) 20 Manual de prácticas de laboratorio de bioquímica 6. Investigar la composición en miliequivalentes de la solución salina a 0.9%, glucosada a 5%, Hartman, Ringer, solución mixta (NaClglucosa) y registrarla en un cuadro. 7. Calcular la osmolaridad de las anteriores soluciones. Discusión Preparación de reactivos 1. Solución de etanol a 50%: Mezclar partes iguales de alcohol y agua destilada, tomando en cuenta la pureza del alcohol. Ajustar a pH de 11.5 con tres gotas de NaOH a 40%. 2. Solución de fenolftaleína a 0.5%: En un matraz volumétrico de 100 ml, colocar 0.5 g de fenolftaleína, mezclar y aforar con alcohol a 50%. Bibliografía Conclusiones Bigelow P. How to make standard solutions for Chemistry. http: www.scn.org [Revisado 16092013]. Chang R. Química, 7a ed. McGraw-Hill, 2003. Kotz JC, Treichel PM. Química y reactividad química, 5a ed. Editorial Thomson, 2003. Práctica pH y amortiguadores • Sonia Uribe Luna • Patricia Heredia Chávez • Sergio Sánchez Enríquez • Pedro Garzón de la Mora Introducción el logaritmo negativo de la concentración de iones hidrógeno. pH = –log10 [H+] Agua La molécula de agua tiene una capacidad limitada para disociarse en un ion hidrógeno (H+), al que también se le llama protón, y un ion hidroxilo (OH−). H2O (l) H+ Agua Protón OH− + Ion hidroxilo En solución acuosa, un protón se combina de inmediato con una molécula de agua para formar el ion hidronio o hidrogenión (H3O+). H+ + Protón 3 H2O (l) Agua H3O+ Hidronio Sin embargo, por convención, en las reacciones de ionización del agua se utiliza la representación del protón en lugar del ion hidronio. Las concentraciones de protones y iones hidroxilo, en agua pura, son de 10−7 M para cada uno, como muestra la siguiente expresión: [H+] = [OH−] = 10−7 M Las concentraciones de ambos iones exponen una relación recíproca: cuando H+ aumenta, OH− disminuye, y viceversa. El producto de sus concentraciones es una constante conocida como producto iónico del agua (Kw), que tiene un valor de 1 × 10−14 M. Kw = [H+] × [OH−] = 1 × 10−14 M Con el fin de facilitar los cálculos para determinar H+, además de su interpretación, en 1909 el químico danés Sørensen definió el potencial hidrógeno (pH) como Más adelante, en 1923 Johannes Brønsted y Thomas Lowry propusieron, en forma independiente, los conceptos de ácido, como la capacidad de las sustancias para ceder protones en una solución acuosa, y de base, como la de aceptar protones. En la práctica, las disoluciones acuosas se clasifican en ácidas, si presentan un pH menor a 7.0; básicas, si el pH es mayor a 7.0, y neutras, si el pH es igual a 7.0. Por otra parte, no todos los ácidos se disocian con la misma facilidad. A los que lo hacen por completo en una solución acuosa, se les considera ácidos fuertes; los que se disocian en parte, son ácidos débiles. Algunos ácidos o bases débiles tienen importancia biológica porque evitan cambios bruscos de pH cuando se les agrega pequeñas cantidades de ácidos o bases. A esta propiedad se le denomina capacidad amortiguadora. El fin de los amortiguadores es mantener el pH estable en un intervalo muy estrecho (p. ej., en la sangre va de 7.35 a 7.45). El pK es el pH necesario para que un ácido esté 50% no disociado y 50% disociado (es decir, la razón o proporción de ácido disociado y no disociado es 1). Cuando la solución presenta un pH cercano a su pK (± 1.0) posee su mayor capacidad amortiguadora. Los ácidos o las bases producidas por el catabolismo de carbohidratos, lípidos y aminoácidos dan lugar a una gran cantidad de compuestos con potencial para modificar el pH fisiológico. Sin embargo, existen sistemas amortiguadores que evitan cambios bruscos del pH. Un ejemplo es el sistema bicarbonatoácido carbónico, que mantiene el pH de los líquidos intercelulares en valores cercanos a 7.4. En éste, la combustión completa de carbohidratos y lípidos genera bióxido de carbono y agua, que 22 Manual de prácticas de laboratorio de bioquímica + CO2 Bióxido de carbono H2O Agua AC H2CO3 Ácido carbónico pKa = 6.1 HCO3− + H+ Bicarbonato Protón AC = anhidrasa carbónica Figura 3-1. Reacción de disociación del ácido carbónico. A la izquierda del ácido carbónico se muestra la disociación mediada por la anhidrasa carbónica y a la derecha la disociación espontánea (sin enzima). se combinan para producir ácido carbónico en el nivel tisular. El ácido carbónico en solución acuosa se disocia para formar su base conjugada (el bicarbonato), lo que genera un sistema amortiguador (figura 3-1). Si aumenta la concentración de protones en el medio, debido a cualquier proceso químico, el equilibrio se desplaza a la izquierda y el exceso de CO2 producido se elimina a través de los pulmones. Por el contrario, si disminuye la concentración de protones, el equilibrio se desplaza a la derecha. Las proteínas (en forma específica, las enzimas) son sensibles a los cambios bruscos de pH. Por tanto, el pH sanguíneo debe conservarse en un intervalo de 7.35 a 7.45, con el fin de mantener la homeostasis. Además de los sistemas amortiguadores de pH, el sistema nervioso (centro respiratorio), el aparato respiratorio y los riñones contribuyen a mantener en nuestros órganos y tejidos el pH en los rangos apropiados. Objetivo general • Analizar las propiedades de soluciones ácidas y básicas. Objetivos específicos • Medir el pH de diferentes sustancias. • Evaluar la capacidad amortiguadora de líquidos biológicos. • Determinar los valores de pK de un ácido poliprótico. Materiales y equipo • • • • • • • • • • • • • • Materiales y equipo Bureta Matraz Erlenmeyer de 250 ml Probeta de 100 ml Pipetas de 1, 5 y 10 ml Vasos de precipitado de 100 y 250 ml Tubos de ensayo 13 × 100 Soporte universal Pinzas en mariposa para bureta Gradilla Potenciómetro Tiras reactivas para pH Agitador magnético Pipetores Soluciones y reactivos Soluciones Muestras* H3PO4 a 0.1 M Saliva NaOH a 0.1 M Orina NaOH a 0.01 N Sudor HCl a 0.01 N (3.8%) Leche NaHCO3 con pH 7.4 Refresco oscuro Reactivo de Yamada Refresco claro Solución amortiguadora de referencia a pH 4.0 Jugo de naranja Solución amortiguadora de referencia a pH 7.0 Yogurt Agua * El alumno debe proporcionar las muestras. Desarrollo experimental Experimento 1 Medición del pH con tiras reactivas Una forma rápida de medir el pH consiste en utilizar tiras reactivas diseñadas para ese fin. Fundamento Las tiras reactivas contienen diferentes compuestos, a los que se les denomina indicadores de pH, que cambian de color de acuerdo con el pH en que se encuentran. A estas mediciones se les considera semicuantitativas, porque no indican el valor exacto del pH. La coloración que presenta la tira se compara con la gama de colores de referencia incluida en el recipiente de las tiras. Procedimiento 1. Sumergir la tira reactiva en el líquido problema y mantenerla por 10 segundos. 2. Retirar la tira y quitar el exceso de líquido. 3. Comparar los cambios de color obtenidos con la gama de colores existentes en el contenedor de las tiras. 4. Registrar los valores de pH obtenidos de las soluciones incluidas en el cuadro 3-1. Práctica 3. pH y amortiguadores Cuadro 3-1. Resultados de la medición de pH de distintas soluciones. Solución 23 Cuadro 3-2. Resultados obtenidos para el pH de diferentes soluciones, antes y después de la exposición a un ácido y a una base. pH obtenido NaOH 0.01N HCl 0.01N Orina 0.5 ml — 2 Orina — 0.5 ml Leche 3 Suero 0.5 ml — Refresco oscuro 4 Suero — 0.5 ml Refresco claro 5 NaHCO3 a 0.1 N y pH 7.0 0.5 ml — 6 NaHCO3 a 0.1 N y pH 7.0 — 0.5 ml 7 Agua destilada 0.5 ml — 8 Agua destilada — 0.5 ml Saliva Tubos Orina 1 Sudor Jugo Yogurt Solución de jabón Solución de sosa cáustica Agua Experimento 2 Sistemas amortiguadores Fundamento El objetivo de este experimento es comparar diferentes líquidos que contienen amortiguadores y ver cuál es más eficaz para evitar cambios importantes de pH ante la exposición a un ácido o una base. Se tiene un control que no es amortiguador (agua). Desarrollo a) Preparar una serie de tubos numerados de acuerdo con el cuadro 3-2. b) Medir el pH de cada solución, empleando tiras reac- tivas. c) Registrar el pH final. d) Analizar los cambios observados. Experimento 3 Capacidad antiácida del hidróxido de aluminio y magnesio y del subsalicilato de bismuto Fundamento El propósito de este experimento es observar el comportamiento de dos fármacos utilizados como antiácidos, cuando se exponen a soluciones básicas y ácidas. Como control, se tiene agua destilada. Muestra (2.5 ml) pH inicial pH final Procedimiento a) Preparar una serie de tubos numerados de acuer- do con el cuadro 3-3. Realizar las diluciones del hidróxido de aluminio y magnesio (Melox) y el subsalicilato de bismuto (Peptobismol). El volumen total debe ser 2.5 ml; de ellos, 0.5 ml corresponden a Melox o Peptobismol, mezclados con 2 ml de agua destilada. b) Agregar la base (NaOH) a la dilución de los tubos nones y el ácido (HCl) a la de los tubos pares. c) Mezclar bien. d) Medir el pH de cada solución, empleando tiras reactivas. Experimento 4 Curva de titulación del ácido fosfórico (H3PO4) Fundamento El ácido fosfórico, H3PO4, es un ácido poliprótico (tiene tres protones, que pueden disociarse). Mediante titulación, es posible determinar los tres valores de pKa de este compuesto. Para titular un ácido débil se agregan cantidades pequeñas de una base fuerte que permite desplazar el equilibrio hacia la formación de su base conjugada. Después de cada adición de la base, se determina el pH, mediante 24 Manual de prácticas de laboratorio de bioquímica Cuadro 3-3. Resultados obtenidos para el pH de hidróxido de aluminio y magnesio (Melox), subsalicilato de bismuto (Peptobismol) y agua, antes y después de exponerlos a una base y a un ácido. Tubos Muestra (2.5 ml) pH inicial NaOH a 0.01 N HCl a 0.01 N 1 Hidróxido de aluminio y magnesio (1:5) 0.5 ml — 2 Hidróxido de aluminio y magnesio (1:5) — 0.5 ml 3 Subsalicilato de bismuto (1:5) 0.5 ml — 4 Subsalicilato de bismuto (1:5) — 0.5 ml 5 Agua destilada 0.5 ml — 6 Agua destilada — 0.5 ml pH final Figura 3-2. Potenciómetro portátil con electrodo de vidrio. potenciometría, y su valor se registra en una gráfica para determinar el comportamiento del ácido débil. De la misma forma, se puede titular una base débil empleando un ácido fuerte. En el proceso de titulación se modifica el pH (en este caso, de valores ácidos a otros cada vez más básicos). Esto se puede determinar a partir de cambios de color, si se agrega a la reacción una mezcla de indicadores de pH, como el reactivo de Yamada. Potenciómetro Se trata de un aparato que mide el pH y que funciona por medio de electrodos. El electrodo es un dispositivo que contiene una solución amortiguadora; al ponerse en contacto con la solución problema, mide la concentración de los hidrogeniones. El uso del potenciómetro depende del modelo. Sin embargo, en forma general se deben tener los siguientes cuidados: • Antes de medir el pH, debe mezclarse la solución que se desea analizar empleando el agitador magnético. Se recomienda evitar el uso de varillas de vidrio como agitadores, porque se corre el riesgo de romper los electrodos, que son frágiles. • Los electrodos deben enjuagarse con agua destilada antes y después de utilizarse, y no se deben tocar con la mano. • Antes de utilizar el potenciómetro, debe calibrarse con una solución de referencia (pH 4, pH 7 o pH 10). • Los electrodos deben mantenerse en agua destilada cuando no estén en uso, evitando que se sequen. Si esto ocurre, deben sumergirse en agua y calibrarse varias veces antes de hacer las mediciones. En la figura 3-2 se muestra una fotografía de un modelo de potenciómetro portátil, junto con sus aditamentos. Procedimiento 1. En un vaso de precipitado de 250 ml, depositar 25 ml de una solución de H3PO4 a 0.1 M. 2. Agregar 4 gotas del reactivo de Yamada (mezcla de indicadores de pH). 3. Medir el pH con un potenciómetro. El potencióme- 4. 5. 6. 7. tro debe calibrarse de antemano con amortiguadores de referencia, a pH 4.0 y pH 7.0. Preparar una bureta con 50 ml de una solución de NaOH a 0.1 M. Agregar al H3PO4 alícuotas de 3.0 ml de NaOH a 0.1 M. Mezclar con el agitador magnético y medir el pH después de cada adición, hasta completar 75 ml de la base NaOH. Graficar en papel milimétrico el volumen de NaOH gastado contra el pH. Determinar los valores de pKa1, pKa2 y pKa3 para el H3PO4. Actividades de aprendizaje 1. Investigar la composición promedio de las siguientes soluciones y cuál de esos compuestos contribuye más al pH de la solución. Práctica 3. pH y amortiguadores 25 26 Manual de prácticas de laboratorio de bioquímica Solución 9. Investigar la utilidad práctica de los siguientes com- Compuesto puestos y marcarlos en el siguiente cuadro: Saliva Orina Antiácido Amortiguador Efecto sistémico Sudor Bicarbonato de sodio Leche Refresco oscuro Hidróxido de magnesio Refresco claro Jugo Hidróxido de aluminio Yogurt Subsalicilato de bismuto Solución de jabón Agua 2. ¿Qué pH tiene la mayor parte de las sustancias estu- diadas en este experimento? 3. De acuerdo con los resultados obtenidos en el experimento 2, investigar qué sistema o sistemas de amortiguadores se encuentran en cada una de las soluciones utilizadas. 10. Explicar la diferencia entre un sistema amortiguador y el de una sustancia con propiedad antiácida. Discusión Descripción del sistema amortiguador Muestra Orina Suero NaHCO3 a 0.1 N y pH 7.0 Agua destilada 4. ¿Cuál de estos amortiguadores es el mejor? 5. ¿Cuál de los antiácidos utilizados en el experimento 3 es mejor? 6. ¿Cuál de los pKa del ácido fosfórico es mejor amor- tiguador a pH fisiológico? 7. Investigar cuáles enfermedades tienen relación con el pH 8. Completar la información del siguiente cuadro: Indicadores del reactivo de Yamada Intervalos de pH Azul de timol Rojo de metilo Azul de bromotimol Fenolftaleína Color Conclusiones Práctica 3. pH y amortiguadores 27 Preparación de reactivos H3PO4 0.1 M NaOH 0.1 M HCl 0.01 N NaOH 0.01 N Solución NaHCO3 a 0.1N: ajustar el pH a 7.0 Reactivo de Yamada: Azul de timol 5.0 mg Rojo de metilo 12.5 mg Azul de bromotimol 50.0 mg Fenolftaleína 100.0 mg Disolver en 200 ml de alcohol etílico a 50% Bibliografía Garzón de la Mora P. Manual de prácticas de bioquímica. Proyecto IV de pH y Buffers, 2002:85-93. McKee T. Bioquímica, 3a ed. Cap 3. El agua: el medio de la vida. McGraw-Hill, 2003:65-91. Roskoski R Jr. Bioquímica. Cap 3. Aminoácidos y proteínas. McGraw-Hill, 1998:65-91. http:www.uclm.es. Equilibrio ácido-base. [Revisado el 16 de septiembre de 2013.] Práctica Aminoácidos y proteínas 4 • Carmen Magdalena Gurrola Díaz • María de Lourdes Isaac Virgen • Sergio Sánchez Enríquez Introducción Las proteínas constituyen el grupo de compuestos más abundante en los seres vivos; en algunos casos representan hasta 50% del peso total seco. Esta abundancia se debe a que desempeñan diversas funciones: Catálisis, en el caso de las enzimas. Transporte, en el de la hemoglobina. Almacenamiento, como sucede con la ferritina. Movimiento (p. ej., actina y miosina). Soporte mecánico (colágeno). Protección inmunológica, a través de los anticuerpos. 7. Regulación de procesos biológicos y comunicación celular, como algunas hormonas y sus receptores. 1. 2. 3. 4. 5. 6. Las proteínas son macromoléculas de elevado peso molecular, porque su estructura consta de cadenas de aminoácidos unidos por enlaces peptídicos entre el grupo alfa carboxilo de un aminoácido y el grupo alfa amino de otro. Aunque en la naturaleza existen más de 300 aminoácidos, las proteínas sólo utilizan 20, de diferente tamaño, forma, carga, capacidad de formar puentes de hidrógeno o enlaces disulfuro y reactividad química. Los aminoácidos tienen la capacidad de formar dos tipos de isómeros, D y L, que indican si el grupo amino se encuentra a la derecha o a la izquierda del carbono quiral. En las proteínas, sólo se encuentran los isómeros L-alfa. Las cuantiosas combinaciones que se pueden lograr con los 20 aminoácidos en las cadenas polipeptídicas, otorgan gran diversidad a las funciones proteínicas. La presencia de grupos químicos ionizados en los aminoácidos permite que las proteínas presenten características fisicoquímicas específicas en el microambiente biológico; de allí la importancia de su estudio. A varios aminoácidos se les denomina esenciales, porque el organismo carece de la capacidad de sintetizarlos y, por tanto, es necesario ingerirlos en la dieta. Los aminoácidos no esenciales son los que el cuerpo humano sí puede sintetizar. El catabolismo deficiente de los aminoácidos lleva a su acumulación en el plasma y su excreción excesiva en la orina; a esto se le conoce como aminoaciduria. En el adulto normal, la excreción urinaria de aminoácidos es constante; en un periodo de 24 horas se excreta un promedio de 200 mg de nitrógeno alfa aminado. Existen diversos trastornos en que aumenta la cantidad de aminoácidos en la orina. Métodos de separación de aminoácidos y proteínas Los métodos de cromatografía en capa fina y de electroforesis son adecuados para determinar la cantidad absoluta y relativa de los diferentes aminoácidos en una muestra (análisis cualitativo); sin embargo, para los análisis cuantitativos es necesaria la cromatografía de líquidos de alta presión (HPLC). • Electroforesis. Se trata de un proceso en que algunas biomoléculas con carga (como proteínas, polinucleótidos, biopolímeros) se separan a partir de su distinta velocidad de migración en un campo eléctrico. Por lo general, los aminoácidos no se presentan en forma aislada; de modo que es necesario separarlos antes de poder cuantificarlos. Entre las técnicas de separación, se mencionan a continuación las de uso más frecuente en el laboratorio. • Cromatografía en capa fina. Se fundamenta en la separación de las moléculas adsorbidas en una placa (fase estacionaria), con una capa muy delgada de 30 Manual de prácticas de laboratorio de bioquímica gel de sílice; se coloca en posición vertical en una cámara con un sistema de solventes (fase móvil), que ascienden debido al fenómeno de capilaridad. La separación se realiza con base en la polaridad de las moléculas. • Analizador automático de aminoácidos (HPLC). Existen dos técnicas para la determinación de aminoácidos mediante cromatografía líquida: en columnas de intercambio iónico y de alta resolución en columnas de fase reversa: ∘ Cromatografía líquida en columnas de intercambio iónico. La cromatografía iónica está relacionada con los métodos modernos y eficaces para la determinación de iones, que se basan en el uso de resinas de intercambio iónico. Se hacen pasar los aminoácidos a través de una columna de resina con grupos catiónicos o aniónicos; dependiendo de la carga de los aminoácidos, éstos se unen a la columna y, más adelante, mediante un cambio gradual en el pH del solvente, se eluye cada aminoácido a un pH distinto (de acuerdo con el punto isoeléctrico del aminoácido). ∘ Cromatografía líquida de alta resolución en columnas de fase reversa. Este método consiste en aplicar aminoácidos disueltos en una fase acuosa acidificada (fase móvil) a una columna de sílice unida a una cadena hidrocarbonada (fase estacionaria). La selectividad se basa en las interacciones específicas entre el soluto y la fase móvil, que puede ser de tipo polar, de formación de puentes de hidrógeno o mediante equilibrios secundarios provocados al variar la composición de la fase móvil (ácido-base, formación de complejos o pares iónicos, adición de complejos metal-ligando o reactivos quirales para separar los isómeros ópticos, etcétera). Objetivo general O R H C C N N H H O C C O R O C H C N + N Cu Cu N N C C O O Aminoácidos + Biuret Color violeta Figura 4-1. Reacción de la ninhidrina. La ninhidrina reacciona con los grupos alfa amino de los aminoácidos. Desarrollo experimental Experimento 1 Prueba de la ninhidrina Fundamento La ninhidrina reacciona de manera específica con el grupo alfa amino de los aminoácidos, sean libres o estén unidos mediante enlaces peptídicos. La ninhidrina a pH de 4 a 8 es un oxidante muy fuerte y siempre reacciona con los grupos alfa amino, liberando amonio; éste se condensa con la ninhidrina reducida y con otra molécula de ninhidrina, formando un compuesto coloreado que va del azul violeta al púrpura. En la figura 4-1 se muestra la reacción química de la ninhidrina con los aminoácidos. Reacción: Figura 4-1. Procedimiento 1. Numerar tres tubos de ensayo de acuerdo con el cua- dro 4-1. 2. En el tubo 1, colocar 1 ml de agua (blanco). 3. En el tubo 2, colocar 1 ml de solución de glicina (o cualquier otro aminoácido) a 1%. Seleccionar pruebas de laboratorio que permitan el estudio de las propiedades fisicoquímicas de aminoácidos y proteínas, además de su identificación. Objetivo específico 4. En el tubo 3, colocar 1 ml de solución de albúmina de huevo. Cuadro 4-1. Organización de los tubos de reacción y su contenido. Utilizar técnicas analíticas que permitan la identificación de aminoácidos en general, aminoácidos específicos y proteínas, en cualquier espécimen biológico. Material Biológico: Químicos: • Solución de albúmina de huevo (clara de huevo diluida 1:50) • Solución de glicina a 1% • Solución de ninhidrina a 0.2% • Agua destilada Agua destilada Glicina 1% Albúmina de huevo Reactivo (ninhidrina a 0.2%) 1 Blanco 1 ml — — 10 gotas 2 Patrón — 1 ml — 10 gotas 3 Problema — — 1 ml 10 gotas Tubo 31 Práctica 4. Aminoácidos y proteínas 5. Agregar a cada tubo 10 gotas de solución de ninhi- Material drina a 0.2%. 6. Mezclar y colocar en baño María durante 5 minutos. Resultados esperados Los tubos 2 y 3 deben presentar el color azul violeta que revela la presencia de aminoácidos. Biológico: Químicos: • Solución de albúmina de huevo (clara de huevo diluida 1:50) • Solución de fenilalanina a 1% • Reactivo de Biuret • Agua destilada Resultados obtenidos Procedimiento 1. Enumerar tres tubos de ensayo, de acuerdo con el cuadro 4-2. 2. En el tubo 1, colocar 2 ml de agua destilada (blanco). 3. En el tubo 2, colocar 2 ml de solución de fenilalanina (u otro aminoácido) a 1%. 4. En el tubo 3, colocar 2 ml de albúmina de huevo a 1%. 5. Añadir a cada tubo 2 ml del reactivo de Biuret. 6. Mezclar y observar. Resultados esperados Experimento 2 Prueba de Biuret Existen varias pruebas para la cuantificación de proteínas en muestras biológicas. La elección del método depende de varios factores; uno de ellos es la cantidad de proteínas en la muestra. Por ejemplo, si la cantidad se encuentra en el orden de los microgramos, es recomendable utilizar la prueba de Lowry. Por el contrario, en muestras en que la cantidad es mayor; la prueba de elección es la de Biuret. El tubo que contiene la proteína albúmina es el único que debe presentar coloración violeta, porque contiene enlaces peptídicos. Resultados obtenidos Fundamento La prueba de Biuret sirve para investigar la presencia de enlaces peptídicos, que representan uniones específicas entre los aminoácidos. Se basa en la formación de sales complejas de color violeta cuando se añade sulfato cúprico en solución alcalina. El complejo está formado por enlaces de coordinación, en que los pares electrónicos proceden de los grupos amino de los aminoácidos de la cadena polipeptídica (figura 4-2). Reacción Cuadro 4-2. Organización de los tubos de reacción y su contenido. Agua destilada Fenilalanina a 1% Albúmina de huevo a 1% Reactivo (Biuret) 1 Blanco 2 ml — — 2 ml 2 Patrón — 2 ml — 2 ml 3 Problema — — 2 ml 2 ml Figura 4-2. Tubo O O R C H+CO 2 H OH O + R C COOH OH NH 2 Ninhidrina + alfa aminoácido O 2H 2O O O OH + NH3 H O N= O - O Complejo coloreado + aldehído Figura 4-2. Reacción de Biuret. El reactivo de Biuret detecta la presencia de enlaces peptídicos. 32 Manual de prácticas de laboratorio de bioquímica Cuadro 4-4. Resultados obtenidos para absorbancia y concentración de proteínas totales. Experimento 3 Determinación de las proteínas totales del suero y la relación entre albúmina y globulina (A:G) Absorbancia Fundamento Blanco La prueba de Biuret permite determinar las proteínas totales del suero. La albúmina reacciona de manera específica con el colorante verde de bromocresol, por el método llamado “error proteínico de los indicadores”, formando una coloración verde proporcional a la concentración de la fracción de albúmina, que puede medirse con un espectrofotómetro. Las globulinas se calculan a partir de la diferencia entre la cantidad de las proteínas totales y la fracción de albúmina. Patrón Materiales Biológicos: Químicos: • Suero o plasma del voluntario • Suero humano, control multiparamétrico (labtrol, ortho, etc.) Concentración de proteínas totales g/dl Problema 1 Problema 2 Problema 3 Cálculos Absorbancia del problema Proteínas totales = × [patrón]* (g100 ml) Absorbancia del patrón *[ ] = Concentración • Solución de verde de bromocresol • Reactivo de Biuret • Agua destilada Determinación de albúmina 1. Disponer de tres tubos: blanco, patrón y problema, de acuerdo con el cuadro 4-5. 2. Mezclar y dejar que repose durante 15 minutos, a temperatura ambiente. Procedimientos 3. Medir la absorbancia del patrón y de la muestra a Determinación de proteínas totales 4. Ajustar a cero de absorbancia con el blanco. 5. Registrar los resultados de absorbancia y concentra- 630 nm. 1. Disponer de tres tubos: blanco, patrón y problema, de acuerdo con el cuadro 4-3. 2. Mezclar y dejar que repose durante 15 minutos a temperatura ambiente. 3. Ajustar a cero de absorbancia con el blanco (545 nm). 4. Medir la absorbancia del patrón y de la muestra y registrarlas en el cuadro 4-4. Cuadro 4-3. Organización de los tubos de reacción y su contenido. Blanco Patrón Problema Agua destilada 100 μl — — Suero problema — — 100 μl Suero control — 100 μl — 5 ml 5 ml 5 ml Reactivo de Biuret ción de albúmina en el cuadro 4-6. Cálculos Absorbancia del problema Albúmina (g100 ml) = Absorbancia del × [patrón] patrón Cuadro 4-5. Organización de los tubos de reacción y su contenido. Blanco Muestra Patrón 5 ml 5 ml 5 ml Suero problema — 20 μl — Suero control — — 20 μl 20 μl — — Solución de verde bromocresol Agua destilada Práctica 4. Aminoácidos y proteínas Cuadro 4-6. Resultados de absorbancia y concentración de albúmina. Absorbancia Concentración de albúmina g/dl Blanco 4. Dejar que seque. 5. Revelar las placas mediante la aplicación, sobre su superficie, de ninhidrina contenida en un atomizador. 6. Calcular la RF (relación de frentes) de cada mancha mediante la siguiente fórmula: RF = Patrón Problema 1 Distancia recorrida por el problema Distancia recorrida por el solvente Discusión Problema 2 Problema 3 Valores normales de referencia Proteínas totales: 6.0 a 8.0 g por 100 ml Albúmina: 3.5 a 5.5 g por 100 ml Globulinas: 1.5 a 2.5 g por 100 ml Experimento 4 Separación de aminoácidos por cromatografía en capa fina Fundamento Conclusiones Se extrae de una fase líquida móvil la sustancia que se quiere separar y se le retiene en una fase sólida. El fenómeno depende de adsorción por fuerzas de van der Waalls, puentes de hidrógeno o intercambio de iones. El método de la cromatografía consiste en extender el adsorbente deseado sobre una placa de vidrio o algún soporte. La gota de solución problema se aplica en un punto inicial conocido. La placa se coloca en una cámara cromatográfica cerrada, junto con un sistema de solventes adecuado. Por capilaridad, el solvente recorre la capa estacionaria y separa los componentes de la muestra. Después de la separación, se sacan las placas y, mediante la adición de ciertos reactivos, se revelan las manchas correspondientes a los aminoácidos y estándares. Procedimiento 1. En la cromatoplaca, colocar (con un tubo capilar) una gota de la mezcla de aminoácidos, de aminoácidos individuales, o ambos, a una distancia de 1 cm del borde. 2. Introducir la placa, con la línea de muestra hacia abajo, en la cámara de cromatografía que contiene el sistema de solventes:ácido acético:butanol:agua VV:30:50:10. Nota: verificar que la altura del solvente no exceda de 0.5 cm. 3. Cerrar la cámara y dejar en reposo, sin moverla. Sacar la placa cuando el solvente llegue a 1.5 cm del borde superior de ésta. Marcar con un lápiz la altura del solvente. 33 Actividades de aprendizaje 1. Nombrar los 10 aminoácidos esenciales. 34 Manual de prácticas de laboratorio de bioquímica 2. Investigar algunos alimentos, en especial de origen 5. Investigar por lo menos tres patologías ocasionadas vegetal, que no aporten alguno de los aminoácidos esenciales. por deficiencias en las enzimas metabolizadoras de los aminoácidos. 3. Investigar las causas de la hipoalbuminemia (dismi- nución de albúmina sérica). Preparación de reactivos a) Reactivo de Biuret 1. Pesar 3 g de sulfato de cobre, 12 g de tartrato de sodio y potasio tetrahidratado y 2 g de yoduro de potasio. 2. Añadir 100 ml de agua destilada y agitar hasta su dilución. 3. Añadir, con movimientos rotatorios constantes, 600 ml de hidróxido de sodio (NaOH) a 10%. 4. Diluir hasta 2 litros con agua destilada y mezclar. b) Solución de verde de bromocresol 4. Investigar qué otras pruebas de identificación de ami- 1. Verde de bromocresol 500 mg y NaOH al 10%. noácidos existen. Bibliografía Garzón de la Mora P. Manual de prácticas de bioquímica. Proyecto V, aminoácidos y su identificación en las proteínas, 2002:94-110. Pérez García G. Bioquímica: temas selectos y prácticas. Práctica 6 aminoácidos y proteínas. 1996:47-53. http:depa.fquim.unam.mx. Estructura de aminoácidos. [Revisado el 16 de septiembre de 2013] Práctica 5 Regulación no específica de la actividad enzimática • Irma Noemí Lúa Ramírez • Carmen Magdalena Gurrola Díaz Introducción Las enzimas son proteínas con capacidad de catalizar reacciones biológicas. Al igual que los catalizadores inorgánicos, las enzimas aumentan la velocidad con que se alcanza el equilibrio de la reacción. El mecanismo que permite que las enzimas incrementen la velocidad de la reacción es la reducción de la energía libre de activación requerida para transformar un sustrato al producto correspondiente, sin afectar la constante de equilibrio. v1 A+B C+D v2 Keq = La actividad de una enzima se evalúa de acuerdo con la velocidad de la reacción. La cinética enzimática estudia la velocidad de la reacción enzimática, los factores que la modifican y el mecanismo de la reacción. Los factores fisicoquímicos que modifican la actividad de la enzima son los siguientes: 1. 2. 3. 4. 5. 6. Concentración del sustrato. Concentración de la enzima. pH. Temperatura. Fuerza iónica. Inhibidores. [C][D] [A][B] A y B = Sustratos C y D = Productos v1 = Velocidad de la reacción para formar los productos v2 = Velocidad de la reacción para formar los sustratos Keq = Constante de equilibrio [ ] = Concentración molar. A continuación se presenta un resumen de las características que distinguen a una enzima: Es una proteína. Resulta muy específica para el sustrato. Incrementa la velocidad de la reacción. No modifica la constante de equilibrio (Keq). Se modifica de manera temporal, pero esta modificación no persiste al final de la reacción, ni forma parte de los productos. 6. Requiere condiciones óptimas para la catálisis. 1. 2. 3. 4. 5. • Patricia Heredia Chávez • Sergio Sánchez Enríquez Catalasa En esta práctica se utilizará la enzima catalasa como modelo para analizar algunos aspectos de la regulación no específica de la enzima (pH, temperatura, tiempo de reacción, concentración del sustrato y concentración de enzima). La catalasa es una hemoproteína que contiene cuatro grupos hemo. Además, posee actividad de peroxidasa, utiliza una molécula de peróxido de hidrógeno (H2O2) como sustrato donador de electrones y otra molécula de H2O2 como oxidante o aceptor de electrones. 2H2O2 g catalasa 2H2O + O2 La catalasa se encuentra en la sangre, la médula ósea, las mucosas, el riñón y el hígado. Su función es la destrucción del H2O2 formado por la acción de las oxidasas. Los microcuerpos, o peroxisomas, se encuentran en cuantiosos tejidos, incluido el hígado. En ellos abundan las oxidasas y la catalasa, lo que sugiere que tal vez haya una ventaja biológica en el agrupamiento de las enzimas que 36 Manual de prácticas de laboratorio de bioquímica producen H2O2 con la enzima que lo destruye. Además de las enzimas peroxisómicas, se debe considerar que los sistemas mitocondriales y microsómicos de transporte de electrones, además de la xantina oxidasa, son fuentes de H2O2. Objetivo general • Evaluar la actividad de la catalasa en presencia de reguladores no específicos. Objetivos específicos • Determinar el efecto del pH sobre la velocidad de reacción. • Identificar el efecto de la temperatura sobre la velocidad de la reacción. • Determinar el efecto de la concentración de sustrato y enzima sobre la velocidad de reacción. • Determinar el efecto del tiempo sobre la velocidad de reacción Materiales y equipo • • • • • • • • • • • • • • 8 matraces volumétricos de 25 ml Gradilla Pipetas graduadas de 1, 5 y 10 ml Micropipeta de 20 μl Matraz Erlenmeyer de 125 ml Probeta de 25 ml Jeringa de 3 ml Torniquete Torundas de algodón con alcohol etílico Tiras reactivas para medir pH Termómetro Vaso de precipitado de 250 ml Pipetor Recipiente con hielo Soluciones y reactivos • Ácido sulfúrico (H2SO4) a 2 N, que contiene 1 mg por ml de sulfato de manganeso (MnSO4) • Permanganato de potasio (KMnO4) a 0.05 N • Soluciones de sustrato: H2O2 a 0.24 % acidulada a pH 3, pH 7 y pH 9 Desarrollo experimental Preparación de la solución de catalasa 1. Obtener una muestra de sangre, con la técnica y los cuidados descritos en la práctica 1. Al mismo tiempo, otro estudiante debe colocar 25 ml de agua destilada (fría) en un matraz pequeño. Depositar 20 μl de sangre total en el matraz con agua fría y mantener la mezcla en baño de hielo. Esta etapa debe realizarse de prisa, porque la sangre se coagula en la pipeta si se deja más de medio minuto. Fundamento En cada experimento, la concentración de H2O2 se determina mediante titulación con estándar de KMnO4. La titulación de un tubo control por cada experimento sirve como medida de la concentración de peróxido al comienzo del experimento. La titulación del tubo experimental es una medida del peróxido remanente al final del experimento. La diferencia entre las dos titulaciones representa la cantidad de peróxido descompuesto. En este experimento, se considera que los miliequivalentes (meq) de peróxido descompuesto por unidad de tiempo son la medida de la actividad de la catalasa. Reacciones 2 H2O2 5 H2O2 + 2 KMnO4 + 6H 2 H2O + O2 5O2 + 2Mn++ + 8H2O Desarrollo Se evalúan el efecto de la concentración de sustrato, la concentración de la enzima, el pH, la temperatura y el tiempo en la actividad de la catalasa. Experimento 1 Efecto de la concentración de la enzima 1. Preparar una serie de matraces de acuerdo con el cua- dro 5-1. Los matraces tienen concentración fija de sustrato (H2O2) y concentración variable de catalasa. El matraz 1 es el control sin enzima. Después de colocar la enzima, todos los matraces deben dejarse en reposo por 5 minutos y en cuanto se detenga la reacción con el H2SO4 2 N (desnaturalizante). 2. Titular KMnO4 a 0.05 N, gota a gota, agitando después de la aplicación de cada gota hasta la aparición de un color rosa permanente. 3. Contar la cantidad de gotas necesarias para adquirir el color permanente. 4. Calcular, de la siguiente manera, los meq de H2O2 destruidos por la catalasa, por mililitro de sangre total: Se calcula la cantidad de meq de H2O2 (x) en las mezclas de reacción. Se considera H2O2 total en las mezclas de reacción con ausencia de catalasa y H2O2 remanente en las mezclas con presencia de catalasa. Para calcular los miliequivalentes (meq) de H2O2 en la titulación, se debe considerar que 1000 ml de KMnO4 a 0.05N contienen 0.05 eq o 50 meq (ver ejercicio de equivalencias en la Práctica 2). Práctica 5. Regulación no específica de la actividad enzimática 37 Cuadro 5-1. Organización y contenido de cada uno de los matraces para el experimento 1. Tubo H2O2 a pH 7 Catalasa 1 5 ml 0.0 ml 2 5 ml 0.10 ml 3 5 ml 0.20 ml 4 5 ml 5 5 ml H2SO4 a2N 5 ml 0.40 ml R E P O S O 0.80 ml 5 min 5 ml Titular (ml de KMnO4 a 0.05 N) meq de H2O2 no destruido meq de H2O2 destruido 5 ml 5 ml 5 ml De aquí se aplica la siguiente fórmula: Experimento 2 A (50 meq) x= 1 000 ml Efecto de la concentración de sustrato 1. Preparar una serie de matraces de acuerdo al cua- x = miliequivalentes de H2O2 A = ml de KMnO4 gastados en la titulación dro 5-2. 2. Calcular los meq de H2O2 destruidos, de acuerdo con 5. Calcular el H2O2 descompuesto: Y = H2O2 total − H2O2 remanente Y = H2O2 descompuesto 6. En los experimentos siguientes, realizar los mismos cálculos para obtener los meq de H2O2 no destruidos. 7. Graficar en papel milimétrico la cantidad de meq de H2O2 destruido contra la concentración de enzima. 8. Interpretar los resultados, explicando el comporta- lo ya descrito. Es necesario observar que en este caso se comparan el matraz 2 con el 1, el 4 con el 3 y el 6 con el 5. 3. Graficar en papel milimétrico la cantidad de meq de H2O2 destruidos en comparación con la concentración del sustrato. 4. Interpretar los resultados, explicando el comportamiento de la actividad de la enzima en función de la concentración del sustrato. miento de la actividad de la enzima en función de su concentración. Cuadro 5-2. Organización y contenido de cada uno de los matraces para el experimento 2. Tubo H2O2 pH 7 H2O Catalasa 1 5 ml — — 2 5 ml — 0.5 ml 3 2.5 ml 2.5 ml — 4 2.5 ml 2.5 ml 0.5 ml 5 1.25 ml 3.75 ml — 6 1.25 ml 3.75 ml 0.5 ml H2SO4 a2N R E P O S O 5 ml 5 ml 5 ml 5 ml 5 ml 5 min 5 ml Titular (ml de KMnO4 a 0.05 N) meq de H2O2 no destruido meq de H2O2 destruido 38 Manual de prácticas de laboratorio de bioquímica Cuadro 5-3. Organización y contenido de cada uno de los matraces para el experimento 3. Tubo H2O2 a pH 7 Catalasa Reposo H2SO4 a2N 1 5 ml — — 5 ml 2 5 ml 0.5 ml 1 min 5 ml 3 5 ml 0.5 ml 3 min 5 ml 4 5 ml 0.5 ml 5 min 5 ml 5 5 ml 0.5 ml 7 min 5 ml 6 5 ml 0.5 ml 10 min 5 ml Titular (ml de KMnO4 a 0.05N) meq de H2O2 no destruido Experimento 3 Experimento 4 Efecto del tiempo sobre la reacción Efecto de la temperatura sobre la velocidad de la reacción 1. Preparar una serie de matraces de acuerdo con el cua- dro 5-3. 2. Calcular los meq de H2O2 destruidos, restando los meq de H2O2 no destruidos de los tubos 2, 3, 4 y 5 a los meq de H2O2 no destruidos del tubo 1. 3. Graficar en papel milimétrico los meq de H2O2 destruidos por minuto en comparación con el tiempo. 4. Interpretar los resultados explicando el comportamiento de la actividad de la enzima en función del tiempo de reacción. meq de H2O2 destruido 1. Preparar una serie de matraces, de acuerdo con el cuadro 5-4. 2. Calcular los meq de H2O2 destruidos restando los meq de H2O2 no destruidos del tubo 2 a los meq de H2O2 no destruidos del 1; hacer lo mismo restando los del 4 a los del 3; los del 6 a los del 5 y los del 8 a los del 7. 3. Graficar en papel milimétrico los meq de H2O2 destruidos en comparación con la temperatura. 4. Interpretar los resultados explicando el comportamiento de la actividad de la enzima en función de la temperatura de reacción. Cuadro 5-4. Organización y contenido de cada uno de los matraces para el experimento 4. Tubo H 2O 2 a pH 7 Temp Catalasa H2SO4 a2N 1 5 ml 15°C 0.5 ml 5 ml 2 5 ml 15°C — 3 5 ml 25°C 0.5 ml 4 5 ml 25°C — 5 5 ml 40°C 0.5 ml 6 5 ml 40°C — 7 5 ml 60°C 0.5 ml 8 5 ml 60°C — R E P O S O 5 ml 5 ml 5 ml 5 ml 5 ml 5 min 5 ml 5 ml Titular (ml de KMnO4 a 0.05 N) meq de H2O2 no destruido meq de H2O2 destruido Práctica 5. Regulación no específica de la actividad enzimática Experimento 5 39 Discusión Efecto del pH sobre la velocidad de la reacción 1. Preparar una serie de matraces, de acuerdo con el cuadro 5-5. 2. Calcular los meq de H2O2 destruidos restando los meq de H2O2 no destruidos resultantes del tubo 2 a los del tubo 1; hacer lo mismo con los del 4 a los del 3; los del 6 al 5 y los del 8 al 7. 3. Graficar en papel milimétrico los meq de H2O2 destruido en comparación con el pH. 4. Interpretar los resultados explicando el comportamiento de la actividad de la enzima de acuerdo con el pH. Conclusiones Cuadro 5-5. Organización y contenido de cada uno de los matraces para el experimento 5. Tubo H2O2 5 ml Catalasa H2SO4 a2N 1 pH 3 0.5 ml 5 ml 2 pH 3 — 3 pH 5 0.5 ml 4 pH 5 — 5 pH 7 0.5 ml 6 pH 7 — 7 pH 9 0.5 ml 8 pH 9 — R E P O S O Titular (ml de KMnO4 a 0.05 N) meq de H2O2 no destruido meq de H2O2 destruido 5 ml 5 ml 5 ml 5 ml 5 ml 5 min 5 ml 5 ml Actividades de aprendizaje 1. Definir enzima, coenzima, cofactor y grupo prosté- tico. 2. Elaborar una lista de los radicales libres que se gene- ran en las células. 40 Manual de prácticas de laboratorio de bioquímica 3. Investigar el pH óptimo de la pepsina, la amilasa sali- Preparación de reactivos val, la fosfatasa alcalina y las hidrolasas lisosómicas. 1. Solución de H2SO4 a 2 N. Ácido sulfúrico (H2SO4; PM = 98; ρ = 1.89). En un matraz volumétrico de 1 L, depositar 600 ml de agua destilada y agregar poco a poco, por las paredes del matraz, 51.8 ml de H2SO4 mezclando en cada adición. Aforar a 1 L con agua destilada. 2. Solución de KMnO4 a 0.05 N. 4. Escribir 4 reacciones en que se genere H2O2 en la célula. a) Permanganato de potasio (KMnO4; PM = 158). En un matraz volumétrico de un litro, depositar 7 g de KMnO4, disolver en casi 400 ml de agua destilada. Una vez disuelta la sal, aforar a un litro con agua destilada. b) 3. Solución de H2O2 a 0.24% y pH de 3, 5, 7 y 9. c) Peróxido de hidrógeno (H2O2; PM 34). d) En un matraz volumétrico, verter 8 ml de H2O2 a 30% y aforar a un litro. Ajustar al pH requerido, utilizando NaOH o HCl, según sea el caso. 5. Explicar la utilidad de determinar la actividad enzi- mática en la clínica. Dar tres ejemplos: a) b) c) Bibliografía Garzón de la Mora P. Manual de prácticas de bioquímica. Proyecto VI: condiciones óptimas para medir una actividad enzimática, 2002:111-125. McKee T. Bioquímica, 3ª ed. Cap 6. Enzimas. McGraw-Hill, 2003:161-199. Práctica 5. Regulación no específica de la actividad enzimática 41 42 Manual de prácticas de laboratorio de bioquímica Práctica 5. Regulación no específica de la actividad enzimática 43 44 Manual de prácticas de laboratorio de bioquímica Práctica 5. Regulación no específica de la actividad enzimática 45 Práctica Metabolismo de carbohidratos 6 • Sergio Sánchez Enríquez • Mercedes Elvira González Hita • Luis Javier Flores Alvarado Introducción Los carbohidratos son las biomoléculas más abundantes de la naturaleza. Representan más de la mitad de todo el carbono orgánico y 0.3% del peso corporal en el ser humano. Además, proporcionan de 50 a 60% de la energía consumida por un individuo. Definición de carbohidrato Los carbohidratos son un grupo de biomoléculas orgánicas, entre las que se incluyen los azúcares, como la sacarosa, y los polisacáridos, como el almidón, el glucógeno y la celulosa, entre otros. En esencia, están compuestos por carbono, hidrógeno y oxígeno, en una proporción 1:2:1; por tanto, su fórmula general es Cn(H2O)n. Clasificación de los carbohidratos Los carbohidratos se clasifican de acuerdo con el número de monómeros que contiene en monosacáridos (un monómero), oligosacáridos (de 2 a 10 monómeros unidos por enlace glucosídico) y polisacáridos (más de 10 monosacáridos unidos). Los monosacáridos, de acuerdo con su grupo funcional, se dividen en aldosas (polihidroxialdehídos) y cetosas (polihidroxicetonas). A su vez, de acuerdo con la cantidad de carbonos que contienen, se subdividen en triosas, tetrosas, pentosas, hexosas y heptosas (de 2 a 7 carbonos, respectivamente). Funciones de los carbohidratos 1. Fuente energética principal (p. ej., la glucosa). 2. Estructura (como la celulosa en las plantas y la qui- tina en el exoesqueleto de los insectos). 3. Precursores de biomoléculas complejas, como los ribonucleótidos del ácido ribonucleico (como la ribosa) y los desoxirribonucleótidos (la desoxirribosa). 4. Almacén de energía, en forma de almidón en los vegetales y de glucógeno en los animales. Carbohidratos de la dieta El individuo puede ingerir los carbohidratos en forma de monosacáridos y disacáridos, también denominados azúcares simples, o de polisacáridos, denominados azúcares complejos. Los azúcares simples aumentan la glucosa sanguínea (glucemia) en mayor proporción y más rápido que los complejos. Por lo anterior, se recomiendan carbohidratos complejos en los pacientes con diabetes mellitus para “suavizar” los picos de hiperglucemia posprandial (después de la ingesta de alimentos). Por lo contrario, en pacientes con hipoglucemia, se recomienda la ingesta o administración intravenosa de azúcares simples, para aumentar la glucemia. Regulación de la glucemia e importancia biológica La concentración normal de glucosa en sangre (normoglucemia) es de 60 a 100 mg100 ml, aun durante los estados posprandial, de ayuno o de inanición. La insulina se encarga de disminuir la glucemia, al promover el ingreso de glucosa en las células, su utilización (glucólisis), su almacenamiento en hígado y músculo en forma de glucógeno (glucogénesis), y su transformación en triacilgliceroles en el tejido adiposo, entre otras acciones. Por otra parte, las hormonas contrarreguladoras de la insulina, como el glucagon, la adrenalina y los glucocorticoides, elevan la glucemia al activar la destrucción de glucógeno (glucogenólisis), la formación de glucosa a partir de lactato, aminoácidos y glicerol (gluconeogénesis), la degradación de triglicéridos (lipólisis) y la degradación de proteínas 48 Manual de prácticas de laboratorio de bioquímica (proteólisis), al mismo tiempo que reducen el empleo periférico de la glucosa. La homeostasis de la glucosa es fundamental, porque las neuronas, los eritrocitos y otras células del organismo utilizan glucosa como combustible principal, y las consecuencias del déficit o ausencia de glucosa en estos tejidos son catastróficas. Cuando el organismo pierde la capacidad de regular la glucemia, la glucosa plasmática se eleva. A este trastorno se le denomina diabetes mellitus. De acuerdo con la Norma Oficial Mexicana, “La diabetes mellitus es la enfermedad sistémica, crónico-degenerativa, de carácter heterogéneo, con grados variables de predisposición hereditaria, con participación de factores ambientales, que se caracteriza por hiperglucemia crónica, debido a la deficiencia en la acción o producción de insulina, lo que afecta el metabolismo intermedio de los carbohidratos, proteínas y grasas”. Categorías de la glucemia en ayuno 1. Glucosa plasmática en ayuno <100 mgdl (<5.6 mmolL) = glucosa normal. 2. Glucosa plasmática en ayuno ≥100 mgdl y ≤125 mgdl (5.6 a 6.9 mmolL) = glucemia anormal de ayuno (prediabetes). 3. Glucosa plasmática en ayuno ≥126 mgdl (≥7.0 mmolL) = diagnóstico provisional de diabetes. También se puede diagnosticar diabetes en hemoglobina glicada o glucosilada ≥6.5%, glucemia ≥200 mgdl durante una curva de tolerancia oral a la glucosa y glucemia casual ≥200 mgdl más signos y síntomas clásicos de diabetes. hiperinsulinemia) induce al desarrollo de un conjunto de alteraciones que evolucionan a otras enfermedades crónicas, como la diabetes mellitus y las enfermedades cardiovasculares. Por tanto, es importante detectar la RI de manera oportuna para evitar, en lo posible, el desarrollo de esas enfermedades. Existen varios métodos para el diagnóstico de resistencia. En esta práctica, se utiliza la medición de la concentración de insulina sanguínea en ayunas, como una expresión de la sensibilidad a la hormona (opcional). También se han propuesto diversas fórmulas para la estimación de RI; una de las más utilizadas es el análisis del modelo homeostático, más conocido como índice HOMA: HOMA-RI = [Concentración de insulina en ayuno (μUml) × Concentración de glucosa en ayuno mmolL] 22.5 La fórmula para el cálculo del HOMA, cuando se utilizan mgdl de glucosa, queda de la siguiente manera: [Concentración de insulina en ayuno (μUml) × Concentración de glucosa en ayuno mgdl] HOMA-RI = 405 En la práctica clínica cotidiana, los métodos más simples y económicos para estimar la RI son la concentración sanguínea de triglicéridos (TG) y el valor de la relación TGHDL − colesterol. Los puntos de corte son: • Nivel circulante de triglicéridos ≥ 130 mgdl. • Relación TGHDL-c ≥ 3.0 Evaluación antropométrica Hemoglobina glucosilada La elevación continua y prolongada de la glucemia, que es una característica de la diabetes, origina la glucosilación de las proteínas del organismo. Esta modificación química causa alteraciones en su función y su estructura, lo que tiene relevancia en las complicaciones crónicas de la diabetes. La hemoglobina glucosilada (HbA1c) y la albúmina glucosilada son las proteínas circulantes en sangre, con aplicación en el diagnóstico y pronóstico de la diabetes. La concentración de HbA1c se utiliza en la práctica clínica como un criterio de la calidad del control del paciente diabético en las 6 a 8 semanas previas a la prueba. Resistencia a la insulina La resistencia a la insulina (RI) se define como la disminución de la capacidad de la insulina para ejercer sus acciones biológicas en tejidos típicos de destino, como el músculo estriado, el hígado o el tejido adiposo. Como respuesta compensatoria, el páncreas produce hiperinsulinemia. La combinación de estas dos condiciones (RI e La antropometría es la técnica que se ocupa de medir las dimensiones físicas y la composición global del cuerpo humano en diferentes edades y estados fisiológicos. Como ventajas principales, se encuentran su sencillez y bajo costo. Las mediciones antropométricas permiten evaluar la composición corporal y hacer inferencias acerca del crecimiento y desarrollo físico, y del estado de nutrición del individuo. Cuando se evalúa la composición corporal, el peso normal se divide entre masa magra (80%) y masa grasa (20%). Los depósitos de grasa visceral están relacionados con el desarrollo de enfermedades crónicas, como resistencia a la insulina, diabetes mellitus y enfermedades cardiovasculares que representan las primeras causas de morbilidad y mortalidad en México y el mundo. En épocas recientes, se ha identificado que el diámetro de cintura tiene más valor, porque, al parecer, está relacionado con los depósitos de grasa visceral y las morbilidades debidas a la obesidad. En el cuadro 6-1 se muestran las mediciones antropométricas más utilizadas en la práctica clínica. 49 Práctica 6. Metabolismo de carbohidratos Cuadro 6-1. Medidas antropométricas y su aplicación en la práctica clínica. Medida Cuadro 6-2. Categorías de la presión arterial normal y de la hipertensión. Evalúa Peso Masa corporal total Estatura Longitud total del cuerpo Circunferencia de muñeca Índice cintura-cadera (ICC) Complexión Depósitos de grasa en la región abdominal Sistólica (mmHg) Diastólica (mmHg) Óptima <120 <80 Normal 120 a 129 80 a 84 Normal alta 130 a 139 85 a 89 Grado I (leve) 140 a 159 90 a 99 160 a 179 100 a 109 Categoría Hipertensión Índice de masa corporal (IMC) Desnutrición, sobrepeso y normalidad Grado II (moderada) Grado III (intensa) >180 >110 Panículo adiposo Espesor de la grasa debajo de la piel Sistólica aislada >140 <90 Sumatoria de panículos adiposos % de grasa corporal % del peso ideal (PI) Desnutrición, sobrepeso y normalidad % del peso habitual (PH) Desnutrición, sobrepeso y normalidad % de cambio reciente de peso (CRP) Riesgo de morbilidad y mortalidad Tomado de Journal of Hypertension (2003;21:1011-1053; Eur Heart J, 1998;19:1434-1503;1998) Objetivos específicos • Desarrollar las habilidades básicas de la antropometría. • Desarrollar habilidades para la toma de presión arterial. • Demostrar habilidades para la obtención y manejo de muestras sanguíneas. • Diferenciar los cambios de la glucemia en el estado pre y posprandial. • Determinar la glucemia utilizando tiras reactivas. Modificado de Trejo B. Evaluación del estado de nutrición. En: Pérez Lizaur AB, Marvan Laborde L. Manual de Dietas normales y terapéuticas, 5a ed. Prensa Médica Mexicana, 2005:57. Materiales y equipo Evaluación de la presión arterial La toma de la presión se utiliza para medir la fuerza o presión que ejerce la sangre en las paredes de las arterias. La sangre no fluye de forma continua, lo hace a borbotones y en oleadas que corresponden a cada latido del corazón. La presión tiene dos medidas: la presión sistólica es la máxima y la diastólica es la mínima; ambas se representan con cifras: 12080. La presión arterial puede presentar variaciones entre una persona y otra, además de variaciones durante el día. Por lo general, cuando una persona duerme, la presión tiende a disminuir; cuando tiene actividad física, a elevarse. La presión alta (hipertensión arterial) desencadena problemas cardíacos, renales, vasculares, etc. En el cuadro 6-2 se muestran los valores de la presión arterial normal y los diferentes grados de hipertensión. Objetivo general • Analizar la relación entre las mediciones antropométricas y la glucemia. • • • • • • • • • • • • • • • • • • • Cinta métrica flexible Báscula de pedestal con estadímetro Marcador de tinta indeleble (permanente) Jeringas desechables de 5 y 10 ml, o aguja y adaptador para vacutainer Tubo vacutainer rojo Torniquete Lancetas Torundas de algodón secas y con alcohol Tiras reactivas para glucosa Pipetas Pasteur Bulbos de látex para pipetas Pasteur Micropipetas de 20, 25, 50 y 200 μl Microtubos de 1.5 ml para centrífuga Gradillas para tubos de ensayo Gradillas para microtubos Pipetas de 5 ml Celdillas de 1 cm para espectrofotómetro Centrífuga clínica Espectrofotómetro de luz visible Soluciones y reactivos • Equipo (kit) para determinación enzimática de glucosa con patrón 50 Manual de prácticas de laboratorio de bioquímica Flujograma de las actividades de la práctica de metabolismo de carbohidratos gramos entre la estatura en metros elevada al cuadrado, como se muestra en la siguiente fórmula: IMC = Evaluación de laboratorio Evaluación clínica (para todos los alumnos) 1. Medir peso, talla y diámetro de cintura 2. Realizar tomas de presión arterial Extraer sangre venosa a tres voluntarios en estado de ayuno Cuantificar glucemia en ayuno utilizando tiras reactivas (el resto de los estudiantes) Cuantificar glucemia basal, 30 y 90 minutos pospandriales Figura 6-1. Flujograma de la práctica del metabolismo de carbohidratos. p t2 p = peso en kilogramos t = talla en metros Resultado _________ 4. Medir la circunferencia de cintura. La circunferencia de cintura (CC) se debe medir en centímetros, utilizando una cinta métrica (figura 6-2), mientras el individuo está parado en posición de firmes, con los brazos colgando del cuerpo y el abdomen descubierto. La cinta debe estar paralela al piso. Tomar como referencia la mitad de la distancia entre el borde costal inferior y el borde superior de la cresta ilíaca. Registrar la medida en centímetros y con una precisión de 0.1 cm. Resultado _________ Desarrollo experimental Procedimiento general (figura 6-1) A) Mediciones antropométricas Las mediciones antropométricas se realizarán de acuerdo con las normas antropométricas internacionales aplicadas por la International Society for the Advancement of Kinanthropometry (ISAK, 2001). Debe tomarse en cuenta que algunas de estas medidas se utilizan de nuevo en la Práctica 7. Todos los alumnos deben realizar las siguientes actividades, trabajando en binas o pares: 1. Medir el peso. El peso corporal se puede medir en báscula de pedestal o con la báscula de bioimpedancia con precisión de ±100 g. El sujeto debe quitarse los zapatos, quedarse con una cantidad mínima de ropa y colocar su cabeza en el plano de Frankfurt. 5. Medición de la circunferencia de cadera. La circunferencia de cadera (CCa) se puede medir en la misma posición que la CC. Realizar la medición, con la cinta métrica paralela al piso, en el nivel de ambos trocánteres mayores y pasando por la parte más prominente de los glúteos. Resultado _________ 6. Calcular el índice de cinturacadera (ICC). El ICC se obtiene al dividir la circunferencia de cintura entre la de cadera, de acuerdo con la siguiente fórmula: ICC = Circunferencia de la cintura Circunferencia de la cadera El ICC es útil para determinar si la grasa corporal está distribuida en el nivel central (abdominal, visceral o androide) o periférica (localizada en brazos y cadera o ginecoide). Es importante conocer esta Resultado _________ 2. Medir la talla. La estatura se puede medir con el estadímetro de la báscula de pedestal o de pared, con una precisión de ±0.5 cm. Medir con los sujetos descalzos y durante una inspiración profunda, mientras mantiene la cabeza en el plano de Frankfurt. Resultado _________ 3. Calcular el índice de masa corporal (IMC). El IMC (índice de Quetelet) es el parámetro más útil y práctico para determinar la condición nutricia de un individuo. Se obtiene al dividir el peso en kilo- Figura 6-2. Cinta métrica flexible para medición de circunferencias corporales. Práctica 6. Metabolismo de carbohidratos 51 distribución porque la grasa visceral se relaciona con mayor riesgo de alteraciones metabólicas y de enfermedades cardiovasculares. Resultado _______ B) Medición de la presión arterial Técnica práctica para la toma de presión arterial La persona que se va a evaluar debe estar sentada en posición cómoda, por lo menos durante 5 minutos, tranquila y sin hablar, con brazos y piernas relajados. • Colocar el brazo sobre el nivel del corazón, de manera que descanse sobre una mesa; si la persona está acostada, extender tan sólo el brazo. • Colocar el brazalete del baumanómetro alrededor del brazo sin ropa, por encima del codo. El brazalete no debe quedar muy apretado; se recomienda que quede suelto donde quepan dos dedos entre el brazo y el mango (figura 6-3). • Colocar el diafragma del estetoscopio en el lado interior de la hendidura del codo (figura 6-4). Insuflar con rapidez el brazalete del baumanómetro con la perilla (bombilla de hule), a una presión de 200 a 220 mmHg (si se insufla la banda con lentitud, se puede alterar la presión). Comenzar la libera- Figura 6-4. Técnica para tomar la presión arterial. Colocar el diafragma del estetoscopio en el lado interno de la hendidura del codo. Insuflar con rapidez el brazalete del baumanómetro con la perilla (bombilla de hule) a una presión de 200 a 220 mmHg; si se insufla el brazalete con lentitud se podría alterar la presión. Resultado de presión arterial (primera toma) ________ Presión arterial (segunda toma) _________ ción del aire poco a poco; es recomendable poner atención para escuchar el pulso del corazón, memorizar o anotar el número indicado en el marcador con el primer latido. Este número es la presión sistólica (máxima). Cuando el pulso se detenga al seguir desinflando la banda, anotar o memorizar una vez más el número indicado, que representa la presión diastólica (baja). Es recomendable dejar pasar por lo menos 3 minutos antes de tomar de nuevo la presión. Este procedimiento requiere cierta práctica. La arteria braquial es un vaso sanguíneo que va del hombro a debajo del codo. Esta arteria es la más utilizada para medir la presión. Figura 6-3. Localización del pulso antebraquial y colocación del brazalete del baumanómetro. Localizar con los dedos índice y medio el pulso de la arteria antebraquial. Colocar el brazalete del baumanómetro alrededor del brazo sin ropa, por encima del codo. La banda no debe quedar muy apretada; es recomendable dejarla tan suelta como para que quepan dos dedos entre el brazo y el mango. C) Extracción y procesamiento de muestras biológicas 1. Extraer, a tres voluntarios, una muestra de 5 ml de sangre venosa. Utilizar tubos vacutainer sin anticoagulante (de tapa roja). El estudiante que extraiga la muestra debe utilizar guantes de látex para su protección. 52 Manual de prácticas de laboratorio de bioquímica 2. Los estudiantes seleccionados deben ingerir un de- sayuno habitual en cuanto se les tomen las muestras basales; deben tomárseles nuevas muestras a los 30 y 90 minutos. 3. Centrifugar las muestras a 2 500 revoluciones por minuto (rpm) durante 5 minutos. 4. Con una pipeta Pasteur, aspirar el suero (líquido de color amarillo en la parte superior del tubo), teniendo cuidado de no aspirar el paquete celular (en el fondo del tubo y de color rojo). D) Determinación de la glucemia en ayuno y posprandial Cuadro 6-4. Resultados de glucemia en ayuno y posprandial. Voluntario 1 Tiempo Voluntario 2 Voluntario 3 Basal 30 minutos 90 minutos 120 minutos (condicionada) Fundamento En solución acuosa, la enzima glucosa oxidasa oxida a la glucosa para dar ácido glucónico y peróxido de hidrógeno. 1. En presencia de la enzima peroxidasa, el peróxido de hidrógeno reacciona con el fenol y la 4-aminofenazona, para formar un complejo de color rojo. 2. La intensidad de color desarrollada se relaciona de forma directamente proporcional a la concentración de la glucosa. 3. Se determina mediante espectrofotometría a una longitud de onda entre 460 y 560 nm, empleando un patrón de 100 mgdl de glucosa. Procedimiento A partir de las muestras obtenidas y procesadas de los tres estudiantes seleccionados, realizar el siguiente procedimiento: 1. Con el marcador indeleble, etiquetar tres tubos de 5. Después de 10 minutos, leer en el espectrofotómetro la absorbancia de cada tubo contra el reactivo de destino, a una longitud de onda de 520 nm. 6. Calcular la glucemia mediante la siguiente fórmula: Glucosa Absorbancia del problema Concentración × = del patrón (mgdl) Absorbancia del patrón 7. Valores esperados: 70 a 105 mgdl o 3.8 a 5.8 mmolL. 8. Realizar el mismo procedimiento después de desayu- nar y tomar muestras a los 30 y 90 minutos. Tomar una nueva muestra, a los 120 minutos, a los estudiantes que después de 90 minutos sigan con valores de glucemia entre 140 y 200 mgdl. Registrar en el cuadro 6-4 los resultados de glucemia de cada uno de los voluntarios: Con los datos obtenidos, realizar un cuadro comparativo de los valores de glucosa en ayuno y posprandial. ensayo, de acuerdo con el esquema del cuadro 6-3. 2. Añadir a cada tubo 2.5 ml de reactivo para glucosa. 3. Preincubar las muestras a 37ºC (con el calor de la Ayuno Pospandrial mano). 4. Agregar 20 μl (0.020 ml) de agua, suero o estándar a los tubos correspondientes y mezclar con suavidad. Cuadro 6-3. Organización y contenido de los tubos para medición de glucosa. Agua destilada Solución patrón Suero o plasma Reactivo No. 1 Blanco 20 μl — — 2.5 ml No. 2 Patrón — 20 μl — 2.5 ml No. 3 Problema — — 20 μl 2.5 ml Tubo E) Determinación de la glucosa sanguínea capilar utilizando tiras reactivas Fundamento Las tiras reactivas para glucosa son tiras plásticas con un cojinete impregnado con reactivos en un extremo. Contienen: • Glucosa oxidasa 0.6 U.I. • Peroxidasa 6.0 U.I. Práctica 6. Metabolismo de carbohidratos • Dihidrocloruro de orto-toluidina 0.0750 mg. • Ingredientes no reactivos 91 mg. Actividades de aprendizaje 1. Realizar una encuesta en que se registre edad, género, Procedimiento 1. Con una torunda impregnada en alcohol, limpiar el dedo que se va a puncionar. 2. Con una lanceta, puncionar el pulpejo o la yema del 2. dedo. 3. Obtener una gota de sangre al ejercer presión en el 4. 5. 6. 7. 8. 9. 10. dedo puncionado. Colocar la gota de sangre en el cojinete reactivo de la tira. Dispersar la gota de sangre sobre el área reactiva. Secar el excedente de sangre a los 30 segundos exactos, ejerciendo presión con papel facial en dos ocasiones (no frotar). Colocar la tira reactiva sobre el papel facial, con el cojinete hacia arriba. Esperar 90 segundos exactos. Realizar la lectura comparando con la carta de colores que está adherida al frasco. Anotar los resultados. NOTA: estas indicaciones pueden variar de acuerdo a la marca de la tira reactiva, por lo cual se sugiere siempre leer las indicaciones del frasco a utilizar. 53 3. 4. 5. peso, talla, IMC, circunferencia de cintura, circunferencia de cadera, ICC y glucemia de cada uno de los integrantes del grupo. Registrar en una base de datos de Excel los datos de la variables anteriores y sacar el promedio y la desviación estándar. Identificar la cantidad y el porcentaje de compañeros que tengan peso bajo, peso normal, sobrepeso, obesidad tipo I, tipo II y tipo III. Analizar qué porcentaje de compañeros tiene glucemia normal, hiperglucemia de ayuno o diabetes, de acuerdo con los criterios descritos en esta práctica. Dividir la base de datos por género y repetir de la acción 1 a la 4. a) ¿La frecuencia de alteraciones de peso (bajo, so- brepeso y obesidad) es mayor en hombres o en mujeres? b) ¿La frecuencia de alteraciones de la glucemia es mayor en hombres o en mujeres? Resultado de la glucemia capilar _________ Discusión Conclusiones 3. Realizar una evaluación propia y de la familia, incluyen- do cada uno de los datos solicitados en el cuadro 6-5. Contestar la encuesta del cuadro 6-6 y determinar cuál es el riesgo propio y de los familiares de desarrollar diabetes mellitus tipo 2. En caso de que el alumno o sus familiares tengan un puntaje mayor de 9, se sugieren cambios en los hábitos de alimentación (especificados por un nutriólogo de la unidad de síndrome metabólico del laboratorio de bioquímica) y un programa de ejercicio (caminata diaria de 30 minutos) para disminuir el riesgo de desarrollar diabetes y para mantenerse sanos. 4. En el cuadro 6-7 se muestran algunas pruebas clínicas y de laboratorio que orientan al grado de control metabólico de un paciente diabético. En caso de que se tenga un familiar con esta enfermedad, evaluar su grado de control metabólico. 5. De acuerdo con este cuadro, indicar cómo se considera el control metabólico del familiar o los familiares diabéticos: Adecuado _________________ Aceptable _________________ Deficiente _________________ Si el familiar tiene un control metabólico deficiente, se sugiere explicar la importancia de lograr un control adecuado. 54 Manual de prácticas de laboratorio de bioquímica Cuadro 6-5. Evaluación de factores de riesgo para diabetes en el entorno familiar del estudiante. Familiares Evaluación Estudiante Padre Madre Otros Presión arterial (mmHg) IMC (kgm2) Diámetro de cintura (cm) Uso de medicamentos antihipertensivos (síno) Último valor de glucosa (mgdl) Actividad física por semana (horas) Consumo de frutas y verduras a diario (síno) Cuadro 6-6. Calificación de riesgo para el desarrollo de diabetes mellitus tipo 2. Variable Puntaje Edad (años) 45 a 54 55 a 64 2 3 IMC (kgm2) Mayor de 25 y menor de 30 Mayor de 30 1 3 Circunferencia de cintura (cm) Hombres: 94 a <102 Mujeres: 80 a <88 Hombres: ≥102; mujeres: ≥88 3 3 4 Uso de medicamentos antihipertensivos (para presión alta) 2 Antecedentes de glucosa sanguínea alta 5 Actividad física menor a 4 horas por semana (individuos que trabajan sentados, no caminan mucho, que en su tiempo libre leen, ven televisión o no realizan labores físicas en el hogar) 2 Falta de consumo diario de frutas y vegetales 1 Total Estudiante Familiares Otros 0 a 20 Una calificación ≥9 significa riesgo alto de desarrollar diabetes mellitus (con 81% de sensibilidad y 76% de especificidad). La sensibilidad es la probabilidad de que la prueba sea positiva para sujetos que, en el futuro, pueden requerir tratamiento farmacológico por diabetes. (En este caso, 81% de las personas con calificación igual o mayor de 9 pueden requerir tratamiento farmacológico por diabetes en el futuro.) La especificidad es la probabilidad de que la prueba sea negativa en personas que no requieran tratamiento farmacológico en el futuro. (En este caso, es probable que 76% de las personas que tengan calificación menor de 9 no desarrollen diabetes tratada con fármacos.) Modificado de: Lindström J, et al. Diabetes Care, 2003;26:725-731. 55 Práctica 6. Metabolismo de carbohidratos Cuadro 6-7. Indicadores de control metabólico. Grado de control Indicador Adecuado Aceptable Deficiente Glucemia en ayunas (mgdl) 80 a 120 121 a 140 >140 Glucemia posprandial 2 h (mgdl) 80 a 160 160 a 180 >180 HbA1c % (hemoglobina glucosilada) 3a6 <7 >8 Colesterol (mgdl) <200 200 a 240 >240 Colesterol de LDL (mgdl) <100 100 a 129 >130 Colesterol de HDL (mgdl) >45 35 a 45 <35 Triglicéridos (mgdl) <130 150 a 250 >250 Relación TGHDL ≥3 <130 >130 Presión arterial (mmHg) <13085 >14090 Índice de masa corporal (kgm2) 20 a 25 >25 Colesterol no HDL (mgdl) Circunferencia de cintura (cm) Mujeres: <88 Hombres: <100 Modificado de American Diabetes Association 1998. Actividad complementaria Resolver el siguiente cuestionario: 3. ¿Cómo se espera que se encuentre la glucemia, la insulina y el glucagón en el estado de ayuno y posprandial? 1. Definir estado posprandial. 4. ¿Qué tipo de carbohidratos elevan menos la glucemia 2. ¿Cuál es la diferencia entre suero y plasma? del paciente diabético? Fundamentar la respuesta. 56 Manual de prácticas de laboratorio de bioquímica 5. ¿Cómo están los niveles de insulina sérica si la perso- na ingiere una dieta abundante en fructosa y por qué? Preparación de reactivos Reactivo para glucosa. Se prepara a temperatura ambiente con agua destilada o desionizada, libre de contaminantes. Al contenido de cada frasco, añadir la cantidad de agua indicada en la etiqueta. Una vez diluido, se tiene la composición del cuadro 6-8. Cuadro 6-8. Composición de reactivos. Ingrediente activo Concentración mínima aproximada Glucosa oxidasa (Aspergillus) 2 000 UL Peroxidasa (rábano picante) 1 250 UL 4-aminofenazona 2 mM Fenolato de sodio 10 mM Amortiguador de fosfatos Excipientes y estabilizadores 100 mM pH 7 ±0.2 Bibliografía 2003 European Society of Hypertension. European Society of Cardiology guidelines for the management of arterial hypertension. Journal of Hypertension, 2003;21:1011-1053. American Diabetes Association. Standards of Medical Care in Diabetes-2013. Diabetes Care, 2013;36:suppl 1:S11-S66. Garzón de la Mora P. Manual de prácticas de bioquímica. Anexo A del proyecto II. 2002:64-66. Islas Andrade SA, Revilla Monsalve C. Diabetes Mellitus, 3a ed. McGraw-Hill, 2005. Lindström J, Tuomilehto J. The diabetes Risk Score. A practical tool to predict type 2 diabetes risk. Diabetes Care, 2003;26:725-731. McLaughlin T, et al. Use of metabolic markers to identify overweight individuals who are insulin resistant. Ann Intern Med, 2003;139:802-809. Recommendations of the Second Joint Task Force of European and other Societies on Coronary Prevention. Prevention of coronary heart disease in clinical practice. European Heart Journal, 1998;19:1434–1503. SSA. Modificaciones a la Norma Oficial Mexicana NOM-015SSA2-1994. Diario Oficial de la Federación. México, 2000. Trejo B. Evaluación del estado de nutrición. En: Pérez Lizaur AB, Marvan Laborde L. Manual de dietas normales y terapéuticas, 5a ed. Prensa Medica Mexicana, 2005:5 Práctica Metabolismo de lípidos • Patricia Heredia Chávez • Irma Ramos Rodríguez Introducción Definición Los lípidos son uno de los principales grupos de biomoléculas de los seres vivos. Se definen como un conjunto de compuestos con heterogeneidad química que tienen en común su poca o nula solubilidad en agua y, por el contrario, su solubilidad en solventes orgánicos como éter y cloroformo, entre otros. Funciones Esa gran heterogeneidad estructural conlleva diversas funciones biológicas. Entre ellas se encuentran, por citar algunas: fuente y almacenamiento de energía (triacilgliceroles), reguladores metabólicos y fisiológicos (hormonas esteroideas y prostaglandinas), vitaminas liposolubles (A, D, E y K), emulsificantes (sales biliares) y estructura de las membranas celulares (fosfolípidos y colesterol). Importancia de la interacción de los lípidos con el agua El modo y el grado de interacción de estas biomoléculas con el agua también determinan aspectos importantes en los procesos biológicos; por ejemplo, el carácter anfipático de los fosfolípidos favorece la formación eficiente de micelas y bicapas. Por otra parte, el carácter apolar de los ácidos grasos y los triacilgliceroles requiere mecanismos específicos de transporte en la sangre, mediante la albúmina y las lipoproteínas plasmáticas. Metabolismo de los lípidos El organismo humano cuenta con la capacidad de sintetizar casi todas las moléculas lipídicas. Sin embargo, 7 • Mercedes Elvira González Hita • Sergio Sánchez Enríquez éste debe obtener de los alimentos algunas vitaminas liposolubles, además los ácidos grasos esenciales, como el linoleico (C18:9,12), de la familia omega 3, y el linolénico (C18:9,12,15), de la familia omega 6. El organismo humano tiene vías metabólicas, tanto anabólicas (síntesis de ácidos grasos, síntesis de triacilgliceroles, síntesis del colesterol, etc.) como catabólicas (lipólisis, oxidación de ácidos, oxidación de cuerpos cetónicos, etc.); la activación de las enzimas de estas vías reguladoras depende de la presencia de múltiples factores bioquímicos y fisiológicos, con el único fin de mantener la homeostasis (para conocer de manera detallada esta regulación, revísese el libro de texto). Consecuencias del exceso de grasa corporal La obesidad es el incremento del peso corporal debido al aumento en la grasa. De manera particular, la grasa localizada en la región visceral propicia diversas alteraciones metabólicas, sobre todo dislipidemias, hiperglucemia e hipertensión. Estas alteraciones se agravan con el envejecimiento y la continua elevación del peso corporal; además, la presencia de factores hereditarios, puede originar el síndrome metabólico (SM), que confiere riesgo para patologías crónico-degenerativas, como diabetes mellitus tipo 2 y enfermedades cardiovasculares, que en la actualidad son las primeras causas de morbilidad y mortalidad en México. El factor fisiopatológico central que vincula la obesidad con las patologías crónicas es la resistencia a la insulina, que se evalúa mediante distintos métodos. El clamp insulina-glucosa es el método más exacto; sin embargo, es costoso, complejo y requiere experiencia en la técnica. Métodos más prácticos y con buena correlación con el clamp son el modelo homeostático (índice HOMA-RI) 58 Manual de prácticas de laboratorio de bioquímica y el índice triacilglicerolescolesterol en lipoproteínas de alta densidad (TGHDL). Diversos organismos internacionales han establecido los criterios para el diagnóstico del SM, con base en la presencia de entidades clínicas en los sujetos afectados. En el caso de México, se ha reportado que los criterios del ATP III para el diagnóstico del SM resultan adecuados (cuadro 7-1). Esta práctica está dirigida a revisar la relevancia clínica de la concentración de lípidos en la sangre, como indicador bioquímico del estado de salud de un individuo y de la aplicación de los parámetros clínicos para la detección del síndrome metabólico. Objetivo general Analizar la relación entre las mediciones antropométricas y el perfil de lípidos. Cuadro 7-1. Definición del síndrome metabólico, de acuerdo con los criterios del ATP III.* Presencia de tres o más de los siguientes criterios: 1. Circunferencia de cintura: >102 cm en hombres y >88 cm en mujeres 2. Triglicéridos (TG) séricos: ≥1.7 mmolL (150 mgdl) 3. Presión sanguínea: ≥13085 mmHg 4. HDL-colesterol: <1.05 mmolL (40 mgdl) en hombres y <1.3 mmoldl (50 mgdl) en mujeres 5. Glucosa sanguínea: ≥6.1 molesL (110 mgdl) *NCEP-ATP III: the National Cholesterol Education Program’s Adult Treatment Panel IIl, mejor conocido como ATP III. Tomado de: Kahn R, Buse J. Diabetologia. ATPIII: adult treatment panel III, 2005;48:1684-1699. Desarrollo experimental Procedimiento general Objetivos específicos 1. Obtener el porcentaje de grasa mediante bioimpe- dancia. 2. Determinar la categoría de peso de acuerdo con el IMC. 3. Determinar el riesgo cardiovascular de acuerdo con el ICC. 4. Determinar la concentración sanguínea de colesterol total, HDL-colesterol y TG. 5. Calcular el valor del índice TGHDL. 6. Relacionar los cambios de concentración de colesterol y TG con la dieta. Materiales y equipo Para antropometría • Báscula de bioimpedancia Para las pruebas de laboratorio • Espectrofotómetro • 8 tubos de ensayo de 13 × 100 • Gradilla para tubos de ensayo • 10 tubos de ensayo de 18 × 150 con tapón • Pinzas para tubo de ensayo • Microtubos cónicos • Parafilm • 10 pipetas serológicas de 5 ml • Micropipetas de 20 μl • Puntas para micropipeta • Vaso de precipitado de 200 ml • Estufa • Termómetro • Agujas para vacutainer verdes y negras • Adaptador vacutainer • Tubos vacutainer de tapa roja y morada • Torniquete • Torundas de algodón con alcohol Los alumnos deben trabajar en binas para realizar las mediciones antropométricas uno al otro. Después deben tomar muestras de sangre, centrifugarlas y obtener el suero o plasma para cuantificar los lípidos. Experimento 1 MEDIDAS ANTROPOMÉTRICAS A) Clasificación del peso corporal de acuerdo con el IMC. A partir del valor de IMC calculado en la Práctica 6, identificar y resaltar o subrayar en qué categoría de peso se encuentra el alumno, de acuerdo con los puntos de corte del cuadro 7-2. Para la interpretación adecuada del IMC se debe considerar si el individuo es de talla baja, si cursa algún estado fisiológico como el embarazo, si presenta aumento de peso a expensas de masa muscular (fisicoculturistas o Cuadro 7-2. Clasificación del peso de acuerdo al IMC.* Criterio Bajo peso Punto de corte 18.50 Peso normal 18.50 a 24.99 Sobrepeso 25.00 a 29.99 Obesidad I 30 a 34.99 Obesidad II 35 a 39.99 Obesidad III (mórbida) *OMS. 40 Práctica 7. Metabolismo de lípidos Cuadro 7-3. Clasificación del riesgo cardiovascular de acuerdo con el ICC. Grado de riesgo Bajo Medio Alto Mujeres: ≥0.80 Hombres: ≥0.90 B) Clasificación del riesgo cardiovascular, de acuerdo con el ICC. A partir del ICC calculado en la práctica 6, identificar y resaltar o subrayar en qué categoría de riesgo se encuentra el alumno, de acuerdo con los puntos de corte del cuadro 7-3. C) Medición del porcentaje de grasa corporal mediante bioimpedancia eléctrica. El fundamento de la bioimpedancia se describe en la Práctica 1. Procedimiento 1. Oprimir el botón naranja y enseguida el verde. Al 3. 4. 5. 6. 7. Género Porcentaje de grasa normal Masculino 15 a 18 Femenino 20 a 25 <0.73 fisicoconstructivistas) y si se trata de niños o personas de edad avanzada (en ambos casos, existen tablas más apropiadas para su evaluación). 2. Cuadro 7-4. Porcentaje de grasa corporal normal de acuerdo con el género. Punto de corte del ICC Mujeres: 0.73 a 0.79 Hombres: 0.73 a 0.89 presentar la opción 1, elegirla oprimiendo de nuevo el botón naranja. Aparecen dos opciones de manera intermitente: adulto y niño. Elegir la adecuada con el botón verde y aceptar con el botón naranja. Cuando aparezcan las siluetas de una mujer y un hombre, elegir la opción adecuada, con el mismo procedimiento del paso anterior. Una vez programada la báscula con la edad y sexo del paciente, sólo falta registrar la estatura en centímetros. Para ello, oprimir el botón verde hasta completar la medida deseada y aceptar con el botón naranja. Queda una señal intermitente en los números de la pantalla. Cuando se borren, oprimir el botón que se encuentra al pie de la báscula y que tiene el número 1. Cuando la báscula marque 0.0 kg, es el momento indicado para pesar al paciente. Éste debe encontrarse descalzo; además, deben hacerse las plantas de los pies con una torunda impregnada en alcohol, para retirar cualquier resto de polvo, sudor o grasa. La primera lectura indica el peso en kilogramos del paciente, seguida por el porcentaje de grasa corporal. 59 La báscula se apaga de manera automática después de que el paciente descienda de ella. Resultado % de grasa _________ . D) Clasificación del porcentaje de grasa de acuerdo con el género. Una vez hecha la medición de grasa mediante impedancia, se debe identificar si el porcentaje obtenido es normal, bajo o alto, de acuerdo con el género (cuadro 7-4). Actividades de aprendizaje 1. Registrar el porcentaje de grasa de cada uno de los in- tegrantes del grupo. 2. Identificar el número y el porcentaje de compañe- ros que tienen obesidad visceral, de acuerdo con el ICC. 3. Identificar el número y el porcentaje de compañeros que tienen alto riesgo cardiovascular, de acuerdo con el ICC. 4. Dividir la base de datos por género. a) ¿Quiénes tienen más grasa corporal, los hombres o las mujeres? b) ¿Quiénes tienen más frecuencia de riesgo cardio- vascular, los hombres o las mujeres? 3. Escribir las conclusiones de acuerdo con los resul- tados. 60 Manual de prácticas de laboratorio de bioquímica 4. ¿Qué acciones se podrían establecer para normalizar principio, a colest-4-en-3-ona y peróxido de hidrógeno. 3. El peróxido de hidrógeno se combina con fenol y 4-aminoantipirina para formar un cromóforo, en cantidades directamente proporcionales a la concentración de colesterol en la muestra. El aumento en la concentración de quinoneimina provoca uno correspondiente en la absorbancia a 500 nm, lo que permite el cálculo de la concentración del colesterol. las variables alteradas? Procedimiento 1. Obtener la muestra de sangre, de casi 5 ml, de volun- Experimento 2 INDICADORES BIOQUÍMICOS A) Determinación cuantitativa del colesterol sérico. 2. Significado clínico La cuantificación del colesterol en suero sirve como indicador de las funciones hepática y biliar, la absorción intestinal, el riesgo de enfermedades cardiovasculares, las funciones tiroideas y las enfermedades arteriales. Las concentraciones de colesterol son importantes en el diagnóstico y la clasificación de hiperlipoproteinemias. De la misma manera, la concentración del colesterol varía de acuerdo con la dieta, el estrés, la edad, el género, el peso corporal, el equilibrio hormonal, la actividad física y el embarazo. 6. Metodología 7. Método enzimático colorimétrico de punto final, que se basa en la formulación de Allain y colaboradores, además de la modificación hecha por Roeschlau. 8. 3. 4. 5. tarios en ayuno de 12 horas. Utilizar el sistema vacutainer o jeringa y colocar la muestra en tubos secos, sin anticoagulante (tapa roja). Es importante que quien tome la muestra se proteja con guantes de látex y siga la norma para toma de muestras (práctica 1, Obtención y manejo de muestras biológicas). Centrifugar las muestras a 3 500 rpm durante 5 minutos, teniendo los cuidados referidos en el apartado de centrifugación de la Práctica 1. Para esto, se necesitan muestras de suero o plasma de un voluntario en ayuno de 12 horas. Organizar los tubos, marcarlos con tinta indeleble, de acuerdo con lo indicado en el cuadro 7-5. Una vez colocados los reactivos, mezclar y dejar en reposo por 10 minutos a 37°C o 15 minutos a temperatura ambiente. Ajustar el espectrofotómetro a 500 nm de longitud de onda y calibrar con el blanco hasta obtener absorbancia cero. Leer la absorbancia de cada muestra, lavando la celdilla con agua destilada entre cada medición. Registrar en el cuadro 7-6 los resultados de la absorbancia de cada muestra. Realizar los cálculos de la concentración de colesterol, de acuerdo con la siguiente fórmula: Absorbancia del Concentración Concentración problema de patrón × del colesterol = Absorbancia del (mgdl) (mgdl) patrón) Fundamento 1. La colesterol esterasa (CE) hidroliza los ésteres de co- lesterol, mediante enzimas, a colesterol y ácidos grasos libres. 2. La acción de la enzima colesterol oxidasa (CO) oxida al colesterol libre, incluido el que se encontraba al 9. Registrar en el cuadro 7-6 los resultados de concen- tración de colesterol para cada muestra. Cuadro 7-5. Organización de los tubos y su contenido para determinación de colesterol. Tubo Agua destilada Solución patrón Suero o plasma Reactivo 1 Blanco 20 μl — — 2.0 ml 2 Patrón — 20 μl — 2.0 ml 3, 4, 5,… Problema 1, 2, 3, … — — 20 μl 2.0 ml Práctica 7. Metabolismo de lípidos Cuadro 7-6. Resultados de absorbancia y concentración de colesterol para cada muestra. Tubo Valor de absorbancia 61 4. Investigar las causas de hipercolesterolemia. Concentración de colesterol total (mg/dl) 1 Blanco 2 Patrón 3 Problema 1 4 Problema 2 5. Investigar las opciones de tratamiento para la hiper- 5 Problema 3 colesterolemia. Actividades de aprendizaje 1. De acuerdo con el fundamento, escribir en el cuadro las estructuras químicas correspondientes: Ésteres de colesterol —— (CE) Colesterol + O2 — + Colesterol-4-en-3-ona + H2O2 H2O2 + 4-aminoantipirina + Fenol-Peroxidasa cromógeno quinoneimina + H2O 6. Investigar cuál es la enzima reguladora de la síntesis de colesterol. 2. Comparar los resultados propios y de los compañe- ros contra los valores de referencia (140 a 200 mgdl) y describir si alguno tuvo el colesterol alto o bajo. 7. Investigar cuál es la enzima a la que inhiben los medi- camentos utilizados para reducir el colesterol. 8. ¿Cuál es la reacción normal propiciada por la enzima a la que inhiben los medicamentos que disminuyen la concentración del colesterol sérico? 3. Investigar cuáles enfermedades se relacionan con la concentración elevada de colesterol (hipercolesterolemia). B) Determinación de la concentración sérica de triacilgliceroles (TG). Significado clínico Los triacilgliceroles son una familia de lípidos compuestos por una molécula de glicerol y por tres ácidos grasos. Sus fuentes son la dieta y la síntesis endógena a partir 62 Manual de prácticas de laboratorio de bioquímica 3. Organizar los tubos, marcarlos con tinta indeleble de carbohidratos. Su cuantificación es importante para el diagnóstico y tratamiento de las hiperlipidemias. Estas enfermedades suelen ser de origen genético o secundarias a otros trastornos como nefrosis, diabetes mellitus y padecimientos endocrinos. Se ha identificado que el aumento de los TG es un factor de riesgo para ateroesclerosis y enfermedades cardiovasculares. 4. 5. Metodología 6. Método enzimático colorimétrico de punto final (Trinder). Este procedimiento se basa en el método de Wako y en las modificaciones de McGowan y colaboradores y de Fossati y colaboradores. 7. 8. Fundamento según corresponda a blanco, patrón o problema 1, 2, 3, etcétera (cuadro 7-7). Una vez colocados los reactivos, mezclar y dejar en reposo por 10 minutos a 37°C o durante 15 minutos a temperatura ambiente. Ajustar el espectrofotómetro a una longitud de onda de 500 nm y calibrar con el blanco hasta obtener absorbancia cero. Leer la absorbancia de cada muestra, lavando la celdilla con agua destilada entre cada medición. Registrar en el cuadro 7-8 los resultados de la absorbancia para cada muestra. Realizar los cálculos de la concentración de TG de acuerdo con la siguiente fórmula: Absorbancia del Concentración problema Concentración de del colesterol = × patrón (mgdl) Absorbancia del (mgdl) patrón) 1. La lipasa hidroliza los TG mediante enzimas a ácidos grasos libres y glicerol. 2. La adenosina trifosfato (ATP) fosforila al glicerol, en presencia de glicerol cinasa, para dar glicerol-3-fosfato y adenosina difosfato (ADP). 3. La enzima glicerol fosfato oxidasa oxida al glicerol-3fosfato para dar dihidroxiacetona fosfato y peróxido de hidrógeno. 4. En una reacción colorimétrica tipo Trinder catalizada por la peroxidasa, el peróxido reacciona con 4-aminoantipirina y 3,5-dicloro-2-hidroxibencen-sulfonato para producir un color rojo. La absorbancia de este cromógeno, es proporcional a la concentración de TG presentes en la muestra. 9. Registrar los resultados de concentración de TG para cada muestra en el cuadro 7-8. Actividades de aprendizaje 1. De acuerdo con el fundamento de esta determina- ción, escribir en el cuadro las estructuras químicas correspondientes: Triacilgliceroles + H2O — lipasa Glicerol + — GK Procedimiento 1. Obtener la muestra de sangre, de casi 5 ml, de los + + 2. ¿Cuál es la función principal de los TG? voluntarios que estén en ayuno de 12 horas. Utilizar el sistema vacutainer o jeringa y colocar la muestra en tubos secos, sin anticoagulante (tapa roja). Los alumnos que tomen la muestra deben protegerse con guantes de látex y seguir la norma para toma de muestras referidas en la Práctica 1. 2. Centrifugar las muestras a 3 500 rpm durante 5 minutos, aplicando los cuidados referidos en la práctica 1, apartado de la centrifugación. Para esta determinación, se requiere de muestras de suero o plasma de un voluntario en ayuno de 12 horas. Cuadro 7-7. Organización de los tubos y su contenido para determinación de TG. Tubo Agua destilada Solución patrón Suero o plasma Reactivo 1 Blanco 20 μl — — 2.0 ml 2 Patrón — 20 μl — 2.0 ml 3, 4, 5,… Problema 1, 2, 3, … — — 20 μl 1.0 ml Práctica 7. Metabolismo de lípidos 6. Investigar cuáles son las opciones de tratamiento Cuadro 7-8. Resultados de absorbancia para cada muestra. Tubo Valor de absorbancia 63 para la hipertrigliceridemia. Concentración de TG (mg/dl) 1 Blanco 2 Patrón 3 Problema 1 4 Problema 2 5 Problema 3 7. Investigar cuál es la enzima reguladora de la síntesis de TG. 3. Comparar los resultados de los compañeros contra los valores de referencia (≤150 mgdl) y describir si alguno tuvo TG altos o bajos. 8. Investiga el mecanismo que utilizan los fibratos para disminuir los TG. 4. Investigar cuáles enfermedades se relacionan con la concentración elevada de TG (hipertrigliceridemia). C) Determinación cuantitativa del HDL-c sérico. Significado clínico 5. Investigar las causas de la hipertrigliceridemia. Las HDL participan en la captación de colesterol de los tejidos y en su transporte hacia el hígado, donde se eliminan en forma de ácidos biliares. Por esta razón, al colesterol HDL se le ha denominado colesterol “bueno”: cuando su concentración es mayor de 40 mgdl en el hombre o de 50 mgdl en la mujer tiene efecto cardioprotector (disminuye el riesgo de infarto cardiaco). Por el contrario, existe una correlación positiva entre concentraciones bajas de colesterol HDL en plasma e incidencia de ateroesclerosis, base fisiopatológica del infarto del miocardio y de accidentes cerebrovasculares. Existen diversos estados patológicos o factores ambientales relacionados con concentraciones reducidas de HDL: enfermedades hepatocelulares agudas o crónicas, hiperalimentación intravenosa, malnutrición intensa, diabetes, anemia crónica, alteraciones mieloproliferativas, enfermedad de Tangier, analfalipoproteinemia, estrés agudo, algunos medicamentos y tabaquismo. 64 Manual de prácticas de laboratorio de bioquímica Cuadro 7-9. Organización de los tubos y su contenido para determinación de HDL-c. Agua destilada Patrón HDL-c (S) Sobrenadante muestra Reactivo A (kit de colesterol) 1 Blanco 100 μl — — 1.0 ml 2 Patrón — 100 μl — 1.0 ml 3 Problema — — 100 μl 1.0 ml Tubo La concentración del colesterol HDL se puede aumentar si se realiza actividad física de manera regular, se aumenta la ingesta de ácidos grasos insaturados o se usan algunos fármacos. Metodología Método enzimático colorimétrico de punto final. Este procedimiento se basa en el método de Burstein y colaboradores, y en las modificaciones de Grove y colaboradores de aislamiento de lipoproteínas por precipitación. Precipitación 1. En un tubo, pipetear 200 μl de la muestra y 500 μl del 2. 3. 4. Fundamento Las lipoproteínas de muy baja densidad (VLDL) y las lipoproteínas de baja densidad (LDL) presentes en la muestra (suero o plasma), se precipitan en presencia de fosfotungstato y iones de magnesio. El sobrenadante contiene las lipoproteínas de alta densidad (HDL); de éste, el colesterol se cuantifica con espectrofotometría mediante las siguientes reacciones acopladas; 5. 6. 7. colesterol colesterol + H2O esterasa esterificado colesterol + ácido graso 8. colesterol colesterol + ½ O2 + H2O oxidasa colestona + H2O2 2 H2O2 + 4-aminoantipirina + fenol quinonaimina + 4H2O peroxidasa Reactivos • El frasco A es el reactivo compuesto por fosfotungstato (0.4 mmolL) y cloruro de magnesio (20 mmolL). • El frasco S es el patrón de colesterol HDL (15 mgdl). • Reactivos adicionales: reactivo de colesterol. • Los reactivos y el patrón están listos para su uso. 9. 10. reactivo A del kit de colesterol HDL. Nota: se pueden modificar los volúmenes de la muestra y el reactivo, siempre y cuando se conserven las proporciones. Agitar bien y dejar en reposo durante 10 minutos a temperatura ambiente. Centrifugar durante 10 minutos a un mínimo de 4 000 rpm en la microcentrífuga refrigerada a 20ºC. El sobrenadante debe ser claro por completo. En el caso de persistir la turbidez o de no obtener una buena sedimentación del precipitado, agregar otros 500 μl del reactivo A, mezclar bien y centrifugar de nuevo. Multiplicar el resultado por 1.7 para corregir la dilución efectuada. Atemperar el reactivo (kit de colesterol) a temperatura ambiente. Pipetear en tubos de ensayo de acuerdo con lo descrito en el cuadro 7-9. Agitar bien e incubar los tubos durante 30 minutos a temperatura ambiente (16 a 25ºC) o durante 10 minutos a 37ºC. Ajustar el espectrofotómetro a 500 nm de longitud de onda y calibrar con el blanco hasta obtener absorbancia cero. Leer la absorbancia de cada muestra, lavando la celdilla con agua destilada entre cada medición. Registrar en el cuadro 7-10 los resultados de la absorbancia para cada muestra. Cuadro 7-10. Resultados de absorbancia para cada muestra y concentración de HDL. Tubo 1 Blanco 2 Patrón 3 Problema 1 Procedimiento 4 Problema 2 Obtener suero o plasma con el procedimiento estándar, ya descrito. 5 Problema 3 Valor de absorbancia Concentración de HDL (mg/dl) Práctica 7. Metabolismo de lípidos 11. Realizar los cálculos de la concentración de HDL de acuerdo con la siguiente fórmula: 65 3. Investigar los mecanismos que hacen que la actividad física aumente la concentración de HDL-c. Absorbancia del Concentración problema Concentración de × patrón (mgdl) del colesterol = Absorbancia del (mgdl) patrón) 12. Registrar en el cuadro 7-10 los resultados de concen- tración de HDL para cada muestra. Valores de referencia Las concentraciones de colesterol HDL varían de manera considerable con la edad y el sexo. Se han recomendado los siguientes valores discriminantes para identificar a individuos con elevado riesgo de enfermedad de las arterias coronarias: Hombres: <40 mgdl Mujeres: <50 mgdl Riesgo alto de enfermedad coronaria >60 mgdl Riesgo bajo de enfermedad coronaria 4. Investigar por qué los ácidos grasos insaturados au- mentan la concentración de HDL-c. Actividades de aprendizaje 1. Comparar los resultados de los compañeros contra los valores de referencia. 5. Investigar cuáles fármacos o medicamentos aumen- tan la concentración de HDL. 2. ¿Qué riesgo cardiovascular tienen estos compañeros, de acuerdo con la concentración de HDL? D) Cálculo del índice TGHDL. Emplear la siguiente fórmula: Valor del índice = Concentración de TG (mgdl) Concentración de HDL-c (mgdl) Valores de referencia Punto de corte para establecer la posibilidad de resistencia a la insulina: ≥3.0. 66 Manual de prácticas de laboratorio de bioquímica Actividades de aprendizaje Discusión 1. Analizar los resultados a partir de los valores de re- ferencia proporcionados. Conclusiones 2. De acuerdo con los resultados del índice TGHDL, identificar si los compañeros tienen o no resistencia a la insulina. Bibliografía 3. Hacer recomendaciones a los compañeros que pudie- ran tener un valor elevado del índice de TGHDL. Khan R, Buse J, Ferranini E, Stern M. The Metabolic Syndrome: Time for a Critical Appraisal. Diabetes Care, 2005:28(9):2289-2304. Product data sheet, Triglyceride-G code No 997-69801. Dallas Tx: Wako Pure Chemical Industries Ltd. Roeschlau P, Bernat E, Gruber WA. Clin, chem Clin: biochem, 1974;12(226). Sánchez-Iglesias A, Fernández-Lucas M, Teruel JL. Fundamentos eléctricos de la bioimpedancia. Nefrologia, 2012;32(2):133-135. The International Society for the Advancement of Kinanthropometry (ISAK). 2001. http:www.isakonline.comint [Consultado el 1 de diciembre de 2013.] Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III Report). Actualización 2004. World Health Organization. Obesity and overweight. http: www.who.int [Consultado el 1 de diciembre de 2013.] Práctica Metabolismo de compuestos nitrogenados • Irma Noemí Lúa Ramírez • María Rosalba Ruiz Mejía • Beatriz Teresita Martín Márquez Introducción Se denomina sustancias o compuestos nitrogenados a las biomoléculas que contienen nitrógeno, ya sea macromoléculas o productos de desecho. Las macromoléculas nitrogenadas con mayor importancia biológica son los ácidos nucleicos y las proteínas; sus precursores son las bases nitrogenadas y los aminoácidos. Otros compuestos nitrogenados son las porfirinas, que se encuentran en la hemoglobina, la mioglobina, los citocromos y la catalasa, entre otras moléculas. Los productos del catabolismo de los ácidos nucleicos, las proteínas y el grupo hemo son el ácido úrico, la urea y la bilirrubina, respectivamente. La creatinina proviene del catabolismo de la fosfocreatina, que se forma a partir de tres aminoácidos (arginina, metionina y glicina) y, por tanto, se le puede considerar como producto del catabolismo de las proteínas. No es posible eliminar del organismo el amoníaco producido por el catabolismo de los aminoácidos; por tanto, es necesario transformarlo en urea en el hígado. Hay varios compuestos nitrogenados más que se obtienen de la incorporación de grupos amino en los carbohidratos y en lípidos (galactosamina, glucosamina, esfingomielina y lecitina), pero no se estudian en esta práctica. Al ácido úrico, la creatinina y la urea se les elimina en la orina y constituyen casi 93% de los compuestos nitrogenados presentes en ésta. El resto lo conforman el amoníaco y otras sustancias. La mayor parte del nitrógeno se excreta como urea. Dentro de los tejidos, es necesaria la desaminación de los aminoácidos destinados al metabolismo energético para proporcionar el esqueleto carbonado. Existen tres mecanismos para la eliminación del grupo amino de los aminoácidos: transaminación, desaminación oxidativa y eliminación de una molécula de agua por una deshidratasa (serina o treonina deshidratasa). 8 • Luis Javier Flores Alvarado • Sergio Sánchez Enríquez La histidina pierde el grupo amino mediante una histidasa. Por último, el glutamato libera amoníaco por desaminación oxidativa. Al amoníaco se le transporta al hígado, donde se combina con CO2 y ATP para formar carbamoil fosfato, que se transforma en urea mediante el ciclo de la urea. Cuando el hígado carece de la capacidad de formar urea debido a una disfunción hepática provocada, por ejemplo, por cirrosis hepática, el amoníaco pasa a la circulación general y provoca daños al sistema nervioso central, que desembocan en coma hepático y, en última instancia, la muerte. Balance nitrogenado En un adulto, se llega a un balance nitrogenado, cuando la cantidad de nitrógeno ingerido es igual a la del eliminado. El balance nitrogenado debe ser positivo durante el crecimiento del individuo o cuando se desea aumentar la masa muscular, y negativo cuando se tiene una alimentación con un contenido proteínico deficiente o cuando se ingiere una cantidad suficiente de proteína y calorías pero con deficiencia en un aminoácido esencial. También se presenta balance negativo por enfermedad debilitante en la que se presenta un aumento del catabolismo proteínico, como se observa en el cáncer, la tuberculosis pulmonar o durante el periodo posoperatorio. Para medir el balance nitrogenado, se debe tomar en cuenta la cantidad de nitrógeno consumida por las proteínas y eliminada por la orina, sobre todo en forma de urea. Sin embargo, también se debe tomar en cuenta el nitrógeno en heces, que representa el nitrógeno no absorbido, y la urea eliminada por el sudor, sobre todo durante el ejercicio intenso. A partir de estudios preliminares en que no se tomó en cuenta que los sujetos que realizaban ejercicio intenso eliminaban urea en el sudor, se llegó a la conclusión errónea de que no se utilizaban proteínas durante el ejercicio. 68 Manual de prácticas de laboratorio de bioquímica Urea Una fracción importante de las proteínas se transforma en urea, como producto de la desaminación de los aminoácidos en el hígado, mediante un proceso denominado ciclo de la urea. La urea se elimina en la orina a través de un proceso complejo que tiene lugar en el riñón y que incluye filtración, secreción, reabsorción y, por último, excreción. La cuarta parte de la urea se metaboliza en los intestinos para formar amoníaco y dióxido de carbono mediante la actividad de la flora bacteriana normal. Más adelante, este amoníaco se reabsorbe del sistema portal y se convierte de nuevo en urea en el hígado. Las concentraciones sanguíneas de urea varían de manera proporcional al contenido de la dieta, al catabolismo de las proteínas durante la degradación tisular y a la función hepática. En personas sanas y que ingieren una dieta promedio, la concentración de urea en sangre es un indicador muy sensible de la función renal. Las concentraciones sanguíneas de urea se elevan antes que se produzca cualquier alteración en las concentraciones de creatinina. Se encuentran concentraciones elevadas de urea en plasma como consecuencia de una dieta rica en proteínas, aumento en el catabolismo de las proteínas, hemorragia gastrointestinal, ligera deshidratación, choque, insuficiencia cardíaca o tratamiento con glucocorticoides (uremia prerrenal). La uremia posrenal se debe a trastornos que obstruyen el flujo urinario: nefrolitiasis, tumor o hipertrofia prostática. La utilidad de la urea como indicador de la función renal está limitada por la variabilidad de su concentración plasmática, como consecuencia de factores no renales. Ácido úrico El ácido úrico es el producto final del catabolismo de las bases púricas (adenina y guanina). Casi todo el ácido úrico se forma en el hígado y en la mucosa intestinal. Se excreta sobre todo a través del riñón; se le filtra en el glomérulo y 98% de él se reabsorbe en el túbulo contorneado proximal. La cantidad eliminada cada día en la orina suele ir de de 250 a 750 mgdl. La excreción varía en función de la ingesta de purinas, el catabolismo endógeno, la insuficiencia renal, la cetoacidosis y el uso de diuréticos. Cuando se eleva la concentración de ácido úrico en plasma, casi siempre se relaciona con una patología, como insuficiencia renal, con procesos de regeneración acelerada y amplia destrucción celular, como en las leucemias y otras neoplasias, con el uso de diuréticos y, sobre todo, con gota primaria o secundaria. Existen cuantiosos alimentos que son fuentes exógenas de purinas (hígado, levadura, alcachofas, riñones, sardinas, etc.) y que, por tanto, llevan a la producción de ácido úrico. Su ingestión tiende a aumentar la cantidad diaria excretada de ácido úrico (uricosuria), más que la uricemia, siempre y cuando la función renal sea normal. Aunque la síntesis de los nucleótidos de purinas y su catabolismo o degradación tienen lugar en todos los tejidos, el urato sólo se sintetiza en los tejidos que contienen xantina oxidasa, sobre todo el hígado y el intestino delgado. La síntesis de urato varía en función del contenido de purinas en la dieta y de la velocidad de biosíntesis, degradación y ahorro de purinas. En condiciones normales, entre dos terceras y tres cuartas partes del urato sintetizado se eliminan a través del intestino. De 8 a 12% del urato filtrado por el glomérulo se excreta en la orina, en forma de ácido úrico. La concentración plasmática de urato varía de acuerdo con la edad y el sexo. La patología genética más frecuente relacionada con elevación de ácido úrico en plasma es la deficiencia adquirida de hipoxantina guanina fosforribosil transferasa. La deficiencia congénita de esta enzima da lugar al síndrome de Lesch Nyhan, que consiste en hiperuricemia con daño neurológico importante. Para el diagnóstico clínico, no debe considerarse el resultado de un ensayo único, sino que debe integrar datos clínicos y de laboratorio. Bilirrubina Los dos principales pigmentos biliares son la bilirrubina y la biliverdina. Se originan en el sistema reticuloendotelial, incluidas las células de Kupffer del hígado y otras células reticuloendoteliales que retiran a los eritrocitos de la circulación. Durante la destrucción de los eritrocitos, se libera hemoglobina; una vez degradada ésta, es posible utilizar de nuevo la globina (parte proteínica) de manera íntegra o aprovechando los aminoácidos que la constituyen. A la fracción porfirínica (grupo hemo) se le desintegra en las células reticuloendoteliales del hígado, el bazo y la médula ósea. Durante la degradación del hemo, se libera hierro y se abre el anillo porfirínico de cuatro grupos pirrólicos, para formar el primer pigmento biliar, la biliverdina. A su vez, la biliverdina se convierte, por reducción, en bilirrubina. La bilirrubina formada en los tejidos se asocia con la albúmina sérica, constituyendo la bilirrubina indirecta, no conjugada, insoluble en agua. En esta forma, la sangre la transporta hacia el hígado, donde las células hepáticas, mediante la acción de la enzima glucuronil transferasa, conjugan la bilirrubina con ácido glucurónico, formando diglucurónido de bilirrubina: bilirrubina directa, conjugada, hidrosoluble. Más adelante, los hepatocitos la segregan en el conducto hepático, que se une con el conducto cístico procedente de la vesícula biliar para formar el colédoco; por ello, se le excreta con la bilis en el intestino delgado, donde el colédoco descarga su contenido. Al llegar al intestino, la bilirrubina se libera del glucurónido y, en un paso posterior, las bacterias intestinales lo reducen hasta 69 Práctica 8. Metabolismo de compuestos nitrogenados urobilinógeno y estercobilinógeno (grupo de urobilinógenos). Enseguida, el intestino absorbe parte del urobilinógeno, que pasa a la sangre y regresa al hígado; allí, las células hepáticas lo absorben y secretan, sin modificar, con la bilis, lo que constituye el ciclo enterohepático del urobilinógeno. Al resto se le excreta, sobre todo en las heces, como urobilinógeno fecal, estercobilinógeno (de 40 a 280 mg diarios), y en la orina (de 0 a 4 mg en 24 horas). Cuando se le expone al aire, el urobilinógeno se oxida y pasa a urobilina. Creatinina La síntesis de la creatina tiene lugar en el hígado a partir de tres aminoácidos: glicina, arginina y metionina. La enzima hepática aminotransferasa forma el radical amidina de la arginina para fijarlo al nitrógeno de la glicina (guanidinoacético). Una transmetilasa que utiliza el metilo de la 5-adenosil-metionina, metila la glucociamina sobre el nitrógeno central, formando la creatina (figura 8-1). La sangre transporta la creatina hasta los músculos, donde mantiene un equilibrio con la fosfocreatina (fosfágeno), y representa una fuente de energía inmediata para volver a formar el ATP, cuando a éste se le transforma en ADP con la contracción muscular. Cada día, casi 2% de la creatina corporal se convierte en creatinina; los músculos no pueden utilizar ésta y se le elimina en la orina. 1 H N NH 3 2 O O 2 NH 3 O NH 2 L-arginina 1 O NH 2 1 Objetivo general • Identificar algunos productos nitrogenados que se encuentran en la sangre y se excretan en la orina. Objetivos específicos • Medir la concentración de urea en suero de sujetos normales mediante un método colorimétrico. • Cuantificar la concentración de ácido úrico en plasma mediante un método espectrofotométrico. • Identificar por medio de un método semicuantitativo la presencia de bilirrubina en la orina. Materiales y equipo • Kit para la determinación de urea • Kit para la determinación de ácido úrico • Tiras reactivas para identificación de metabolitos en orina • Centrífuga clínica • Pipeta graduada de 5 ml • Tubos de ensayo • Gradilla • Espectrofotómetro • Jeringas desechables • Torniquete • Torundas con alcohol • Vasos de precipitado • Palillos de madera o pipetas Pasteur • Plato caliente • Etiquetas • Micropipeta de 0.02 ml Glicina Aminotransferasa 2 O Desarrollo experimental O H N 1 NH 2 Acetato de guanidino NH 3 2 1 1 NH 3 O NH 2 O L-ornitina O O Creatincinasa Determinación de urea por color Fundamento Transmetilasa 2 Experimento 1 La urea presente en el suero origina, de acuerdo con las reacciones descritas a continuación, un indofenol coloreado que se cuantifica mediante espectrofotometría. CH 3 N NH 2 NH 2 1 ATP O 2 CH3 N O ADP H 2 N P O O NH 2 O 2 Creatina Urea + H2O O H3C NH NH Creatinina ureasa NH4+ + Salicilato + NaCIO 2NH4+ + CO2 nitroprusiato indofenol 1 Fosfocreatina (PCr) Muestra Eliminación por vía renal Figura 8-1. Vía metabólica para la síntesis de creatinina. Suero, plasma (no hemolizado) u orina. La urea en suero o plasma es estable durante 7 días a temperatura de 2 a 8°C. Se recomienda la heparina como anticoagulante. 70 Manual de prácticas de laboratorio de bioquímica Cuadro 8-1. Organización y contenido de los tubos para determinar concentración de urea. Tubo Blanco Patrón Muestra Patrón de urea (S) — 10 μl — Muestra — — 10 μl 1 ml 1 ml 1 ml Reactivo (A) Determinación de ácido úrico uricasa/peroxidasa Fundamento El ácido úrico presente en la muestra origina, de acuerdo con las reacciones acopladas que se describen a continuación, un complejo coloreado que se cuantifica mediante espectrofotometría. Ácido úrico + O2 + 2H2O Procedimiento 1. Atemperar los reactivos a temperatura ambiente. 2. Pipetear en tubos de ensayo, de acuerdo con el cua- dro 8-1. Agitar bien e incubar los tubos durante 10 minutos a temperatura ambiente (16 a 25°C) o durante 5 minutos a 37°C. 3. Pipetear, de acuerdo con el cuadro siguiente: Reactivo (B) Experimento 2 Blanco Patrón Muestra 1 ml 1 ml 1 ml 4. Agitar bien e incubar los tubos 10 minutos a tempe- ratura ambiente o (16 a 25°C) durante 5 minutos a 37°C. 5. Leer la absorbancia (A) del patrón y de la muestra, a 600 nm, frente al blanco. El color es estable durante 2 horas. 6. Calcular la concentración de urea en la muestra a partir de la siguiente fórmula general: AMuestra × CPatrón × Factor de dilución de la muestra APatrón = CMuestra Si se utiliza para calibrar, el patrón de urea suministrado, Urea sérica = (Amuestra Apatrón) × 50 = mgdl Resultado _________ Valores de referencia Suero y plasma: 15 a 39 mgdl de urea = 7 a 18 mgdl = 2.5 a 6.5 mmolL de urea. En el periodo neonatal, las concentraciones son inferiores; en personas mayores de 60 años, se encuentran valores superiores a los de adultos. Las concentraciones también tienden a ser un poco mayores en hombres que en mujeres. uricasa Alantoína + CO2 + H2O2 2H2O2 + Aminoantipirina + DCFS Quinonaimina + 4H2O peroxidasa Muestra Suero o plasma (no hemolizado) u orina. El ácido úrico en suero o plasma es estable durante 7 días a 2 a 8°C. Los anticoagulantes como heparina, EDTA, oxalato o fluoruro, no interfieren. Procedimiento 1. Atemperar el reactivo a temperatura ambiente. 2. Pipetear en tubos de ensayo de acuerdo con el cua- dro 8-2. Agitar bien e incubar los tubos durante 10 minutos a temperatura ambiente (16 a 25°C) o durante 5 minutos a 37°C. 3. Leer la absorbancia (A) del patrón y la muestra, a 520 nm, frente a blanco. El color es estable durante 30 minutos, por lo menos. 4. Calcular la concentración de ácido úrico en la muestra a partir de la siguiente fórmula general: AMuestra × CPatrón × Factor de dilución de la muestra APatrón = CMuestra Si se utiliza para calibrar, el patrón de ácido úrico suministrado, el ácido úrico sérico = (AMuestra APatrón × 6 = mgdl Resultado _________ Valores de referencia Suero y plasma: Hombres: 3.5 a 7.2 mgdl = 210 − 420 μmolL Mujeres: 2.6 a 6.0 mgdl = 150 − 350 μmolL Es recomendable que cada laboratorio establezca sus propios intervalos de normalidad. Práctica 8. Metabolismo de compuestos nitrogenados Cuadro 8-2. Organización y contenido de los tubos para determinar concentración de ácido úrico. Tubo Blanco Patrón Muestra 25 μl — — Patrón de ácido úrico (S) — 25 μl — Muestra — — 25 μl 1 ml 1 ml 1 ml Agua destilada Reactivo (A) Actividades de aprendizaje 1. Investigar y completar el siguiente cuadro. Parámetros Densidad Experimento 3 Identificación de metabolitos en orina con tira reactiva Fundamento El análisis de orina se realiza con pruebas secas listas para su empleo; se trata de tiras recubiertas de reactivos inmovilizados en un soporte plástico. Al sumergir la tira en la muestra de orina, se inicia una reacción que proporciona un producto coloreado. La lectura se efectúa frente a una escala de color estandarizada. 71 pH Resultados obtenidos Valores normales Patología relacionada con la alteración 1.000 a 1.030 5y6 Leucocitos Negativos Nitritos Negativos Proteínas Negativos Glucosa Normal Cuerpos cetónicos Negativos Urobilinógeno Negativo Bilirrubina Negativa Sangre Negativa 2. Investigar qué medicamento inhibe a la enzima xanti- na oxidasa y para qué enfermedad se utiliza. Muestra Orina. Procedimiento 1. Emplear orina fresca y no centrifugada. Mezclar bien 2. 3. 4. 5. la muestra. La orina a analizar no debe tener más de 4 horas de emitida. Sumergir la tira reactiva por un instante (1 segundo como máximo) en la orina. Al retirarla, rozar el canto lateral del borde del recipiente para eliminar el exceso de orina. Después de 60 segundos (zona de leucocitos después de 60 a 120 segundos) comparar el color de reacción con la escala cromática. Los cambios de color que aparecen en el margen de las zonas reactivas o después de más de 2 minutos, carecen de importancia diagnóstica. Las coloraciones rosas más débiles deben valorarse como hallazgos positivos, es decir, patológicos. 3. Investigar cuáles son las causas de la hiperbilirrubi- nemia. 72 Manual de prácticas de laboratorio de bioquímica 4. Completar el siguiente cuadro de las porfirias (en- Discusión fermedades por alteraciones en la síntesis del grupo hemo). Enfermedad Enzima deficiente Manifestaciones clínicas Tratamiento Conclusiones 5. Investigar cuáles son los productos terminales de la degradación de las pirimidinas (citosina, timina y uracilo). Bibliografía Bayardo Pérez B. Apuntes de Análisis Clínicos. Facultad de Ciencias Químicas, 1978:32-33. Baynes JW, Dominiczak MH. Bioquímica Médica, 2a ed. Elsevier Mosby, 2006:251 y 328. Borel JP. Bioquímica dinámica. Síntesis de creatina y fosfocreatina. Ed Médica Panamericana, 1989:677-678. Garzón de la Mora P. Proyecto X metabolismo de substancias nitrogenadas. 2002:159-167. McKee T. Bioquímica. Metabolismo del Nitrógeno I y II, 3a ed. Cap 14 y 15. McGraw-Hill, 2003:502-529. Práctica Extracción de DNA de células vegetales • Sonia Uribe Luna • Irma Noemí Lúa Ramírez • María Rosalba Ruiz Mejía Introducción Los ácidos nucleicos son polímeros de nucleótidos unidos por enlaces fosfodiéster. Por su composición química, se han clasificado en dos tipos: ácido desoxirribonucleico (DNA) y ácido ribonucleico (RNA). Los nucleótidos que forman al DNA están constituido por el azúcar 2′-desoxirribosa unido mediante enlace éster a ácido fosfórico y mediante enlace N-glucosídico a una de las cuatro bases nitrogenadas (adenina, guanina, timina o citosina). Los nucleótidos del DNA forman una hélice constituida por dos hebras antiparalelas que se mantienen unidas mediante puentes de hidrógeno. Para empaquetarse, el DNA se une a nucleoproteínas, denominadas histonas; y cuando se quieren separar estos componentes, se aplica tratamiento con ácidos o con concentraciones altas de sales. Los nucleótidos del RNA se encuentran formados por el azúcar ribosa, unida mediante enlace glucosídico a una de cuatro bases nitrogenadas (adenina, guanina, uracilo o citocina), formando moléculas de una sola cadena. La función del DNA es la de almacenar y transferir la información genética que conforma a un organismo y a su descendencia. El genoma de un individuo comprende la totalidad de la información genética contenida en el DNA. El DNA junto con los tres tipos de RNA (rRNA, tRNA y mRNA) participa en la biosíntesis ordenada de los componentes de la célula, codificando la expresión espacio temporal de las proteínas y respondiendo a los estímulos del medio ambiente. El genoma se encuentra organizado en forma diferente en las células procarióticas y eucarióticas; en estas últimas presenta un mayor grado de complejidad. El genoma de las células procarióticas está integrado dentro de 9 • Mercedes Romero Gómez • Sergio Sánchez Enríquez una sola molécula de DNA circular, dispuesta de modo compacto en una zona nuclear denominada nucleoide. El tamaño del genoma bacteriano se puede ejemplificar con el de Escherichia coli; tiene 1 360 nm y se encuentra constituido por 4 700 kilopares de bases (kpb). El genoma de las células eucarióticas se encuentra organizado en cromosomas, que son estructuras de DNA relacionadas con proteínas básicas, a las que se les denomina histonas, y proteínas no histonas; las histonas tienen carga positiva a pH fisiológico y neutralizan las cargas negativas del fosfato de los nucleótidos, lo que confiere estabilidad y permite que el DNA que mide casi 2 metros de longitud se empaquete en un núcleo de 10 μm de diámetro. El genoma humano está constituido por 46 cromosomas y contiene 5 × 106 kpb en su totalidad. De acuerdo con el tipo de célula en estudio, para aislar los ácidos nucleicos es necesario romper la membrana y la pared celular mediante métodos físicos, químicos o enzimáticos, para liberar las moléculas de DNA al medio extracelular. A partir de esto, la purificación de los ácidos nucleicos se realiza mediante la extracción de las proteínas y los lípidos con solventes orgánicos, y su recuperación, en un paso posterior, al precipitarlos con alcohol (isopropanol o etanol). En la actualidad, se obtiene DNA de diferentes tipos de células; bacterias, linfocitos, hepatocitos, espermatozoide humano y de otros mamíferos, células vegetales, etcétera. Objetivo general • Aislar e identificar el DNA extraído del germen de trigo. 74 Manual de prácticas de laboratorio de bioquímica Objetivos específicos • Obtener DNA de germen de trigo. • Identificar el DNA mediante la reacción de la difenilamina. tración de cloruro de sodio en el amortiguador CSC hace que el DNA se precipite en presencia de alcohol y a baja temperatura. Obtención de DNA de germen de trigo 1. Colocar en el congelador (−20ºC) un vaso de precipi- Materiales y equipo • • • • • • • • • • • • • • Mortero con pistilo Vasos de precipitado de 250 ml Vaso de precipitado de 125 ml Pipetas de 1, 5 y 10 ml Centrífuga Tubos de centrífuga de 13 × 100 Gasa Varilla de vidrio o cucharita de plástico Hielo Plato caliente Embudo Probeta de 25 ml Etanol de 96º frío Agua destilada Soluciones y reactivos • • • • • • • • • • • • • Amortiguador SAS Solución de TRIS a 0.4 M y pH 8.5 Lauril sulfato de sodio a 4% en agua vv EDTA salino a pH 8 Amortiguador CSC Difenilamina Ácido sulfúrico concentrado Citrato de sodio Cloruro de sodio Sacarosa Cloruro de magnesio Mercaptoetanol Ácido acético glacial tado que contiene 100 ml de etanol absoluto. 2. Pesar 5 g de germen de trigo y colocarlo en un morte- 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. ro. Agregar al mortero un trocito de hielo y moler el germen hasta que el material quede macerado. Transferir el germen molido a un vaso de precipitado y agregar 20 ml de amortiguador SAS y un trozo de hielo. Congelar y dejar reposar durante 10 minutos. Descongelar bajo el chorro de agua de la llave. Transferir el homogeneizado a tubos de ensayo, a través de una gasa doble, y exprimir el material. Centrifugar el filtrado durante 10 minutos a 3 000 rpm y desechar el sobrenadante. Resuspender el botón en 5 ml (para todos los tubos) de solución amortiguadora Tris, pH 8.5. Pasar el contenido a un vaso de precipitado de 100 ml. Agregar 0.5 ml de EDTA salino. Añadir 5 ml de lauril sulfato de sodio. Agregar 1 ml de amortiguador CSC y mezclar. Verter el contenido de la mezcla anterior, con mucha lentitud, por la pared de un vaso de precipitado que contenga 100 ml de etanol enfriado a −20ºC. Nota: En este paso, el DNA forma una nata blanquecina como resultado de su precipitación con el etanol. Pasar la nata con la varilla de vidrio o la cucharita de plástico a un tubo de ensayo. Actividad de aprendizaje Desarrollo experimental Realizar el diagrama de flujo del procedimiento para la obtención del DNA. Experimento 1 Obtención del DNA de germen de trigo Extracción del DNA Fundamento El germen de trigo se muele con el objetivo de obtener partículas más finas y destruir las nucleasas del DNA. El siguiente objetivo consiste en romper la pared celular, lo que se lleva a cabo al agregar la solución amortiguadora SAS. Posteriormente se fija para obtener células más disgregadas, se centrifuga para obtener un botón que contiene las células, que se mantienen en una solución amortiguadora. Se agrega un detergente como el lauril sulfato de sodio, para emulsificar las membranas lipídicas. En la siguiente etapa, se utiliza EDTA y citrato de sodio, que son quelantes de Ca++ y Mg++, respectivamente; estos cationes estabilizan las nucleoproteínas. La alta concen- Práctica 9. Extracción de DNA de células vegetales Anote las observaciones, explicando el proceso realizado y el aspecto del material obtenido. 75 Discusión Experimento 2 Identificación de la desoxirribosa Fundamento Se basa en la reacción del azúcar desoxirribosa, presente en el DNA, con el reactivo difenilamina, que forma un complejo azul en condiciones ácidas. Conclusiones Procedimiento 1. En un tubo de ensayo de 15 ml, colocar la nata de DNA obtenida a partir del germen de trigo y lavarla de manera cuidadosa con agua destilada para eliminar el exceso de alcohol. 2. Agregar 5 ml del reactivo de difenilamina. 3. Poner el tubo de ensayo en baño de agua hirviendo durante 8 minutos. 4. Observar la coloración. Actividad de aprendizaje Realizar el diagrama de flujo del procedimiento para la identificación de la desoxirribosa. Identificación de la desoxirribosa Preparación de reactivos 1. Amortiguador SAS. Pesar: • 1.21 g de TRIS (hidroximetil amino metano). • 17.1 g de sacarosa. • 0.5 g de MgCl2. Disolver cada compuesto en agua destilada utilizando vasos de precipitado, de manera individual. Vaciar las diluciones anteriores en un matraz volumétrico al que se añaden 1.75 ml de mercaptoetanol y aforar con agua a un litro. 76 Manual de prácticas de laboratorio de bioquímica 2. Solución de TRIS a 0.4 M. Pesar 48.4 g de TRIS (hidroximetil amino metano), disolver y aforar a un litro con agua destilada, ajustando a un pH de 8.5. 3. Lauril sulfato de sodio a 4%. Pesar 20 g de lauril sulfato de sodio, disolver en agua destilada y aforar en un matraz volumétrico de 500 ml. Disolver cada compuesto en agua destilada utilizando vasos de precipitado de manera individual. Vaciar las diluciones anteriores en un matraz volumétrico y aforar a 500 ml. 6. Difenilamina. Disolver 5 g de difenilamina en 500 ml de ácido acético glacial, agregar 14 ml de ácido sulfúrico concentrado. 4. EDTA salino. Pesar: • 18.6 g de EDTA (etilendiamino tetraacético). • 4.25 g de NaCl. Disolver cada compuesto en agua destilada utilizando vasos de precipitado de manera individual. Vaciar las diluciones anteriores en un matraz volumétrico de 500 ml. Aforar con agua destilada y ajustar la solución a un pH de 8. 5. Amortiguador CSC. Pesar: • 22 g de citrato de sodio. • 43.8 g de NaCl. Bibliografía McKee T. Bioquímica, 3a ed. Cap 17. Ácidos nucleicos. McGrawHill, 2003:562-608. Pérez García G. Bioquímica: temas selectos y prácticas, 3a ed. Laboratorio de Bioquímica CUCS, 1996:130. Plummer DT. Bioquímica práctica, 2a ed. McGraw-Hill, 1981:208. http:learn.genetics.utah.edu. Extracción de DNA de germen de trigo. [Revisado el 22 de septiembre de 2013.] Apéndice Definición de prefijos, unidades y constantes físicas • Sonia Uribe Luna Prefijos de uso frecuente Prefijo Simbología Equivalente a tera T 1012 giga G 109 mega M 106 kilo k 103 hecta H 102 deci d 10−1 centi c 10−2 mili m 10−3 micro μ 10−6 nano n 10−9 pico p 10−12 femto f 10−15 atto a 10−18 yacto y 10−21 1 78 Manual de prácticas de laboratorio de bioquímica Constantes físicas Constante física Símbolo o abreviatura Valor Número de Avogadro N 6.022 × 1023 mol−1 Curie Ci 3.7 × 1010 desintegraciones s−1 Dalton Da 1.661 × 10−24 g Constante de Faraday F 96 487 JV mol−1 23 062 cal V−1 mol−1 Constante de los gases R 8.314 J mol−1 K−1 1.987 cal mol−1 K−1 Constante de Planck h 6.626 × 10−34 J s 1.584 × 10−34 cal s Velocidad de la luz (vacío) c 2.997 × 10−10 cm s−1 Otros factores Pi ln (loge) X = 2.303 log10 X 1.0 J = 0.239 cal = 107 erg = 1 W s 3.1416 Apéndice 2 Constantes biológicas • Mercedes Romero Gómez Prueba Muestra Unidades convencionales Factor de conversión Unidades SI Varón: 140 a 440 μmolL Mujer: 80 a 350 μmolL Ácido úrico Suero Varón: 2.4 a 7.4 mgdl Mujer: 1.4 a 5.8 mgdl Bilirrubina Suero Total: 0.1 a 1.2 mgdl Directa (conjugada con glucuronato): 0.1 a 0.4 mgdl; indirecta (no conjugada): 0.1 a 0.7 mgdl Bióxido de carbono (CO2) total Suero 22 a 28 meqL Peligro: <15 o >40 meqL 1.00 22 a 28 mmolL Calcio (Ca2+) total Suero 22 a 28 meqL Peligro: <15 o >40 meqL 0.25 2.1 a 2.6 mmolL Colesterol Suero Deseable: <200 mgdl Valor límite: 200 a 239 mgdl Riesgo grande: >240 mgdl 0.03 Deseable: <5.2 mmolL Valor límite: 5.2 a 6.1 mmolL Colesterol de HDL Suero Varón: 27 a 67 mgdl Mujer: 34 a 88 mgdl 0.026 0.7 a 1.73 mmolL 0.88 a 2.28 mmolL Colesterol de LDL Suero <130 mgdl 0.026 <3.37 mmolL Creatinina (Cr) Suero 0.6 a 1.2 mgdl Depuración de creatinina Orina de 24 h simultánea con creatinina en suero o plasma Adultos: 90 a 140 mlmin1.73 m2 BSA Electroforesis de proteínas Suero Adultos: Albúmina: 3.3 a 4.7 gdl α1: 0.1 a 0.4 gdl α2: 0.3 a 0.9 gdl β: 0.7 a 1.5 gdl γ: 0.5 a 1.4 gdl 59.48 17.10 83.3 0.017 10.00 2 a 21 μmolL <7 μmolL 50 a 100 μmolL 1.5 a 2.3 mls1.73 m2 BSA 33 a 47 gL 1 a 4 gL 3 a 9 gL 7 a 15 gL 5 a 14 gL (Continúa) 80 Manual de prácticas de laboratorio de bioquímica Prueba Muestra Unidades convencionales Factor de conversión Unidades SI Glucosa Suero 60 a 105 mgdl Peligro extremo: <40 o >500 mgdl 0.06 3.3 a 6.3 mmolL Hematócrito Sangre completa Varón: 39 a 49% Mujer: 35 a 45% 0.01 Varón: 0.39 a 0.49% Mujer: 0.35 a 0.45% Hemoglobina (HbA1c) (glucosilada) Suero 3.9 a 6.9% (según el método) Hemoglobina total (Hb) Sangre completa Varón: 13.6 a 17.5 gdl Mujer: 12.0 a 15.5 gdl Hierro (Fe2+) Suero 50 a 175 μgdl 0.18 9 a 31 μmolL Magnesio (Mg2+) Suero 1.8 a 3.0 mgdl 0.41 0.75 a 1.25 mmolL Nitrógeno de la urea en sangre Suero 8 a 20 mgdl 0.36 2.9 a 7.1 mmolL Oxígeno, presión parcial de (pO2) Sangre completa heparinizada 83 a 108 mmHg 0.13 11.04 a 14.36 Kpa pH Sangre completa Arterial: 7.35 a 7.45 Venosa: 7.31 a 7.41 Plomo (Pb) Sangre completa Niño: <25 μgdl Adulto: <40 μgdl 0.05 Niño: <1.21 μmolL Adulto: <1.93 μmolL Proteínas totales Plasma o suero 6.0 a 8.0 gdl Sodio (Na+) Suero 135 a 145 meqL Tiempo de protrombina (PT) Sangre completa 11 a 15 s Peligro: ≥30 (específica de laboratorio) Tiempo parcial de tromboplastina activada (PTT) Plasma 25 a 35 s (varían los valores) Peligro: ≥60 s Triacilgliceroles Suero <165 mgdl Bibliografía Nicoll CD. Apéndice de valores de laboratorio de referencia. En: Tierney LN, Jr, McPhee SJ, Papadakis MA. Diagnóstico clínico y tratamiento, 39a ed. México: El Manual Moderno, 2006:1613-1623. 10.0 10.0 1.0 0.01 60 a 80 gdl 135 a 145 mmolL Apéndice Determinación del gasto energético diario (GED) 3 • Sergio Sánchez Enríquez • Patricia Heredia Chávez El GED indica la cantidad de calorías que un individuo debe consumir para abastecer los requerimientos energéticos que le permitan realizar las actividades tanto fisiológicas como físicas. Si el gasto corresponde a lo que consume en los alimentos, el individuo mantendrá su peso ideal; por lo contrario, si el consumo de alimentos supera el gasto energético diario, el individuo aumentará de peso. El gasto energético comprende los siguientes mecanismos termogénicos: a) Metabolismo basal o gasto energético basal en repo- so (MB) de 60 a 70%. b) Actividad dinámica específica de los alimentos de 6 a 10%. c) Termogénesis inducida por el ejercicio de 20 a 100%. Metabolismo basal (MB) Una forma práctica para determinar el metabolismo basal es multiplicando 24 kcal por el peso del individuo en kilogramos, dando por resultado la cantidad de calorías que requiere el individuo para sobrevivir durante 24 h (si estuviera en reposo, acostado, boca arriba, sin ingesta de alimentos y sin realizar actividades intelectuales). Ejemplo: para un individuo de 80 kg de peso 24 kcal × 80 kg = 1 920 kcal24 h Acción dinámica específica de los alimentos (ADE) Se refiere a las calorías que quema la persona durante el proceso de masticación, digestión y absorción de los alimentos, también conocida como termogénesis inducida por la ingesta y digestión de los alimentos. Su valor varía entre 6 y 10% del gasto energético basal, dependiendo de la cantidad y tipo de ingesta. Termogénesis por la actividad física (AF) En forma práctica, la actividad física se puede clasificar de la siguiente manera: Actividad física leve = 20% (del gasto energético basal). Ejemplo. La mayor parte de su actividad física la realiza sentado. Actividad física moderada = 30% (del gasto energético basal). Ejemplo. La actividad física que desarrolla un ama de casa. Actividad física intensa = 40% (del gasto energético basal). Ejemplo. La actividad de un albañil. Actividad física extrema = 100% (del gasto energético basal). Ejemplo. Deportistas de alto rendimiento. Fórmula de Harris Benedict para determinar el gasto energético diario Varones: 66.5 + 13.75 (P) + 5.08 (T) – 6.78 (E) + ADE + AF Mujeres: 65.51 + 9.56 (P) + 1.85 (T) – 4.68 (E) + ADE + AF En donde: P = peso expresado en kilogramos E = edad expresada en años T = talla expresada en centímetros ADE = acción dinámica específica de los alimentos AF = actividad física Las proporciones ideales de nutrimentos para mantenerse sano son las siguientes: 82 Manual de prácticas de laboratorio de bioquímica Cuadro A3-1. Calorías aportadas por cada gramo de proteínas, lípidos y carbohidratos. Nutrimento Cuadro A3-3. Grupos de alimentos y raciones recomendadas. kcal/gramo Cereales y tubérculos Proteínas 4 Arroz cocido ½ de taza Lípidos 9 Arroz inflado ½ de taza Carbohidratos 4 Bolillo con migajón ⅓ de pieza Tortilla 1 pieza mediana Bollo para hamburguesa ½ pieza Camote en cuadritos ¼ de taza Donas azucaradas ⅓ de pieza Galletas de barquillo rellenas 2 piezas Galletas con chispas de chocolate 1 ½ piezas Galletas con malvavisco 1 pieza Galletas de animalitos 6 piezas Galletas de avena y pasas 1 pieza mediana Galletas de centeno 3 piezas medianas Galletas de coco y nuez 1 ⅓ de piezas Galletas de higo 1 ½ piezas Galletas de mantequilla 3 piezas medianas Galletas dedos de novia 1 ¾ de piezas Galletas palitos salados 2 piezas Galletas para sopa 20 piezas Galletas saladas 3 piezas Galletas sándwich de vainilla o chocolate 1 ⅓ de piezas Harina de arroz 1 ½ cdas. soperas Harina de centeno 2 ⅓ de cdas. soperas Harina de trigo integral 2 ½ cdas. soperas Harina de trigo refinada 2 cdas. soperas Hojuelas de avena ¼ de taza Hojuelas de maíz ¾ de taza Hojuelas de maíz azucaradas ½ taza Proteínas = 20% como máximo (0.78 a 1.27 gkg de peso). Lípidos = 20 a 30% de las calorías calculadas, de las cuales: 20% lípidos insaturados y 10% saturados. Carbohidratos = 50 a 60% de las calorías calculadas. En el cuadro A3-1 se presentan las calorías que aporta cada uno de los nutrimentos. Es muy recomendable conocer los grupos de alimentos, las cantidades de nutrimentos que cada uno de ellos aporta y las kilocalorías que proporcionan por cada ración ingerida; esta información se encuentra en el cuadro A3-2. Con toda la información presentada se puede diseñar un menú saludable al combinar algunos de los alimentos mencionados, los cuales, si son del mismo grupo, resultan intercambiables para que se varíe día con día el menú, siempre y cuando se respeten las raciones. Las cantidades de alimentos específicos de cada grupo de alimentos se muestran en el cuadro A3-3. Cuadro A3-2. Grupos de alimentos, equivalentes y composición promedio de nutrimentos. Grupo Energía Proteínas Lípidos Carbohidratos (kcal) (g) (g) (g) Cereales y tubérculos 68 2 0 15 Leguminosas 97 7 1 15 Verduras 28 2 0 5 Frutas 40 0 0 10 Carne, queso y huevo (grupo A) 75 7 5 0 Leche 160 8 8 12 Hojuelas de papa ⅓ de taza Grasa 45 0 5 0 Hot cakes (panqueques) 1 pieza mediana Azúcares 40 0 0 10 (Continúa) Apéndice 3. Determinación del gasto energético diario (GED) Cuadro A3-3. Grupos de alimentos y raciones recomendadas (Continuación). Cereales y tubérculos Verduras Berenjena Libre Berro Libre Betabel ½ taza Brócoli Libre Calabacita ½ taza Cebolla ½ taza Cilantro Libre Col Libre Maicena 2 cdas. soperas Maíz (granos) ½ taza Maíz palomero inflado 3 tazas Medias noches ½ pieza Pan alemán 1 rebanada delgada Pan de caja blanco, tostado o integral 1 rebanada Panqué casero 1 rebanada delgada Col de Bruselas ½ taza Panqué de jengibre 1 rebanada delgada Coliflor Libre Papa en cuadritos ½ taza Chayote Libre Pastas para sopa ½ taza Chilacayote Libre Pastelitos con nueces (brownies) 1 pieza Chile poblano ½ taza Ejote tierno Libre Pay de cereza 1 rebanada muy delgada Espárrago ½ taza Pay de durazno 1 rebanada muy delgada Espinaca Libre Pay de fresa 1 rebanada muy delgada Flor de calabaza Libre Pay de limón con merengue 1 rebanada muy delgada Flor de colorín Libre Pay de manzana 1 rebanada muy delgada Hongos ½ taza Pay de piña 1 rebanada muy delgada Huazontle ½ taza Pay de zarzamora 1 rebanada delgada Jitomate Libre Salvado de trigo ½ taza Lechuga Libre Tapioca cruda 1 ½ cdas. soperas Nabo ½ taza Nopal Libre Leguminosas Arverjones ½ taza Pepino Libre Chícharos (guisantes) ½ taza Perejil Libre Frijoles ( judías) ½ taza Pimiento morrón ½ taza Garbanzos ½ taza Poro ½ taza Habas ½ taza Quelite ½ taza Lentejas ½ taza Rábano Libre Soya texturizada 1 ½ tazas, rehidratada Romerito Libre Tomate Libre Verduras 83 Acelga Libre Verdolaga Libre Alcachofa Libre Zanahoria ½ taza Apio Libre (Continúa) 84 Manual de prácticas de laboratorio de bioquímica Cuadro A3-3. Grupos de alimentos y raciones recomendadas (Continuación). Frutas Ración Contenido de fibra Carnes, huevo y pescado Subgrupo A Aves sin piel: avestruz, codorniz, pavo, pollo 30 g Clara de huevo 2 Capulín 12 piezas Mediana Ciruela 8 piezas Mediana 2 piezas Baja Conejo desgrasado: costilla, lomo, pierna 30 g Ciruela pasa Chabacano fresco 3 piezas Mediana Cordero desgrasado 30 g 5 mitades Mediana Mariscos: almejas, camarones, jaibas, ostiones 30 g Chabacano seco Chicozapote 1 pieza pequeña Mediana Quesos: cabra, cottage, fresco, parmesano, requesón 30 g Chirimoya 110 taza Alta 2 piezas Baja Pescado: fresco, congelado o ahumado, sardinas drenadas, atún drenado 30 g Dátil Durazno 1 pieza pequeña Mediana 30 g Fresa ¾ de taza Alta Res desgrasada: aguayón, bola, empuje, falda, filete, lengua, T-bone, rosbif Granada 2 piezas Alta 2 piezas pequeñas Alta Ternera desgrasada: costilla, lomo, pierna 30 g Guayaba Higo fresco 1 pieza Mediana Jícama ¾ de taza, en cuadritos Baja Agua de coco natural 1 taza Lima 2 piezas Mediana Almendra con chocolate 2 piezas Mamey 110 taza Baja Azúcar refinada 2 cucharaditas Mandarina 1 pieza Mediana Caramelo macizo 2 piezas Mango ½ pieza pequeña Mediana Chocolate en barra de 23 g ⅓ barra Manzana 1 pieza Mediana Gelatina preparada ⅓ de de taza Manzana en puré ½ taza Baja Horchata de arroz ½ taza Jalea Naranja 1 pieza pequeña Alta 1 rebanada delgada Nectarina ½ pieza Baja Leche condensada 1 cucharada Papaya ¾ de taza Mediana Mermelada de frutas 1 cucharadita Pasas 2 cdas. soperas Baja Miel de abeja 1 cucharadita Pera ½ pieza pequeña Alta Miel de maíz 1 cucharada Piña ½ taza, en cuadritos Mediana Miel de maple 1 cucharada Plátano (banana) ½ pieza (9 cm) Baja Nieve ¼ de taza Sandía 1 taza, en cuadritos Baja Piloncillo refinado 2 cucharadas Toronja ½ pieza Baja Queso de tuna Tuna ½ pieza Alta ½ rebanada delgada Uva 10 piezas Baja Refresco ⅓ de taza Zarzamora ½ pieza Alta Azúcares (Continúa) Apéndice 3. Determinación del gasto energético diario (GED) Cuadro A3-3. Grupos de alimentos y raciones recomendadas (Continuación). Grasas Aceites vegetales 1 cucharadita Aceitunas 15 piezas pequeñas o 7 grandes Aguacate 30 g o 1⁄5 de pieza Ajonjolí (sésamo) 1 cucharada Almendra 10 piezas Avellana 7 piezas Cacahuate (maní) 5 piezas Coco rallado 1 cucharada Crema de cacahuate 1 cucharadita Crema espesa 1 cucharada Manteca de cerdo 1 cucharadita Manteca vegetal 1 cucharadita Mantequilla 1 cucharadita Margarina 1 cucharadita Mayonesa 1 cucharadita Nuez 2 piezas Paté de hígado 1 cucharada Pepitas (semillas) 1 cucharada Pistacho 4 piezas Piñón 2 cucharaditas Queso crema 1 cucharada Semillas de girasol 1 cucharada Tocino 1 rebanada delgada Leche Leche descremada 1 taza Yogurt de leche descremada 1 taza 85 Bibliografía Espinosa T. Aspectos básicos de calorimetría. En: Casanueva E y cols. Nutriología médica, 2a ed. México: Editorial Panamericana, 2001:516-527. Pérez-Lizaur AB. Plan alimentario para el individuo sano y el individuo enfermo. En: Casanueva E y cols. Nutriología Médica, 2a ed. México: Editorial Panamericana, 2001:532-672. ERRNVPHGLFRVRUJ Apéndice 4 Historia clínica • Sergio Sánchez Enríquez Fecha ____/____/____ día mes año DATOS DE REGISTRO NÚMERO DE FICHA: NOMBRE: DIRECCIÓN: CALLE: COLONIA: CÓDIGO POSTAL: CIUDAD: TEL. CONVENCIONAL: TEL. CELULAR: RADIOLOCALIZADOR: E-MAIL: EDAD: GÉNERO: LUGAR DE NACIMIENTO: LUGAR DE RESIDENCIA: URBANA URBANA RURAL MESES: AÑOS: RURAL ¿DESDE CUÁNDO? MASCULINO FEMENINO ESTADO CIVIL: SOLTERO CASADO DIVORCIADO UNIÓN LIBRE VIUDO OTRO ESCOLARIDAD: PRIMARIA SECUNDARIA PREPARATORIA LICENCIATURA MAESTRÍA DOCTORADO SÍ NO OCUPACIÓN: DESEMPLEADO 88 Manual de prácticas de laboratorio de bioquímica ANTECEDENTES HEREDOFAMILIARES ¿VIVE SU PADRE? SÍ NO SÍ NO CAUSA DE MUERTE ¿VIVE SU MADRE? CAUSA DE MUERTE HERMANOS TOTAL FEMENINOS VIVOS MASCULINOS VIVOS CAUSA DE MUERTE DE HERMANOS OBESIDAD EN ABUELO PATERNO SÍ NO OBESIDAD EN ABUELA PATERNA SÍ NO OBESIDAD EN ABUELO MATERNO SÍ NO OBESIDAD EN ABUELA MATERNA SÍ NO OBESIDAD EN PADRE SÍ NO OBESIDAD EN MADRE SÍ NO OBESIDAD EN HERMANOS SÍ NO OBESIDAD EN TÍOS PATERNOS SÍ NO OBESIDAD EN TÍOS MATERNOS SÍ NO ABUELO PATERNO DIABÉTICO SÍ NO ABUELA PATERNA DIABÉTICA SÍ NO ABUELO MATERNO DIABÉTICO SÍ NO ABUELA MATERNA DIABÉTICA SÍ NO PADRE DIABÉTICO SÍ NO MADRE DIABÉTICA SÍ NO HERMANOS DIABÉTICOS SÍ NO ¿CUÁNTOS? TÍOS PATERNOS DIABÉTICOS SÍ NO ¿CUÁNTOS? TÍOS MATERNOS DIABÉTICOS SÍ NO ¿CUÁNTOS? FAMILIARES CON PRESIÓN ALTA SÍ NO ¿CUÁNTOS? FAMILIARES CON INFARTO AL CORAZÓN SÍ NO ¿CUÁNTOS? FAMILIARES CON EMBOLIA CEREBRAL SÍ NO ¿CUÁNTOS? FAMILIARES CON ASMA BRONQUIAL SÍ NO ¿CUÁNTOS? FAMILIARES CON HONGOS EN UÑAS SÍ NO ¿CUÁNTOS? FAMILIARES CON HONGOS EN PIEL SÍ NO ¿CUÁNTOS? FAMILIARES CON ALERGIA A ALIMENTOS SÍ NO ¿CUÁNTOS? FAMILIARES CON OTRA ALERGIA SÍ NO ¿CUÁNTOS? Apéndice 4. Historia clínica 89 ANTECEDENTES PERSONALES NO PATOLÓGICOS ¿CUÁNTO PESÓ AL NACER? RAZA/ETNIA MESTIZA VACUNAS SÍ GRAMOS NO SÉ CAUCÁSICA NATIVA NEGRA ORIENTAL OTRA BCG DPT POLIO TRIPLE QUÍNTUPLE PISO: TIERRA CEMENTO MOSAICO OTRO TECHO: MATERIAL LÁMINA TEJA OTRO SERVICIOS: AGUA DRENAJE LUZ TELÉFONO ANIMALES DOMÉSTICOS: SÍ NO ¿CUÁNTOS? NO RESPECTO DE LA CASA QUE HABITA: NÚMERO DE CUARTOS: NÚMERO DE PERSONAS POR CUARTO: HIGIENE: BAÑO: DIARIO CADA TERCER DÍA 1 VEZ POR SEMANA OTRA ASEO DE LAS MANOS: SIEMPRE ESTÁN SUCIAS ANTES DE COMER DESPUÉS DE IR AL BAÑO OTRA LAVADO DE LOS DIENTES: DESPUÉS DE CADA ALIMENTO 1 VEZ POR DÍA EN OCASIONES NUNCA CAMBIO DE ROPA: DIARIO CADA TERCER DÍA SEMANAL OTRO HISTORIA LABORAL: TRABAJOS DESARROLLADOS: ¿TIENE ALGÚN RIESGO EN SU TRABAJO? SÍ ¿ACTUALMENTE TIENE TRABAJO? SÍ ¿HA TENIDO PERIODOS DE DESEMPLEO? SÍ ¿CÓMO CONSIDERA SU SITUACIÓN ECONÓMICA ACTUAL? EXCELENTE BUENA REGULAR ¿TIENE ALGO QUE LE PREOCUPE? SÍ NO ¿QUÉ COSA? SÍ NO YA NO EDAD DE INICIO ¿CUÁNTO TIEMPO HA FUMADO (EN AÑOS)? CANTIDAD DE CIGARRILLOS POR DÍA ¿CONOCE EL RIESGO? SÍ NO YA NO CANTIDAD EDAD DE INICIO TIEMPO DE CONSUMO (EN AÑOS) ¿DESDE CUÁNDO DEJÓ DE BEBER? ALCOHOL CERVEZA BRANDY NO NO FIJO OCASIONAL OTRO NO MALA SOBRE ADICCIONES: TABAQUISMO INGESTIÓN DE BEBIDAS ALCOHÓLICAS TIPO DE BEBIDA TEQUILA ¿DESDE CUÁNDO DEJÓ DE FUMAR? FRECUENCIA VODKA 90 Manual de prácticas de laboratorio de bioquímica ¿TOMA ALCOHOL EN SITUACIONES DIFÍCILES, PARA TOMAR VALOR O SENTIRSE ALEGRE? SÍ NO ¿HA FALTADO A SU TRABAJO POR PROBLEMAS EN LA MANERA DE BEBER? SÍ NO ¿HA TENIDO PROBLEMAS LEGALES POR CAUSA DEL ALCOHOL? SÍ NO ¿HA TENIDO PROBLEMAS SOCIALES POR CAUSA DEL ALCOHOL? SÍ NO ¿BEBE POR LA MAÑANA ANTES DE REALIZAR CUALQUIER OTRA ACTIVIDAD? SÍ NO ¿LE APETECE BEBER CUANDO ESTÁ SOLO? SÍ NO ¿PRESENTA ENROJECIMIENTO DE LA CARA, PALPITACIONES, FALTA DE AIRE Y MALESTAR GENERAL ANTES DE TERMINAR LA PRIMERA BEBIDA? SÍ NO ¿A CUÁNTAS COPAS O CERVEZAS PRESENTA USTED ESTOS SÍNTOMAS? 1A3 3A5 MÁS DE 5 ¿HA SIDO NECESARIO RECURRIR A ALGÚN TRATAMIENTO DEBIDO A SU FORMA DE BEBER? SÍ NO ESPECIFIQUE ¿SABE LOS DAÑOS A LA SALUD QUE OCASIONA? SÍ NO ESPECIFIQUE YA NO EDAD DE INICIO ¿DESDE CUÁNDO YA NO? ¿CUÁNTO TIEMPO HA SIDO DEPENDIENTE (EN AÑOS)? FRECUENCIA DE LA ADICCIÓN EN NÚMERO DE VECES POR DÍA ¿CONOCE EL RIESGO? MENOS DE 1 TOXICOMANÍAS DROGADICCIÓN SÍ NO TIPO DE DROGA SOLVENTE MARIGUANA COCAÍNA TACHAS DE DISEÑO ¿CONSUME CAFÉ? SÍ NO YA NO EDAD DE INICIO ¿DESDE CUÁNDO YA NO? ¿CUÁNTO TIEMPO HA SIDO DEPENDIENTE (EN AÑOS)? TAZAS AL DÍA ÚLTIMA FECHA DE CONSUMO MEDICAMENTOS TIPO DE MEDICAMENTOS ¿USA PLANTAS MEDICINALES? SÍ NO YA NO ¿DESDE CUÁNDO? ÚLTIMA FECHA DE CONSUMO ¿LOS HA SUSPENDIDO POR SU CUENTA? SÍ NO FRECUENCIA DE CONSUMO ¿DESDE CUÁNDO YA NO? ANTIBIÓTICOS ANTIINFLAMATORIOS LAXANTES DIURÉTICOS OTROS SÍ NO YA NO CANTIDAD FRECUENCIA FRECUENCIA DE CONSUMO ¿DESDE CUÁNDO YA NO? NOMBRE DE LA PLANTA PREPARACIÓN ¿PARA QUÉ ENFERMEDAD? MEJORÓ EMPEORÓ IGUAL RESULTADO Apéndice 4. Historia clínica ANTECEDENTES PERSONALES PATOLÓGICOS ¿PADECE ALGUNA ENFERMEDAD? SÍ ¿DESDE CUÁNDO? NO ¿RECIBE TRATAMIENTO? SÍ FECHA DIAGNÓSTICA: ¿ES USTED DIABÉTICO? SÍ ¿PADECE CONVULSIONES? SÍ NO NO TIPO I II TRATAMIENTO: LESIONES OCASIONADAS SÍ FECHA DIAGNÓSTICA: TRATAMIENTO: SÍ NO TIPO FECHA DIAGNÓSTICA: ¿SU ENFERMEDAD SE RELACIONA CON AUMENTO DE PESO? SÍ ¿PADECE PRESIÓN ALTA? SÍ NO ¿DESDE CUÁNDO? FECHA DIAGNÓSTICA: ¿SU ENFERMEDAD SE RELACIONA CON AUMENTO DE PESO? ¿LE HAN DETECTADO EL ÁCIDO ÚRICO ALTO? SÍ ¿HA PADECIDO HONGOS EN LA PIEL O LAS UÑAS? ¿HA PADECIDO ALGUNA ALERGIA? ¿PADECE ASMA? ¿CUÁL? TRATAMIENTO: FECHA DIAGNÓSTICA: NO ¿CUÁL? NO NO TRATAMIENTO: SÍ NO TRATAMIENTO: NO ¿DESDE CUÁNDO? TRATAMIENTO: SÍ NO ¿DESDE CUÁNDO? TRATAMIENTO: SÍ NO ¿DESDE CUÁNDO? TRATAMIENTO: CAUSA ALIMENTOS MEDICAMENTOS ANIMALES OTRAS ENFERMEDADES QUE HAYA PADECIDO OTRAS 91 92 Manual de prácticas de laboratorio de bioquímica ANTECEDENTES GINECOOBSTÉTRICOS EDAD DE SU PRIMERA REGLA (MENARQUIA) AÑOS IRREGULARIDADES MENSTRUALES SÍ ¿CADA CUÁNDO TIENE SU REGLA? DÍAS ¿CUÁNTO DURA SU REGLA? DÍAS ¿SE HA EMBARAZADO? NO TIPO TRATAMIENTO SÍ NO NÚMERO DE VECES NÚMERO DE ABORTOS SÍ NO ¿CUÁNTOS? CAUSAS NÚMERO DE CESÁREAS SÍ NO ¿CUÁNTAS? CAUSAS ¿UTILIZA MÉTODOS ANTICONCEPTIVOS? SÍ NO TIPO FECHA DE ÚLTIMA REGLA FECHA DE ÚLTIMO PARTO, CESÁREA, O AMBOS INTERROGATORIO POR APARATOS Y SISTEMAS DOLOR DE CABEZA SÍ NO MAREOS SÍ NO VÉRTIGO SÍ NO CANSANCIO FÁCIL SÍ NO CALAMBRES SÍ NO MUCHO SUEÑO MALA CALIDAD DEL SUEÑO SANGRADO FÁCIL O EXCESIVO (NO MENSTRUAL) SÍ NO MORETONES FÁCILES SÍ NO PALIDEZ DE LA PIEL SÍ NO DOLORES ARTICULARES (COYUNTURAS) SÍ NO ALTERACIONES DEL SUEÑO SÍ NO INSOMNIO RIGIDEZ DE LAS ARTICULACIONES SÍ NO ¿CUÁNTO TIEMPO LE DURA? HINCHAZÓN, EDEMA DE MIEMBROS SUPERIORES E INFERIORES SÍ NO POR LA MAÑANA DURANTE EL DÍA POR LA NOCHE HINCHAZÓN, EDEMA DE LA CARA SÍ NO POR LA MAÑANA DURANTE EL DÍA POR LA NOCHE DOLOR DE PECHO EDEMA DE ARTICULACIONES SÍ SÍ NO NO ¿CUÁL? ANSIEDAD SÍ NO IRRITABILIDAD SÍ NO TRISTEZA EXAGERADA SÍ NO LLORA FÁCILMENTE SÍ NO COMPULSIONES SÍ NO AUTOMEDICACIÓN SÍ NO Apéndice 4. Historia clínica HOSPITALIZACIONES SÍ NO CAUSA FECHA CIRUGÍAS SÍ NO CAUSA FECHA INFECCIONES FRECUENTES DE VÍAS RESPIRATORIAS ALTAS SÍ NO ¿CUÁLES? INFECCIONES FRECUENTES DE VÍAS RESPIRATORIAS BAJAS SÍ NO ¿CUÁLES? INFECCIONES FRECUENTES DE VÍAS URINARIAS SÍ NO ¿CUÁLES? INFECCIONES FRECUENTES DE LA PIEL SÍ NO ¿CUÁLES? INFECCIONES FRECUENTES DEL ESTÓMAGO SÍ NO ¿CUÁLES? OTRAS INFECCIONES FRECUENTES SÍ NO ¿CUÁLES? 93 HÁBITOS PERSONALES ¿A QUÉ HORA SE LEVANTA? ¿A QUÉ HORA SE ACUESTA? ¿CUÁNTO TIEMPO DUERME? ¿TOMA SIESTA? SÍ NO DURACIÓN ¿CUÁNTAS VECES COME AL DÍA? VECES ¿COME ENTRE COMIDAS? SÍ ¿COME FUERA DE LA CASA? SÍ NO FRECUENCIA VECES ¿CÓMO PREFIERE LA COMIDA? ASADA COCIDA FRITA DE TODO ¿COME ALIMENTOS INTEGRALES? SÍ NO FRECUENCIA VECES ¿COME PRODUCTOS CHATARRA? SÍ NO FRECUENCIA VECES ¿DESDE CUÁNDO TIENE SOBREPESO? DESDE LA NIÑEZ EN LA ADOLESCENCIA DE ADULTO DESPUÉS DEL PARTO ¿ALGUNA SITUACIÓN LE PROVOCA HAMBRE? SÍ NO ¿CUÁL? ¿SE CONSIDERA ADICTO AL REFRESCO? SÍ NO ¿CUÁL? ¿CÓMO SONSIDERA EL CONSUMO DE SAL DE MESA? LEVE MODERADO ¿CUÁNTA AGUA TOMA DURANTE EL DÍA? LITROS ¿PADECE ESTREÑIMIENTO? NO SÍ FRECUENCIA DE EVACUACIONES NO OTROS DESPUÉS DE LA MENOPAUSIA INTENSO VECES 94 Manual de prácticas de laboratorio de bioquímica ACTIVIDAD FÍSICA ¿PRACTICA EJERCICIO? SÍ NO TIPO DE EJERCICIO/DEPORTE CAMINA CORRE MOTIVO YA NO DESDE GUSTO SALUD OTRO ¿HA SENTIDO MEJORÍA EN SU SALUD CON EL EJERCICIO? SÍ NO ESPECIFIQUE FRECUENCIA DE VECES A LA SEMANA 0A2 3A5 5A7 DURACIÓN DEL EJERCICIO (MINUTOS/SESIÓN) 20 A 30 45 A 60 60 A 90 MÁS DE 90 MUY LEVE LEVE MODERADA ALTA TIEMPO DE PRACTICARLO MESES AÑOS ¿LO REALIZA ACOMPAÑADO? SÍ NO ESPECIFIQUE ¿PERTENECE A ALGÚN CLUB DEPORTIVO? SÍ NO ESPECIFIQUE SÍ NO ESPECIFIQUE 5 A 15 INTENSIDAD EDAD DE INICIO AÑOS ¿EN DÓNDE REALIZA LA SESIÓN DE EJERCICIO? ¿LE GUSTARÍA ASISTIR A ALGÚN GRUPO PARA PRACTICAR EJERCICIO? ACTIVIDAD LABORAL HORAS AL DÍA NÚMERO DE DÍAS A LA SEMANA NIVEL DE INTENSIDAD ACTIVIDAD EN EL HOGAR HORAS AL DÍA NÚMERO DE DÍAS A LA SEMANA NIVEL DE INTENSIDAD FACTORES DIETÉTICOS ¿CON QUÉ FRECUENCIA BEBE LECHE? VECES CANTIDAD ¿CON QUÉ COCINA? ACEITE ¿CUÁLES UTILIZA EN SUS PLATILLOS O BIEN EN SU PREPARACIÓN? CREMA MANTEQUILLA CHORIZO OTROS ml MANTECA QUESOS TOCINO ADEREZOS FRECUENCIA DE CONSUMO CARNE SÍ NO VECES TIPO HUEVO SÍ NO VECES ¿CUÁNTOS? FRIJOLES SÍ NO VECES ¿CUÁNTOS? VERDURAS SÍ NO VECES ¿CUÁNTOS? FRUTAS SÍ NO VECES ¿CUÁNTOS? PAN SÍ NO VECES ¿CUÁNTOS? CEREALES SÍ NO VECES ¿CUÁNTOS? POSTRES SÍ NO VECES ¿CUÁNTOS?