Unidad 4. Form - IES Villablanca
Anuncio

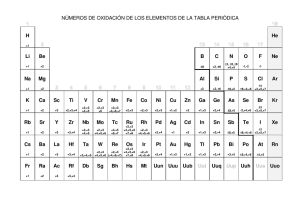
Física y Química Unidad 4. Formulación FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA Índice de contenido TABLAS DE NÚMEROS DE OXIDACIÓN MÁS COMUNES....................................2 MECANISMO DE FORMULACIÓN..............................................................................2 NOMENCLATURAS EN QUÍMICA INORGÁNICA....................................................2 NOMENCLATURA CON PREFIJOS...................................................................................................2 NOMENCLATURA CON NÚMEROS DE OXIDACIÓN....................................................................2 NOMENCLATURA CLÁSICA..............................................................................................................3 COMPUESTOS BINARIOS.............................................................................................3 1.-ÓXIDOS:COMBINACIONES BINARIAS CON OXÍGENO ( - 2 ).................................................3 1-A METALES...................................................................................................................................3 1-B NO METALES............................................................................................................................3 2.-COMPUESTOS CON HIDRÓGENO.................................................................................................3 2-A METALES..................................................................................................................................3 2-B NO METALES...........................................................................................................................4 3.- SALES BINARIAS...........................................................................................................................5 COMPUESTOS TERNARIOS.........................................................................................5 1. – HIDRÓXIDOS..................................................................................................................................5 2. – ÁCIDOS OXOÁCIDOS...................................................................................................................6 Tabla periódica con los números de oxidación........................................................................................7 AUTOEVALUACIÓN......................................................................................................8 Página 1 de 8 Física y Química Unidad 4. Formulación Para formular un compuesto es útil suponer que está constituido por iones, aunque sabemos que en los compuestos covalentes no hay separación de cargas (recordemos que comparten pares de electrones). Definimos número de oxidación: La carga imaginaria, positiva o negativa que se asigna a cada elemento de un compuesto inorgánico. Se debe cumplir que la suma de los números de oxidación de todos los átomos del compuesto debe ser cero. TABLAS DE NÚMEROS DE OXIDACIÓN MÁS COMUNES Metales Li Na K Rb Cs Ag Be Mg Ca Sr Ba Zn y Cd Fe Ni y Co Nº oxidación +1 +2 +2 y +3 Metales Cu y Hg Pb y Sn Cr Mn Au Al Nº oxidación +1 y +2 +2 y +4 +2+3 +6 +3+4+6+7 +1 y +3 +3 No metales H Nº oxidación -1 +1 No metales B Nº oxidación -3 +3 F Cl Br I O S Se Te -1 -1+1+3+5+7 -2 -2+2 +4 +6 N P As Sb C Si -3,12345 -3+3+5 -4 +2+4 +4 MECANISMO DE FORMULACIÓN Para compuestos binarios, se coloca a la izquierda el elemento que actúa con número de oxidación positivo y a la derecha el elemento con nº de oxidación negativo, con los subíndices intercambiados, según los números de oxidación. En el caso de compuestos ternarios, como se verá, tienen mecanismo de formulación diferente. NOMENCLATURAS EN QUÍMICA INORGÁNICA NOMENCLATURA CON PREFIJOS Se colocan los prefijos MONO, DI, TRI, TETRA, PENTA, HEXA, HEPTA para el elemento con subíndices 1,2,3,4,5,6, y 7 delante del nombre del grupo; La preposición DE y el elemento con los prefijos correspondientes. Ejemplo: SO2 Dióxido de azufre N2O3 Trióxido de dinitrógeno El prefijo MONO se quita y sólo en algunos compuestos es costumbre dejarlo, como en el CO, que se nombra siempre monóxido de carbono. Utilizaremos en 3º de ESO esta nomenclatura para compuestos con NO METALES NOMENCLATURA CON NÚMEROS DE OXIDACIÓN Se coloca el nombre del grupo, la preposición DE y el nombre del elemento. Cuando dicho elemento tiene dos o más nº de oxidación, se coloca entre paréntesis y números romanos el número de oxidación con el que actúa. Cuando el elemento sólo tiene un nº de oxidación, NO se pone con números romanos. Ejemplos:Cu2O Óxido de cobre ( I ) CuO Óxido de cobre ( II ) Al2O3 Óxido de aluminio Utilizaremos esta nomenclatura en 3º ESO para compuestos con METALES Página 2 de 8 Física y Química Unidad 4. Formulación NOMENCLATURA CLÁSICA Se coloca el nombre del grupo con las terminaciones OSO e ICO y con los prefijos HIPO y PER cuando el elemento posee más de dos nº de oxidación, según los casos, que no daremos en el nivel de 3º ESO COMPUESTOS BINARIOS 1.-ÓXIDOS:COMBINACIONES BINARIAS CON OXÍGENO ( - 2 ) 1-A METALES Formados por METAL más OXÍGENO. Se escribe a la derecha el metal y a la izquierda el oxígeno y se intercambian en los subíndices los números de oxidación. Se nombran con nomenclatura CON NÚMEROS DE OXIDACIÓN: La palabra ÓXIDO seguida de la preposición DE y el nombre del METAL y con paréntesis y nº romanos el número de oxidación del metal, si hay más de uno. Ejemplo1: Nombre PbO PbO2 Ba O Ag2O Ni2O3 Ejemplo 2: óxido de oro(III) óxido de sodio óxido de calcio óxido de cobalto(II) óxido de mercurio(I) 1-B NO METALES Formados por NO METAL más OXÍGENO. En nomenclatura con prefijos se nombran con ÓXIDO DE NO-METAL con los prefijos correspondientes. Ejemplo 3: Nombre Cl2O3 Cl2O5 Cl2O7 SO2 SO3 CO2 Ejemplo 4: pentaóxido de dinitrógeno trióxido de selenio heptaóxido de bromo tetraóxido de dinitrógeno monóxido de carbono 2.-COMPUESTOS CON HIDRÓGENO 2-A METALES Formados por metal más hidrógeno. El nº de oxidación del H es -1 y por lo tanto se escribe a la derecha y a la izquierda el metal. Página 3 de 8 Física y Química Unidad 4. Formulación Para nombrarlos, se emplea la palabra HIDRURO, siguiendo las normas de nomenclatura con números de oxidación Ejemplo 5: Nombre CaH2 FeH2 NiH3 AgH CuH Ejemplo 6: hidruro de potasio hidruro de cadmio hidruro de plomo(IV) hidruro de niquel(II) hidruro de aluminio 2-B NO METALES 2 – B 1º HIDRÁCIDOS Son combinaciones del hidrógeno con F; Cl; Br, I, S, Se y Te; Se les denomina así porque sus disoluciones acuosas manifiestan carácter ácido. Se formulan con el H a la izquierda (Nº oxidación -1) y el No metal a la derecha. En nomenclatura con prefijos, se nombra el NO METAL con la terminación URO seguido del hidrógeno con prefijo di o sin prefijo. En nomenclatura tradicional se nombra con la palabra ÁCIDO y el NO METAL con la terminación HÍDRICO. Ejemplo 7: N. con prefijos N. Tradicional HBr H2S HI HCl Ejemplo 8: Fluoruro de hidrógeno Ácido selenhídrico Telururo de dihidrógeno 2 - B 2º CON OTROS NO METALES Estos compuestos no tienen carácter ácido; por eso se clasifican en este grupo. El hidrógeno se escribe a la derecha y el no metal a la izquierda. En nomenclatura con prefijos sigue las mismas normas que los hidruros metálicos(uso de prefijos griegos). En la tradicional, tienen nombres especiales. Ejemplo 9: N. con prefijos Tradicional NH3 Amoniaco PH3 Fosfano AsH3 SbH3 BH3 Borano H2O Agua CH4 Metano Página 4 de 8 Física y Química SiH4 Ejemplo 10: Amoniaco Metano Agua Trihidruro de fósforo Unidad 4. Formulación Fórmula 3.- SALES BINARIAS Son compuestos formados por un Metal y No Metal. Se nombran con el nombre del No Metal terminado en URO, la preposición DE seguido el nombre del metal, con las normas ya mencionadas en la nomenclatura con números de oxidación. Ejemplo 11: Nombre KCl MgBr2 Ni S PbCl4 Sn S2 BaBr2 CaSe Li2 S Ejemplo12: yoduro de cinc cloruro de plata sulfuro de cobalto(II) bromuro de oro(III) fluoruro de aluminio seleniuro de níquel(III) Fórmula COMPUESTOS TERNARIOS 1. – HIDRÓXIDOS Están formados por un METAL más el grupo HIDROXO ( OH ) - que tiene número de oxidación ( -1 ). Se nombran con la palabra HIDRÓXIDO seguido del metal correspondiente, con las normas con números de oxidación correspondientes. Ejemplo 13 Nombre Al (OH) 3 Cu OH Co (OH)2 Na OH Fe (OH)3 Ejemplo 14 Fórmula hidróxido de magnesio hidróxido de potasio hidróxido de mercurio (II) hidróxido de plomo (IV) hidróxido de aluminio Página 5 de 8 Física y Química Unidad 4. Formulación 2. – ÁCIDOS OXOÁCIDOS Son compuestos ternarios formados por HIDRÓGENO - NO METAL - OXÍGENO. Pueden considerarse como derivados de la adición de agua a los óxidos no metálicos correspondientes. HaXbOc. Para nuestro nivel, sólo estudiaremos los oxoácidos más corrientes presentes en cualquier laboratorio y con su nombre tradicional. Ejemplos: H2SO4 HClO3 HNO3 H2CO3 Nomenclatura Tradicional Ácido sulfúrico Ácido clórico Ácido nítrico Ácido carbónico Página 6 de 8 Física y Química Unidad 4. Formulación Tabla periódica con los números de oxidación 1A 2A 3B 4B 5B 6B 7B 8B 1B 2B 3A 4A 5A 6A 7A 1 H +1 -1 3 Li +1 4 Be +2 5 B +3 -3 6 C +4 +2 -4 7 N +5 +4 +3 +2 +1 -3 8 O -2 9 F -1 11 Na +1 12 Mg +2 13 Al +3 14 Si +4 -4 15 P +5 +3 -3 16 S +6 +4 +2 -2 17 Cl +7 +5 +3 +1 -1 19 K +1 20 Ca +2 33 As +5 +3 -3 34 Se +6 +4 -2 35 Br +7 +5 +3 +1 -1 37 Rb +1 51 Sb +5 +3 -3 52 Te +6 +4 -2 53 I +7 +5 +3 +1 -1 55 Cs +1 24 Cr +6 +5 +4 +3 +2 25 Mn +7 +6 +4 +3 +2 26 Fe +3 +2 27 Co +3 +2 28 Ni +2 29 Cu +2 +1 30 Zn +2 38 Sr +2 46 Pd +4 +2 47 Ag +1 48 Cd +2 50 Sn +4 +2 56 Ba +2 78 Pt +4 +2 79 Au +3 +1 80 Hg +2 +1 82 Pb +4 +2 Página 7 de 8 8A Física y Química Unidad 4. Formulación AUTOEVALUACIÓN Nombra los siguientes compuestos 1. Hg(OH)2 2. FeCl3 3. P2O3 4. CsH 5. CaSe 6. SrBr2 7. HCl 8. TeO3 9. Li2O 10. NO2 11. NaOH 12. Br2O7 13. B2S3 14. Au(OH)3 15. NH3 16. CaF2 17. CuH2 18. KI 19. NaCl 20. NiI2 21. H2SO4 Formula los siguientes compuestos 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. Óxido de hierro(III) Hidróxido de aluminio Ácido clórico trióxido de azufre bromuro de cobalto (III) pentacloruro de fósforo metano agua hidruro de potasio sulfuro de dihidrógeno sulfuro de plomo (II) hidruro de calcio heptaóxido de diyodo dióxido de carbono bromuro de estroncio tetrahidruro de silicio ácido clorhídrico óxido de magnesio yoduro de oro (III) ácido nítrico hidróxido de cobre (II) Página 8 de 8