haga click aquí
Anuncio

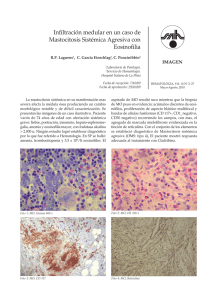
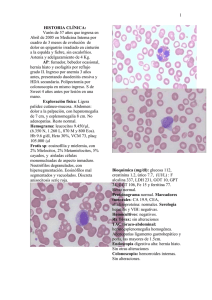
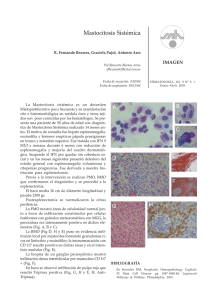
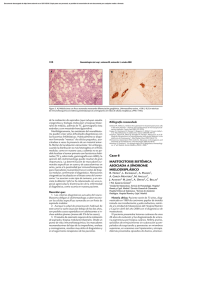
Dignóstico de las Mastocitosis Luis Escribano Unidad de Mastocitosis Laboratorio K. Frank Austen Hospital Ramón y Cajal Madrid Red Española de Mastocitosis Octubre 2006 Los mastocitos (MC) son células efectoras del sistema inmune que se originan en un precursor hematopoyético CD34+ localizado tanto en la médula ósea como en la sangre periférica y del cordón umbilical.1;2 Dicho precursor expresa los antígenos (Ags) de superficie CD34, CD13 y CD117, pero no el receptor FcεRI.2;3 La expression de c-kit (CD117) en la membrana del MC se mantiene en los elementos maduros mientras que se pierde el CD34 y, en un alto porcentaje de casos el CD13.4-6 La maduración de los MC se lleva a cabo en órganos extramedulares en los cuáles el MC adquiere características fenotípicas específicas relacionadas con su estadio de maduración y activación, el tejido en el que se localice y diversos aspectos relacionados con el microambiente,7-9 Los MC se localizan preferentemente en el tejido conectivo y son más numerosos en las zonas de posible contacto con antígenos como la dermis, dónde se localizan en la proximidad de los vasos sanguíneos, linfáticos y nervios,10 la mucosa y submucosa del tubo digestivo,11 la conjuntiva,12;13 los alvéolos pulmonares y las vías respiratorias.14 El SCF, producido por las células del estroma, y su receptor, el c-kit, localizado en la membrana del MC, son dos factores fundamentales para la proliferación15 la diferenciación y la activación de los MC.16-21 22 Asimismo, la activación del kit por su ligando, SCF, es crítica para la prevenir la apoptosis23 y para la inducción de la adhesión a fibronectinas.24 1) Kitamura Nature 1981;291:159 2) Rottem Blood 1994;84:2489 3) Kirshenbaum J. Immunol. 1991;146:1410. 4) Orfao Am.J.Pathol. 1996; 149:1493 5) Escribano Blood 1998;91:2731 6) Escribano An.Cell.Pathol. 998; 16: 151 7) Irani Proc.Natl.Acad.Sci.U.S.A 1986;83:4464 8) Lawrence J. Immunol. 1987;139:3062 9) Kitamura Annu.Rev.Immunol. 1989;7: 59 10) Cowen Br.J.Dermatol 1979;100:635 11) Strobel J.Clin.Pathol. 1981;34:851. 12) Irani J.Allergy Clin.Immunol. 1990;86:34. 13) Baddeley Clin. Exp. Allergy 1995; 25:41. 14) Schulman J.Immunol. 1982;129:2662. 15) Nocka KEMBO J. 1990;9:3287. 16) Bischoff J.Exp.Med. 1992;175:237. 17) Costa J.Exp.Med. 1996; 183:2681. 18) Valent Blood 1992;80:2237 19) Saito J.Immunol. 1996; 157:343. 20) Tsai Proc.Natl.Acad.Sci.U.S.A. 1991;88:6382. 21) Nilsson J.Immunol. 1994;153:3717. 22) Galli Adv.Immunol. 1994;55:1. 23) Yee J.Biol.Chem. 1994;269:31991. 24) Dastych.Immunol. 1994;152:213. Las mastocitosis son un grupo heterogéneo de enfermedades poco frecuentes caracterizadas por una proliferación clonal de mastocitos (MC) en diversos tejidos como la piel, la médula ósea (MO), el tubo digestivo y el hueso, entre otros. Existen diferentes formas de mastocitosis en cuanto a la edad de aparición (formas pediátricas y del adulto), el número de tejidos afectados (formas cutáneas puras y formas sistémicas) y el comportamiento clínico (indolente o agresivo). (revisado en: 1) Etiopatogenia Existen dos marcadores clave en la etiopatogenia de la enfermedad: 1) La mutación somática en la molécula del c-kit Asp816Val localizada en el bucle de activación, que se ha detectado en más del 93% de las mastocitosis del adulto y alrededor del 40% de las formas pediátricas. Esta mutación hace posible la activación (autofosforilización) del c-kit y la activación de los MC independientemente de su ligando el Stem Cell Factor (SCF).2,3 2) La existencia de un inmunofenotipo (IF) aberrante, específico de la enfermedad, en los MC de MO y otros tejidos caracterizado por la expresión de los antígenos CD25 (±CD2) y la sobre expresión de moléculas relacionadas con la activación, la adhesión y la trasducción de señales. En conjunto, todas estos cambios inmunofenotípicos sugieren una alteración profunda en los sistemas relacionados con la activación celular en las mastocitosis.4-8 Bibliografía. 1). Valent P, et al. Leuk.Res. 2001;25:603-625. 2) Longley et al. Nature Genet. 1996; 12: 312-314. 3. Garcia-Montero et al. Blood 2006 108:2366-2372. 4) Orfao et al. Am. J. Pathol. 1996;149:1493-1499. 5) Escribano et al. Cytometry 1998;34:223-228. 6) Escribano et al. Blood 1998;91:2731-2736. 7) Diaz-Agustin et al. Br.J.Haematol. 1999; 106:400-405. 8. Nuñez et al. Br.J.Haematol. 2002257-265. Alrededor del 90% de las mastocitosis del adulto son formas de buen pronóstico y, como era de esperar, la “carga mastocitaria” total en estos casos es baja. Nuestra experiencia en más de 1.000 mil estudios de médula ósea, mediante citometría de flujo, en mastocitosis y otras enfermedades nos ha permitido conocer el porcentaje de mastocitos en diversos grupos: Sujetos normales: 0.001% to 0.08% Hiperplasia de mastocitos Médula ósea reactiva: 0.1% a 0.3% Síndromes mielodisplásicos: 0.1% a 0.3% (en algunos casos) Linfoma linfoplasmocítico: 0.1% to 0.3% (en la mayoría de los casos) Mastocytosis Mastocitosis Sistémica Indolente: 0.05% a 1% Mastocitosis Sistémica agresiva: >1% Leucemia de mastocitos >30% Características citológicas de los mastocitos normales y de mastocitosis. Tomado de: Sperr, Escribano et al. Leuk Res 25:603-25, 2001. Subsets of MC-lineage cells defined by morphologic examination of primary and cultured MC Blast, type I, type II no signs of maturation, small cytoplasmic compartment, fine nuclear chromatin, nucleoli Metachromatically granulated blast = Metachromatic blast blast-like morphology; nuclear pattern as in blasts, nucleoli, few metachromatic granules (it is impossible to distinguish between mast cells and basophils at this maturation stage) Mast (cell lineage) cells: Promastocyte (= premature mast cell) Mitotic activity ! Mastocyte (mature or immature) Typical tissue mast cell (mature) variable form of cell (polymorph), nuclei bi or poly-lobulated, N/C ratio high (immature) or low (mature), nuclear chromatin fine (immature) or condensed (mature), nucleoli may be present, cytoplasm often hypogranulated (without signs of degranulation). spindle shaped or oval cell (polymorph), oval or round nucleus, excentric position of nucleus, N/C ratio high (immature) or low (mature), nuclear chromatin fine (immature) or condensed (mature) cytoplasm often hypogranulated (without signs of degranulation), surface projections common. round or oval cell, small to medium sized, round or oval nucleus, central position, condensed chromatin, low N/C ratio, cytoplasm typically well granulated, may be hypogranulated. Microscopía electrónica. Utraestructuralmente los MC de las mastocitosis presentan características específicas y es posible demostrar tanto la presencia de desgranulación cómo la internalización de diversos tipos de peroxidasa exógena (ver figuras 1A-1C) FIGURA 1A Intestino Piel Adenoides Ultraestructura de mastocitos de diversos tejidos en mastocitosis. Tomado de Escribano et al. J Histochem Cytochem 32:573 578, 1984. J Histochem Cytochem 35:213 220, 1987 Desgranulación de mastocitos de médula ósea FIGURA 1B Desgranulación en sacabocados en los mastocitosis de médula ósea en un paciente con mastocitosis sistémica. Tomado de Gabriel et al. Allergy 43:430 434, 1988. Escribano et al. Histochemistry 93:279 285, 1990. En la siguiente imagen 8Figura 1C) pueden verse como la M electrónica permite distinguir, en un caso de mastocitosis sistémica, la peroxidasa endógena de los mastocitos (flechas verdes) de la exógena (flechas rojas) captada de neutrófilos y eosinófilos. FIGURA 1C Endogenous and Exogenous Mast Cell Peroxidase Endogenous peroxidase was inhibited by AMT Cuadro clínico Existen tres tipos de manifestaciones clínicas; las que se producen como consecuencia de la liberación masiva de mediadores mastocitarios, las secundarias a la liberación crónica de los mismos y, casi exclusivamente en las formas más agresivas, las debidas a la infiltración tisular. La liberación de mediadores mastocitarios puede producir el prurito, el enrojecimiento facial y de la parte superior del tronco, sensación de calor y, a veces, palpitaciones, opresión torácica, cefalea. Los cuadros más severos con hipotensión, síncope o anafilaxia son menos frecuentes. En algunos pacientes, el cuadro clínico predominante es el dolor abdominal recurrente acompañado de diarrea. En la leucemia de mastocitos son habituales los cuadros repetidos y graves de liberación masiva de mediadores. Aunque menos habituales, los síntomas neuropsiquiátricos como los cuadros depresivos o la falta de atención deben ser tenidos en cuenta por su efecto negativo sobre el bienestar de los pacientes o sobre cu capacidad para el trabajo. En las mastocitosis sistémicas indolentes con lesión histológica en la médula ósea la osteopenia es una complicación presente en cerca del 30% de los casos (Escribano, datos no publicados). Un diagnósticotico tardío puede dar lugar a fracturas patológicas. Las lesiones óseas líticas son casi exclusivas de las formas agresivas. La infiltración tisular severa, especialmente en las formas agresivas y en la leucemia de mastocitos, puede dar lugar a signos y síntomas secundarios a la existencia de organomegalias, como el dolor, la hinchazón abdominal y las alteraciones en la circulación portal. Exploración física La afectación cutánea se produce en cerca del 90% de los casos y existen tres formas de afectación: el mastocitoma cutáneo solitario o múltiple, la urticaria pigmentosa (UP) y sus variantes y la mastocitosis cutánea difusa (MCD). El mastocitoma solitario, generalmente único, se da en los niños y suele ser una tumoración elevada, de color rojizo y de 2-3 cm de diámetro que se enrojece y se hace más prominente con el rascado En la UP las lesiones son habitualmente de pequeño diámetro, maculopapulares de color marrón y afectan a un porcentaje variable de la superficie cutánea en un pequeño porcentaje de formas pediátricas pueden aparecer vesículas y ampollas en los primeros meses de evolución. La MCD se da en los niños y existe una infiltración generalizada de la piel. Es la forma más severa de las mastocitosis pediátricas, se acompaña de cuadros agudos de liberación de mediadores, a veces con riesgo vital, y constituye una verdadera emergencia médica que requiere un diagnóstico precoz y un tratamiento intensivo desde el primer momento. La hepatoesplenomegalia palpable y las adenomegalias son habituales en las formas agresivas en las que el hiperesplenismo es relativamente frecuente y puede existir hipertensión portal y ascitis. En un pequeño porcentaje de mastocitosis indolentes se puede detectar crecimiento hepático o esplénico mediante ecografía o TAC, especialmente en casos de larga evolución. Diversas formas de afectación cutánea en las mastocitosis Diagnostic Criteria for Systemic Mastocytosis (Meeting Vienna, September 2000 ) Ver Figura 2 Major 1. Multifocal dense infiltrates of mast cells in BM and/or other extracutaneous organs Minor 2. >25% of mast cells in tissue morphologically abnormal 3. 816 codon c-kit mutation: Blood, Bone Marrow, lesional tissue * 3 . Aberrant immunophenotype (CD2 and/or CD25): Bone Marrow, blood, lesional tissue 4. Baseline total tryptase levels >20 ng/ml (not applicable if associated hematologic disease) *Currently considered as a major criteria by REMA Required Criteria a) major + 1 minor criteria or b) 3 minor criteria CRITERIOS DIAGNÓSTICOS (FIGURA 2) CD117-PE CD117 -APC FLOW CYTOMETRY CYTOLOGY 100 101 102 103 104 WDSM 100 101 102 103 104 CD2-PE CD117-PE Mast cell Hyperplasia Control-FITC 100 101 102 103 104 ISM MCL Molecular probes Immunohistochemistry (tryptase) ISM ISM CD25-FITC ASM MCL Wid-type D816V ESPECTRO DE LAS MASTOCITOSIS CUTÁNEAS (Figura 3) La lesión cutánea se produce en cerca del 90% de los casos de mastocitosis. Una vez confirmada, clínica e histológicamente, las posibilidades diagnósticas más frecuentes son las siguientes: Mastocitosis cutánea pura. Afectación de la piel y ausencia de afectación medular cuyos mastocitos son morfológicamente normales, no forman agregados, el inmunofenotipo es nomal y no se detecta la mutación D816 (ni otro tipo de mutación). Se trata de una forma excepcional en el adulto Mastocitosis sistémica indolente. Los mastocitos son morfológicamente anormales. En una primera fase (ISM I) no existen agregados, el inmunofenotipo es aberrante y se detecta la mutación del kit en más del 97% de los casos. Mastocitosis sistémica bien diferenciada. Los mastocitos están aumentados, su morfología es normal y presentan signos de desgranulación. Se observan agregados. El inmunofenotipo es normal y la mutación es negativa en más del 95% de los casos. Figura 3. El espectro de las Mastocitosis cutáneas Bone Marrow Mastocitosis cutánea pura CYTOLOGY IMMUNOPHENOTYPE C-kit CD117 -PE IMMUNOHISTOCHEMISTRY 10 0 10 1 10 2 10 3 10 4 CD25 -FITC Wild -type Control CD117 -PE ISM I 10 0 Skin 10 2 103 10 4 D816V CD25 -FITC CD117 -PE ISM II WDSM 10 1 100 WDSM: Indolent Systemic Mastocytosis; WDSM: well-differentiated systemic mastocytosis 101 - 102 103 CD25-FITC 104 Wild -type Mastocitosis sistémica agresiva A B Afectación de médula ósea (A y B) con osteoesclerosis. Pueden verse focos hipercelulares (A) que recuerdan un síndrome mieloproliferativo (A) junto a otros con fibrosis marcada (B). La figura C ilustra la aefctación esplénica. C La β-triptasa, que se acumula en los gránulos secretores de los mastocitos y se libera durante el proceso de exocitosis,1 se eleva en las situaciones clínicas asociadas con desgranulación mastocitaria masiva. En cuanto a la α-triptasa, los trabajos recientes parecen apoyar que se libera de forma constitutiva al plasma2 y sus valores normales se han establecido entre 1 y 11,5 ng/mL. La determinación de los valores de triptasa en suero ha demostrado ser útil como marcador de la activación mastocitaria en la anafilaxia y, más recientemente, como un indicador fiable de la carga mastocitaria total en las mastocitosis 2-6. Actualmente, la única técnica comercial disponible para la cuantificación de la triptasa total es el sistema UNICAPTM de Pharmacia En las mastocitosis del adulto, la triptasa total es normal en las forma cutáneas puras, está moderadamente elevada en la mayor parte de las mastocitosis indolentes y es superior a 200 ng/ml en las mastocitosis agresivas y en las leucemias de mastocitos. En las mastocitosis sistémicas indolentes, la forma clínica más frecuente en los adultos, la triptasa suele ser normal en los estadios iniciales de la enfermedad, aumenta a lo largo de los primeros años de la evolución hasta alcanzar cifras alrededor de los 35 ng/ml y se puede mantener en valores similares más de 10 años en un elevado porcentaje de pacientes (Luis Escribano, datos no publicados) sugiriendo que la carga mastocitaria total permanece estable 1. Schwartz et al. J.Clin.Invest. 1989;83:1551-1555. 2. Schwartz et al J.Clin.Invest. 1995;96:2702-2710. 3. Schwartz et al N.Engl.J.Med. 1987;316:1622-1626. 4. Van der Linden et al J.Allergy Clin.Immunol. 1992;90:110-118. 5. Sperr et al Int.Arch.Allergy Immunol. 2002;128:136-141. 6. Schwartz et al J.Immunol. 2003;170:5667-5673. La cifra de triptasa total al inicio de la enfermedad predice el comportamiento clínico de las mastocitosis pediátricas (REMA, datos no publicados) Urticaria pigmentosa (n=32) Triptasa>14 ng/ml 4/32 (12,5%) *Todos ellos desarrollaron vesículas o ampollas en las lesiones y necesitaron tratamiento intensivo. En dos de ellos fue necesario el tratamiento con PUVA Triptasa<14ng/ml 28/32 (87,5%) *Síntomas ligeros o moderados. Ninguno necesitó tratamiento intensivo Mastocitosis cutánea difusa (n=4) Triptasa: 54 ng/ml, 68 ng/ml, 69.3 y 80 ng/ml *3 casos: vesículas, ampollas, anafilaxia: ingreso en UCI + PUVA *1 caso: vesículas, ampollas. Pérdida de seguimiento. Falleció Existe una correlación entre la triptasa total y la carga mastocitaria en las mastocitosis del adulto (REMA, datos no publicados) Group CM ISM ISM SM- SM-ana ASM stage I stage II AHNMD Mean ± SD 4.2 ± 2.5 12.77 ± 8.9 76.9 ± 99 28.3 ± 22.2 50.8 ± 58.6 63.67 ± 594.7 Min-max 1.9-8.3 2.5-34.1 4.7-633* 11-67 10.4-220* 74.7-1970 No. 7 18 83 5 11 9 Excepciones MSI asociada a esclerosis ósea difusa MS asociada a anafilaxia en los episodios agudos MS asociadas a otras hemopatías que cursan con elevación de la triptasa como leucemias agudas mieloides, síndromes mielodisplásicos y síndromes hipereosinofílicos El inmunofenotipo característico de las mastocitosis Antigen CD2 CD11c CD13 CD25 CD33 CD35 CD41a CD42b CD49d CD49e CD51 CD54 CD59 CD61 CD63 CD69 CD71 CD117 Light scatter Autofluorescence Controls Mastocytosis NEG + (71%) + (33%) NEG ++/+++ (100%) NEG** NEG NEG +/++ (100%) + (100%) + (100%) + (75%) + (100%) + (66%) ++ (100%) + (100%) + (100%) +++ (100%) + (63%)FITC/++ (92%) PE +/++ (100%) + (75%) ++ (100%) +++ (100%) ++ (100%) + (45%) + (45%) +/++ (80%) + (30%) + (45%) ++ (100%) +++ (100%) + (22%) +++ (100%) ++/+++ (100%) + (38%) ++ (100%) ++ ++ +++ +++ In red the most representative markers for diagnosis TOMADO DE: 1. Orfao et al. Am. J. Pathol. 1996;149:1493 2. Escribano et al. Cytometry 1998;34:223 3. Escribano et al. Blood 1998;91:2731 4. Diaz-Agustin et al. Br.J.Haematol. 1999; 106:400 5. Nuñez et al. Br.J.Haematol. 2002257-265. 256 512 768 1024 10 FSC-Height 10 1 10 CD2–FITC 1 10 2 10 3 10 4 10 2 10 3 10 4 0 10 1 10 2 10 3 10 4 10 3 10 4 CD45 -FITC CD25 -PE 0 10 CD34 -FITC CD117-PE 10 0 CD117-PE 0 CD33-PE CD117-PE TRANSFORMED SSC Immunophenotype of BMMC in mast cell leukemia 10 10 0 10 1 10 2 CD11c–FITC 10 3 10 4 0 10 1 10 2 CD69-FITC 256 512 100 768 1024 101 102 103 104 CD25-FITC CD117-PE CD117-PE FSC-Height 100 101 102 103 104 100 101 102 103 104 CD2-FITC 0 256 512 768 1024 FSC-Height -> 101 102 103 104 100 101 CD25 PE 102 103 104 102 103 104 CD69-FITC Ascitic fluid 0.013% 100 101 102 103 104 Pleural efussion 0.013% 100 101 CD35-FITC CD25-FITC CD117-APC Transformed SSC FITC CD117-PE 100 Spleen 0.3% CD117-PE 0 CD117-PE CD117-PE TRANSFORMED SSC Aggressive systemic mastocytosis. Utility of Flow Cytometry in the Detection of Clonal Mast Cells in Tissues other than Bone Marrow Multilineal involvement in mastocytosis Systemic mastocytosis is a disorder of a hematopoietic progenitor cell capable of giving rise to not only mast cells but other hematopoietic lineages In a prospective study carried out in a group of 113 adult mastocytosis we have found the presence of D816V c-kit mutation in virtually all adults (93%) with indolent and aggressive forms of SM, except Well-differentiated SM (29%), while other c-kit mutations were rarely (<3%) detected. In around one third of patients with mutated mast cells, the c-kit mutation was also detected in CD34+ haematopoietic cells (34%) and eosinophils (31%), and, to a lower extent, in monocytic and neutrophil-lineage BM precursors cells (both 21%). Most poor-prognosis SM cases (81%) carried the c-kit mutation in two or more BM myeloid cell populations while this was only detected in a small proportion (27%) of indolent cases (p=0.02). In summary, our results support the notion that c-kit mutation is a hallmark of SM in adults where it targets a pluripotent haematopoietic stem cell. The prognostic significance of these observations in indolent systemic mastocytosis for the prediction of the clinical outcome disease requires further investigation in a large series of cases with long follow-up. García Montero et al. (REMA) Blood. 2006 Oct 1;108(7):2366-72 Prevalence of c-kit point mutation in adult mastocytosis Total cases Cases with c-kit mutation on BM mast cells Mast cells MCL 5/6 (83%) Mast cells CD34+ HPC Eosinophils Monocytes Neutrophils 2/2 2/2 1/1 N.A. 1/1 9/38 (24%) 9/42 (21%) 4/37 (11%) 3/37 (8%) ISM 72/74 (97%) 43/43 SM-ana 14/14 (100%) 13/13 0/13 0/13 0/13 0/13 WDSM 2/7 (28%) 2/2 1/2 0/2 0/2 0/2 ASM 6/6 (100%) 5/5 3/4 4/5 3/4 4/5 SMAHNMD 13/13(100%) 9/9 6/9 5/8 4/7 TOTAL 105/113 (93%) 20/65 (31%) 12/57 (21%) 12/58 (21%) 6/9 21/61 (34%) García Montero et al. (REMA) Blood. 2006 Oct 1;108(7):2366-72 Pruebas diagnósticas en las mastocitosis del adulto Recuento y fórmula, bioquímica, coagulación Ferritina, Vitamina B12 folatos Triptasa Metabolismo óseo Estudios en tejidos Biopsia de piel: si existe lesíon cutánea Aspirado y biopsia de médula ósea Citología e histología (triptasa, c-kit) Inmunofenotipo por citometría de flujo (CD25, CD2) Biología molecular: mutaciones c-kit (piel) Estudios de imagen Ecografía abdominal, densitometría ósea, RX de huesos, TAC, Pruebas diagnósticas en las mastocitosis pediátricas Recuento y fórmula, bioquímica, coagulación Ferritina, Vitamina B12 folatos Triptasa Estudios en tejidos Biopsia de piel Histología (triptasa, c-kit) Biología molecular: mutaciones c-kit Inmunofenotipo por citometría de flujo (CD25, CD2)?? Estudios de imagen Ecografía abdominal Clasificación de las mastocitosis del adulto (n=174). REMA, Junio 2005 Formas de buen pronóstico 156/174 (89,6%) MC: 8 (4.6%) Con lesión cutánea 140/156 MSI: 126 (72%) MSBD: 6 (3.4%) MS-anafilaxia: 12 (6.9%) MS aislada de MO: 3 (1.7%) Mastocitoma óseo: 1 (0.5%) Formas de mal pronóstico 18/174 (10,4%) MSA: 9 (5%) 1 con lesión cutánea MS-AHNMD: 6 (3.4%). 4 con lesión cutánea Leucemia de Mastocitos: 2 (1%) Diagnostic algorythm in adult mastocytosis with skin lesions with neither symptoms nor sings of aggressivity Skin biopsy compatible Bone marrow study Normal MC morphology normal MC percentaje No MC aggregates CD25- MC No c-kit mutation Normal MC morphology Increased MC percentaje MC aggregates CD25- MC No c-kit mutation Abnormal MC morphology Increased MC percentaje ± MC aggregates CD25++ MC D816V mutation (≈97%) Pure cutaneous Mastocytosis Well-differentiated Systemic Mastocytosis Indolente Systemic Mastocytosis without AHNMD Algoritmo diagnóstico en mastocitosis del adulto sin lesión cutánea y con cuadros recurrentes de anafilaxia o colapso vascular Triptasa basal elevada Estudio completo de alergia Desencadenante detectado Desencadenante no detectado Evitar de forma estricta el (los) alérgeno (s) o anticuerpo (s) responsable (s) Repetir triptasa cada 2 meses Estudio de médula ósea No criterios de mastocitosis Si persiste elevada Criterios de mastocitosis Proseguir el estudio de alergia Mastocitosis sistémica sin lesión cutánea asociada a anafilaxia recurrente o colapso vascular Algoritmo diagnóstico básico en mastocitosis pediátricas (urticaria pigmentosa y mastocitosis cutánea difusa) Lesión cutánea sugestiva Biopsia cutánea (histología y estudio de mutaciones del c-kit) Compatible Estudio analítico básico Control estricto de la evolución cada 6-8 meses (hasta que se confirme la regresión absoluta de la enfermedad) Evolución de las mastocitosis pediátricas Control estricto hasta regresión completa Piel + (Biopsia)* Triptasa persistencia tras la pubertad o complicaciones CURACIÓN ≈ 85%?? Biopsia MO * IF Normal Morfología MC normal. No agregados MC No mutación c-kit Mastocitosis cutánea pura Inmunofenotipo normal Aumento MC de MO con morfología normal. Agregados MC No mutación c-kit Mastocitosis sistémica Bien diferenciada Morfología MC normal CD25++ (+/- agregados MC) Mastocitosis sistémica indolente *Estudio de las mutaciones de c-kit en mastocitos (Triptasa normal) Organomegalias Morphología MC anormal CD25++ Agregados MC Mastocitosis sistémica agresiva Actuarial survival. REMA, datos no publicados Kaplan-Meier N=176 (11 -6%- inicio pediátrico 1,0 Cumulative probability of survival ASM+MCL CM + IBMM + SM-ana + WDSM 0,8 ISM SM-AHNMD ASM + MCL censored 0,6 CM + IBMM + SM-ana + WDSM censored ISM-censored SM-AHNMD censored 0,4 0,2 Cum Survival 0,0 0,0 100,0 200,0 300,0 400,0 500,0 Time (months) No. at risk 170 92 53 17 CM: pure cutaneous mastocytosis (n=7); IBMM: isolated bone marrow mastocytosis (n=3); SM-ana: systemic mastocytosis without skin involvement associated to recurrent anaphylaxia or vascular collapse (n=14); WDSM: welldifferentiated systemic mastocytosis (n=6); ISM: indolent systemic mastocytosis (n=131); SM-AHNMD: associated to other hematological clonal disease; ASM: aggressive systemic mastocytosis (n=6); MCL: mast cell leukemia (n=4). Evolución del número de casos de nuevo diagnóstico vistos en la Unidad de Mastocitosis del Hospital Ramón y Cajal 72 80 70 60 50 40 30 20 10 0 70 43 21 re ) 4 tu b 20 0 5 (o c 20 0 3 20 0 2 20 0 1 0 20 0 9 19 9 8 19 9 7 19 9 6 5 19 9 5 19 9 14 11 20 0 13 6 Adultos 31 28 49 40 33 27 Niños 15 5 ) br e (s ep tie m 20 04 20 0 20 03 20 02 20 01 4 1 20 00 19 99 60 50 40 30 20 10 0 Año 2005 Pacientes nuevos: 117 adultos y 67 niños Revisiones: 362 adultos y 62 niños La creación de Unidades Monográficas es una base fundamental para la prevención, el diagnóstico y el tratamiento de las “enfermedades poco frecuentes” El control, directo o indirecto, de los pacientes con enfermedades poco frecuentes en estas Unidades influye tanto en la calidad de vida como en el pronóstico En las enfermedades poco frecuentes la transferencia de información desde las Unidades Monográficas a todos los médicos es una obligación ética Para ello deben disponer de protocolos específicos para la prevención, el diagnóstico y el tratamiento; así como un sistema de información telefónico y por correo electrónico que esté disponible las 24 horas Hospital Ramón y Cajal Unidad de Mastocitosis R Núñez, L Sánchez, Carolina Ruiz, Lucía Morago Servicio de Alergia Belén de la Hoz, David González Servicio de A. Patológica Mónica García-Cosío Servicio de Dermatología Isabel Aldanondo, Teresa Gárate Servicio de Inmunología Manuela Cuevas Servicio de Pediatría UCI Adultos UCI Pediátrica Servicio de Anestesia Hospital Virgen del Valle, Toledo Próximamente me trasladaré al Hospital Virgen del Valle de Toledo dónde se creará un nuevo Centro de Referencia (“Centro de Estudios de Mastocitosis”) Los detalles sobre la fecha de apertura, teléfonos, correo electrónico, etc, aparecerán el la página web de la Asociación Española de Pacientes con Mastocitosis www.aedm.org Contacto: [email protected] Red Española de Mastocitosis Hospital Ramón y Cajal ( Madrid ) Luis Escribano. Centro de investigación del Cáncer Alberto Orfao Universidad de Malaga Francisca Sánchez Jiménez Universidad de Santiago de Compostela Luis Botana Instituto de Salud Carlos III Mercedes Domínguez Hospital del Niño Jesús Antonio Torrelo Hospital Universitario de Albacete Sonia Herrero José Manuel Azaña Hospital Virgen de la Salud, Toledo Olivia López Barrantes Agradecimientos Instituto de Salud Carlos III Dirección General de Investigación de la CAM Fundación MMA Fundación J. Cortés Martínez