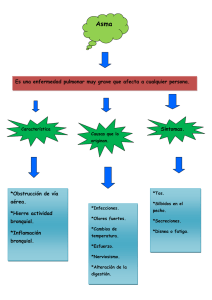
revista numero 5
Anuncio

Alergia Revista ISSN-0025151 Volumen 57 Número 5 Septiembre-octubre 2010 México Órgano oficial del Colegio Mexicano de Inmunología Clínica y Alergia, AC y de la Sociedad Latinoamericana de Alergia, Asma e Inmunología EDITORIAL 133 Inmunodeficiencias primarias: reto emergente en países en desarrollo Martín Becerril Ángeles ARTÍCULOS ORIGINALES 135 146 153 Tos crónica en pediatría. Revisión y análisis José Antonio Sacre Hazouri Prevalencia de asma en adolescentes. Relación con el sexo y el tabaquismo activo Irma Aída Torres Fermán, Francisco Vázquez Nava, Ricardo Antonio Calafell Ceballos, Eliza Mireya Vázquez Rodríguez, Víctor Manuel Almeida Arvizu, María del Carmen Barrientos Gómez, Dolores Lin Ochoa, José Peinado Herreros, María Concepción Iribar Ibabe Prevalencia de la hipersensibilidad al polen de Cupressus en pacientes alérgicos en Monterrey, México Liborio Rafael Leal García, Sandra Nora González Díaz, María del Carmen Zárate Hernández, Alfredo Arias Cruz, Lucía Leal Villarreal, María Amelia Manrique López, Dora Alicia Valdés Burnes ARTÍCULO DE REVISIÓN 159 Panorama epidemiológico de las inmunodeficiencias primarias en México Erika Coria Ramírez, Sara Espinosa Padilla, Francisco Espinosa Rosales, María Eugenia Vargas Camaño, Lizbeth Blancas Galicia CASOS CLÍNICOS 164 El mejor foro de exposición de la Alergia en México, Ahora con la participación de la WAO y el Simposium de GLORIA 171 176 Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton María Guadalupe Román Jiménez, Marco Antonio Yamazaki Nakashimada, Lizbeth Blancas Galicia Síndrome de Wiskott-Aldrich María Guadalupe Román Jiménez, Marco Antonio Yamazaki Nakashimada, Lizbeth Blancas Galicia Neutropenia congénita grave Wilmer Córdova Calderón, Javier Pérez Rojas, César Galván Calle, Lizbeth Blancas Galicia WORLD ALLERGY ORGANIZATION- IA ACI Registrada en Index Medicus. Periódica (http://dgb.unam.mx/periodica.html). Health Sciences Serials (SERLINE) Bibliomex (UNAM) EMBASE/Excerpta Médica. Consejo Nacional de Ciencia y Tecnología (CONACyT). Centro Nacional de Información y Documentación en Salud (CENIDS). Index Medicus Latinoamericano (IMLA) LILACS, Directorio de Revistas Latindex (http://www.latindex.org) y en la Base de Datos Internacional de EBSCO (MedicLatina). Alergia REVISTA MEXICO Órgano Oficial del Colegio Mexicano de Inmunología Clínica y Alergia, A.C. Editor en Jefe Dr. Martín Becerril Ángeles (e-mail: [email protected]) Asesor del Editor en Jefe Dr. Francisco Espinosa Larrañaga Coeditores Dr. Juan José Luis Sienra Monge, Dr. Ricardo Lascurain Ledesma Editor Emérito Dr. Jesús Pérez Martín Editores Asociados Dr. Daniel Aguilar Ángeles Dr. Humberto Ortega Gómez Dr. Juan Espinoza Ayala Dr. Álvaro Pedroza Meléndez Dr. Víctor Manuel Almeida Dra. Sandra González Díaz Dr. Arnulfo Nava Zavala Dr. Renato Berrón Pérez Dr. Ricardo L. Guido Bayardo Dra. Blanca Estela del Río Navarro Consejo Editorial Dr. Jorge Guillén Toledo Dra. Nelly Ramírez Chanona Dra. Nelly Cisneros Dr. Juan Carlos Ivancevich Dr. Noel Rodríguez Pérez Dr. José G. Huerta López Dr. Joaquín Esquer Flores Dr. Gerardo T. López Pérez Dra. María Isabel Rojo Gutiérrez Consejo Editorial Internacional Oscar Aldrey (Caracas, Venezuela) Jean Bousquet (Montpellier, Francia) G. Walter Canonica (Génova, Italia) Álvaro Cruz (Salvador, Brasil) Robert N. Hamburger (Estados Unidos) Richard F. Lockey (Florida, Estados Unidos) Charles K. Naspitz (San Pablo, Brasil) Todor Popov (Sofía, Bulgaria) José Rosado Pinto (Lisboa, Portugal) Joaquín Sastre (Madrid, España) Susan Tarlo (Toronto, Canadá) Paulo Barrera Perigault (Panamá, Panamá) Attilio Boner (Verona, Italia) Fernán Caballero (Caracas, Venezuela) Ana Luz Caballero Sibrián (San Salvador, San Salvador) Luis Caraballo (Cartagena, Colombia) Adnan Custovic (Manchester, Reino Unido) Allen Kaplan (Carolina del Sur, Estados Unidos) Javier Mallol (Santiago, Chile) Hugo E. Neffen (Santa Fe, Argentina) Jorge Quel (Estados Unidos) Natalio Salmun (Buenos Aires, Argentina) Revaz Sepiashvili (Moscú, Rusia) Alkis Togias (Maryland, Estados Unidos) Consejo Directivo 2009-2011 Carlos D. Crisci (Rosario, Argentina) Luis Delgado (Porto, Portugal) Connie Katelaris (Sidney, Australia) Rubén Martínez Pichardo (Matanzas, Cuba) Gianni Passalacqua (Génova, Italia) Johannes Ring (Munich, Alemania) Mario Sánchez Borges (Caracas, Venezuela) Horacio M. Serra (Córdoba, Argentina) Daniel Vervloet (Marsella, Francia) Dra. María Isabel Rojo Gutiérrez Dr. Mario Alberto Bermejo Guevara Presidente Secretario 1 Dr. Raúl Humberto Barnica Alvarado Dr. Miguel Alejandro Medina Ávalos Vicepresidente Tesorero 1 Presidentes de Capítulo 2009-2011 Sureste: Dr. Sergio de Jesús Romero Tapia Metropolitano: Dr. José Cariño Vázquez Noreste: Dr. Juan Antonio Medina Adame Sergio Bonini (Roma, Italia) Mario Calvo Gil (Valdivia, Chile) Víctor H. Croce (Córdoba, Argentina) Eduardo Egea (Colombia) Mark Larche (Londres, Reino Unido) Fabio Morato Castro (San Pablo, Brasil) Ruby Pawankar (Tokio, Japón) Cristian Rodríguez (Santiago, Chile) María Luisa Sanz (Navarra, España) Dirceu Solé (San Pablo, Brasil) Sally Wenzel (Colorado, Estados Unidos) Dra. Ana Luisa López González Dra. María Antonia Rivera Gómez Secretario 2 Comisario Dra. Désirée Erlinda Sophia Dra. Doris Nereida López Lizárraga Larenas Linnemann Presidente Coordinador Local Tesorero 2 Centro: Dr. Rodolfo Celio Murillo Centro Occidente: Dr. Carlos Correa Serrano Noroeste: Dr. Héctor Stone Aguilar Colegio Mexicano de Inmunología Clínica y Alergia, A.C. Antonio M. Anza núm. 27, Colonia Roma, 06700, México, DF. Tel. 55742435. E-mail: [email protected]. Consulte el contenido completo en: www.nietoeditores.com.mx Alergia REVISTA MEXICO Volumen 57, número 5, septiembre-octubre, 2010 CONTENIDO Contents EDITORIAL EDITORIAL 133 133 Inmunodeficiencias primarias: reto emergente en países en desarrollo Martín Becerril Ángeles Primary immunodeficiencies: an emerging challenge in developing countries Martín Becerril Ángeles ARTÍCULOS ORIGINALES ORIGINAL ARTICLES 135 146 135 146 153 Tos crónica en pediatría. Revisión y análisis José Antonio Sacre Hazouri Prevalencia de asma en adolescentes. Relación con el sexo y el tabaquismo activo Irma Aída Torres Fermán, Francisco Vázquez Nava, Ricardo Antonio Calafell Ceballos, Eliza Mireya Vázquez Rodríguez, Víctor Manuel Almeida Arvizu, María del Carmen Barrientos Gómez, Dolores Lin Ochoa, José Peinado Herreros, María Concepción Iribar Ibabe Prevalencia de la hipersensibilidad al polen de Cupressus en pacientes alérgicos en Monterrey, México Liborio Rafael Leal García, Sandra Nora González Díaz, María del Carmen Zárate Hernández, Alfredo Arias Cruz, Lucía Leal Villarreal, María Amelia Manrique López, Dora Alicia Valdés Burnes 153 Chronic cough in pediatrics. Review and analysis José Antonio Sacre Hazouri Asthma prevalence in adolescents. Relation to sex and active smoking Irma Aída Torres Fermán, Francisco Vázquez Nava, Ricardo Antonio Calafell Ceballos, Eliza Mireya Vázquez Rodríguez, Víctor Manuel Almeida Arvizu, María del Carmen Barrientos Gómez, Dolores Lin Ochoa, José Peinado Herreros, María Concepción Iribar Ibabe Prevalence of hypersensitivity to Cupressus pollen in allergic patients in Monterey, Mexico Liborio Rafael Leal García, Sandra Nora González Díaz, María del Carmen Zárate Hernández, Alfredo Arias Cruz, Lucía Leal Villarreal, María Amelia Manrique López, Dora Alicia Valdés Burnes ARTÍCULO DE REVISIÓN REVIEW ARTICLE 159 159 Panorama epidemiológico de las inmunodeficiencias primarias en México Erika Coria Ramírez, Sara Espinosa Padilla, Francisco Espinosa Rosales, María Eugenia Vargas Camaño, Lizbeth Blancas Galicia Epidemiological view of primary immunodeficiencies in Mexico Erika Coria Ramírez, Sara Espinosa Padilla, Francisco Espinosa Rosales, María Eugenia Vargas Camaño, Lizbeth Blancas Galicia CASOS CLÍNICOS CLINICAL CASES 164 164 171 176 Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton María Guadalupe Román Jiménez, Marco Antonio Yamazaki Nakashimada, Lizbeth Blancas Galicia Síndrome de Wiskott-Aldrich María Guadalupe Román Jiménez, Marco Antonio Yamazaki Nakashimada, Lizbeth Blancas Galicia Neutropenia congénita grave Wilmer Córdova Calderón, Javier Pérez Rojas, César Galván Calle, Lizbeth Blancas Galicia 171 176 Satisfactory evolution of a patient diagnosed in childhood with Bruton’s disease María Guadalupe Román Jiménez, Marco Antonio Yamazaki Nakashimada, Lizbeth Blancas Galicia Wiskott-Aldrich syndrome María Guadalupe Román Jiménez, Marco Antonio Yamazaki Nakashimada, Lizbeth Blancas Galicia Severe congenital neutropenia Wilmer Córdova Calderón, Javier Pérez Rojas, César Galván Calle, Lizbeth Blancas Galicia Revista Alergia México es una publicación bimestral, órgano oficial del Colegio Mexicano de Inmunología Clínica y Alergia, AC y de la Sociedad Latinoamericana de Alergia, Asma e Inmunología. Editor responsable: Enrique Nieto R. El contenido de los artículos es responsabilidad directa de los autores y no necesariamente refleja el punto de vista de los patrocinadores. Los derechos autorales de los trabajos científicos son propiedad exclusiva del Colegio Mexicano de Inmunología Clínica y Alergia, AC, por lo que para cualquier tipo de reproducción, total o parcial por cualquier medio, impreso o electrónico, se requerirá la autorización escrita del editor. © 2002 Colegio Mexicano de Inmunología Clínica y Alergia, AC. Número de Certificado de Licitud de Título: 12350 y de Contenido: 9913. Número de Reserva de Título en Derechos de Autor: 04-2008-011713154800-102. Autorizada como publicación periódica por Sepomex, núm. de registro: PP09-1500. Publicación indizada en Periódica (http://dgb.unam.mx/periodica.html), en el Directorio de Revistas Latindex (http://www.latindex.org) y en la Base de Datos Internacional de EBSCO (MedicLatina). Publicación realizada, comercializada y distribuida por EdiCIÓN Y FARMACIA, SA de CV. Domicilio de la publicación: Calle E, manzana 8, número 1, colonia Educación, CP 04400, México, DF. Tel.: 5678-2811. Fax: 5544-3225. Correo electrónico: [email protected] Impresa en: Roma Color SA de CV. Pascual Orozco 70, colonia San Miguel Iztacalco, CP 08650, México, DF. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Revista Alergia México 2010;57(5):133-134 Editorial Inmunodeficiencias primarias: reto emergente en países en desarrollo E l origen de la inmunología está históricamente ligado a las enfermedades infecciosas; el primer registro relacionado trata de la protección que contra la viruela logró en 1798 Edward Jenner, quien inoculó la pus de las úlceras de una granjera con viruela en los brazos de un niño sano de ocho años, quien mostró inmunidad contra los intentos posteriores en los que se le quería causar viruela.1 A partir del siglo XIX el trabajo que muchos investigadores han hecho en modelos animales y humanos, ya sean sanos o enfermos, ha dilucidado los mecanismos de la respuesta inmunitaria. La publicación del primer caso de agammaglobulinemia, que fue el caso de un niño de ocho años de edad con infecciones neumocócicas recurrentes y ausencia de gammaglobulina y que publicó Ogden Bruton en 1952, se considera el origen del estudio y de la atención a las inmunodeficiencias, a pesar de que antes se publicaron casos de neutropenia (en Alemania en 1922), ataxia-telangiectasia (en París en 1926), candidiasis mucocutánea (en 1929), síndrome de Wiskott-Aldrich (en Alemania en 1937) e inmunodeficiencia combinada grave, entonces llamada “agammaglobulinemia tipo suizo” (en 1950).1 La importancia clínica que las inmunodeficiencias han adquirido en los últimos años ha sido favorecida por la disponibilidad de más y mejores técnicas de laboratorio y por una mayor cantidad de artículos que sobre dicho tema se han publicado. De suma importancia son los lineamientos diagnósticos y terapéuticos del Comité de Expertos en Inmunodeficiencias Primarias de la Unión Internacional de Sociedades Inmunológicas, ya que cada dos años actualizan la clasificación de estas enfermedades y difunden los mecanismos moleculares y celulares de éstas.2 Otro aspecto relevante es que los www.nietoeditores.com.mx países de la región, además de compartir programas de tratamiento, han integrado sus registros de inmunodeficiencias primarias en las bases de datos, que día a día se aproximan a la prevalencia real de las inmunodeficiencias que ocurren en cada país. En este número se exponen varios artículos sobre inmunodeficiencias. Uno de ellos, Panorama epidemiológico de las inmunodeficiencias primarias en México, expone –además de los casos mexicanos– algunos resultados de los reportes que en 1998 y 2007 publicó el Grupo Latinoamericano de Inmunodeficiencias Primarias. El reporte de 2007 abarcó 12 países (cuatro países más que en 1998) y 3,321 pacientes (1,893 pacientes más que en 1998), en quienes las deficiencias de anticuerpos (53%) fueron las inmunodeficiencias primarias más frecuentes. En dicho artículo se menciona que la Fundación Mexicana para Niños y Niñas con Inmunodeficiencias Primarias atiende gratuitamente a los pacientes debido a que es una organización no lucrativa. En México, además del Instituto Nacional de Pediatría, otros hospitales de tercer nivel cuentan con clínicas de inmunodeficiencias. El trabajo coordinado del grupo latinoamericano semeja el trabajo que 39 países europeos hacen en la red ESID, con casi 7,500 pacientes y 20% de ellos con inmunodeficiencia común variable.3 En otras regiones hay países que trabajan individualmente, de ahí que sus estadísticas sean diferentes en número de casos y en proporción de tipos de inmunodeficiencias. En este número también se publica el caso de un niño de seis años con agammaglobulinemia de Bruton; el diagnóstico, sustentado inicialmente por una concentración de 199 mg/dL de IgG, se confirmó con una mutación en el gen BTK. El paciente tuvo una evolución clínica satisfactoria, sin infecciones y con administración regular de inmunoglobulina intravenosa. Otro caso de inmunodeficiencia primaria es el de un niño de tres años con síndrome de Wiskott-Aldrich y con antecedente de Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 133 Editorial muerte temprana de un familiar de primer grado. El cuadro clínico fue característico, con trombocitopenia, anemia, eccema e infecciones graves y frecuentes. Un año después del diagnóstico se le hizo un trasplante de sangre de cordón umbilical, que fue fallido, de ahí que cuatro semanas después falleciera por choque séptico. El último caso de inmunodeficiencia es el de una niña con neutropenia congénita grave y con infección perineal en la primera semana de vida; fue diagnosticada por neutrófilos de 355 cel/mm3 y aspirado de la médula ósea, con detención de la maduración mieloide. El tratamiento temprano, desde el mes y medio de vida, con factor estimulante de colonias de granulocitos –en dosis ajustadas para normalizar la cuenta de neutrófilos y prevenir infecciones– ha hecho posible que la paciente tenga buena calidad de vida, sin más procesos infecciosos graves. Hasta hace pocos años las inmunodeficiencias primarias eran un problema porque en los planes de salud de muchos países, principalmente en los países en desarrollo, no se habían atendido debidamente. En la actualidad se cuenta con clasificaciones actualizadas frecuentemente, se conocen mejor los mecanismos responsables de los defectos moleculares o celulares y están bien descritos los genotipos y fenotipos para varias afecciones. Ante una sospecha clínica fundamentada de inmunodeficiencia, en pacientes de cualquier edad, las técnicas de laboratorio actuales de diagnóstico posibilitan, incluso en etapas prenatales, una detección oportuna. Las opciones de tratamiento, de acuerdo con la enfermedad, incluyen el uso de IgG intravenosa en presentaciones procesadas mediante pasteurización, pH bajos con pepsina o con solventes-detergentes, diversas citocinas –como la G-CSF (indicada en neutropenias), el IFN-γ (indicada en enfermedad granulomatosa crónica), la IL-2 (indicada en inmunodeficiencia combinada grave), etc.– y el trasplante de células madre hematopoyéticas de donadores idénticos (indicado, como primera 134 opción, en inmunodeficiencia combinada grave), con supervivencia de 90% a cinco años; el trasplante también ha sido eficaz, entre otras enfermedades, en el síndrome de Wiskott-Aldrich y en la deficiencia de adhesión leucocitaria; la terapia génica ha mostrado a largo plazo restauración de la respuesta inmunitaria en inmunodeficiencia combinada grave ligada al cromosoma X y en la variedad con deficiencia de adenosina desaminasa, aunque en enfermedad granulomatosa crónica el efecto ha sido transitorio; sin embargo, los vectores retrovirales de esta terapia pueden inducir enfermedades leucoproliferativas.4,5 De acuerdo con las condiciones actuales de investigación epidemiológica y clínica, difusión científica y colaboraciones internacionales, esperamos contar en los próximos años con mejores recursos para ofrecer una atención médica adecuada, que disminuya la mortalidad y eleve la calidad de vida de los pacientes con inmunodeficiencias primarias. Dr. Martín Becerril Ángeles REFERENCIAS 1. Stiehm ER, Johnston RB Jr. A history of pediatric immunology. Pediatr Res 2005;57:458-467. 2. Notarangelo LD, Fischer A, Geha RS, Casanova JL, et al. International Union of Immunological Societies Expert Committee on Primary Immunodeficiencies. J Allergy Clin Immunol 2009;124:1161-1178. 3. Gathmann B, Grimbacher B, Beauté J, Dudoit Y, et al. The European internet-based patient and research database for primary immunodeficiencies: results 2006-2008. Clin Exp Immunol 2009;157:S3-11. 4. Gennery AR, Slatter MA, Grandin L, Taupin P, et al. Transplantation of hematopoietic stem cells and long-term survival for primary immunodeficiencies in Europe: entering a new century, do we do better? J Allergy Clin Immunol 2010;126:602-610. 5. Kohn DB. Update on gene therapy for immunodeficiencies. Clin Immunol 2010;135:247-254. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Revista Alergia México 2010;57(5):135-145 Artículo original Tos crónica en pediatría. Revisión y análisis José Antonio Sacre Hazouri* RESUMEN Objetivo: revisar y analizar la bibliografía sobre tos crónica en niños. Material y métodos: se buscaron en PubMed artículos relevantes con las palabras clave tos, tos crónica, tos crónica en pediatría, tos persistente y reflujo gastroesofágico en niños. Resultados: la tos en los niños es común, y en la mayor parte de los casos es indicio de infecciones respiratorias. Raramente se vincula con enfermedades graves, aunque debe valorarse en todos los niños que la sufran durante más de ocho semanas; se recomienda hacer una historia clínica cuidadosa, examen físico, telerradiografía de tórax y espirometría (si la edad del paciente lo permite). Si el diagnóstico no es evidente (tos no específica), será útil el abordaje de acuerdo con las características de la tos húmeda-productiva o seca; en cada caso, el tratamiento debe basarse en el origen del padecimiento. Si esto no es posible, se indica una prueba terapéutica con corticoides inhalados en niños con tos seca (posibilidad de asma) y con antimicrobianos en tos productiva (posibilidad de bronquitis bacteriana prolongada [BBP] o sinusitis). En caso de no observarse respuesta favorable en el tiempo esperado, deberá suspenderse el tratamiento, analizar el caso y considerar diagnósticos alternativos. Las causas múltiples deben ser tratadas en forma simultánea. Habrá que tener cuidado con la administración indiscriminada de medicamentos contra la tos y resfriado de venta al público, ya que provocan efectos adversos importantes. Conclusiones: la historia clínica y el examen físico, aunados a investigaciones exhaustivas, permiten elaborar el diagnóstico correcto en la mayoría de los casos de tos crónica. En las Figuras 1 y 2 se resumen el abordaje diagnóstico y la toma de decisiones. En los casos difíciles, complejos o raros, se sugiere referir al paciente al pediatra especialista en inmunología clínica, alergia y enfermedades respiratorias. Palabras clave: tos, tos crónica en niños, mecanismos de tos, reflujo gastroesofágico en niños. ABSTRACT Objective: To review and to analyze the existing literature regarding chronic cough in children. Material and methods: We searched published articles in PubMed using the key words: cough, chronic cough, chronic cough in children, persistent cough, gastroesophageal reflux in children. Results: Cough in children is common; the majority of cases reflect respiratory infections. Cough is rarely associated to a serious disorder. All children with cough persisting for more than 8 weeks should be evaluated. A careful history, physical examination, chest x-ray, and spirometry (in an able child) are recommended for all children with chronic cough. If a diagnosis is no evident (nonspecific cough), then an approach based on characterizing the cough as “wet” or “dry” is helpful. In each case, specific etiology-based treatment is recommended when possible; otherwise, a therapeutic trial is indicated with inhaled corticosteroids (ICS) for children with dry cough (for possible asthma) and antibiotics for wet cough (for possible protracted bacterial bronchitis [PPB] or sinusitis). The treatment should be reviewed within the specified time frame for normal response. If no effect is obvious, the treatment should be stopped and alternative diagnosis considered. Multiple etiologies may need to be treated concomitantly. Every effort should be made to identify the underlying cause. Data suggests potential harmful effects of medications used for symptomatic relief of acute or chronic cough in children. Conclusions: Medical history and physical examination, together with appropriate investigations allow the correct diagnosis of chronic cough. The diagnostic approach is summarized in Figures 1 and 2. Most cases can be managed with this algorithm. For the difficult, complex and rare cases referral to a Pediatric specialist in Allergy, Clinical Immunology and Respiratory Diseases is warranted. Key words: cough, chronic cough in children, cough mechanisms, gastroesophageal reflux in children. * Profesor de posgrado en pediatría, inmunología-alergia y neumología, Universidad Veracruzana. Inmunología clínica, alergia, rinología y pediatra. Instituto Privado de Alergia, Inmunología y Vías Respiratorias (INPAIR), Córdoba, Veracruz, México. Correspondencia: Dr. José Antonio Sacre Hazouri. Av. 9 núm. 1808, esq. calle 20, col. San José, CP 94560, Córdoba, Veracruz, México. Correo electrónico: [email protected] Recibido: agosto, 2010. Aceptado: octubre, 2010. Este artículo debe citarse como: Sacre-Hazouri JA. Tos crónica en pediatría. Revisión y análisis. Rev Alerg Mex 2010;57(5):135-145. www.nietoeditores.com.mx Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 135 Sacre Hazouri JA L a tos es el síntoma por el que más comúnmente se busca atención médica;1 en los niños se relaciona con infecciones de la vía respiratoria superior y se resuelve de manera espontánea. De 35 a 40% de los niños en edad escolar tosen incluso 10 días después de contraer un resfriado común, y 10% de los preescolares lo hacen 25 días después de sufrir una infección de la vía respiratoria superior.2 La tos se vincula con factores ambientales como los contaminantes intra y extramuros (materia particulada y gases irritantes), y la exposición a tabaco y humedad en casa.3 La tos reportada por los padres correlaciona escasamente con la evaluación objetiva de su frecuencia, duración e intensidad.4,5 Este síntoma altera la dinámica familiar, disminuye la calidad de vida de los niños y ocasiona estrés a los padres.5 Es frecuente que se trate con medicamentos adquiridos sin prescripción (OTC) en la farmacia. Se ha reportado que cada semana, 10% de los niños de Estados Unidos reciben algún medicamento OTC contra la tos. Aunque la FDA ha autorizado estos fármacos en adultos, su eficacia y seguridad en niños se han cuestionado;1,6,7 pues se ha observado que causan efectos adversos e incluso la muerte de algunos lactantes. En enero de 2008, la FDA publicó su sugerencia de uso de medicamentos OTC contra la tos y resfriados y puso en evidencia mayores riesgos que beneficios.8 Recomienda evitar su administración a niños menores de cuatro años. La Academia Americana de Pediatría cuestiona su eficacia y seguridad en niños menores de seis años. MECANISMOS DE TOS: REFLEJOS Y VÍAS NEURALES La tos constituye un reflejo de protección de la fisiología normal respiratoria, que coadyuva en el aclaramiento de secreciones y detritus celulares, y mejora la función mucociliar; es un síntoma común de enfermedad respiratoria. Los receptores de tos se localizan en la vía respiratoria, desde la laringe a los bronquios segmentarios;9 se estimulan por virus, aeroalergenos y químicos. Existen dos tipos distintos de fibras aferentes: 1) receptores irritantes de rápida adaptación (RAR) y receptores irritantes de lenta adaptación (SAR) y 2) fibras C no mielinizadas, sensibles a capsaicina.10,11 Las primeras responden a estímulos mecánicos o químicos 136 presentes en la vía respiratoria hasta los bronquiolos respiratorios, especialmente en la pared posterior de la tráquea, la carina y las áreas de bifurcación de las vías aéreas grandes y medianas. Las que están en el canal auditivo externo, la membrana timpánica, la pleura y el pericardio responden sólo a la estimulación mecánica. Las fibras C contienen neuropéptidos y son sensibles a la estimulación química más que a la mecánica.12 Su estimulación provoca la contracción del músculo liso bronquial, vasodilatación, aumento de permeabilidad capilar y secreción de moco.13 El reflejo de tos posee estímulos aferentes vagales del glosofaríngeo o trigémino, y se distingue por centralización en el tallo cerebral y modulación cortical; su actividad motora eferente involucra a los músculos respiratorios. La sensibilidad del reflejo de tos puede ser modulada farmacológicamente, como con los inhibidores de enzima convertidora de angiotensina, o por enfermedad, como las infecciones virales respiratorias,14 el asma y la enfermedad por reflujo gastroesofágico. La prevalencia de la sensibilidad del reflejo de tos es similar en niñas y niños prepúberes, pero se incrementa en las mujeres durante la pubertad y la edad adulta. Mediante estimulación mecánica puede provocarse tos en 10% de los recién nacidos de pretérmino (27 semanas de gestación) y hasta en 90% de los recién nacidos a término.15 ¿POR QUÉ TOSEMOS? Podemos toser porque: a) tenemos que hacerlo (tos subconsciente) y b) pensamos que tenemos que hacerlo (tos consciente). Tos subconsciente. La gente tose cuando una sustancia extraña toca y estimula los nervios sensoriales de la laringe y las vías respiratorias grandes. Esta tos es inmediata (dentro de 25 mseg)16 y fuerte, y puede provocarse de forma inconsciente. Es un reflejo de defensa vital que previene que la sustancia penetre a los pulmones. Recientemente se identificó un fenotipo especial de nervio sensorial que se sitúa en la laringe, la tráquea y el bronquio principal, la “fibra de tos”. Estas fibras provocan tos cuando son activadas aun en animales anestesiados. Conducen potenciales de acción tres a cinco veces más rápido que las fibras C, y tres a cinco veces más lento que los receptores irritantes de rápida Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Tos crónica en pediatría y de lenta adaptación.17 La fibra de tos traqueal no es estimulada directamente por mediadores inflamatorios, distensión traqueal o contracción del músculo liso. Es exquisitamente sensible a estímulos finos, delicados, y al incremento de concentraciones de iones de hidrógeno.18 El reto con alergenos aumenta la excitabilidad de este nervio, disminuyendo cuatro veces su umbral de activación.19 Tos consciente. La gente tose porque piensa que tiene que hacerlo. Existe una sensación consciente de irritación en la faringe que aminora temporalmente al toser. En estos casos, no hay necesariamente alguna sustancia que irrite las fibras de tos. El ejemplo más obvio de este tipo es la tos seca persistente no productiva por infección respiratoria posviral; puede acompañar a enfermedades de la vía aérea, como asma o EPOC. En humanos conscientes, la inhalación de sustancias químicas activa fibras C nociceptoras y el reflejo de tos. Se ha demostrado interacción entre las fibras C y las fibras de tos (FT), concepto conocido como sensibilización central, mediante la cual se produce una amplificación sináptica en el tallo cerebral que induce el reflejo de tos. Las fibras C capaces de sensibilizar esta vía no requieren estar en las vías aéreas centrales. La activación de fibras C pulmonares y esofágicas puede provocar centralmente el reflejo de tos.20 TOS EN NIÑOS La tos en niños difiere de la de los adultos en términos de duración, presentación y causalidad, y su clasificación demuestra estas diferencias. Se dice que los “niños normales tosen”; de acuerdo con cuantificaciones objetivas, los niños en edad escolar (en promedio 10 años de edad, sin enfermedad respiratoria en las cuatro semanas previas al estudio) sufren 10 a 11 (incluso 34) episodios de tos por día.21 Algunas veces estos episodios de “tos normal” son prolongados o nocturnos, lo que inquieta a los padres. En otoño e invierno son frecuentes las infecciones virales recurrentes que originan tos persistente con cortos periodos asintomáticos intermedios. La tos posinfecciosa puede tener múltiples causas, como un aumento en la sensibilidad del reflejo de tos. Se piensa que menos de 5% de la tos que dura más de ocho semanas es posinfecciosa (además del síndrome pertusoide).22 TOS ANORMAL Es la tos concomitante con enfermedades subyacentes y la tos ineficaz por problemas neuromusculares o anormalidades estructurales de la vía aérea. Puede clasificarse por su duración (aguda o crónica); por su carácter, su calidad (seca o húmeda), hora de presentación (día o noche), edad del niño y origen (específica o no específica). Las diferentes categorías se traslapan, por lo que puede haber confusiones. Para diagnosticarla, es importante averiguar lo siguiente: Duración de la tos. En estudios y consensos la tos en adultos se define como aguda si dura menos de tres semanas; subaguda, si dura de tres a ocho semanas; o crónica, si se prolonga más de ocho semanas.23 Por lo general, la tos aguda y subaguda en adultos y niños son causadas por infección viral de la vía respiratoria y no requieren evaluación diagnóstica específica. La definición de tos crónica o persistente en niños varía en duración de tres a doce semanas, dependiendo del estudio o guía.24,25 Calidad de la tos. El carácter o calidad de la tos en niños es de ayuda diagnóstica, a diferencia de lo que ocurre en los adultos, en quienes no es importante para predecir su origen (guías 2006 del Colegio Americano de Médicos Especialistas en Enfermedades del Tórax, ACCP) [Cuadro 1].23 Tos seca o húmeda. La tos “húmeda” o “productiva” en niños se asocia con secreciones detectadas por broncoscopia y puede ser reportada por padres y clínicos.26 Los niños pequeños raramente expectoran, a pesar de tener exceso de secreciones. Un cuestionario aplicado recientemente a más de 2,000 niños de 11 a 15 años mostró una prevalencia de tos crónica productiva de 7.2%.27 Esta tos se relaciona en forma importante con reportes de asma sintomática y exposición ambiental al tabaco.28 La tos crónica productiva es rara en niños con asma no complicada. La sinusitis con o sin asma también puede ser causa de tos productiva, y responde a tratamiento con antibióticos. La tos crónica con esputo purulento en niños siempre es patológica y requiere evaluación inmediata, descartar fibrosis quística, bronquiectasias (sin fibrosis quística) y síndromes de disfunción mucociliar. Tos nocturna. Se considera una característica del asma; sin embargo, en estudios objetivos no se ha de- Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 137 Sacre Hazouri JA mostrado esta afirmación, y la tos nocturna reportada por los padres no se relaciona con cuantificaciones objetivas,4,29 por lo que deberán buscarse otras causas. La “tos habitual” característicamente cesa por la noche.30 Edad del niño. Este aspecto es muy importante. En lactantes y preescolares deberán considerarse anormalidades anatómicas de la vía aérea superior e inferior y del tubo gastrointestinal, así como la posible aspiración de cuerpo extraño (Cuadro 1). En niños y adultos, la tos es influida por aspectos psicológicos.23 La tos habitual es más frecuente en niños30 y, de acuerdo con las estadísticas, las causas de tos en adolescentes son similares a las de los adultos.31-33 TOS ANORMAL EN NIÑOS. ORIGEN En las guías 2006 del Colegio Americano de Enfermedades del Tórax (ACCP) se publicó un algoritmo diagnóstico propuesto para tos específica y no específica en niños. La tos específica se relaciona con enfermedad subyacente respiratoria o sistémica; la necesidad de mayores investigaciones es evidente por los signos y síntomas, las radiografías y los resultados de laboratorio (Cuadro 2). La tos productiva frecuente (diaria) es el mejor indicador clínico de tos específica. La disnea crónica, la hemoptisis, los hallazgos anormales en las radiografías (tele de tórax) y en la auscultación son predictivos de tos específica.34 Este tipo de tos se define como tos en ausencia de otros signos y síntomas (Cuadro 2); es aislada, un Cuadro 2. Tos especifica. Indicadores (síntomas y signos) en niños. Requieren diagnóstico específico y tratamiento adecuado Tos diaria, húmeda o productiva Sibilancias o estertores (auscultación) Disnea crónica Disnea por ejercicio Hemoptisis Duración de más de seis meses Neumonía recurrente Anormalidades cardiacas Inmunodeficiencia Detención en el crecimiento y desarrollo Hipocratismo digital Problemas de deglución síntoma único o predominante, y típicamente seca. En muchos casos se relaciona con infecciones posvirales y con el aumento en la sensibilidad de receptores de tos.35 Por lo general, su alivio es espontáneo.36 La tos específica y la no específica pueden tener orígenes que se traslapen. En adultos, algunos estudios prospectivos han mostrado que más de 90% de los casos de tos crónica no específica (que dura más de ocho semanas) puede atribuirse a tres causas principales: síndrome de tos vinculado con la vía aérea superior (UACS), previamente conocido como síndrome de escurrimiento retronasal (debido a rinitis alérgica, no alérgica y sinusitis), asma o bronquitis eosinofílica y enfermedad por reflujo gastroesofágico.23 Se han efectuado muy pocos estudios similares en niños. En una prueba prospectiva en niños pequeños preescolares altamente Cuadro 1. Características de la tos en niños Característica de la tos Recién nacidos y lactantes Perruna o metálica Seca, staccato Húmeda, productiva Origen posible Crup, traqueomalacia-anormalidades anatómicas de la vía respiratoria o digestiva Clamidofilia BBP, sinusitis Preescolares-escolares Perruna o metálica Espasmódica-paroxística (quintosa) Húmeda, productiva (con o sin esputo evidente) Crup Asma, síndrome coqueluchoide (pertussis) BBP, sinusitis Adolescencia Perruna o metálica Espasmódica-paroxística (quintosa) Húmeda, productiva (con o sin esputo evidente) Habitual-psicogénica Asma, síndrome coqueluchoide (pertussis) Neumonía-bronquitis bacteriana prolongada-sinusitis 138 Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Tos crónica en pediatría seleccionados (2.6 años en promedio), referidos a un centro pediátrico especializado en vía respiratoria, el síndrome de tos vinculado con la vía aérea superior, el asma y la enfermedad por reflujo gastroesofágico fueron concomitantes con menos de 10% de la tos persistente, aunque a la mitad de los niños se le había diagnosticado asma antes de la referencia.31 El 89% tenía tos húmeda, con una duración media de seis meses. En 62% se había manifestado durante el primer año de vida, y en 43% había sido por exposición al humo de tabaco. La causa primaria de la tos en esta cohorte fue la bronquitis bacteriana prolongada, diagnosticada en 40% de los casos;31 sin embargo, la muestra de este estudio no es representativa de la población pediátrica en general. Un reporte observacional retrospectivo de tos crónica en preescolares (de 3.9 años en promedio) referidos a un centro respiratorio europeo indicó que el diagnóstico predominante era bronquitis bacteriana prolongada.37 En un reciente estudio prospectivo realizado en Estados Unidos con niños mayores (9.2 años en promedio) que habían sufrido tos crónica durante más de ocho semanas, sin exposición a humo de cigarro, se encontraron causas similares a las reportadas en adultos: síndrome de tos vinculado con la vía aérea superior (23%), enfermedad por reflujo gastroesofágico (28%), asma (13%) y origen múltiple (20%).32 En 90% de los casos se halló una causa específica. En otro estudio de niños (8.4 años en promedio) referidos a un hospital pediátrico en Turquía, se determinó que las causas más comunes de tos que persistía más de ocho semanas fueron: asma (25%), bronquitis bacteriana prolongada (23%), síndrome de tos vinculado con la vía aérea superior (20%) y enfermedad por reflujo gastroesofágico (5%).33 Estas diferencias en resultados reflejan variaciones en edad y en poblaciones estudiadas (Cuadro 3). Bronquitis bacteriana prolongada Esta tos es crónica, productiva, con resultado positivo del lavado broncoalveolar, escasamente caracterizada, subdiagnosticada y con frecuencia confundida con asma;37 su tratamiento es con antibióticos. La broncoscopia típicamente revela una respuesta inflamatoria neutrofílica de la vía aérea y función inmunitaria adaptativa normal.38 Los organismos más comúnmente implicados son: Streptococcus pneumoniae, Haemophilus influenzae y Moraxella catarrhalis. Una alternativa razonable para evitar la broncoscopia invasora es la administración de antibióticos como prueba terapéutica (por ejemplo, amoxicilina con clavulanato durante dos semanas);31 sin embargo, esto no facilita el diagnóstico. Enfermedad por reflujo gastroesofágico Es común en recién nacidos, lactantes y niños; se vincula con síntomas respiratorios como la tos, al igual que las alteraciones en el mecanismo de la deglución con aspiración sin enfermedad por reflujo gastroesofágico en lactantes.39 Aunque un gran porcentaje de niños con síntomas respiratorios tienen enfermedad por reflujo gastroesofágico diagnosticada mediante pHmetría esofágica, los síntomas (pirosis, regurgitación) pueden ser sutiles, especialmente en los más pequeños.40 Persiste la controversia entre la asociación específica de enfermedad por reflujo gastroesofágico y la tos.41 La respuesta al espesamiento de la fórmula y el alimento para lactantes y la supresión de ácido es un indicio de este padecimiento,42 aunque puede no haber mejoría si la tos es concomitante con reflujo no ácido detectado por impedanciometría.43 En estudios comparativos se ha encontrado que el contenido ácido del reflujo no es el único mediador responsable de los síntomas, y que la pHmetría intraesofágica no detecta 90% del reflujo cuando es fisiológico o no ácido, por lo que los resultados normales de estas prueba no descartan a la ERGE como causal de síntomas respiratorios. Hace poco, Bingol Boz y col.44 demostraron la utilidad y mayor sensibilidad de la gammagrafía (método no invasor) para detectar reflujo gastroesofágico en pediatría, en una prueba que incluyó a 72 niños con tos crónica de origen desconocido (una vez descartadas causas estructurales, congénitas, hereditarias, neurológicas y respiratorias crónicas). Del total de pacientes, 65 con edad media de 10.3 años y enfermedad por reflujo gastroesofágico, según la gammagrafia con tecnecio 99m, mostraron correlación positiva entre el número de episodios de reflujo y tos, misma que disminuyó significativamente con tratamiento antirreflujo administrado durante dos meses: procinéticos, inhibidores de bomba de protones y alginato sódico.44 La gammagrafía se realiza en una hora, es sencilla y tiene mayor sensibilidad que la pHmetría de 24 horas para detectar reflujo con pH normal o no ácido.44 La impedanciometría intraluminal Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 139 Sacre Hazouri JA Cuadro 3. Estudios prospectivos del origen de la tos en pacientes pediátricos Población de pacientes Institución Edad Definición de tos crónica Antecedentes personales Evaluación Hallazgos Marchant y col.31 Khoshoo y col.32 108, cohorte prospectiva referida a centro pediátrico respiratorio de tercer nivel Royal Children’s Hospital, Brisbane, Australia < 18 años (media, 2.6 años) > 3 semanas (duración media, 6 meses) Tabaquismo en casa: 43%, 62% edad de inicio de tos < 1 año; 89% tos productiva Todos: rx de tórax, espirometría en > 6 años, broncoscopia/BAL (n: 102) o esputo inducido (n: 4), evaluación de FQ, IGs, IgE, anticuerpos vs Mycoplasma y pertussis. Seleccionados: TCAR tórax, pHmetría 40, presentación consecutiva a 108, presentación consecutiva clínica de neumología pediátrica a clínica por siete meses BBP 40%, resolución natural 22%, bronquiectasias 6%, asma 4%, UACS 3%, ERGE 3%, habitual 1%, idiopática 5%, causas múltiples 55% ERGE 28%, UACS 23% (alergia), asma 13%, idiopática 10%, infección 5%, aspiración 3%, causas múltiples 20% West Jefferson Medical Center, Nueva Orleans, Estados Unidos Media, 9.3 años > 8 semanas Sin exposición a humo de tabaco Todos: rx de tórax, PFT, broncoscopia, reto con metacolina, cloruros en sudor, pHmetría, impedanciometría, pruebas de alergia, IGs. Seleccionados: esofagogastroduodenoscopia, trago de bario, TC sinusal, TC tórax, evaluación inmunitaria, prueba de A1AT Asilsoy y col.33 Children’s Hospital and Research Center, Izmir, Turquía 6-14 años (media, 8.4 años) > 4 semanas (duración media, 4 meses) 56% exposición a tabaco; 52% tos productiva; 30% antecedente familiar de atopia Todos: radiografía tórax, PFT. Seleccionados: respuesta a broncodilatadores, TCAR tórax, broncoscopia/BAL, scintigrafía gastrointestinal, prueba de sacarina nasal, cloruros en sudor, IGs, PPD, anticuerpos vs Mycoplasma Asma 25%, BBP 23%, UACS 20%, ERGE 5%, bronquiectasias 3%, alivio natural 2%, TB/ Mycoplasma 2%, malformación congénita 1%, causas múltiples 19% BAL: lavado broncoalveolar; FQ: fibrosis quística; TCAR: TC de alta resolución; PFT: pruebas de función pulmonar; A1T1: alfa 1 antitripsina; BBP: bronquitis bacteriana prolongada; UACS: síndrome de tos asociado con vía respiratoria superior, rinitis alérgica, no alérgica, sinusitis; ERGE: enfermedad por reflujo gastroesofágico. es más compleja, costosa y necesita valorarse durante 24 horas. Los diagnósticos de enfermedad por reflujo gastroesofágico o asma no son mutuamente excluyentes, sobre todo en niños mayores.40,45 Los síntomas respiratorios pueden deberse al reflujo aspirado hacia las vías respiratorias o ser secundario al reflejo vagal en el tercio inferior del esófago.10,44 Síndrome de tos habitual (tos psicogénica) Es importante reconocer la tos habitual y otros problemas respiratorios, como la disfunción de cuerdas vocales,46 la hiperventilación y la disnea asociada con problemas laríngeos.46 La tos habitual puede confundirse con asma, síndrome de tos vinculado con la vía aérea superior o con alguna causa de tos crónica.45,46 Por lo general, esta tos es seca, carraspeante, perruna, repetitiva, intermitente y muy frecuente durante el día. Su sonido es muy molesto; el niño parece no alterarse (la belle indiference), pese a 140 que inquieta a padres, maestros y cuidadores, y altera la dinámica escolar y social. De manera característica, se aprecia mejoría significativa cuando el niño se distrae o se queda dormido. La tos suele ser reproducida al solicitarlo. Suele manifestarse después de una infección de la vía respiratoria superior, con un inicio corto de tos productiva seguido de tos característica. La frecuencia de problemas psicosomáticos o psicológicos reportados en estos pacientes varía ampliamente; aunque pocos sufren un padecimiento psicológico severo. La tos habitual puede ser difícil de diferenciar de los tics (si bien la vocalización característica del síndrome de Tourette no suele estar presente). EVALUACIÓN DE LA TOS CRÓNICA EN NIÑOS En la Figura 1 se muestran algunas recomendaciones. El tratamiento farmacológico de prueba se utiliza Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Tos crónica en pediatría ¿Síntomas y signos de enfermedad respiratoria? No ¿Radiografía de tórax, espirometría anormal? No ¿Es la tos característica? Sí Evaluar tos específica Sí Sí (Figura 2) ¿Signos y síntomas sugieren tos específica? No Tos no específica Revisar en una a dos semanas 1. Observar, esperar, revisar. Generalmente posinfecciosa. 2. Evaluar: exposición al tabaco, actividad del niño, preocupación de los padres 3. Tratar la causa evidente Aliviándose o aliviada Tos persistente Discutir opciones con los padres Tratamiento de prueba Tos seca: ICS durante cuatro semanas Observar, esperar, revisar Tos húmeda: antibióticos durante 15 a 21 días Figura 1. Algoritmo. Evaluación de tos crónica en niños. frecuentemente como modalidad diagnóstica, aunque pueden requerirse ensayos múltiples antes de encontrar el origen de la tos. Las recomendaciones se basan en la opinión de “expertos”, debido a la carencia de estudios controlados en pediatría.1,10 La duración del tratamiento farmacológico se fija de forma empírica, y el abandono prematuro del mismo puede impedir la resolución de la tos. Los niños con tos productiva prolongada deberán tratarse inicialmente con antibióticos por la posibilidad de que se trate de bronquitis bacteriana prolongada o sinusitis crónica. Con frecuencia se observa tos productiva recurrente en la sinusitis tratada de manera inadecuada. En los niños con tos seca, una prueba terapéutica con corticoesteroides inhalados pone en evidencia la posible existencia de asma. Las pruebas diagnósticas son útiles en pacientes cuya historia clínica y examen físico no revelan claramente el diagnóstico, así como en sujetos con tos crónica específica (Figura 2).1 También se recomienda referir al enfermo con el inmunoalergólogo o especialista en vías respiratorias (Figura 2).1 Debe hacerse una placa de tórax a todos los niños con tos crónica. La TC de tórax sin contraste es un requisito para confirmar el diagnóstico de bronquiectasias o enfermedad pulmonar intersticial.1,10 En pacientes con síntomas concomitantes persistentes de la vía aérea superior, la TC de senos paranasales permite descartar enfermedad sinusal;47 sin embargo, hay que tener en cuenta que pueden observarse alteraciones en niños asintomáticos.48 Mediante la rinofaringolaringoscopia flexible diagnóstica puede evaluarse la enfermedad rinosinusal u obstructiva, el crecimiento adenoideo o amigdalino, algún padecimiento en la orofaringe y la laringe (orgánica o funcional) y alteraciones en la deglución.46,49-52 La espirometría puede realizarse en la mayoría de los niños mayores de seis años y en algunos mayores de tres años con previo adiestramiento.23 La obstrucción reversible de la vía aérea (>12% de mejoría en FEV1) mostrada por espirometría con administración de broncodilatador sugiere el diagnóstico de asma. Si Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 141 Sacre Hazouri JA Tos específica Obstrucción reversible de la vía aérea o elevación de FeNO No Sí Asma: confirmar con cuatro semanas de tratamiento con IC Valorar factores de riesgo de: Bronquiectasias Neumonía recurrente Aspiración Infecciones crónicas o menos comunes Anormalidades de la vía aérea Enfermedad pulmonar intersticial Enfermedades pulmonares menos frecuentes (fibrosis quística) Enfermedad cardiaca Interconsulta con especialista en inmunología clínica y alergiaenfermedades respiratorias Figura 2. Evaluación de tos crónica específica en niños. FeNO: óxido nítrico exhalado. los resultados de la espirometría son normales, habrá que realizar exámenes más avanzados para confirmar el diagnóstico. Se puede valorar la hiperreactividad bronquial con prueba de provocación con metacolina; no obstante, los resultados positivos no confirman necesariamente el diagnóstico de asma o la reacción al tratamiento. En los pacientes con función pulmonar anormal que no responden a broncodilatadores o corticoesteroides inhalados deberá descartarse la posibilidad de bronquiectasias, aspiración, enfermedad pulmonar intersticial, infección crónica, anormalidades estructurales de la vía aérea, padecimientos cardiacos y enfermedad por reflujo gastroesofágico. Es posible calificar el grado de inflamación de la vía aérea a través de la prueba de esputo inducido. El hallazgo de menos de 2% de eosinófilos permite diagnosticar asma y predecir una mejor respuesta a los corticoesteroides inhalados.53 La medición de óxido nítrico exhalado (FeNO) es muy útil cuando es normal. 142 En adultos jóvenes, los valores superiores a 19 ppb apoyan el diagnóstico de asma;54 en niños se han reportado resultados similares. El óxido nítrico exhalado puede predecir la respuesta a los corticoesteroides inhalados en adultos con tos crónica.55 En los niños, la tos crónica sin historia clínica de sibilancias, obstrucción reversible de la vía aérea o marcadores elevados de inflamación puede descartar el diagnóstico de asma. Deben realizarse estudios de laboratorio complementarios para descartar enfermedades infecciosas, fibrosis quística e inmunodeficiencias. La determinación cuantitativa de inmunoglobulinas y la valoración cuantitativa y funcional de subclases de inmunoglobulinas deberán considerarse en niños con tos crónica persistente secundaria a infecciones bacterianas recurrentes. Con la broncoscopia flexible pueden detectarse alteraciones de la vía aérea, infección crónica o aspiración con o sin cuerpo extraño; sin embargo, no se ha demostrado su utilidad en adultos con tos crónica.56 Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Tos crónica en pediatría TRATAMIENTO DE LA TOS EN PEDIATRÍA Medicamentos antitusivos sin prescripción (denominados OTC) Los informes de niños destacan que los medicamentos sin prescripción contra la tos y los resfriados poseen poca o nula eficacia clínica.57 La Academia Americana de Pediatría sugiere evitar el dextrometorfano (así como la codeína) para el tratamiento de cualquier tipo de tos.58 Estos medicamentos se han vinculado con morbilidad significativa y raramente con mortalidad asociada con su ingestión accidental o intencional.6,7 Tratamiento contra el asma Para el manejo de la tos asmática se siguen las guías publicadas basadas en la edad del paciente.59 Es importante, sin embargo, que se haya establecido claramente el diagnóstico de asma, ya que no hay estudios que apoyen la administración empírica de broncodilatadores b2 adrenérgicos, anticolinérgicos, teofilina o modificadores de leucotrienos contra la tos crónica no específica en niños.23 Se recomienda hacer una prueba terapéutica con corticoesteroides inhalados en niños con tos crónica, seca y aislada, por la posibilidad de que se trate de asma, a dosis moderadas (200 a 400 mcg/día de fluticasona, 400 a 800 mcg/ día de budesonida o equivalente); el uso de espaciadores o nebulizadores dependerá de la edad y habilidades de los pacientes. El tiempo sugerido de tratamiento varía de dos a doce semanas, si bien la mayoría de los enfermos responde en las primeras cuatro semanas. La existencia de más de una causa de tos puede retardar la reacción al tratamiento si no se tratan apropiadamente. Será importante revalorar de manera periódica la terapéutica y suspenderla en caso de no haber respuesta. Por sí misma, dicha respuesta no confirma el diagnóstico de asma. Se ha demostrado que los broncodilatadores anticolinérgicos con o sin b2 agonistas ejercen un ligero efecto positivo en la tos posinfecciosa.60 Tratamiento contra la tos causada por enfermedades de la vía aérea superior Los padecimientos de la vía aérea superior que pueden provocar tos son: rinitis alérgica, rinitis no alérgica y sinusitis, aunque también se ha vinculado con la hipertrofia adenoidea y amigdalina en niños.45,50-52 A diferencia del efecto que ejercen en los adultos, en los niños los antihis- tamínicos (solos o combinados con descongestionantes, dextrometorfano o codeína) no afectan la duración ni la intensidad de la tos aguda, incluso parecen no aliviar la tos aguda nocturna ni los problemas del sueño relacionados.61 Las guías norteamericanas sobre tos en adultos (ACCP) recomiendan el tratamiento con un antihistamínico de primera generación, como la dexbromofeniramina, dado que los de segunda generación no son eficaces. Morice y col.62 reportaron que la dexbromofeniramina, a diferencia de otros antihistamínicos, bloquea el receptor de capsaicina llamado potencial transitorio vanilloide 1 (TRPV1), y es un receptor putativo de tos. Esto es probablemente lo que induce sus efectos antitusivos, más que cualquier propiedad antihistamínica; por tal razón, es erróneo suponer que la respuesta a la dexbromofeniramina fundamenta el diagnóstico de enfermedad de la vía aérea superior. En realidad, este medicamento alivia varios tipos de tos a través de su efecto en TRPV1.62 Algunos reportes destacan la disminución de los accesos de tos en niños con rinitis alérgica tras la administración de cetirizina, terfenadina y corticoesteroides intranasales como mometasona.63-65 Tratamiento contra la enfermedad por reflujo gastroesofágico Si bien los metanálisis realizados no demuestran que el tratamiento contra la enfermedad por reflujo gastroesofágico en la tos crónica no específica en niños y adultos sea eficaz,41 varios estudios recientes revelan lo contrario. 1,8,44 Algunos tratamientos útiles contra la enfermedad por reflujo gastroesofágico en niños incluyen inhibidores de la bomba de protones, agentes procinéticos, antagonistas H2 y alginato sódico.1,8,44 En estudios en adultos, la respuesta de la tos y otras manifestaciones extraesofágicas al tratamiento puede ocurrir en ocho a doce semanas.23 Cada vez con mayor frecuencia se reconoce la importancia del reflujo no ácido que no responde al tratamiento convencional supresor de ácido en la enfermedad por reflujo gastroesofágico. Antimicrobianos Los antibióticos no tienen efectos en la tos aguda provocada por infecciones virales.66 En casos de rinosinusitis purulenta persistente o infección rinosinusal cuyos síntomas se prolongan más de 10 días, se ha demostrado Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 143 Sacre Hazouri JA que los antibióticos disminuyen la duración de la tos.67 También se indican en lactantes y preescolares con bronquitis bacteriana prolongada. Tratamiento contra el síndrome de tos habitual Se han recomendado varias modalidades de tratamiento, como la autohipnosis, la retroalimentación y la terapia de sugestión, la cual ha inducido el cese de la tos en 15 minutos.68-70 Estas modalidades deberán efectuarlas médicos calificados. REFERENCIAS 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 144 Goldsobel AB, Chipps BE. Cough in the pediatric population. J Pediatr 2010;156(3):352-358. Hay AD, Wilson A, Fahey T, Peters TJ. The duration of acute cough in preschool children presenting to primary care: a prospective cohort study. Fam Pract 2003;20:696-705. Fuentes-Leonarte V, Tenias JM, Ballester F. Levels of pollutants in indoor air and respiratory health in preschool children: a systematic review. Pediatr Pulmonol 2009;44:231-233. Archer LNJ, Simpson H. Night cough counts and diary cough scores in asthma. Arch Dis Child 1985;60:473-474. Marchant JM, Newcorribe PA, Juniper EF, Sheffield JK, et al. What is the burden of chronic cough for families? Chest 2008;134:303-309. Lokker N, Sanders L, Perrin EM, Kumar D, et al. Parental misinterpretations of over-the-counter pediatric cough and cold medication labels. Pediatrics 2009;123:1464-1471. Shaefer MK, Shehab N, Cohen AL, Budnitz DS. Adverse events from cough and cold medications in children. Pediatrics 2008;121:783-787. US Food and Drug Administration Nonprescription Drug Advisory Committee. Cold, cough, allergy, bronchodilator, antiasthmatic drug products for over-the-counter human use, October 18 and 19, 2007. Available from: www.fda. gov/ohrms/dockets/ac/07/briefing/2007-4323b1-02-FDA. pdf. Accessed September 21,2008. Chang AB. Cough, cough receptors, and asthma in children. Pediatr Pulmonol 1999;28:59-70. Chow PY, Ng DKK. Chronic cough in children. Singapore Med J 2004;45(10):462-469. (CHOW 1.) Widdicombe JG. Afferent receptors in the airways and cough. Resp Physiol 1998;114:5-15. (CHOW 5.) Karlsson JA. The role of capsaicin sensitive C-fiber afferent nerves in the cough reflex. Pulm Pharmacol 1996;9:315-21. (CHOW 7.) Lee YL, Pisarri TE. Afferent properties and reflex functions of bronchopulmonary C-fibers. Resp Physiol 2001;125:47-65. (CHOW 8.) O’Connell F, Thomas VE, Studham JM, Pride NB, et al. Capsaicin cough sensitivity increases during upper respiratory infection. Respir Med 1996;90:279-286. Chang AB, Widdicombe JG. Cough throughout life: children, adults and the senile. Pulm Pharmacol Ther 2007;20:371-382. 16. Addington WR, Stephens RE, Widdicombe JG, Ockey RR, et al. Electrophysiologic latency to the external obliques of the laryngeal cough expiration reflex in humans. Am J Phys Med Rehabil 2003;82(5):370-373. 17. Canning BJ, Mazzone SB, Meeker SN, Mori N, et al. Identification of the tracheal and laryngeal afferent neurons mediating cough in anaesthetized guinea-pigs. J Physiol 2004;557(Pt 2):543-558. 18. Kollarik M, Undem BJ. Mechanisms of acid-induced activation of airway afferent nerve fibers in guinea-pig. J Physiol 2002;1:543. 19. Canning BJ. Interactions between vagal afferent nerve subtypes mediating cough. Pulm Pharmacol Ther 2002;15:187-192. 20. Mazzone SB, Canning BJ. Plasticity of the cough reflex. Eur Resp Rev 2002;12:85,236-242. 21. Munyard P, Bush A. How much coughing is normal? Arch Dis Child 1996;74:531-534. 22. Kwon NH, Oh MJ, Min TH, Lee BJ, et al. Causes and clinical features of subacute cough. Chest 2006;129:1142-1147. 23. Irwin RS, Baumann MH, Bolser DC, Boulet LP, et al. Diagnosis and management of cough: ACCP evidence-based clinical practice guidelines. Chest 2006;129(Suppl 1):1S-292S. 24. Shields MD, Bush A, Everard ML, McKenzie SA, et al. British Thoracic Society Guidelines: recommendations for the assessment and management of cough in children. Thorax 2008;63(Suppl III):iii1-15. 25. Chang AB, Landau LI, Van Asperen PP, Glasgow MJ, et al. Cough in children: definitions and clinical evaluation. Med J Aust 2006;184:398-403. 26. Chang AB, Eastburn MM, Gaffney J, Faoagali J, et al. Cough quality in children: a comparison of subjective vs bronchoscopic findings. Respir Res 2005;6:1-8. 27. Carter E, Debley J, Redding G. Chronic productive cough in school children: prevalence and associations with asthma and environmental tobacco smoke exposure. Cough 2006;2:11-8. 28. Chang AB, Redding GJ, Everard ML. Chronic wet cough: protracted bronchitis, chronic suppurative lung disease and bronchiectasis. Pediatr Pulmonol 2003;36:73-75. 29. Li AM, Lex C, Zacharasiewicz A, Wong E, et al. Cough frequency in children with stable asthma: correlation with lung function, exhaled nitric oxide, and sputum eosinophil count. Thorax 2003;58:974-978. 30. McGarvey L, Warke T, McNiff C, Heaney L, et al. Psychogenic cough in a schoolboy: evaluation using an ambulatory cough recorder. Pediatr Pulmonol 2003;36:73-75. 31. Marchant J, Marters IB, Taylor SM, Cox NC, et al. Evaluation and outcome of young children with chronic cough. Chest 2006;129(1 Suppl):1132S-41. 32. Khoshoo V, Edell D, Mohnot S, Haydel R, et al. Associated factors in children with chronic cough. Chest 2009;136:811-815. 33. Asilsoy S, Bayram E, Agin H, Apa H, et al. Evaluation of chronic cough in children. Chest 2008;134:1122-1128. 34. Marchant JM, Masters IB, Taylor SM, Chang AB. Utility of signs and symptoms of chronic cough in predicting specific cause in children. Thorax 2006;61:694-698. 35. Chang AB, Phelan PD, Sawyer SM, Robertson CF. Airway hyperresponsiveness and cough-receptor sensitivity in Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Tos crónica en pediatría 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. 47. 48. 49. 50. 51. children with recurrent cough. Am J Respir Crit Care Med 1997;155:1935-1939. Brooke AM, Lambert PC, Burton PR, Clarke C, et al. Recurrent cough: natural history and significance in infancy and early childhood. Pediatr Pulmonol 1998;26:256-261. Donnelly D, Critchlow A, Everard ML. Outcomes in children treated for persistent bacterial bronchitis. Thorax 2007;62:80-84. Marchant JM, Gibson PG, Grissell TV, Timmins NL, Masters IB, Chang AB. Prospective assessment of protracted bacterial bronchitis: airway inflammation and innate immune activation. Pediatr Pulmonol 2008;43;1092-1099. Sheikh S, Allen E, Shell R, Hruschak J, et al. Chronic aspiration without gastroesophageal reflux as a cause of chronic respiratory symptoms in neurologically normal infants. Chest 2001;120:1190-1195. Eid NS. Gastroesophageal reflux is a major cause of lung disease: pro. Pediatr Pulmonol 2004;(Suppl 26):194-196. Chang AB, Lasserson TJ, Kiljander TO, Connor FL, et al. Systematic review and meta-analysis of randomized controlled trials of gastroesophageal reflux interventions for chronic cough associated with gastroesophageal reflux. BMJ 2006;332:11-17. Rudolph CD, Mazur LJ, Liptak GS, Baker RD, et al. Guidelines for evaluation and treatment of gastroesophageal reflux in infants and children: recommendations of the North American Society for Pediatric Gastroenterology and Nutrition. J Pediatr Gastroenterol Nutr 2001;(32 Suppl):S1-31. Mattioli G, Pini-Prato A, Gentilino V, Caponcelli E, et al. Esophageal impedance/pH monitoring in pediatric patients: preliminary experience with 50 cases. Dig Dis Sci 2006;51:2341-2347. Bingol Boz A, Aydin F, Celmeli F, Boz A, et al. Does gastroesophageal reflux scintigraphy correlate with clinical findings in children with chronic cough? Nuclear Medicine Communications 2009;30:802-806. Weinberger M, Abu-Hasan M. Pseudo-asthma: when cough, wheezing, and dyspnea are not asthma. Pediatrics 2007;120:855-864. Sacre Hazouri JA. Cuando la causa de la disnea se encuentra en la laringe. ¿Asma de difícil control, resistente al tratamiento? ¿Disfunción de las cuerdas vocales? ¿O ambas? Rev Alerg Mex 2006;53(4):150-161. American Academy of Pediatrics Subcommittee on Management of Sinusitis and Committee on Quality Improvement. Clinical practice guideline: management of sinusitis. Pediatrics 2001;108:798-808. Diament MJ, Senac MO, Gilsanz V, Baker S, et al. Prevalence of incidental paranasal sinus opacification in pediatric patients: a CT study. J Comput Assist Tomogr 1987;11:426-31. Sacre Hazouri JA. Rinofaringolaringoscopía flexible en la evaluación de pacientes con problemas alérgicos y de vías respiratorias altas. Rev Alerg Mex 1996;43(6):157-164. Sacre Hazouri JA. Rinitis alérgica. Enfermedades coexistentes y complicaciones. Revisión y análisis. Rev Alerg Mex 2006;53(1):9-29. Sacre Hazouri JA. Estudio del niño con obstrucción recurrente de las vías respiratorias superiores. Rev Alerg Mex 1999;46(6):161-165. 52. González DS, Sacre HJ, Escalante DA, Galindo RG, y col. Lineamientos del Colegio Mexicano de Inmunología Clínica y Alergia, AC, para el diagnóstico y tratamiento de la rinitis alérgica. Rev Alerg Mex 2006;53:S19-S42. 53. Spahn JD. Asthma biomarkers in sputum. Immunol Allergy Clin North Am 2007;27:607-622. 54. Kostikas K, Papaioannou AI, Tanou K, Koutsokera A, et al. Portable exhaled nitric oxide as a screening tool for asthma in young adults during pollen season. Chest 2008;133:906913. 55. Hahn PY, Morgenthales TY, Lim KG. Use of exhaled nitric oxide in predicting response ton inhaled corticosteroids for chronic cough. Mayo Clin Proc 2007;82:1350-1355. 56. Barnes TW, Afessa B, Swanson KL, Lim KG. The clinical utility of flexible bronchoscopy in the evaluation of chronic cough. Chest 2004;126:268-272. 57. Schroeder K, Fahey T. Over-the-counter medications for acute cough in children and adults in ambulatory settings. Cochrane Database Syst Rev 2008;1:CD001831. 58. American Academy of Pediatrics Committee on Drugs. Use of codeine and dextromethorphan containing cough remedies in children. Pediatrics 1997;99:918-920. 59. National Asthma Education and Prevention Program. Expert Panel Report 3. Guidelines for the diagnosis and management of asthma. Available from: www.nhlbi.nih.gov/ guidelines/asthma/. Accessed. September 21, 2008. 60. Holmes PW, Barter CE, Pierce RJ. Chronic persistent cough: use of ipratropium bromide in undiagnosed cases following upper respiratory tract infection. Respir Med 1992;86:425429. 61. Paul IM, Yoder KE, Crowell KR, Shaffer ML, et al. Effect of dextromethorphan, diphenhydramine, and placebo on nocturnal cough and sleep quality for coughing children and their parents. Pediatrics 2004;114:e85-90. 62. Morice AH. Post-nasal drip syndrome. A symptom to be sniffed at? Pulm Pharmacol Ther 2004;17(6):343-345. 63. Ciprandi G, Tosca M, Ricca V, Passalaqua G, et al. Cetirizine treatment of allergic cough in children with pollen allergy. Allergy 1997;52:752-754. 64. Ciprandi G, Tosca M, Iudice A, Buscaglia S, et al. Terfenadine in allergic chronic cough in children. Allergy 1992;47:60-61. 65. Gawchick S, Goldstein S, Prenner B, John A. Relief of cough and nasal symptoms associated with allergic rhinitis by mometasone furoate nasal spray. Ann Allergy Asthma Immunol 2003;90:416-421. 66. Arroll B, Kenealy T. Antibiotics for the common cold and acute purulent rhinitis. Cochrane Database Syst Rev 2002;3. 67. Dowell SR, Schwartz B, Phillips WR. Appropriate use of antibiotics for URI Consensus Team. Am Fam Physician 1998;58:1113-1123. 68. Anbar RD, Hall HR. Childhood habit cough treated with self-hypnosis. J Pediatr 2004;144:213-217. 69. Lokshin B, Lindgren S, Weinberger M, Koviach J. Outcome of habit cough in children treated with a brief session of suggestion therapy. Ann Allergy 1991;67:579-582. 70. Ramanuja S, Kelkar P. Habit cough. Ann Allergy Asthma Immunol 2009;102:91-95. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 145 Revista Alergia México 2010;57(5):146-152 Artículo original Prevalencia de asma en adolescentes. Relación con el sexo y el tabaquismo activo Irma Aída Torres Fermán,* Francisco Vázquez Nava,*,** Ricardo Antonio Calafell Ceballos,*** Eliza Mireya Vázquez Rodríguez,* Víctor Manuel Almeida Arvizu,**** María del Carmen Barrientos Gómez,* Dolores Lin Ochoa,* José Peinado Herreros,1 María Concepción Iribar Ibabe1 Resumen Antecedentes: la prevalencia de asma en adolescentes parece estar aumentando y los determinantes no están bien establecidos. Objetivo: determinar en adolescentes la asociación entre sexo, tabaquismo activo y prevalencia de asma. Participantes y método: estudio transversal en el que se incluyeron 6,922 estudiantes, con edades entre 12 y 18 años y con residencia en un área urbana del noreste de México. Se desarrolló un cuestionario con base en los cuestionarios que el Estudio Internacional de Asma y Alergias en la Niñez (ISAAC por sus siglas en inglés) y la Encuesta de Salud Respiratoria de la Comunidad Europea (ECRHS por sus siglas en inglés) utilizan. La relación entre sexo, tabaquismo y asma se determinó mediante un modelo de regresión logística. Resultados: de la población total, 46.3% fueron hombres; 7.3% sufrían de asma y 17.3% declararon ser fumadores activos. Los resultados de este estudio mostraron que en adolescentes no se asociaron el sexo masculino (razón de momios [odds ratio, OR] ajustada = 0.55; intervalo de confianza de 95% [IC 95%]: 0.48-0.63), el tabaquismo activo (OR ajustada = 1.12; IC 95%: 0.89-1.42) y la prevalencia de asma. El sexo femenino (OR ajustada = 1.44; IC 95%: 1.13-1.84) y el tabaquismo activo (OR ajustada = 1.38; IC 95%: 1.15-1.67) se asociaron con sibilancias en los últimos 12 meses. El sexo femenino (OR ajustada = 1.53; IC 95%: 1.34-1.76) se asoció con la prevalencia de ataques de tos seca nocturna. Conclusiones: en adolescentes el sexo y el tabaquismo no se asocian con la prevalencia de asma. El sexo femenino se asocia con prevalencia de sibilancias en los últimos 12 meses y con accesos de tos seca nocturna. Palabras clave: sexo, tabaquismo activo, asma, adolescentes. Abstract Background: Asthma prevalence in adolescents appears to be increasing and determinants are not well established. Objective: To determine the association between sex and active smoking with asthma prevalence in adolescents. Participants and method: In this cross-sectional study 6,922 students, ages 12 to 18 years, residents in an area of northeastern Mexico, were included. We developed a questionnaire based on The International Study of Asthma and Allergies in Childhood (ISAAC) and on The European Community Respiratory Health Survey (ECRHS). The association between sex and active smoking with asthma prevalence was determined using a logistic regression model. Results: Of the total population, 46.3% were males, 7.3% suffered from asthma and 17.3% were cigarette smokers. We found that sex (OR = 0.55; CI 95%: 0.48-0.63) and active smoking (adjusted OR = 1.12; CI 95%: 0.89-1.42) were not associated with asthma prevalence. Females (OR = 1.44; CI 95%: 1.13-1.84) and active smoking (adjusted OR = 1.38; CI 95%: 1.15-1.67) were associated with prevalence of wheezing in the last 12 months, and with prevalence of dry cough at night (OR = 1.53; CI 95%: 1.34-1.76). Conclusions: Teenager males and active smoking were not associated with asthma prevalence. Females had an association with wheezing in the last 12 months and dry cough at night. Key words: sex, tobacco-smoke, asthma, adolescent. * Departamento de Investigación de la Facultad de Medicina de Tampico, Universidad Autónoma de Tamaulipas, Tamaulipas, México. ** Profesor e investigador de tiempo completo de Alergología e Inmunología, Unidad de Investigación en Epidemiología Clínica, Hospital General 6, IMSS, Ciudad Madero, Tamau lipas, México. *** Facultad de Odontología de la Universidad Veracruzana, Campus Minatitlán, Veracruz, México. **** Servicio de Alergia e Inmunología Clínica, Centro Médico Nacional Siglo XXI, IMSS, México, DF. 1 Facultad de Medicina, Universidad de Granada, Granada, España. 146 Correspondencia: Dr. Francisco Vázquez Nava. Reforma 100-B, colonia Árbol Grande, CP 89490, Ciudad Madero, Tamaulipas, México. Correo electrónico: [email protected] Recibido: junio, 2010. Aceptado: agosto, 2010. Este artículo debe citarse como: Torres-Fermán IA, VázquezNava F, Calafell-Ceballos RA, Vázquez-Rodríguez EM y col. Prevalencia de asma en adolescentes. Relación con el sexo y el tabaquismo activo. Rev Alerg Mex 2010;57(5):146-152. www.nietoeditores.com.mx Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Prevalencia de asma en adolescentes E l asma constituye la enfermedad respiratoria crónica de mayor prevalencia en niños y adolescentes; existe evidencia de que su prevalencia sigue aumentando en diversas partes del mundo.1-7 Los resultados de estudios acerca del origen del asma en adolescentes muestran que la asociación entre algunos factores de riesgo, como el sexo y el tabaquismo activo, y la aparición de asma requiere ser mejor estudiada.8,9 El aumento de la prevalencia de asma en adolescentes no puede atribuirse únicamente a cambios genéticos;10 muchas hipótesis se han formulado, pero no se ha llegado a un consenso.11,12 Algunos investigadores han asociado en adolescentes el sexo con la aparición de asma; sin embargo, los resultados han sido diferentes.8 Autores como Maziak y col. y Strachan y col., entre otros, han reportado una mayor incidencia de asma en varones;5,13 en contraste, otros autores –como Larsson y Fagan y col.– han señalado un predominio de asma en mujeres adolescentes.14,15 Asimismo, el tabaquismo activo en adolescentes constituye en el mundo un problema de salud de carácter epidémico. 16,17 Como consecuencia de la elevada prevalencia de asma18 y tabaquismo activo19 en adolescentes, algunos autores han investigado si el tabaquismo activo pudiera estar asociado con la aparición de asma en adolescentes;20,21 los resultados hasta ahora obtenidos no son concluyentes. Algunos autores han encontrado una asociación entre tabaquismo activo y aparición de asma;15 otros la han identificado en mujeres fumadoras pero no en hombres fumadores.22 En contraparte, otros investigadores –como Ulrik y col. y Thomsen y col.– no han encontrado asociación entre tabaquismo activo y aparición de asma en adolescentes.23,24 En consecuencia, el presente trabajo de investigación se hizo con una amplia muestra poblacional de adolescentes, residentes en una zona urbana del noreste de México, para determinar la asociación entre sexo, tabaquismo activo y prevalencia de asma. PARTICIPANTES y método Éste es un estudio transversal basado en un estudio de población. Se incluyeron adolescentes entre 12 y 18 años de edad, que asistían regularmente a escuelas secunda- rias, preparatorias y universidades del área urbana del noreste de México. Dicha zona –que se encuentra a 542 km al noreste de la Ciudad de México, en la región sur del estado de Tamaulipas, sobre el litoral del Golfo de México– comprende las ciudades de Tampico, Ciudad Madero y Altamira. Las tres ciudades comparten un área de 1,492.7 km2 y cuentan con una población de 605,431 habitantes. El Comité Ético del Hospital General núm. 6 del IMSS de Ciudad Madero, Tamaulipas, y el de la Facultad de Medicina de Tampico de la Universidad Autónoma de Tamaulipas, México, revisaron y aprobaron el proyecto de investigación. Los adolescentes participantes en el estudio fueron seleccionados por medio de uno de los programas de servicio que presta la Facultad de Medicina a la comunidad. Para realizar este estudio se obtuvo el permiso de las autoridades educativas de la zona conurbada de Tampico-Madero-Altamira. Los planteles escolares se seleccionaron mediante la técnica de muestreo aleatorio simple. En cada una de las escuelas seleccionadas se solicitó una lista de los nombres de los estudiantes inscritos. Una vez que se obtuvieron las listas de los grupos escolares, los alumnos fueron seleccionados mediante el sistema de números aleatorios. Los datos se recopilaron y analizaron entre junio de 2006 y marzo de 2008. Para registrar la información se utilizó en forma anónima un cuestionario de autocontestación, compuesto de 24 ítems cuyas preguntas eran cerradas y de respuesta múltiple y binomial. Por medio de este instrumento se registró la información de los participantes, referente a la edad, sexo, estatura, peso, índice de masa corporal, clase y frecuencia de la práctica deportiva, antecedentes familiares de enfermedades alérgicas, existencia de fumadores dentro del hogar (padre y madre), si era fumador(a) activo(a), frecuencia y edad de inicio, asma diagnosticada por un médico, síntomas de asma, severidad y tratamiento. Las preguntas referentes al asma fueron tomadas –y adaptadas a nuestro medio– de los cuestionarios que el Estudio Internacional de Asma y Alergias en la Niñez (ISAAC por sus siglas en inglés) y la Encuesta de Salud Respiratoria de la Comunidad Europea (ECRHS por sus siglas en inglés) utilizan.25,26 Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 147 Torres Fermán IA y col. Medidas de interés y codificación de las variables Asma actual Para establecer el diagnóstico de asma y los síntomas de asma incluimos las siguientes preguntas: 1) alguna vez en tu vida, ¿has tenido un silbido en el pecho?, 2) en los últimos 12 meses, ¿has tenido un silbido en el pecho sin que hayas sufrido gripe o resfriado común?, 3) ¿un médico te ha dicho que sufres de asma?, y 4) en los últimos 12 meses, ¿te has despertado por las noches a causa de un ataque de tos seca sin que hayas padecido gripe o resfriado común? El diagnóstico de asma se estableció cuando los adolescentes, los padres o los tutores de los jóvenes respondían afirmativamente la pregunta siguiente: ¿un médico te ha dicho que sufres de asma? Esta variable fue codificada de esta manera: 1 = asma actual presente, y 0 = asma actual ausente. También se les cuestionó sobre el tipo de medicamentos que estaban ingeriendo. Revisamos los medicamentos contra el asma y los clasificamos de esta manera: esteroides orales o inhalados, broncodilatadores orales o inhalados y otros medicamentos. La información acerca del consumo de medicamentos contra el asma no se consideró para establecer el diagnóstico de asma. Tabaquismo activo La información de esta variable se obtuvo de las respuestas dadas a las siguientes preguntas: 1) ¿tú fumas? Las opciones de respuesta fueron: a) sí, al menos un cigarro al día, b) sí, al menos un cigarro a la semana, c) sí, al menos un cigarro por mes, d) sí, pero sólo en ocasiones especiales, e) no, yo no fumo, y 2) ¿has fumado alguna vez en la vida? Las opciones fueron: a) no, nunca he fumado, b) sí, fumé un cigarro para probar, pero no he fumado en los últimos seis meses, c) sí, pero dejé de fumar hace más de un año. Con base en la definición utilizada en la Encuesta Nacional de Adicciones México 2002 consideramos que una persona era fumadora cuando al momento de la entrevista reportaba haber fumado.27 Esta variable independiente la codificamos así: 1 = fumador y 0 = no fumador. Una vez establecido el cuestionario, se capacitó a los encuestadores para que capturaran en forma correcta la 148 información, sobre todo la relacionada con el diagnóstico de asma y tabaquismo, así como con otras variables consideradas en el estudio. Los datos se analizaron con el paquete estadístico SPSS, versión 16.0. Se determinaron las frecuencias simples y las medidas de tendencia central (medias y desviación estándar) y se utilizó una tabla de contingencia de 2 X 2 (prueba de la ji al cuadrado, OR e IC de 95%) para determinar, por sexo y tabaquismo activo (variables independientes), el riesgo de asma actual (variable dependiente). Se realizó un análisis de regresión logística, haciendo una eliminación regresiva, para determinar la asociación de las principales variables. Cualquier valor de p menor que 0.05 se consideró significativo y la atopia familiar, el tabaquismo pasivo (padre o madre [o ambos] fumadores) y la rinitis alérgica se utilizaron como covariables. Se solicitó y obtuvo el consentimiento de los participantes o el de sus padres o tutores cuando el caso lo requería. Resultados Se estudiaron 6,922 adolescentes: 46.3% fueron hombres y la edad media fue de 15.17 ± 1.67. La prevalencia de tabaquismo activo fue de 17.3%, y la de asma actual, 7.3%. Aproximadamente 11.1% de los adolescentes reportó que en los últimos 12 meses, antes del estudio, sufrió sibilancias. Los datos muestran que las mujeres (17.1%) sufrieron por las noches más ataques de tos seca que los hombres (11.9%). En el Cuadro 1 se muestran, por sexo, cada una de las variables demográficas y clínicas de la población estudiada. El porcentaje de pacientes masculinos con asma que requirieron atención en el servicio de Urgencias (3.0 vs 2.7%), que fueron hospitalizados (1.9 vs 1.2%) y que se ausentaron de la escuela (3.2 vs 3.0%) fue ligeramente mayor que el porcentaje de pacientes femeninos. Encontramos que la prevalencia de asma era mayor en hombres que en mujeres (8.2 vs 6.5%). Según nuestro análisis, la asociación entre el sexo masculino y la prevalencia de asma en adolescentes (OR ajustada = 0.55; IC 95%: 0.48-0.63; p = 0.000) fue estadísticamente significativa, después de controlar el resto de las variables incluidas en el modelo de regresión. El porcentaje Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Prevalencia de asma en adolescentes Cuadro 1. Características demográficas y clínicas por género de la población estudiada Población total Edad (media ± DE) Antecedente familiar de alergia Existencia de fumadores en el hogar Padre Madre Ambos padres Tabaquismo activo Asma actual Sibilancias en los últimos 12 meses Sibilancias alguna vez en la vida Despierta por acceso de tos seca Atendido en urgencias por asma Hospitalizado por asma Ausentismo escolar por asma Hombres (n, %) Mujeres (n, %) Total (n, %) 3,206 (46.3) 15.17 ± 1.71 1,518 (47.3) 1,161 (36.2) 717 (22.4) 243 (7.6) 201 (6.3) 624 (19.5) 263 (8.2) 336 (10.5) 736 (23.0) 381 (11.9) 97 (3.0) 61 (1.9) 103 (3.2) 3,716 (53.7) 15.18 ± 1.63 2,067 (55.7) 1,294 (34.8) 765 (20.6) 324 (8.7) 205 (5.5) 574 (15.5) 240 (6.5) 429 (11.5) 875 (23.5) 635 (17.1) 102 (2.7) 45 (1.2) 110 (3.0) 6,922 (100.0) de adolescentes con asma fue ligeramente mayor en el grupo de jóvenes fumadores activos (8.3 vs 7.1%). En adolescentes no se asoció el tabaquismo activo (OR ajustada = 1.12; IC 95%: 0.89-1.42; p = 0.317) con la prevalencia de asma (Cuadro 2). Nuestros datos muestran que el porcentaje de adolescentes con antecedentes de sibilancias en los últimos 12 meses, antes del estudio, fue mayor en mujeres (11.5 vs 10.5%) [Cuadro 3]. Después del análisis en los últimos 12 meses el sexo femenino (OR ajustada = 1.44; IC 95%: 1.13-1.84; p = 0.003) se encontró significativamente asociado con sibilancias. Asimismo, en los últimos 12 meses la prevalencia de sibilancias fue mayor en fumadores activos (14.4 vs 10.4%). El tabaquismo activo (OR ajustada = 1.38; IC 95%: 1.15-1.67; p = 0.001) parece constituir un factor de riesgo importante asociado con sibilancias. Los resultados de los análisis a adolescentes acerca de la relación entre sexo, tabaquismo activo y accesos de tos seca durante el sueño nocturno fueron diferentes. Los datos (OR ajustada = 1.53; IC 95%: 1.34-1.76; p = 0.000) muestran que el riesgo de padecer este síntoma fue mayor en las mujeres que en los hombres (Cuadro 4). En adolescentes no se asoció el tabaquismo activo con accesos de tos seca nocturna (OR ajustada = 1.12; IC 95%: 0.94-1.34; p = 0.182). 3,585 (51.8) 2,455 (35.5) 1,482 (21.4) 567 (8.2) 406 (5.9) 1,198 (17.3) 503 (7.3) 765 (11.1) 1,611 (23.3) 1,016 (14.7) 199 (2.9) 106 (1.5) 213 (3.1) Discusión Sexo y asma En una muestra de 6,922 adolescentes el sexo masculino parece no estar asociado con la prevalencia de asma. En reportes previos se han proporcionado resultados diferentes. Algunos investigadores han identificado una mayor prevalencia de asma en adolescentes varones; sin embargo, en este grupo de edad la relación entre sexo masculino y asma no fue significativa después del análisis estadístico (Maziak y col., hombres 16.3% vs mujeres 15.4% ; OR = 1.1; IC 95%: 0.91-1.31).5,19 Sin embargo, después de estudiar a una población desde la niñez hasta los 33 años de edad para conocer cuál era la incidencia y pronóstico de asma y sibilancias en dicha población, Strachan y col. encontraron que en adolescentes el sexo masculino se encuentra asociado con la prevalencia de asma.13 En oposición a estos últimos reportes, algunos grupos de investigación –como los de Larsson y Fagan y col.– han señalado que en adolescentes el sexo femenino constituye un factor de riesgo de asma.14,15 De acuerdo con lo antes expuesto, es evidente la necesidad de desarrollar nuevos proyectos de investigación para aclarar en forma definitiva la relación entre sexo y prevalencia de asma en adolescentes. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 149 Torres Fermán IA y col. Cuadro 2. Asociación entre sexo, tabaquismo activo y prevalencia de asma actual en adolescentes Asma actual Hombres Mujeres Fumador en casa Fumador en casa Padre Madre Ambos fuman Fumador activo Atopia familiar (+) (-) (+) (-) (+) (-) (+) (-) (+) (-) (+) (-) Sí (%) No (%) Regresión logística OR (IC 95%) Valor de p 263 (8.2) 240 (6.5) 193 (7.9) 310 (6.9) 110 (7.4) 393 (7.2) 46 (8.1) 457 (7.2) 37 (9.1) 466 (7.2) 99 (8.3) 404 (7.1) 341 (9.5) 162 (4.9) 2,943 (91.8) 3,476 (93.8) 2,262 (92.1) 4,157 (93.1) 1,372 (92.6) 5,047 (92.8) 521 (91.9) 5,898 (92.8) 369 (90.9) 6,050 (92.8) 1,099 (91.7) 5,320 (92.9) 3,244 (90.5) 3,175 (95.1) 0.55 (0.48-0.63) 0.000 1.10 (0.91-1.32) 0.322 1.01 (0.81-1.26) 0.924 1.08 (0.78-1.48) 0.622 1.17 (0.82-1.67) 0.376 1.12 (0.89-1.42) 0.317 2.05 (1.68-2.48) 0.000 (+): adolescentes con la característica; (-): adolescentes sin la característica. Cuadro 3. Asociación entre sexo, tabaquismo activo y prevalencia de sibilancias en los últimos 12 meses en adolescentes Sibilancias en los últimos 12 meses Mujeres Hombres Fumador pasivo Padre Madre Ambos fuman Fumador activo Atopia familiar (+) (-) (+) (-) (+) (-) (+) (-) (+) (-) (+) (-) Sí (%) No (%) Regresión logística OR (IC 95%) Valor de p 429 (11.5) 336 (10.5) 302 (12.3) 463 (10.4) 174 (11.7) 591 (10.9) 69 (12.2) 696 (11.0) 59 (14.5) 706 (10.8) 172 (14.4) 593 (10.4) 499 (13.9) 266 (8.0) 3,287 (88.5) 2,870 (89.5) 2,153 (87.7) 4,004 (89.6) 1,308 (88.3) 4,849 (89.1) 498 (87.8) 5,659 (89.0) 347 (85.5) 5,810 (89.2) 1,026 (85.6) 5,131 (89.6) 3,086 (86.1) 3,071 (92.0) 1.44 (1.13-1.84) 0.003 1.14 (0.97-1.33) 0.089 1.06 (0.88-1.27) 0.521 1.05 (0.80-1.37) 0.697 1.21 (0.91-1.70) 0.183 1.38 (1.15-1.67) 0.001 1.83 (1.56-2.14) 0.000 (+): adolescentes con la característica; (-): adolescentes sin la característica. Tabaquismo y asma No hay duda de que el tabaquismo activo tiene un efecto nocivo para la salud, así se ha documentado en diversos trabajos de investigación. Sin embargo, se ha discutido que el tabaquismo activo sea en adolescentes un factor de riesgo potencial de asma. En sus trabajos algunos autores no encontraron asociación 150 entre tabaquismo y aparición de asma.6 Sin embargo, otros investigadores sustentan la hipótesis de que el tabaquismo activo constituye en adolescentes un factor de riesgo potencial de asma.2,13,18 Nuestros datos confirmaron la primera propuesta, ya que no encontramos en adolescentes una asociación entre tabaquismo activo y prevalencia de asma. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Prevalencia de asma en adolescentes Cuadro 4. Asociación entre sexo, tabaquismo activo y prevalencia de accesos de tos seca durante el sueño nocturno en adolescentes Accesos de tos seca durante el sueño nocturno Sí (%) No (%) Mujeres Hombres Fumador pasivo Padre Madre Ambos fuman Fumador activo Atopia familiar (+) (-) (+) (-) (+) (-) (+) (-) (+) (-) (+) (-) 635 (17.1) 381 (11.9) 376 (15.3) 640 (14.3) 229 (15.5) 787 (14.5) 81 (14.3) 935 (14.7) 66 (16.3) 950 (14.6) 192 (16.0) 824 (14.4) 657 (18.3) 359 (10.8) 3,081 (82.9) 2,825 (88.1) 2,079 (84.7) 3,827 (85.7) 1,253 (84.5) 4,653 (85.5) 486 (85.7) 5,420 (85.3) 340 (83.7) 5,566 (85.4) 1,006 (84.0) 4,900 (85.6) 2,928 (81.7) 2,978 (89.2) Regresión logística OR (IC 95%) Valor de p 1.53 (1.34-1.76) 0.000 1.03 (0.89-1.18) 0.655 1.06 (0.90-1.25) 0.440 0.92 (0.72-1.18) 0.531 1.04 (0.79-1.37) 0.773 1.12 (0.94-1.34) 0.182 1.85 (1.61-2.12) 0.000 (+): adolescentes con la característica; (-): adolescentes sin la característica. Sibilancias en los últimos 12 meses De acuerdo con los datos registrados en este proyecto, el porcentaje de mujeres que reportó haber tenido sibilancias en el último año fue ligeramente mayor. A diferencia de lo que Ulrik y col. reportaron, encontramos que el sexo femenino se asocia con la prevalencia de sibilancias en los últimos 12 meses.23 Respecto a la relación entre tabaquismo y síntomas de asma, múltiples trabajos de investigación reportaron que el tabaquismo activo se asocia con sibilancias en los últimos 12 meses.25-30 Sin embargo, otros autores no encontraron asociación entre estas dos variables.23 Nuestros datos sustentan que en adolescentes el tabaquismo activo y las sibilancias en los últimos 12 meses se asocian, porque identificamos que los adolescentes que fuman tienen 1.38 veces más riesgo de padecer sibilancias en los últimos 12 meses que los no fumadores. Accesos de tos seca durante el sueño nocturno Respecto a los ataques de tos seca durante la noche, Fagan y col. reportaron que en su población de estudio hubo una prevalencia de 28.8%, lo cual es el síntoma de asma que con más frecuencia se reporta en esta clase de enfermos.15 En nuestro estudio la prevalencia de tos seca nocturna fue de 14.7%. Cuando algunos investigadores, como Fagan y col. y Maziak y col., estudiaron la relación entre género y síntomas de asma en adolescentes, encontraron que el sexo femenino se relaciona con accesos de tos seca nocturna.5,15 Los resultados de nuestro estudio coinciden con los que estos autores reportaron, porque encontramos que el porcentaje de mujeres adolescentes (17.1%) que sufren accesos de tos seca por las noches es mayor que el porcentaje de hombres (11.9%). Más aún, en nuestro estudio la relación entre sexo femenino y tos seca nocturna fue significativa después de que ajustamos las variables de confusión que incluimos en el modelo de regresión logística (sexo femenino vs sexo masculino: OR = 1.53; IC 95%: 1.34-1.76). Asimismo, investigaciones recientes reportan que el tabaquismo activo favorece los ataques de tos seca nocturna;17 sin embargo, otros autores no asocian estas dos variables.23Los resultados obtenidos en nuestro estudio sustentan la hipótesis de que en adolescentes el tabaquismo activo no se asocia con accesos de tos seca nocturna. Según información reciente, la prevalencia de asma y el tabaquismo son mayores en adolescentes de países industrializados.1,5,7,15 A pesar de que México es considerado un país en vías de desarrollo, la prevalencia de asma y el tabaquismo activo en sus adolescentes9 ponen de manifiesto que en todo el mundo estas dos condiciones constituyen problemas relevantes de salud. Los hallazgos de este trabajo refuerzan la importancia Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 151 Torres Fermán IA y col. de realizar campañas para reducir el tabaquismo activo, sobre todo en los grupos de población que están en pleno desarrollo y que padecen una enfermedad respiratoria como el asma; el propósito es asegurarles una mejor calidad de vida en edades posteriores. REFERENCIAS 1. Gerson AS, Guan J, Wang C, To T. Trends in asthma prevalence and incidence in Ontario, Canada, 1966-2005: a population study. Am J Epidemiol 2010;172:728-736. 2. Moreau D, Ledoux S, Choquet M, Annesi-Maesano. Prevalence and severity of asthma in adolescents in France. Crosssectional and retrospective analyses of a large populationbased sample. Int J Tuberc Lung Dis 2000;4:639-648. 3. Vargas Becerra MH. Epidemiología del asma. Rev Alerg Mex 2009;56:S3-S9. 4. Carvajal UI, García ML, Busquets MR, Suárez MM, et al. Geographic variation in the prevalence of asthma symptoms in Spanish children and adolescents. International study of asthma and allergies in childhood (ISAAC) phase 3, Spain. Arch Bronconeumol 2005;41(12):659-666. 5. Maziak W, Behrens T, Brasky TM, Duhme H, et al. Are asthma and allergies in children and adolescents increasing? Results from ISAAC phase 1 and 111 surveys in Münster, Germany. Allergy 2003;58:572-579. 6. Vink NM, Postma DS, Schouten JP, Rosmalen JG, Boezen HM. Gender differences in asthma development and remission during transition through puberty: the TRacking Adolescents’ Individual Lives Survey (TRAILS) study. J Allergy Clin Immunol 2010;126:498-504. 7. Hong SJ, Lee S, Sohn MH, Shims JY, et al. Self-reported prevalence and risk factors of asthma among Korean adolescents: 5-year follow-up study, 1995-2000. Clin Exp Allergy 2004;34:1556-1562. 8. Wiesch DG, Samet JM. Epidemiology and natural history of asthma. In: Adkinson NF Jr, Yunginger JW, Busse WW, Bochner BS, et al., editors. Middleton’s allergy: principles and practice. 5th ed. St. Louis: Mosby, 1998;p:799-815. 9. Vázquez-Nava F, Peinado-Herreros JM, Saldívar-González AH, Barrientos Gómez MC, et al. Association between family structure, parental smoking, friends who smoke, and smoking behavior in adolescents with asthma. Sci World J 2010;10:62-69. 10. Lemanske RF, Busse WW. Asthma. J Allergy Clin Immunol 2003;111:S502-S519. 11. Chipps BE. Determinants of asthma and its clinical course. Ann Allergy Asthma Immunol 2004;93:309-316. 12. Kay AB, Gelfand EW, Smith LJ, Tashkin D. Natural history of asthma from childhood to adulthood. Clin Exp All Rev 2002;2:117-127. 13. Strachan DP, Butland BK, Anderson HR. Incidence and prognosis of asthma and wheezing illness from early childhood to age 33 in a national British cohort. BMJ 1996;312:1195-1199. 152 14. Larsson L. Incidence of asthma in Swedish teenagers: relation to sex and smoking habits. Thorax 1995;50:260-264. 15. Fagan JK, Scheff PA, Hryhorezuk D, Ramakrishnan V, et al. Prevalence of asthma and other allergic diseases in an adolescent population: association with gender and race. Ann Allergy Asthma Immunol 2001;86:177-184. 16. Organización Mundial de la Salud. Convenio marco de la Organización Mundial de la Salud para el control del tabaco. Rev Sanid Milit Mex 2005;59:179-192. 17. Sánchez AL. Tabaquismo en la infancia. Arch Bronconeumol 2004;40:1-4. 18. Annesi-Maesano I, Oryszczyn MP, Raherison C, Kopferschmitt C, et al. Increased prevalence of asthma and allied diseases among active adolescent tobacco smokers after controlling for passive smoking exposure. A cause for concern? Clin Exp Allergy 2004;34:1017-1023. 19. Yáñez AM, López R, Serra-Batlles J, Roger N y col. Consumo de tabaco en adolescentes. Estudio poblacional sobre las influencias parentales y escolares. Arch Bronconeumol 2006;42:21-24. 20. Romero PPJ. Asma y humo de tabaco. Arch Bronconeumol 2004;40:414-418. 21. Kaplan BA, Mascie GN. Smoking and asthma among 23 year olds. J Asthma 1997;34:219-229. 22. Chen Y, Dales R, Krewski D, Breithaupt K. Increased effects of smoking and obesity on asthma among female Canadians: the National Population Health Survey, 1994-1995. Am J Epidemiol 1999;150:255-262. 23. Ulrik CS, Backer V, Hesse B, Dirksen A. Risk factors for development of asthma in children and adolescents: findings from a longitudinal population study. Respir Med 1996;90:623-630. 24. Thomsen SF, Ulrik CS, Kyvik KO, Larsen K, et al. The incidence of asthma in young adults. Chest 2005;127:19281934. 25. Mata FC, Fernández BM, Pérez MM, Guillén GF. Validation of the Spanish version of the Phase III ISAAC questionnaire on asthma. J Investig Allergol Clin Immunol 2005;15:201210. 26. European Community Respiratory Health Survey. Variations in the prevalence of respiratory symptoms, self-reported asthma attacks, and use of asthma medication in the European Community Respiratory Health Survey (ECRHS). Eur Respir J 1996;9:687-695. 27. Instituto Nacional de Estadística Geografía e Informática. Encuesta Nacional de Adicciones 2002. México: INEGI, 2002. Disponible en: http://www.inegi.gob.mx/est/contenidos/espanol/proyectos/metadatos/encuestas/ena_2312.asp?c=6186. 28. Austin JB, Selvaraj S, Godden D, Russel G. Deprivation, smoking and quality of life in asthma. Arch Dis Child 2005;90:253-257. 29. Bai J, Peat J, Berry G, Marks GB, Woolcock AJ. Questionnaire items that predict asthma and other respiratory conditions in adults. Chest 1998;114:1343-1348. 30. Galván FC, Suárez RG, Oliva HC, Doménech ME. Patología respiratoria en los jóvenes y hábito tabáquico. Arch Bronconeumol 2000;36:186-190. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Revista Alergia México 2010;57(5):153-158 Artículo original Prevalencia de hipersensibilidad al polen de Cupressus en pacientes alérgicos en Monterrey, México1 Liborio Rafael Leal García,* Sandra Nora González Díaz,* María del Carmen Zárate Hernández,* Alfredo Arias Cruz,* Lucía Leal Villarreal,* María Amelia Manrique López,* Dora Alicia Valdés Burnes* RESUMEN Antecedentes: el polen de Cupressus es uno de los principales agentes causales de enfermedades respiratorias alérgicas en Norteamérica. En un estudio previo de la concentración polínica de Monterrey, este polen ocupó el tercer lugar en frecuencia. Objetivo: conocer la sensibilización a Cupressus en pacientes atendidos en el Centro Regional de Alergia e Inmunología Clínica del Hospital Universitario José Eleuterio González. Material y métodos: se diseñó un estudio observacional, transversal y prospectivo en el que se aplicó un cuestionario para valorar los síntomas alérgicos y la potencial exposición al polen, una prueba cutánea con extracto alergénico de Cupressus en dilución de 1:20 y una prueba cutánea con otros 36 aeroalergenos. Resultados: se realizó la prueba cutánea con extracto alergénico de Cupressus en 256 pacientes, de los cuales 136 eran mujeres; en cuanto a la edad, 130 eran menores de 18 años y 126, adultos. La prueba fue positiva en 39 individuos (15.2%). De los 36 aeroalergenos probados en el centro, Cupressus ocupó el séptimo lugar en frecuencia. De los 130 menores de 18 años, sólo 10 (7.7%) fueron positivos, en tanto que entre los 129 adultos, el número aumentó a 29 (22.5%, p = 0.001). Los pacientes con prueba positiva a Cupressus también dieron positivo al menos a otro aeroalergeno en 97% de los casos (p ≤ 0.001). Conclusiones: la sensibilización a Cupressus resultó ser alta en este grupo de estudio (15.2%). Debe considerarse la aplicación rutinaria de extracto alergénico de Cupressus en pacientes con alergia respiratoria; sin embargo, es necesario realizar más pruebas para conocer con precisión la prevalencia de esta sensibilización y sus posibles implicaciones clínicas en esta población. Palabras clave: Cupressus, sensibilización, pruebas cutáneas, prevalencia, rinitis. ABSTRACT Background: Cupressus pollen is one of the main causes of allergic respiratory disease in North America. In a previous study of pollen concentration in Monterrey, Cupressus occupied the 3rd place in frequency. Objective: To know the sensitization to Cupressus in patients treated at our center. Methods: We conducted an observational, cross-sectional and prospective study, with a questionnaire to assess potential exposure and allergic symptoms to pollen, skin tests with allergen extract of Cupressus 1:20 dilution, and skin tests with others 36 aeroallergens in our hospital. Results: We did Cupressus skin test in 256 patients (136 women), 130 younger than 18 years old and 126 adults. The skin test was positive in 39 patients (15.2%). Of the 36 aeroallergens tested, Cupressus occupied the 7th place in frequency. Of the 130 under 18 years, only 10 (7.7%) had a positive skin test. Among the other 129 adults, 29 (22.5%) had a positive skin test (p = 0.001). Patients with a positive skin test Cupressus had at least one positive skin test to other aeroallergen in 97% of cases (p ≤ 0.001). Conclusions: Cupressus sensitization in our study group was high (15.2%). The routine use of allergen extract of Cupressus should be considered in patients with respiratory allergy. However, it is necessary to determine precisely the prevalence of sensitization and its possible clinical implications. Key words: Cupressus, sensitization, skin tests, prevalence, rhinitis. 1 * Este protocolo fue aprobado por el Comité de Ética y Elegibilidad del Hospital Universitario José Eleuterio González, Monterrey, NL, México. Centro Regional de Alergia e Inmunología Clínica, Hospital Universitario José Eleuterio González, Monterrey, Nuevo León. Correspondencia: Dr. Liborio Rafael Leal García. Centro Regional de Alergia e Inmunología Clínica, Hospital Universitario José Eleuterio González, Universidad Autónoma de Nuevo León. Madero y Gonzalitos s/n, colonia Mitras Centro, CP 64460, Monterrey, Nuevo León, México. Correo electrónico: [email protected] Recibido: agosto, 2010. Aceptado: septiembre, 2010. Este artículo debe citarse como: Leal-García LR, González-Díaz SN, Zárate-Hernández MC, Arias-Cruz A y col. Prevalencia de hipersensibilidad al polen de Cupressus en pacientes alérgicos en Monterrey, México. Rev Alerg Mex 2010;57(5):153-158. www.nietoeditores.com.mx Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 153 Leal García LR y col. L os padecimientos atópicos, como la rinoconjuntivitis, el eccema atópico y el asma afectan a 25% de la población mundial.1-3 Sus síntomas suelen ser desencadenados por diversos alergenos. Los pólenes de plantas pueden actuar como alergenos al contacto o exposición en pacientes sensibilizados. Las plantas producen grandes cantidades de polen y, por tanto, son una importante fuente de alergenos en suspensión en el aire (aeroalergenos).1,4 El alto contenido de polen en el ambiente se relaciona con la aparición de asma, rinitis y alergia ocular en sujetos genéticamente susceptibles.1,2 El muestreo de aeroalergenos proporciona información clínicamente valiosa para determinar el posible riesgo de generación de síntomas de alergia en personas sensibilizadas.5 Un 20% de la población alérgica al polen vive en países industrializados, en donde se ha llevado a cabo gran parte de la investigación para identificar las especies y los alergenos de polen que causan la alergia.6,7 Al tratar al paciente es fundamental conocer los tipos específicos de aeroalergenos que existen en el área donde reside y cuáles de ellos pudieron sensibilizarlo.8 El médico alergólogo debe seleccionar el número y el tipo de extractos alergénicos de plantas y hongos de mayor importancia clínica para incluirlos en su panel de pruebas cutáneas con el fin de establecer un diagnóstico preciso. Adicionalmente, deberán tomarse en consideración las épocas de mayor o menor concentración y la reactividad cruzada para formular de manera adecuada la inmunoterapia.8 En 2004 se estudió la concentración polínica del aire del área metropolitana de la ciudad de Monterrey, Nuevo León, mediante la utilización de un captador volumétrico tipo Hirst (Burkard Manufacturing Co. Ltd., Rickmansworth, UK). Los meses de máxima concentración polínica, en general, fueron febrero y marzo. El polen de Cupressus, el cual es responsable de muchos casos de polinosis en el mundo, ocupó el tercer lugar en frecuencia en dicho estudio.9 Cupressus pertenece a la familia Cupressaceae dentro del orden de las coníferas.10-12 Hace poco se identificó el Cup s 1 como un alergeno específico causante de la sensibilización alérgica intensa al polen de coníferas. Cupressus es originario de las montañas del este y del sur de la región mediterránea, del sur de Estados Unidos y del norte de México. Su área de 154 distribución se extendió a los países circunmediterráneos merced a su cultivo con fines ornamentales; poliniza de enero a febrero. El polen de la familia Cupressaceae es una de las causas principales de enfermedades alérgicas respiratorias en invierno en América del Norte, Japón y los países del Mediterráneo.13,14 A pesar de su alta concentración polínica, Cupressus sólo se incluye en las baterías de pruebas cutáneas de 17% de los consultorios de alergólogos en México, entre los que no se encuentra este centro de diagnóstico y tratamiento. El objetivo de este estudio fue investigar la frecuencia de sensibilización a Cupressus en pacientes atendidos en este centro, con la finalidad de valorar su posible inclusión en la batería de extractos alergénicos para pruebas cutáneas e inmunoterapia.9,16 PACIENTES Y MÉTODO De octubre de 2009 a febrero de 2010 se realizó un estudio observacional, transversal y prospectivo, el cual fue aprobado por el Comité de Ética del Hospital Universitario Dr. José Eleuterio González. Se reclutaron los pacientes, de cualquier edad y sexo, atendidos en el Centro Regional de Alergia e Inmunología Clínica del Hospital Universitario de Monterrey, Nuevo León, a quienes se les habían realizado pruebas cutáneas a aeroalergenos y que estaban dispuestos a dar su consentimiento informado o asentimiento, en el caso de los menores de edad. Se excluyeron los sujetos con inmunosupresión, dermatitis generalizada o localizada en el sitio de aplicación (espalda), que estuvieran recibiendo inmunoterapia para tratar enfermedad alérgica, antihistamínico, o ambos, que padecieran alguna enfermedad mental y los que rechazaron participar en el protocolo. Cada uno de los reclutados respondió un cuestionario elaborado en el centro para valorar los síntomas de enfermedades alérgicas y su potencial asociación con la exposición al polen de Cupressus (en casa o en la de algún vecino), así como para recabar sus datos demográficos. El cuestionario incluyó una fotografía de Cupressus para que los pacientes pudieran identificarlo mejor. A todos se les realizaron pruebas cutáneas en la espalda tipo prick con duotip que contenía extracto alergénico comercial de Cupressus arizonica (Allerstand) en una concentración de 1:20 peso-volumen (P/V); además, Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Prevalencia de hipersensibilidad al polen de Cupressus en pacientes alérgicos en Monterrey, México se les aplicó la batería de 36 aeroalergenos comúnmente usados en el centro, como: Fraxinus, Junglans, Juniperus, Ligustrum, Populus, Prosopis y Quercus. Se utilizó una solución de fosfato de histamina (en concentración de 10 mg/mL) como testigo positivo y una solución diluyente glicerinada de fosfatos como testigo negativo. La lectura de las pruebas cutáneas se hizo a los 15 minutos de la aplicación, con una regla milimétrica. La prueba se consideró positiva si la roncha medía 3 mm o más por encima del testigo negativo. Para calcular el tamaño de la muestra se utilizó una desviación estándar (Z) de 1.96 y un margen de error del 5%, lo cual arrojó un resultado de 148 pacientes. Los datos se analizaron en el programa SPSS versión 17.0 para Windows. Se determinaron las medias, las frecuencias y la ji al cuadrado; y se estableció como significativa una p < 0.05. RESULTADOS Se aplicaron pruebas cutáneas con extracto alergénico de Cupressus a 256 pacientes con un rango de edad de 2 a 77 años y una media de 21.8 años ± 17.5, predominantemente del sexo femenino (53.1%). Del total, 130 (50.8%) eran menores de 18 años de edad y el resto eran adultos, que se distribuyeron en diferentes grupos de edad: preescolares (23%), escolares (19.5%), adolescentes (7.8%), adultos de 18 a 40 años (33.6%), adultos de 41 a 59 años (12.5%) y ancianos (3.5%). Un 91.8% (n = 235) de los pacientes residía en el área metropolitana de Monterrey; 3.5% (n = 9) en otros municipios de Nuevo León, y 4.7% (n=12) en otros estados del país. De los 256 pacientes, 35.2% (n = 90) refirieron haber tenido contacto con el árbol de Cupressus, 14.4% (n = 13) en su casa y 85.5% (n = 77) en casa de algún vecino. La prueba cutánea con el extracto de Cupressus fue positiva en 39 sujetos (15.2%), 21 hombres y 18 mujeres (p = 0.34). Cupressus ocupó el primer lugar en frecuencia de respuesta positiva dentro del grupo de los árboles probados y el séptimo lugar entre los extractos (Cuadro 1). Un 6.69% (n = 9) de los 130 menores de 18 años y 23.8% (n = 30) de los 126 adultos resultaron positivos a la prueba cutánea (p = 0.001). El rango de edad en el que hubo más positivos fue de 18 a 40 años, con 27.9% (p = 0.002) (Cuadro 2). De los 36 individuos con prueba Cuadro 1. Aeroalergenos con mayor frecuencia de respuesta positiva en las pruebas cutáneas 1 2 3 4 5 6 7 Extracto alergénico Número (%) D. pteronyssinus D. farinae Cynodon Lolium Salsola Amaranthus Cupressus 94 (36.7) 85 (33.2) 54 (21.1) 46 (18) 45 (17.6) 43 (16.8) 39 (15.2) Cuadro 2. Prueba cutánea a Cupressus por edad (p = 0.002) Rango de edad en años Preescolar (2-5) Escolar (6-12) Adolescencia (13-17) Adulto joven (18-40) Adulto mayor (41-59) Anciano (60 o más) Total Positiva Negativa 2 (3.4%) 5 (10%) 2 (10%) 24 (27.9%) 5 (15.6%) 1 (11.1%) 39 (15.2%) 57 (96.6%) 45 (90%) 18 (90%) 62 (72.1%) 27 (84.4%) 8 (88.9%) 217 (84.8%) cutánea positiva a Cupressus, 35 (89.7%) habitaban en el área metropolitana de Monterrey, uno en el municipio de Linares y tres en el estado de Tamaulipas. De los 90 sujetos que tuvieron contacto con Cupressus, sólo 15.5% (n = 14) dieron positivo en la prueba cutánea (p = 0.916); entre ellos, el principal diagnóstico fue rinitis alérgica (p = 0.005). Del total de pacientes, 250 (97.7%) refirieron síntomas nasales; esta cifra fue de 97.4% (n = 39) entre los positivos al extracto de Cupressus, aunque no tuvo valor estadísticamente significativo. Los síntomas bronquiales (tos o sibilancias) afectaron a 10% (n=39) de los sujetos positivos (p = 0.024), si bien los síntomas oculares y dermatológicos no tuvieron significancia estadística. El tiempo de evolución de los síntomas fue mayor a 10 años en 69% (27) de los positivos al extracto alergénico (p = 0.04). En cuanto a la reactividad cruzada de Cupressus con los extractos alergénicos aplicados en el centro, la asociación más significativa fue con Juniperus, ya que de los 39 individuos con prueba cutánea positiva a Cupressus y 33 a Juniperus, 27 fueron positivos a ambos (p < 0.001). De los 39 sujetos positivos a Cupressus, hubo Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 155 Leal García LR y col. una correlación significativa (p < 0.05) con todos los extractos alergénicos de pastos aplicados en el servicio: Cynodon (53.8%), Lolium (43.6%), Phleum (43.6%), Bromus (35.9%), Sorghum (30.8%) y Holcus (20.5%); al igual que con todas las malezas: Amaranthus (46.2%), Salsola (43.6%), Ambrosia (41%), Atriplex (25.6%), Chenopodium (25.6%), Helianthus (25.6%) y Artemisa (17.9%); con respecto a los árboles, hubo correlación con Juniperus (69.2%), Fraxinus (38.5%), Ligustrum (30.8%), Prosopis (30.8%), Quercus (20.5%) y Junglans (12.8%); en cuanto a los hongos aplicados, sólo se encontró una correlación estadísticamente significativa con Alternaria (12.8%), DMF pteronyssinus (56.4%), Felis (28.2%), Blatella (23.1%) y el polvo de casa (15.3%). El 45.7% (n=117) de los pacientes fue positivo a algún polen del centro; 31.6% (n=37) de ellos a Cupressus (p ≤ 0.001); 46.4% (n = 119) resultó positivo a algún alergeno intramuro, como Cupressus (22.7%, es decir, 27 personas, p = 0.002). Los individuos con una prueba cutánea positiva a Cupressus tuvieron al menos otra prueba positiva a otro aeroalergeno en 97% de los casos (p ≤ 0.001) (Cuadro 3). Cuadro 3. Comparación del resultado de la prueba cutánea a Cupressus con el resultado de las pruebas cutáneas con los extractos de los aeroalergenos utilizados en el CRAIC (p ≤ 0.001) Cupressus Resultado de las pruebas cutáneas a aeroalergenos Total Positivo Negativo Total Positivas* 38 125 163 Negativas 1 92 93 39 217 256 * Resultado positivo para al menos uno de los aeroalergenos probados. DISCUSIÓN En este estudio se encontró una alta prevalencia de sensibilización a Cupressus (15.2%) principalmente en los adultos, lo que concuerda con lo reportado en la bibliografía. En una prueba realizada por Fiorina en Liguria, Italia, la prevalencia de sensibilización a Cupressus fue de 1%;17 Ariano, en Liguria, y De Luca, en Roma, refirieron cifras de 7.2 y 9.3% respectivamente, mientras que Charpin reportó en Marsella una prevalencia de 156 9.6%.18-20 Por su parte, Bousquet inició en Montpellier una prueba sólo con pacientes alérgicos, en la cual calculó una sensibilización a Cupressus de 15%.21 Sin, en Turquía, obtuvo una prevalencia de 15.4%, que es muy similar a los resultados del estudio descrito aquí.22 En algunas otras pruebas se han encontrado prevalencias de sensibilización tan altas como 17.4%, en Lacio, y de 23% en Madrid.23,24 Las manifestaciones clínicas de los pacientes sensibilizados al polen de Cupressus son similares a las de una viriasis invernal, lo que podría explicar el subdiagnóstico; un ejemplo de esto es el aumento de la prevalencia de sensibilización al polen de Cupressus en Italia de 9.9% en 1991 a 24.5% en 1993 y a 35.4% en 1994; por lo que es muy importante correlacionar la exposición al polen de Cupressus con los síntomas alérgicos.25 La rinitis es común entre los pacientes sensibilizados al polen de ciprés; sin embargo, los síntomas nasales podrían estar asociados con la respuesta hacia otros aeroalergenos, ya que la monosensibilización a Cupressus es poco frecuente, como se observó en este estudio.26 Algunos pacientes con sensibilización a Cupressus pueden experimentar síntomas pulmonares. En este estudio, 10% de los individuos con prueba cutánea positiva refirió síntomas bronquiales (p = 0.02), mientras que Bousquet y De Luca reportaron asma en 15.7 y 37.5%, respectivamente, de las personas sensibilizadas a este polen.19,26 Aunque los síntomas pulmonares no son tan comunes como los nasales en este grupo, es indispensable investigar en ellos la coexistencia de este tipo de padecimientos. El tiempo de evolución de los síntomas alérgicos en los pacientes sensibilizados a Cupressus es prolongado, e incluso puede ser mayor a 10 años.26 En 69% de los sujetos de este estudio, el diagnóstico de sensibilización a Cupressus se hizo cuando tenían más de 10 años con síntomas alérgicos (p = 0.04), aunque el inicio de los síntomas en cierto porcentaje de estos pacientes podría estar relacionado con la sensibilización a otros aeroalergenos. Sin, en Turquía, realizó un estudio en el que utilizó un panel de 26 aeroalergenos, y observó una monosensibilización a Cupressus de 1.5%, lo que es similar a lo encontrado en esta investigación (2.6%).22 Por el contrario, Papa determinó una monosensibilización a Cupressus de 19.4% al realizar pruebas cutáneas para Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Prevalencia de hipersensibilidad al polen de Cupressus en pacientes alérgicos en Monterrey, México aeroalergenos comunes, mientras Bousquet, en un estudio con pacientes alérgicos al polen de ciprés en el que utilizó un panel de 23 aeroalergenos, reportó una monosensibilización de 29% a Cupressus.23,26 Debido a que pertenecen a la misma familia Cupressaceae, existe una alta reactividad cruzada entre Cupressus y Juniperus.14 En este estudio, 79% de los pacientes sensibilizados a Juniperus fueron positivos en la prueba cutánea para Cupressus, mientras que 67% de los sensibilizados a Cupressus fueron también positivos a Juniperus. En un estudio clínico controlado con placebo realizado por Ariano, que incluyó a 20 pacientes sensibilizados a Cupressus, se aplicó inmunoterapia subcutánea específica con dicho agente a 10 de ellos durante 12 meses.27 A diferencia de los integrantes del grupo placebo, los del grupo de inmunoterapia mostraron mejoría significativa en la escala de síntomas y, en consecuencia, una disminución en el consumo de medicamentos y en los síntomas inducidos en pruebas de provocación nasal específica. Estos resultados sugieren que podría considerarse la inmunoterapia específica para Cupressus en pacientes sensibilizados al mismo, con potencial exposición y posible asociación de sus síntomas alérgicos. CONCLUSIÓN La sensibilización a Cupressus fue alta en este grupo de estudio (15.2%). Debería considerarse el uso rutinario del extracto alergénico de Cupressus en el diagnóstico y tratamiento de pacientes con alergia respiratoria; sin embargo, es necesario realizar más estudios en esta población para conocer con exactitud la prevalencia de la sensibilización y sus posibles implicaciones clínicas. REFERENCIAS 1. 2. Moreno-Grau S, Moreno J, Vergara N, Ibarrola I, et al. Correlation between Olea europaea and Parietaria judaica pollen counts and quantification of their major allergens Ole e 1 and Par j 1-Par j 2. Ann Allergy Asthma Immunol 2006;96:858-864. European Community Respiratory Health Survey (ECRHS). Variations in the prevalence of respiratory symptoms, selfreported asthma attacks, and use of asthma medication in the European Community Respiratory Health Survey (ECRHS). Eur Respir J 1996;9:687-695. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. Lancet 1998;351:12251232. Casas C, Márquez J, Suárez-Cervera M, Seoane-Camba JA. Immunocytochemical localization of allergenic proteins in Parietaria judaica L (Urticaceae) pollen grains. Eur J Cell Biol 1996;70:179-188. Port A, Hein J, Wolff A, Bielory L. Aeroallergen prevalence in the northern New Jersey-New York City metropolitan area: a 15-year summary. Ann Allergy Asthma Immunol 2006;96:687-691. Vega-Maray AM, Fernández-González D, Valencia-Barrera R, Suárez-Cervera M. Allergenic proteins in Urtica dioica, a member of the Urticaceae allergenic family. Ann Allergy Asthma Immunol 2006;97:343-349. De Weerd NA, Bhalla PL, Singh MB. Aeroallergens and pollinosis: molecular and immunological characteristics of cloned pollen allergens. Aerobiologia 2002;18:87-106. Méndez J, Huerta J, Bellanti J, Ovilla R, Escobar A. Alergia: enfermedad multisitémica. Fundamentos básicos y clínicos. México: Editorial Médica Panamericana, 2008;p:67-72. Rocha EA, Alvarado VM, Torres CTE, Foroughbakhch PR. Principales tipos polínicos presentes en el aire de la zona norte del área metropolitana de Monterrey, Nuevo León. Ciencia UANL 2008;11:69-76. Togawa A, Panzani RC, Garza MA, Kishikawa R, et al. Identification of Italian cypress (Cupressus sempervirens) pollen allergen Cup s 3 using homology and cross-reactivity. Ann Allergy Asthma Immunol 2006;97:336-342. Ramirez DA. The natural history of mountain cedar pollinosis. J Allergy Clin Immunol 1984;73:88-93. Panzani R, Centanni G, Brunel M. Increase of respiratory allergy to the pollens of cypresses in the south of France. Ann Allergy Asthma Immunol 1986;56:460-463. Suárez-Cervera M, Castells T, Vega-Maray A, MorenoGrau S, et al. Effects of air pollution on Cup a 3 allergen in Cupressus arizonica pollen grains. Ann Allergy Asthma Immunol 2008;101:57-66. Charpin D, Calleja M, Lahoz C, Pichot C, Waisel Y. Allergy to cypress pollen. Allergy 2005;60:293-301. Larenas D, Arias A, Guidos G, Cid M. Alergenos usados en las pruebas cutáneas en México. Alergia Rev Mex 2009;56(2):41-47. Huertas A, Mozota J, García A. Prevalencia de sensibilización cutánea a polen de palmera y de morera en el sureste español. Allergol Inmunol Clin 2002;17:193-196. Fiorina A, Scordamaglia A, Guerra L, Canonica GW, Passalacqua G. Prevalence of allergy to cypress. Allergy 2002;57:861-862. Ariano R, Passalacqua G, Panzini R, Venturi S, et al. Airborne pollens and prevalence of pollinosis in western Liguria. A 10-year study. J Investig Allergol Clin Immunol 1999;9:229-234. De Luca A, Graziani E, Anticoli S, Simeoni S, et al. Respiratory allergy to Cupressus sempervirens in Rome. Allergol Immunopathol 1997;25(5):229-232. 157 Leal García LR y col. 20. Charpin D. Epidemiology of cypress allergy. Allerg Immunol 2000;32:83-85. 21. Bousquet J, Cour P, Guérin B, Michel F. Allergy in the Mediterranean area. I. Pollen counts and pollinosis of Montpellier. Allergy 1984;14:249-258. 22. Sin AZ, Ersoy R, Gulbahar O, Ardeniz O, et al. Prevalence of cypress pollen sensitization and its clinical importance in Izmir, Turkey, with cypress allergy assessed by nasal provocation. J Investig Allergol Clin Immunol 2008;18(1):46-51. 23. Papa G Romano A, Quarantino D, Artesani MC, et al. Prevalence of sensitization to Cupressus sempervirens: a 4-year retrospective study. Sci Total Environ 2001;270:83-87. 158 24. Subiza J, Feo Brito F, Pola J. Pólenes alergénicos y polinosis en 12 ciudades españolas. Rev Esp Alergol Inmunol Clin 1998;13:45-58. 25. Mari A, di Felice G, Afferni C, Barletta B, et al. Cypress allergy: an underestimated pollinosis. Allergy 1997;52:355-356. 26. Bousquet J, Knani J, Ferrando R, Cour P, et al. Heterogeneity of atopy. I. Clinical and immunologic characteristics of patients allergic to cypress pollen. Allergy 1993;48:183-188. 27. Ariano R, Panzani RC, Augeri G. Double-blind placebo controlled specific immunotherapy with mixed CupressaceaeTaxodiaceae pollens in respiratory allergy to Cupressus sempervirens. Allergol Immunopathol 1997;25(1):23-29. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Revista Alergia México 2010;57(5):159-163 Artículo de revisión Panorama epidemiológico de las inmunodeficiencias primarias en México Erika Coria Ramírez,* Sara Espinosa Padilla,** Francisco Espinosa Rosales,** María Eugenia Vargas Camaño,* Lizbeth Blancas Galicia** RESUMEN Las inmunodeficiencias primarias son trastornos raros del sistema inmunitario que se distinguen por la recurrencia de infecciones. Con frecuencia, no son reconocidas sino hasta varios años después, cuando han causado complicaciones irreversibles y la calidad de vida del paciente está severamente afectada. En México, la baja prevalencia de estas enfermedades se debe al subdiagnóstico de médicos poco familiarizados con ellas y a la inaccesibilidad de los estudios de diagnóstico en la mayor parte de los hospitales. En Europa y otros países se han juntado esfuerzos para formar un registro de pacientes con inmunodeficiencias primarias que permita estimar su prevalencia y realizar guías de diagnóstico y tratamiento. En México no hay un registro similar; sin embargo, de 1998 a 2004 se ha triplicado el número de casos reportados. Se calcula una incidencia mínima de 0.16 a 0.24 por cada 100,000 nacimientos para la enfermedad granulomatosa crónica (EGC), la inmunodeficiencia combinada severa (IDCS) y la agammaglobulinemia ligada al cromosoma X (ALX), lo cual se encuentra por debajo de lo reportado en otros países. En este artículo se revisan los aspectos epidemiológicos en nuestro país, y se comparan con lo publicado en la bibliografía internacional. Palabras clave: epidemiología, inmunodeficiencias primarias, México. ABSTRACT Primary immunodeficiencies are rare immunologic diseases whose main characteristics are recurrent infections. These diseases are frequently unsuspected and the delayed diagnosis makes complications irreversible with the consequent poor quality of life. In Mexico, primary immunodeficiencies have a low prevalence, which is secondary to under-diagnosis and the lack of specialized laboratory studies in most hospitals. Since there is a registration of primary immunodeficiency cases in Europe and other developed countries, it is possible to estimate the incidence of primary immunodeficiencies and to elaborate guidelines of diagnosis and treatment. In our country we do not have any epidemiological registry; however, from 1998 to 2004 the number of cases of primary immunodeficiency has increased; the minimal incidence calculated is 0.16 to 0.24 per 100,000 births for chronic granulomatous disease, severe combined immunodeficiency and X linked agammaglobulinemia, this data is still very low compared to other international registries. We present an epidemiological review of primary immunodeficiency prevalence in Mexico compared to some international reports. Key words: epidemiology, primary immunodeficiencies, Mexico. * ** Servicio de Inmunología Clínica y Alergia. Centro Médico Nacional 20 de Noviembre, ISSSTE. Unidad de Investigación en Inmunodeficiencias. Instituto Nacional de Pediatría. Correspondencia: Dra. Lizbeth Blancas Galicia. Instituto Nacional de Pediatría, Insurgentes Sur núm. 3700, letra C, Insurgentes Cuicuilco, CP 04530, México, DF. Correo electrónico: [email protected] Recibido: junio, 2010. Aceptado: agosto, 2010. Este artículo debe citarse como: Coria-Ramírez E, EspinosaPadilla S, Espinosa-Rosales F, Vargas-Camaño ME, BlancasGalicia L. Panorama epidemiológico de las inmunodeficiencias primarias en México. Rev Alerg Mex 2010;57(5):159-163. www.nietoeditores.com.mx L as inmunodeficiencias primarias son un grupo heterogéneo de enfermedades hereditarias que comprenden alteraciones en el desarrollo, función o ambos, del sistema inmunitario. Generalmente, se manifiestan como infecciones recurrentes que representan un reto diagnóstico. En la mayor parte de los casos, se trata de trastornos monogénicos que siguen una herencia de tipo mendeliano; sin embargo, en otros casos tienen un origen poligénico más complejo. La penetrancia de la enfermedad, la variabilidad de su expresión y las interacciones gen-ambiente pueden contribuir a su diversidad fenotípica.1 Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 159 Coria-Ramírez E y col. La Organización Mundial de la Salud y el Comité de Clasificación de Inmunodeficiencias Primarias de la Unión Internacional de Sociedades de Inmunología, las dividen en ocho grupos de acuerdo con el fenotipo característico: 1) inmunodeficiencias combinadas de células T y B; 2) inmunodeficiencias predominantemente de anticuerpos; 3) otros síndromes de inmunodeficiencias bien definidos; 4) enfermedades por disregulación inmunitaria; 5) defectos congénitos del número o función de los fagocitos, o de ambos; 6) defectos de la inmunidad innata; 7) trastornos autoinflamatorios y 8) deficiencias del complemento.2 A partir de 1952, año en que Brutton describió por primera vez la agammaglobulinemia ligada al cromosoma X, se han descrito por lo menos 200 formas distintas de inmunodeficiencia primaria. Los avances en la investigación médica han permitido la identificación de más de 140 genes responsables de los diferentes fenotipos que caracterizan a estos trastornos.3 Con excepción de la deficiencia de IgA, la cual se reporta en uno de cada 300 a 400 nacidos vivos,4 todas las otras formas de inmunodeficiencia primaria son raras, con una prevalencia global de aproximadamente uno por cada 10,000 habitantes. Se ha observado una frecuencia mayor en poblaciones endogámicas o con tasas altas de consanguinidad.1 La prevalencia reportada varía entre países y sus regiones, esto se explica por el escaso conocimiento de estas enfermedades y la falta de diagnóstico y registro epidemiológico.5 Los médicos comúnmente no están informados sobre la presentación clínica de las inmunodeficiencias primarias y, en consecuencia, los pacientes fallecen o permanecen sin tratamiento durante varios años. Algunos países han creado un registro nacional de inmunodeficiencias primarias, a través del cual es posible estimar la incidencia y prevalencia de las mismas. Los registros internacionales tienen en común un cuestionario y una base de datos que permiten captar las manifestaciones clínicas y los hallazgos inmunológicos que determinan el fenotipo de estas alteraciones, e identificar patrones de distribución geográfica para disminuir la clasificación diagnóstica errónea. En países en vías de desarrollo, la información epidemiológica de estas enfermedades se encuentra limitada por la falta de conocimiento y los medios para 160 su diagnóstico y tratamiento; esto ocasiona retraso en el manejo preciso, lo que conlleva complicaciones irreversibles y en ocasiones la muerte. Se ha reportado que en 22.4% de los casos, el diagnóstico de inmunodeficiencia común variable se hizo 10 años después de la primera manifestación de los síntomas.4 La Sociedad Europea de Inmunodeficiencias (ESID) desarrolló una base de datos en línea en la que se capta la información clínica y de laboratorio de los pacientes con inmunodeficiencias primarias, lo que permite estimar la prevalencia de estos trastornos en Europa y establecer guías de diagnóstico y tratamiento. Los objetivos de la Sociedad Europea de Inmunodeficiencias son mejorar el diagnóstico, la clasificación, el pronóstico y el tratamiento de los individuos con estos padecimientos. En 2009 se publicaron los resultados obtenidos durante los cuatro años previos; hasta ese momento, se habían registrado 7,430 pacientes de 70 centros en 30 países. El padecimiento más frecuente fue la inmunodeficiencia común variable (20.7% de los casos), seguida de la deficiencia de subclases de inmunoglobulina G (7.4%); ambas son deficiencias de anticuerpos. La base de datos de la Sociedad Europea de Inmunodeficiencias arroja una esperanza de vida de 1 a 49 años, según el tipo de inmunodeficiencia. La prevalencia en los países que conforman la Sociedad Europea de Inmunodeficiencias varía considerablemente, Francia tiene la tasa más alta: 3.7:100,000 habitantes.3 Esta base electrónica se actualiza constantemente; de hecho, en el primer semestre de 2010 se reportaron más de 11,700 casos en 70 centros, en especial de deficiencias de anticuerpos.6 Algunos países desarrollan su registro de inmunodeficiencias primarias, como Irán, donde se han recabado 930 casos durante tres décadas en 16 centros. Se encontraron 40 inmunodeficiencias distintas, de las cuales las deficiencias de anticuerpos fueron las más comunes (38.4%), seguidas por la enfermedad granulomatosa crónica (17.8%), que es un defecto de la fagocitosis. Sin incluir a los pacientes con deficiencia de IgA, por ser asintomáticos, establecieron una prevalencia de 6 por cada 100,000 nacidos vivos. La proporción de afectación hombre-mujer fue de 1.7 a 1. Más de 60% de los pacientes tenía antecedentes de consanguinidad. Antes de 1980, sólo se habían reportado cinco casos, mientras que en la última década se diagnosticaron 704; esto refleja que el Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Panorama epidemiológico de las inmunodeficiencias primarias en México retraso en el diagnóstico disminuyó de aproximadamente siete años antes de 1990, a tres años durante 1990-1995, y a tan sólo 15 meses después de 1995.7 En Australia y Nueva Zelanda se reporta una prevalencia que va de 4.9 a 12.4 por 100,000 habitantes, dependiendo de la región. El registro nacional de estos países incluye 1,209 pacientes de 88 centros. El 77% de los casos corresponde a deficiencias de anticuerpos; de éstas, la inmunodeficiencia común variable es el trastorno más reportado (38.4%). Las deficiencias de complemento siguen en orden de frecuencia: angioedema hereditario, 4.5% de los casos, y la inmunodeficiencia combinada severa en 3.4%.8 La edad promedio de los pacientes es de 31 años, lo que demuestra que en estos países es mayor la esperanza de vida. En algunas naciones de Asia se creó una base de datos que está disponible en internet, la cual tiene como propósito favorecer la investigación, diagnóstico y tratamiento de los pacientes con inmunodeficiencias primarias. Esta base permite identificar distintas alteraciones proteicas y mutaciones en los genes implicados en el desarrollo y función del sistema inmunitario; sin embargo, no reporta la prevalencia estimada en cada país.9,10 Estados Unidos también tiene un registro nacional. En el año 2008 se realizó una encuesta vía telefónica. A través de una lista de números al azar se contactaron 10,000 domicilios en todo el país y se logró entrevistar a 27,000 personas, de las cuales 23 habían sido diagnosticadas con inmunodeficiencia primaria (inmunodeficiencia común variable, deficiencia de IgA, deficiencia de IgG, agammaglobulinemia ligada al cromosoma X, inmunodeficiencia combinada severa y enfermedad granulomatosa crónica). La prevalencia calculada de inmunodeficiencia primaria fue de 1 por cada 1,200 personas, aproximadamente;11 ésta es una frecuencia mayor de la reportada en otros países, quizá porque existe un mejor sistema de diagnóstico. En México no se cuenta con datos epidemiológicos globales que permitan evidenciar la magnitud de estas enfermedades. El primer reporte de nuestro país corresponde a los datos publicados en 1998 en el también primer reporte del Registro del Grupo Latinoamericano de Inmunodeficiencias Primarias (LAGID). En él participaron ocho naciones que aportaron 1,428 pacientes. Brasil, Argentina y Costa Rica tuvieron las tasas de prevalencia más altas. Los datos que corresponden a México sólo fueron de un centro hospitalario, el Instituto Nacional de Pediatría. Las inmunodeficiencias primarias más comunes fueron la deficiencia de anticuerpos (58%), seguida de los síndromes bien definidos como ataxia telangiectasia y candidiasis mucocutánea crónica (18%) y los trastornos en la fagocitosis (9%, Cuadro 1).12 Este reporte utiliza una clasificación distinta a los consensos más actuales, por lo que no es posible comparar los datos por grupo de inmunodeficiencias primarias sino únicamente por cada una en particular. Posteriormente, García y col. publicaron los resultados obtenidos de 1970 a 2000 en el Instituto Nacional de Pediatría. Durante este periodo, se diagnosticaron 171 pacientes con inmunodeficiencia primaria, sobre todo ataxia telangiectasia (24.5%), agammaglobulinemia ligada al cromosoma X (11.1%) e inmunodeficiencia común variable (8.7%).13 Este estudio retrospectivo no permite calcular la incidencia de estos trastornos en nuestra población. En el segundo reporte de LAGID, publicado en 2007, participaron 12 países que tenían 3,321 pacientes con inmunodeficiencias primarias. Las más reportadas fueron las deficiencias de anticuerpos (53.2%), la DIgA es el fenotipo más común; los síndromes bien definidos correspondieron a 22.6%, la inmunodeficiencia combinada de células T y B a 9.5% y los trastornos de la fagocitosis a 8.6% (Cuadro 1). Todos los países que participaron en el primer reporte de LAGID en 1998 tuvieron un incremento en los casos de inmunodeficiencias primarias de 10 a 80% (Figura 1).5 En México, de 2000 a 2005 se reportó una tasa de natalidad de 22.3 por cada 1,000 habitantes, con un total de 2,368,260 nacimientos por año; en dicho periodo, únicamente se informaron 399 casos, lo que indica una incidencia muy baja debido al subdiagnóstico. Del primero al segundo registro de LAGID, México incrementó tres veces el número de pacientes (Figura 2);5 sin embargo, la tasa mínima esperada de agammaglobulinemia ligada al cromosoma X, enfermedad granulomatosa crónica e inmunodeficiencia común variable es de 0.16 a 0.24 por 100,000 nacimientos, que aún es baja en comparación con la de otros países de Latinoamérica y con lo asentado en la bibliografía internacional. Si se toma en cuenta la tasa de nacimientos y los datos Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 161 Coria-Ramírez E y col. Cuadro 1. Distribución y comparación de proporciones de las inmunodeficiencias primarias entre el primero (ocho países) y el segundo reportes (12 países) del Grupo Latinoamericano de Inmunodeficiencias Primarias (LAGID) Tipo de inmunodeficiencia primaria 1er reporte N 1,428 % 2º reporte N 3,321 % p* 828 257 71 114 129 29 58 18 5 8 9 2 1767 751 315 110 286 93 53.2 22.6 9.5 3.3 8.6 2.8 0.002 <0.001 <0.001 <0.001 0.637 0.124 Anticuerpos Síndromes bien definidos Combinadas Desregulación inmunitaria Fagocitarias Complemento Núm de casos * Ji al cuadrado. 1400 1200 1000 800 600 400 200 0 na nti e Arg sil ile ico guay guay ica bia Ch Méx lom sta R ra Uru o Co Pa C Bra 1998 2004 Núm de casos Figura 1. Comparación del número de casos de inmunodeficiencias primarias entre ocho países participantes en el primer y segundo reporte de LAGID. 160 140 120 100 80 60 40 20 0 Deficiencia IDCS de Ac EGC 1998 CONCLUSIONES SWA Neutropenia AT severa 2007 Figura 2. Comparación del número de casos reportados por México de las inmunodeficiencias primarias más frecuentes en el primero y el segundo reportes de LAGID. Ac: anticuerpos; IDCS: inmunodeficiencia combinada severa; EGC: enfermedad granulomatosa crónica; SWA: síndrome de Wiskott-Aldrich; AT: ataxia-telangiectasia. 162 ofrecidos por el Instituto Nacional de Pediatría, es claro que debe haber un mayor número de casos registrados, por lo que es necesario insistir en el diagnóstico de estas enfermedades. La Fundación Mexicana para Niños y Niñas con Inmunodeficiencias Primarias (FUMENIP) es una organización civil no lucrativa que se creó en respuesta a la necesidad de apoyar la difusión de las inmunodeficiencias entre los médicos y la población general, y de proporcionar de manera gratuita el tratamiento que requieren los niños más necesitados de México, todo con el fin de favorecer el diagnóstico oportuno y una mejor calidad de vida. Entre las actividades que realiza la FUMENIP se encuentra la impartición de un taller a los médicos de primer contacto de distintos estados de la República Mexicana. De septiembre de 2009 a la fecha, este taller se ha dictado en el Distrito Federal, Toluca, Puebla, Puerto Vallarta, Veracruz, León, Villahermosa, Tijuana, San Luis Potosí y Mérida. Con estos cursos se espera que en un año más aumente el número de casos diagnosticados. En México existen sesgos en la prevalencia de las inmunodeficiencias primarias debido al subregistro de los casos producto del desconocimiento de los médicos sobre estos trastornos. Es necesario trabajar conjuntamente para mejorar la sospecha, diagnóstico y tratamiento de estos pacientes, de otro modo, continuarán muriendo sin diagnóstico o Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Panorama epidemiológico de las inmunodeficiencias primarias en México viviendo con una enfermedad sin causa aparente que afecta su calidad de vida. La generación de un registro nacional fidedigno de inmunodeficiencias primarias evidenciará la epidemiología de estas enfermedades y su repercusión actual. Referencias 1. 2. 3. 4. 5. Notarangelo LD. Primary immunodeficiencies. J Allergy Clin Immunol 2010;125:S182-194. Notarangelo LD, Fischer A, Geha RS, Casanova JL, et al. Primary immunodeficiency diseases: 2009 update. International Union of Immunological Societies Expert Committee on Primary Immunodeficiencies. J Allergy Clin Immunol 2009;124:1161-1178. Gathmann B, Grimbacher B, Beauté J, Dudoit Y, et al. The European internet-based patient and research database for primary immunodeficiencies: results 2006-2008. Clin Exp Immunol 2009;157(Suppl 1):3-11. Morimoto Y, Routes JM. Immunodeficiency Overview. Prim Care Clin Office Pract 2008;35:59-173. Leiva LE, Zelazco M, Oleastro M, Carneiro-Sampaio M, et al. Primary Immunodeficiency Diseases in Latin America: 6. 7. 8. 9. 10. 11. 12. 13. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 The Second Report of the LAGID1 Registry. J Clin Immunol 2007;27:101-108. http://www.esid.org/statistics.php Rezaei N, Aghamohammadi A, Moin M, Pourpak Z, et al. Frequency and clinical manifestations of patients with primary immunodeficiency disorders in Iran: Update from the Iranian Primary Immunodeficiency Registry. J Clin Immunol 2006;26:519-532. Kirkpatrick P, Riminton S. Primary immunodeficiency diseases in Australia and New Zealand. J Clin Immunol 2007;27:517-524. Keerthikumar S, Raju R, Kandasamy K, Hijikata A, et al. RAPID: Resource of Asian Primary Immunodeficiency Diseases. Nucleic Acids Res 2009;37:863-867. http://rapid.rcai.riken.jp/. Boyle JM, Buckley RH. Population prevalence of diagnosed primary immunodeficiency diseases in the United States. J Clin Immunol 2007;27:497-502. Zelazko M, Carneiro-Sampaio M, Cornejo de Luigi M, Garcia de Olarte D, et al. Primary immunodeficiency diseases in Latin America: First report from eight countries participating in the LAGID. J Clin Immunol 1998;18:61-66. García-Cruz ML, Camacho R, Ortega-Martell JA, BerronPérez R, et al. Registro de inmunodeficiencias primarias en pacientes mexicanos en una institución de tercer nivel: experiencia de 30 años. Alergia e Inmunol Pediatr 2002;11:48-66. 163 Revista Alergia México 2010;57(5):164-170 Caso clínico Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton María Guadalupe Román Jiménez,* Marco Antonio Yamazaki Nakashimada,** Lizbeth Blancas Galicia*** RESUMEN La agammaglobulinemia de Bruton, que es una inmunodeficiencia primaria, se manifiesta en los primeros meses de edad cuando las concentraciones séricas de las inmunoglobulinas maternas disminuyen. Se distingue por infecciones recurrentes y agammaglobulinemia. Paciente masculino de 6 años 9 meses con antecedente consanguíneo de tercer grado. Producto de término de tercera gestación. Esquema de inmunizaciones completo. Padeció candidiasis oral a los tres meses de edad, varicela a los siete meses y dos cuadros complicados de bronconeumonía al año 6 meses y a los 6 años 1 mes de edad. Ingresó al Instituto Nacional de Pediatría con fiebre de 39°C y tos. A la exploración física se encontró peso y talla en el percentil 25, tórax con hipoventilación basal derecha y estertores crepitantes en ambas bases pulmonares. La biometría hemática mostró leucocitosis y neutrofilia, se inició tratamiento con antibiótico, se solicitaron inmunoglobulinas séricas –IgM: 56 mg/dL, IgA: 0.9 mg/dL, IgG: 199 mg/dL–, se diagnosticó agammaglobulinemia –probablemente ligada al cromosoma X– y se inició cada 21 días la aplicación de inmunoglobulina G intravenosa. Durante su evolución padeció tres cuadros de rinosinusitis, un evento de otitis media supurada y cuatro cuadros más de bronconeumonía, que ameritaron 37 días de hospitalización. Se realizó el diagnóstico molecular, que reportó mutación en el gen BTK. Actualmente, el paciente cursa sin infecciones y hace de manera normal sus actividades diarias. Las inmunodeficiencias primarias, particularmente la deficiencia de anticuerpos, deben considerarse parte del diagnóstico diferencial de infecciones recurrentes en las vías respiratorias altas y bajas. El diagnóstico temprano mejora la calidad de vida y la supervivencia. Palabras clave: agammaglobulinemia, enfermedad de Bruton, inmunodeficiencia primaria. ABSTRACT Bruton’s agammaglobulinemia is a primary immunodeficiency with a disease onset during the first months of age, when the maternal serum immunoglobulin levels decrease. It is characterized by recurrent infections and agammaglobulinemia. We report the case of a 6 year-old male patient with third-degree consanguinity, product of a third pregnancy and complete immunization scheme. He had a history of oral candidiasis at the age of 3 months; chicken pox at the age of 7 months, and two episodes of complicated bronchopneumonia at the age of 1 year and 6 years. He was admitted to the hospital because of fever and cough. Examination of the chest showed rales and right basilar hypoventilation, and a blood cell count revealed leukocytosis and neutrophilia. The diagnosis of pneumonia was made. He was treated with IV antibiotics. Serum immunoglobulins were reported to be low (IgM 56 mg/dL, IgA 0.9 mg/dL and IgG 199 mg/ dL). With these findings the clinical diagnosis of X-linked agammaglobulinemia (ALX) was concluded. A molecular test was performed finding a BTK gene confirming the diagnosis of Bruton disease. Therapy with intravenous IgG was started every 21 days. During his evolution he presented three episodes of rhinosinusitis, one of suppurative otitis media and four events of pneumonia that required 37 days of hospitalization. After hospital discharge the patient is free of infections and he returned to his daily activities. In cases of recurrent and severe respiratory infections in children we must consider primary immunodeficiency disease in the differential diagnosis, mainly antibodies deficiency. Early diagnosis and treatment improves the survival and quality of life in these patients. Key words: agammaglobulinemia, Bruton’s disease, primary immunodeficiency. * Médico pasante del Servicio Social en Investigación, Unidad de Investigación en Inmunodeficiencias. ** Médico adscrito al servicio de Inmunología. *** Investigadora de la unidad de Investigación en Inmunode ficiencias. Instituto Nacional de Pediatría, México, DF. Recibido: agosto, 2010. Aceptado: septiembre, 2010. Correspondencia: Dra. Lizbeth Blancas Galicia. Insurgentes sur 3700-C, colonia Insurgentes Cuicuilco, CP 04530, México, DF. www.nietoeditores.com.mx 164 Este artículo debe citarse como: Román-Jiménez MG, YamazakiNakashimada MA, Blancas-Galicia L. Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton. Rev Alerg Mex 2010;57(5):164-170. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton L a agammaglobulinemia ligada al cromosoma X es una inmunodeficiencia primaria causada por una mutación en el gen que codifica a la tirosina cinasa de Bruton; su alteración afecta la diferenciación temprana del linfocito B.1,2 En 1952 el Dr. Ogden C Bruton describió esta enfermedad como un defecto inmunológico de la producción de inmunoglobulinas; ésta fue la primera inmunodeficiencia primaria descrita en la que se conoció la inmunopatogenia.3 Antes del primer año de vida el cuadro clínico se distingue por infecciones bacterianas recurrentes en las vías aéreas altas y bajas, disminución marcada o ausencia de inmunoglobulinas séricas y linfocitos B ausentes en sangre periférica.4 Los avances en el diagnóstico molecular han hecho posible que en los últimos 15 años se identifiquen los genes responsables de las inmunodeficiencias primarias. El diagnóstico temprano repercute en la calidad de vida y en la supervivencia a largo plazo de estos pacientes.5 FISIOPATOGENIA La maduración del linfocito B se lleva a cabo en la médula ósea, donde las células madre pluripotenciales se diferencian en linfocitos B maduros; este proceso dará como origen formas celulares cada vez más diferenciadas, que incluyen: un precursor linfoide, un linfocito pro-B, un linfocito pre-B, un linfocito B inmaduro y finalmente un linfocito B maduro, célula plasmática o célula B de memoria. De la misma manera que en otras células del sistema inmunitario, los linfocitos B exhiben moléculas que son exclusivas de ellos y que sirven como marcadores de diferenciación de los diferentes estadios secuenciales de su desarrollo.6 Para mencionar uno de estos marcadores, la molécula CD19 está presente en el linfocito B maduro (Figura 1). La proteína que resulta afectada en la agammaglobulinemia ligada al cromosoma X es la tirosina cinasa de Bruton, que funciona como un transductor de señales, del medio intracitoplasmático al medio intranuclear. Está presente en todas las células hematopoyéticas, excepto en las células T y natural killer; está íntimamente relacionada con las vías de señalización que regulan la proliferación y diferenciación del linfocito B.7 La activación de los receptores de membrana del linfocito B conlleva a la fosforilación de moléculas de señalización intracelular –como la tirosina cinasa de Bruton–, lo que genera la liberación de calcio contenido en los depósitos intracelulares (retículo endoplásmico), la producción de inositol-1,4,5-trifosfato y diacilglicerol que activan los factores de transcripción nuclear, los cuales inducen la expresión de genes necesarios para la reorganización del citoesqueleto, el ingreso de la célula B a la fase S del ciclo celular, los rearreglos del ADN en las inmunoglobulinas y la continuidad del proceso de maduración (Figura 2).7,8 Las mutaciones presentes en la enfermedad de Bruton condicionan un defecto en la diferenciación de linfocito pro-B a linfocito pre-B, lo que afecta las formas celulares maduras debido a que la producción de linfocitos B periféricos e inmunoglobulinas se ausenta o disminuye en forma importante.9 IgM Médula ósea Célula madre pluripotencial Linfocito pre-B Linfocito pro-B Linfocito inmaduro IgM IgD Linfocito maduro Figura 1. Estadios madurativos de los linfocitos B. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 165 Román Jiménez MG y col. Membrana celular Tirosina cinasa de Bruton DAG IP3 Ca+ Transcripción Núcleo Maduración de precursores de linfocito B Figura 2. Transducción de señales en el linfocito B. La fosforilación (P) de las moléculas de señalización intracelular, incluida Btk, conlleva a la liberación de calcio (Ca+) y a la formación de inositol-1,4,5-trifosfato (IP3) y diacilglicerol (DAG), que activan los factores de transcripción (FT) para que ingresen al núcleo y se inicie la expresión de genes, cuyos productos son necesarios para la activación funcional del linfocito B. BLNK: vinculador de células B; Syk: tirosina cinasa del bazo; Fionia: proteína tirosina cinasa Fionia isoforma A; Lyn: proteína tirosina cinasa Lyn isoforma A; PKC: proteína cinasa C-theta; PLCγ2: fosfolipasa C-gamma; MAPK: mitógenos activados por proteína cinasa. MANIFESTACIONES CLÍNICAS En 1952 Bruton describió el caso de un niño de ocho años de edad que desde los cuatro años fue susceptible a infecciones de vías respiratorias altas y bajas recurrentes y secundarias a agentes bacterianos (Streptococcus pneumoniae). Después de que Bruton demostró con una electroforesis de proteínas séricas la ausencia de inmunoglobulinas (Figura 3), aplicó un tratamiento de gammaglobulina subcutánea, con el cual el niño mejoró radicalmente. De esta forma, Bruton asoció la agammaglobulinemia con la susceptibilidad a infecciones.3 166 Los pacientes con agammaglobulinemia ligada al cromosoma X suelen tener aparición de infecciones bacterianas recurrentes a los seis meses de edad, ya que a dicha edad ocurre una disminución fisiológica de las inmunoglobulinas maternas (Figura 4).4 La mayoría cursan con infecciones en las vías respiratorias, como sinusitis, otitis media crónica y neumonías de repetición.10,11 Conley y col. observaron que la otitis media crónica es frecuentemente la primera manifestación clínica antes de establecer el diagnóstico. En dichos pacientes los agentes infecciosos son bacterias encapsuladas y enterovirus, ya que los anticuerpos desempeñan una función importante en su neutralización.12 Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton A Albúmina α1 α2 β1 β2 B Albúmina Gamma α1 α2 β1 β2 Gamma Figura 3. Electroforesis de proteínas séricas. A) Patrón electroforético normal, en el que se observan seis picos correspondientes a albúmina, alfa 1 (α1), alfa 2 (α2), beta 1 (β1), beta 2 (β2) y gamma. B) Patrón electroforético de paciente con agammaglobulinemia, en el que no existe el sexto pico correspondiente a gamma. Fracción de la concentración de inmunoglobulinas en suero de adulto Concentraciones transitorias bajas de IgG 100 IgM IgG maternas transferidas pasivamente IgG IgA 0 Concepción -6 -3 Nacimiento 3 Meses 6 9 1 2 3 4 5 Adulto Años Figura 4. Concentraciones de inmunoglobulinas prenatales y posnatales. Las concentraciones transitorias bajas de IgG, que se observan en el lactante entre 6 y 8 meses de vida, son debidas a la disminución de las concentraciones de IgG materna, ya que los anticuerpos propios comienzan a incrementarse paulatinamente. También se ha reportado sepsis de foco pulmonar debida a Pseudomonas sp. y Staphylococcus sp. y relacionada con neutropenia y manifestaciones cutáneas, diarrea crónica por Giardia y, en menor frecuencia, cuadros de artritis séptica.12,13 En la exploración física una observación importante es la ausencia de amígdalas y ganglios cervicales, que en ciertas situaciones son apenas detectables.4 La agammaglobulinemia ligada al cromosoma X es trasmitida por un patrón de herencia recesivo ligado al cromosoma X, por lo que los varones son los afectados y las mujeres son las portadoras. Sin embargo, sólo 50% de los pacientes con cuadro clínico y resultados sugestivos de laboratorio tiene antecedentes familiares del fenotipo clínico, ya que el trastorno genético se mantiene en la población por nuevas mutaciones en el gen BTK (mutaciones de novo).5 Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 167 Román Jiménez MG y col. DIAGNÓSTICO TRATAMIENTO Ante un cuadro clínico de infecciones respiratorias recurrentes y severas debe realizarse un abordaje diagnóstico (Figura 5) con el propósito de establecer un diagnóstico diferencial adecuado. El diagnóstico se establece cuando se encuentran concentraciones séricas de inmunoglobulinas por abajo de dos desviaciones estándar. Los linfocitos B detectados con el marcador de superficie CD19 se encuentran en menos de 2%, cuando lo normal es 10%. El diagnóstico definitivo se establece cuando se detecta una mutación en el gen BTK.12,14 La administración de inmunoglobulina intravenosa es el tratamiento de elección, porque ha mostrado disminuir en forma significativa el número de infecciones, los ingresos hospitalarios y la aparición de daño pulmonar crónico, como las bronquiectasias; además, previene la meningitis severa. El inicio del tratamiento de remplazo con inmunoglobulina debe hacerse inmediatamente después del diagnóstico; se recomienda que cada 21 a 28 días se administren, en forma intravenosa o subcutánea, 400 a 500 mg/kg/dosis.4,12,13,15 CASO CLÍNICO Lactante Infecciones respiratorias recurrentes Otitis Sinusitis Neumonía Ganglios y amígdalas normales Ganglios y amígdalas ausentes Inmunoglobulinas séricas bajas Inmunoglobulinas séricas ausentes HTI IDCV Hiper-IgM ALX o AAR CD 40L- Hiper-IgM CD 40L+ IDCV HTI Figura 5. Diagnóstico diferencial en las Iinmunodeficiencias de anticuerpos. HTI: hipogammaglobulinemia transitoria de la infancia; IDCV: inmunodeficiencia común variable; ALX: agammaglobulinemia ligada al cromosoma X; AAR: agammaglobulinemia autosómica recesiva. 168 Paciente masculino de 6 años 9 meses de edad, con consanguinidad de tercer grado y producto de término de tercer embarazo, cuya gestación fue normoevolutiva y sin complicaciones; fue atendido en la unidad hospitalaria, pesó 3,400 gramos, sufrió onfalorrexis a los ocho días de vida extrauterina, no recibió lactancia materna y le aplicaron en forma completa el esquema de inmunizaciones. Padeció candidiasis oral a los tres meses de edad, varicela a los siete meses y dos cuadros de bronconeumonía a los 18 meses y a los 6 años 1 mes de edad, por los que fue hospitalizado en dos ocasiones (cada una de 15 días) en un hospital de segundo nivel, en el que recibió esteroides y antibióticos no especificados. Además, cursó con múltiples infecciones en las vías respiratorias altas, por lo que fue valorado por diferentes facultativos, pero éstos no obtuvieron una respuesta terapéutica definitiva. Ingresó al Instituto Nacional de Pediatría con fiebre de 39°C; además de rechazo por vía oral, tuvo astenia, adinamia y tos productiva no cianosante ni emetizante; previamente había recibido gentamicina y amikacina intramuscular durante cinco días, pero no mostró mejoría. A la exploración física se encontró apariencia igual a su edad cronológica, peso y talla en el percentil 25, perímetro cefálico de 52 cm, normocéfalo, facies sin dismorfia, asimetría de pabellones leve –el izquierdo más pequeño que el derecho–, cara con verrugas planas, capacidad respiratoria sin datos de dificultad, tórax con hipoventilación basal derecha y estertores crepitantes en ambas bases pulmonares, genitales de acuerdo con edad y sexo pero con fimosis, palidez tegumentaria Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Evolución satisfactoria de un paciente diagnosticado en la infancia con enfermedad de Bruton generalizada y desarrollo psicomotor adecuado. La biometría hemática mostró leucocitosis y neutrofilia, se diagnosticó bronconeumonía complicada con atelectasia y se inició tratamiento con antibiótico intravenoso. Por el antecedente de infecciones severas y recurrentes se solicitaron pruebas de inmunoglobulinas séricas y electrólitos en sudor para descartar inmunodeficiencia primaria humoral y fibrosis quística, respectivamente. Los valores obtenidos fueron: cloro en sudor: 32 mmol/L (valor de referencia < 70 mmol/L), IgM: 56 mg/dl (48207 mg/dL), IgA: 0.9 mg/dL (33-202 mg/dL), IgG: 199 mg/dL (633-1,280 mg/dL). Por los resultados anteriores se diagnosticó agammaglobulinemia con probable patrón de trasmisión hereditaria recesiva ligada al cromosoma X, por lo que cada 21 días se aplicó inmunoglobulina G intravenosa a 600 mg/kg/dosis. Durante la evolución posterior del paciente no hubo apego a la aplicación de la inmunoglobulina G intravenosa, por lo que el paciente padeció dos cuadros de rinosinusitis –en la región maxilar y en la región etmoidal, respectivamente–, un evento de pansinusitis –confirmada por TAC– en senos paranasales –con aislamiento de Acinetobacter iwoffi (sensible a ceftriaxona) y Pseudomonas putida (sensible a trimetoprim/sulfametoxazol)–, un evento de otitis media supurada y cuatro cuadros más de bronconeumonía, que ameritaron 37 días de hospitalización y tratamiento con ceftriaxona y dicloxacilina IV. Se realizó TAC pulmonar, que reveló bronquiectasias basales bilaterales de predominio derecho, y broncoscopia, que confirmó síndrome de supuración broncopulmonar secundario a neumopatía crónica. Se manejó profilaxis con azitromicina, broncodilatador beta 2 de acción prolongada y esteroide inhalado por las fosas nasales. Se realizó citometría de flujo, que reveló CD19 de 0.1% (porcentaje bajo en correlación con el testigo: CD19 de 10%), y secuenciación del gen BTK, que reveló una mutación, con lo cual se confirmó enfermedad de Bruton o agammaglobulinemia recesiva ligada al cromosoma X (Figura 6). Actualmente, el paciente acude regularmente a que le apliquen inmunoglobulina G intravenosa, cursa sin infecciones y acude a la escuela. CONCLUSIÓN Hemos expuesto el caso de un paciente con agammaglobulinemia ligada al cromosoma X, quien visitó a muchos médicos antes de recibir un diagnóstico certero. La mayoría de los pacientes con diferentes inmunodeficiencias primarias tiene, entre el inicio de los síntomas y el diagnóstico, un periodo crítico de cinco años en promedio. En niños con agammaglobulinemia ligada al cromosoma X está implícita la formación de bronquiectasia y –por tanto– de daño pulmonar irreversible, a pesar del tratamiento de reemplazo con gammaglobulina. Además, para que el tratamiento sea eficaz, la inmunoglobulina G intravenosa debe aplicarse cada 21 a 28 días; en un inicio el tratamiento de nuestro paciente no fue regular, lo cual I II III IV V VI VII Figura 6. Árbol genealógico. Se observa consanguinidad cinco generaciones arriba del paciente. No hay otro miembro afectado. Las tres hermanas del paciente son posibles portadoras. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 169 Román Jiménez MG y col. se explica por la existencia de múltiples cuadros infecciosos. La difusión de las inmunodeficiencias primarias, como la agammaglobulinemia ligada al cromosoma X, es fundamental para establecer un diagnóstico temprano y, una vez diagnosticada, el reemplazo de inmunoglobulina G por vía intravenosa debe realizarse en forma regular para que el tratamiento sea eficaz. REFERENCIAS 1. Tsukada S, Saffran DC, Rawlings DJ, Parolini O, et al. Deficient expression of a B cell cytoplasmic tyrosine kinase in human X-linked agammaglobulinemia. Cell 1993;72(2):279-290. 2. Vetrie D, Vorechovsky I, Sideras P, Holland J, et al. The gene involved in X-linked agammaglobulinemia is a member of the src family of protein-tyrosine kinases. Nature 1993;361(6409):226-233. 3. Bruton OC. Agammaglobulinemia. Pediatrics 1952;9(6):722728. 4. Conley ME, Howard V. Clinical findings leading to the diagnosis of X-linked agammaglobulinemia. J Pediatr 2002;141(4):566-571. 5. Conley ME, Dobbs AK, Farmer DM, Kilic S, et al. Primary B cell immunodeficiencies: comparisons and contrasts. Annu Rev Immunol 2009;27:199-227. 6. Ghia P, ten BE, Sanz E, de la Hera A, et al. Ordering of human bone marrow B lymphocyte precursors by single-cell polymerase chain reaction analyses of the rearrangement status of the immunoglobulin H and L chain gene loci. J Exp Med 1996;184(6):2217-2229. 170 7. Mohamed AJ, Yu L, Backesjo CM, Vargas L, et al. Bruton's tyrosine kinase (Btk): function, regulation, and transformation with special emphasis on the PH domain. Immunol Rev 2009;228(1):58-73. 8. Maas A, Hendriks RW. Role of Bruton's tyrosine kinase in B cell development. Dev Immunol 2001;8(3-4):171-181. 9. Conley ME, Rohrer J, Rapalus L, Boylin EC, Minegishi Y. Defects in early B-cell development: comparing the consequences of abnormalities in pre-BCR signaling in the human and the mouse. Immunol Rev 2000;178:75-90. 10. Ochs HD, Smith CI. X-linked agammaglobulinemia. A clinical and molecular analysis. Medicine (Baltimore) 1996;75(6):287-299. 11. Plebani A, Soresina A, Rondelli R, Amato GM, et al. Clinical, immunological, and molecular analysis in a large cohort of patients with X-linked agammaglobulinemia: an Italian multicenter study. Clin Immunol 2002;104(3):221-230. 12. Winkelstein JA, Marino MC, Lederman HM, Jones SM, et al. Xlinked agammaglobulinemia: report on a United States registry of 201 patients. Medicine (Baltimore) 2006;85(4):193-202. 13. Chun JK, Lee TJ, Song JW, Linton JA, Kim DS. Analysis of clinical presentations of Bruton disease: a review of 20 years of accumulated data from pediatric patients at Severance Hospital. Yonsei Med J 2008;49(1):28-36. 14. Conley ME, Notarangelo LD, Etzioni A. Diagnostic criteria for primary immunodeficiencies. Representing PAGID (Pan-American Group for Immunodeficiency) and ESID (European Society for Immunodeficiencies). Clin Immunol 1999;93(3):190-197. 15. Quartier P, Debre M, De BJ, Sayegh N, et al. Early and prolonged intravenous immunoglobulin replacement therapy in childhood agammaglobulinemia: a retrospective survey of 31 patients. J Pediatr 1999;134(5):589-596. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Revista Alergia México 2010;57(5):171-175 Caso clínico Síndrome de Wiskott-Aldrich María Guadalupe Román Jiménez,* Marco Antonio Yamazaki Nakashimada,** Lizbeth Blancas Galicia*** RESUMEN El síndrome de Wiskott-Aldrich, que es una inmunodeficiencia primaria, se distingue por microtrombocitopenia congénita, eccema e infecciones recurrentes. Se comunica el caso de un paciente de 3 años 6 meses, quien tuvo un tío materno que murió a los tres meses de edad por sepsis fulminante de foco pulmonar. Nació en 27 semanas, pesó 1,400 g y fue hospitalizado a los dos meses de vida por sangrado del tubo digestivo bajo, plaquetopenia e infecciones severas. Desde la edad de cuatro meses y antes de llegar a nuestra institución fue hospitalizado en 54 ocasiones. A su ingreso tenía dermatosis diseminada, cuello con ganglios de 0.5 cm y retraso psicomotor. Resultados de laboratorio: hemoglobina de 8.1 g/dL, trombocitopenia de 31,000/uL y volumen plaquetario de 5.6 fL (en varias ocasiones le transfundieron paquetes globulares y concentrados plaquetarios). grupo sanguíneo A+, IgM 39.3 mg/dL, IgA 67 mg/dL e IgG 1,380 mg/dL (cada 21 días le aplicaron inmunoglobulina G). El trasplante de médula ósea se postergó por complicaciones, que ameritaron 13 hospitalizaciones por plaquetopenia severa, sangrado del tubo digestivo bajo, artritis séptica, gastroenteritis infecciosa, otitis media supurada crónica y foliculitis severa. A los cuatro años se le realizó trasplante de médula ósea de cordón umbilical, para lo cual fue preparado previamente; sin embargo, 26 días después del trasplante falleció por choque séptico. En el síndrome de Wiskott-Aldrich y en otras inmunodeficiencias primarias el pronóstico del trasplante de médula ósea depende de que éste se realice en etapas tempranas de la vida. Es importante comunicar a los médicos de primer contacto los signos y síntomas iniciales. Palabras clave: Wiskott-Aldrich, trombocitopenia, inmunodeficiencia primaria. ABSTRACT The Wiskott-Aldrich syndrome is a primary immunodeficiency characterized by congenital microthrombocytopenia, eczema and recurrent infections. This paper reports the case of a 3-year-6-month male patient, whose maternal uncle died at the age of 3 months due to fulminant sepsis from a pulmonary infection. The patient was a product of the first pregnancy, he was born at 27 weeks’ gestation and weighed 1,400 g. As a neonate he was hospitalized during the first 2 months of life because of a low gastrointestinal bleeding, thrombocytopenia and severe infections. In the next 4 months and before coming to our hospital the infant was hospitalized 54 times. On admission he presented disseminated dermatosis, enlarged neck lymph nodes and psychomotor retardation. Laboratory studies revealed hemoglobin 8.1 g/dL, platelets 31,000/uL, mean platelet volume 5.6 fL, IgM 39.3 mg/dL, IgA 67 mg/dl, IgG 1,380 mg/dl. On several occasions he received globular packages and platelet concentrates. The infusion of immunoglobulin G was started every 21 days. Bone marrow transplantation was delayed due to the complications that merited 13 hospitalizations and severe thrombocytopenia, low gastrointestinal bleeding, septic arthritis, infectious gastroenteritis, chronic suppurative otitis media and severe folliculitis. At the age of 4 years BMT of cord was performed, and 26 days after transplantation he presented septic shock and died. The prognosis of bone marrow transplantation in Wiskott-Aldrich syndrome and in other primary immunodeficiencies depends on the promptness of its performance at early stages in life. It is important that the first contact physicians be aware of the primary immunodeficiency signs and symptoms. Key words: Wiskott-Aldrich, thrombocytopenia, primary immunodeficiency. * Médico pasante del Servicio Social en Investigación, Unidad de Investigación en Inmunodeficiencias. ** Médico adscrito al servicio de Inmunología. *** Investigadora de la unidad de Investigación en Inmunode ficiencias. Instituto Nacional de Pediatría, México, DF. Correspondencia: Dra. Lizbeth Blancas Galicia. Insurgentes sur 3700-C, colonia Insurgentes Cuicuilco, CP 04530, México, DF. Recibido: agosto, 2010. Aceptado: septiembre, 2010. Este artículo debe citarse como: Román-Jiménez MG, YamazakiNakashimada MA, Blancas-Galicia L. Síndrome de WiskottAldrich. Rev Alerg Mex 2010;57(5):171-175. www.nietoeditores.com.mx E l síndrome de Wiskott-Aldrich, que es una inmunodeficiencia primaria ligada al cromosoma X, se distingue por microtrombocitopenia congénita, eccema e infecciones recurrentes, así como por un mayor riesgo de linfomas y autoinmunidad.1 Se estima que su incidencia en el mundo es de 1 a 10 en un millón de recién nacidos vivos y la expectativa de vida es de 15 años sin trasplante de médula ósea.1,2 Es causado por una mutación en el gen WASP, que codifica para la proteína del síndrome de WiskottAldrich, presente sólo en las células hematopoyéticas. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 171 Román Jiménez MG y col. Los pacientes afectados padecen una combinación de inmunodeficiencia humoral y celular, que se manifiesta por susceptibilidad a infecciones recurrentes.3 La gravedad del cuadro puede variar de una familia a otra, lo cual depende en gran medida de la mutación y sus efectos en la expresión de la proteína, ya que predispone un fenotipo clínico variable.2 Dichos pacientes pueden vivir hasta la edad adulta; sin embargo, una proporción significativa fallece por hemorragia, infecciones graves o enfermedad maligna.4 El trasplante de células hematopoyéticas es el tratamiento definitivo. Exponemos el caso clínico de un paciente mexicano con síndrome de Wiskott-Aldrich, que se diagnosticó tempranamente; sin embargo, el trasplante de médula ósea se realizó cuando el paciente tenía cuatro años de edad. CASO CLÍNICO Paciente masculino de 3 años 6 meses, con padres aparentemente sanos y tío materno finado a los tres meses de edad por sepsis de foco pulmonar. Fue hijo de primera gestación, no tuvo control prenatal, se obtuvo por parto vaginal en una unidad hospitalaria, nació en 27 semanas de gestación, tuvo un peso de 1,400 gramos y fue hospitalizado a los dos meses de vida. A los padres se les comunicó diagnóstico presuntivo de síndrome de Wiskott-Aldrich por sangrado del tubo digestivo bajo, plaquetopenia e infecciones severas. El paciente egresó pesando 2,200 gramos y se contraindicó la aplicación de todo tipo de inmunizaciones debido al diagnóstico de inmunodeficiencia primaria. Desde la edad de cuatro meses y antes de llegar a nuestra institución fue hospitalizado, en el ISSSTE y en hospitales privados, en 54 ocasiones por sangrado del tubo digestivo bajo y epistaxis asociada con choque hemorrágico, gingivorragia, infecciones dentales e infecciones respiratorias, como otitis media crónica, sinusitis y neumonía; en ocho ocasiones fue tratado con inmunoglobulina intravenosa y factor de transferencia. A los tres años también padeció dermatitis atópica. Con el propósito de que recibiera tratamiento especializado, fue referido a un hospital de tercer nivel, en el que fue hospitalizado para que recibiera un trasplante de médula ósea. A su ingreso el paciente exhibía estas características: edad aparentemente menor a la cronológica; peso y 172 talla por debajo del percentil 5; dolicocéfalo; cabello bien implantado; lesiones dérmicas caracterizadas por pápulas eritematosas, que confluían y formaban en los pabellones auriculares placas excoriadas con liquenificación y edema; múltiples caries y abundante placa dentobacteriana en la cavidad oral; cuello cilíndrico con ganglios palpables de 0.5 cm en la región cervical; tórax normolíneo con adecuada entrada y salida de aire; ruidos cardiacos rítmicos de adecuada intensidad y sin agregados; abdomen blando, depresible y no doloroso a la palpación; sin hepatomegalia ni esplenomegalia; peristalsis normal; extremidades con hipotrofia muscular y sin limitación de los arcos de movilidad; llenado capilar y pulsos normales; genitales normales para la edad según estadios de Tanner; piel con dermatosis diseminada en la cabeza, el tronco y las extremidades; piel sin dermatosis en las palmas y las plantas; espalda con petequias; extremidades con estigmas de rascado; excoriaciones; costras hemáticas; equimosis; zonas de dermatitis perianal y psicomotricidad con retraso para su edad. Los resultados de laboratorio fueron: hemoglobina de 8.1 g/dL, trombocitopenia de 31,000/uL y volumen plaquetario de 5.6 fL (en varias ocasiones le transfundieron paquetes globulares y concentrados plaquetarios). Grupo sanguíneo A y factor RH+, aglutinina anti-A negativa, aglutinina anti-B 1: 4, Coombs directo negativo, IgM 39.3 mg/dL (47-200 mg/dL), IgA 67 mg/dl (22-159 mg/ dL), IgG 1,380 mg/dl (441-1,135 mg/dl). Durante 16 días de hospitalización el paciente tuvo gastroenteritis infecciosa y otitis crónica, por lo que recibió tratamiento con ceftriaxona y clindamicina intravenosa. Luego, cada 21 días le aplicaron gammaglobulina intravenosa a 400 mg/kg/dosis e inmunizaciones (neumococo heptavalente y vacuna DPT acelular). El trasplante de médula ósea se postergó por complicaciones, que ameritaron 13 hospitalizaciones por plaquetopenia severa asociada con sangrado de tubo digestivo bajo y múltiples infecciones (artritis séptica, gastroenteritis infecciosa, otitis media supurada crónica y foliculitis severa). A la edad de 4 años 7 meses el paciente recibió –trece meses después de su ingreso– el trasplante de médula ósea, para lo cual fue preparado con busulfán y ciclosfosfamida. El cordón fue compatible con el paciente en Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Síndrome de Wiskott-Aldrich 5/6 antígenos, la transfusión ocurrió sin incidentes y la nutrición se inició en forma parenteral. Hubo respuesta inflamatoria sistémica a los cuatro días del trasplante y se realizó en el catéter central un cultivo, el cual fue positivo para bacterias grampositivas, por lo que el paciente fue tratado con clindamicina, meropenem y vancomicina. Posteriormente, el paciente tuvo dificultad respiratoria secundaria a neumonía nosocomial por Staphylococcus aureus, por lo que ameritó intubación endotraqueal. Luego ingresó a terapia intensiva, donde 26 días después del trasplante falleció por choque séptico. REVISIÓN DE LA BIBLIOGRAFÍA El síndrome de Wiskott-Aldrich es causado por una mutación en el gen WASP, que codifica para la proteína del síndrome de Wiskott-Aldrich (WASp), presente sólo en las células hematopoyéticas. La proteína WASp es un regulador clave del citoesqueleto y de la señalización de múltiples funciones celulares, especialmente de la motilidad celular. El citoesqueleto, un conjunto de proteínas responsables de mantener la configuración de la membrana plasmática y la movilización y migración celular, está formado por filamentos de actina y miosina. La proteína WASp participa en la polimerización de la actina; cuando ésta resulta afectada, se impide la movilización celular a través de los filopodios y se produce ausencia de microfilamentos en las plaquetas, de ahí que éstas sean rápidamente destruidas en el bazo; también resulta afectada la fagocitosis.3,5 El gen WASP, responsable del síndrome de WiskottAldrich se localiza en el brazo corto del cromosoma X, en la región Xp 11.23 a Xp 11.3, consta de 12 exones, con 1,823 pares de bases, codifica una proteína de 502 aminoácidos que se expresa de forma selectiva en células hematopoyéticas CD34+.6,7 Imai y col. estudiaron la respuesta inmunitaria de pacientes con síndrome de wiskott-Aldrich clásico. Cuando inmunizaron a estos pacientes con un bacteriófago, éstos no produjeron anticuerpos en forma normal; específicamente, tuvieron un defecto en el cambio de isotipo e incapacidad para desarrollar memoria inmunológica, a pesar de que las concentraciones de inmunoglobulinas son normales en pacientes con este síndrome. Esto se debe a que tienen una escasa respuesta humoral a antígenos poli- sacáridos y proteínicos, lo cual justifica la administración de inmunogammaglobulina G intravenosa.6 Las diferentes mutaciones en el gen WASP producen espectros clínicos diferentes. Se han descrito el síndrome de wiskott-Aldrich clásico (susceptibilidad a infecciones, trombocitopenia y eccema), la trombocitopenia intermitente o ligada al cromosoma X y la neutropenia ligada al cromosoma X.8 Manifestaciones clínicas La tríada característica del síndrome de wiskott-Aldrich clásico es microtrombocitopenia, eccema e infecciones recurrentes. Las manifestaciones clínicas generalmente ocurren al nacimiento y consisten en petequias, equimosis, sangrado del tubo digestivo bajo, epistaxis y hemorragia intracraneal, afecciones que se manifiestan como trombocitopenia asociada con un volumen plaquetario disminuido. La cantidad de plaquetas puede variar considerablemente, pero suele estar por abajo del valor normal; este dato es la piedra angular para diagnosticar síndrome de wiskott-Aldrich clásico y trombocitopenia ligada al cromosoma X.2 La existencia de infecciones severas desde el nacimiento es un dato importante para establecer dichos diagnósticos, que se distinguen por cuadros recurrentes de neumonía, otitis media, abscesos en piel, enterocolitis, meningitis, sepsis, infección de las vías urinarias e infecciones virales por molusco contagioso y herpes simple. En la mayoría de los casos el agente etiológico son bacterias y en la minoría de los casos son hongos, como Candida sp., Aspergillus sp. y Pneumocystis carinii.2,6 El eccema, una manifestación característica durante la lactancia y la infancia, persiste hasta la edad adulta; en la mayoría de los casos se manifiesta en forma grave y resistente al tratamiento. Los pacientes con trombocitopenia ligada al cromosoma X padecen con menor frecuencia eccema e infecciones, y a menudo les diagnostican erróneamente púrpura trombocitopénica idiopática.2 Las enfermedades autoinmunitarias son frecuentes e incluyen: anemia hemolítica seguida de vasculitis renal, púrpura de Henoch-Schönlein, enfermedades intestinales autoinmunitarias, neutropenia, dermatomiositis, angioedema recurrente, uveítis y vasculitis cerebral.2,9 Los tumores malignos hematológicos pueden ocurrir durante la infancia, pero son más frecuentes en adoles- Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 173 Román Jiménez MG y col. centes y jóvenes. El linfoma de células B asociado con el virus de Epstein-Barr es el linfoma que más se reporta. Algunos pacientes también pueden padecer displasia de médula ósea.2,6 diagnóstico El síndrome de wiskott-Aldrich o trombocitopenia ligada al cromosoma X debe sospecharse en varones con sangrado asociado con eccema severo o moderado. El diagnóstico se corrobora con exámenes de laboratorio; la biometría hemática confirma plaquetopenia y plaquetas pequeñas. Por citometría de flujo el número de linfocitos circulantes puede ser normal, estar discreta o francamente disminuido a expensas de linfocitos T; los linfocitos B pueden ser normales o estar moderadamente disminuidos.10 Las concentraciones de IgG se encuentran frecuentemente en rango normal; la IgM está disminuida y las inmunoglobulinas IgA e IgE se encuentran elevadas.2 El diagnóstico definitivo es detectar la mutación en el gen WASP.8 tratamiento La transfusión de plaquetas radiadas, la administración de inmunogammaglobulina G intravenosa, la esplenectomía y la profilaxis con antibióticos (trimetoprim) y antivirales (aciclovir) son los tratamientos iniciales que mejoran el pronóstico de los pacientes con síndrome de wiskott-Aldrich. El tratamiento contra el eccema requiere esteroides tópicos y, en casos severos, esteroides sistémicos. El trasplante de médula ósea es el único tratamiento curativo, pero sus indicaciones son puntuales.4,11 La esplenectomía está indicada para disminuir la plaquetopenia severa (< 20,000) y para casos en los que no pueda realizarse el trasplante de médula ósea.6,11 En un estudio realizado a pacientes con esplenectomía Litzman y col. reportaron que el recuento plaquetario aumentó, en un seguimiento de 23 meses después de la esplenectomía, a 232,000 plaquetas en promedio. En este grupo de pacientes hay un porcentaje que tiende a tener recurrencia de plaquetopenia secundaria a anticuerpos antiplaquetas, destrucción plaquetaria en el sistema retículo-endotelial y por los defectos per 174 se de éstas.9,12 Estos pacientes tienen mayor riesgo de padecer sepsis por bacterias encapsuladas, por lo que antes del procedimiento quirúrgico son obligatorias la inmunización contra Streptococcus pneumoniae, Haemophilus influenzae y Neisseria meningitidis, así como la administración de antibiótico profiláctico (penicilina y trimetoprim/sulfametoxazol).12 En la aplicación de inmunizaciones a pacientes con wiskott-Aldrich debe considerarse que no hay una adecuada respuesta inmunitaria, por lo cual la eficacia es parcial. Ante la administración de vacunas con microorganismos muertos debe titularse la producción de anticuerpos específicos. Las vacunas de microorganismos vivos atenuados no son recomendables. Si algún paciente se expuso al virus de la varicela, se le deben administrar dosis altas de inmunogammaglobulina G intravenosa y medicamentos antivirales.8 El trasplante de médula ósea es una opción terapéutica contra el síndrome de wiskott-Aldrich; sin embargo, las características de los pacientes para los que está indicado no están claramente definidas por los centros internacionales de trasplante debido a que el espectro clínico del síndrome de wiskott-Aldrich es variable y a que no hay estudios que demuestren qué es mejor, la esplenectomía o el trasplante de médula ósea. En pacientes con un cuadro clínico leve se prefiere no optar por este último; sin embargo, está indicado en casos graves desde el punto de vista inmunológico (infecciones graves) o hematológico (hemorragia severa).11 La supervivencia de los pacientes trasplantados depende de lo siguiente: tipo de donador, edad, tipo de condicionamiento, antecedente de esplenectomía y experiencia del hospital.13,14 En México la mayor parte de los trasplantes son realizados por enfermedades hematológicas.15,16 En el Instituto Nacional de Pediatría a 10 pacientes se les diagnosticó síndrome de wiskott-Aldrich; de éstos, cuatro recibieron un trasplante, pero sólo uno sobrevivió con adecuada calidad de vida.17 Consideramos que los casos reportados son pocos, por lo cual es importante difundir los signos y síntomas de la enfermedad para establecer un diagnóstico oportuno. En la Unidad de Investigación en Inmunodeficiencias del Instituto Nacional de Pediatría se realiza el diagnóstico molecular, que para el asesoramiento genético es el diagnóstico definitivo. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Síndrome de Wiskott-Aldrich CONCLUSIÓN El síndrome de wiskott-Aldrich es una inmunodeficiencia primaria severa con un fenotipo clínico variable. Las bases moleculares de esta inmunodeficiencia primaria se han estudiado ampliamente; se ha reportado que los defectos celulares ocasionados por la mutación en el gen WASP son la causa del fenotipo inmunológico. Los pacientes con síndrome de wiskott-Aldrich pueden vivir hasta la edad adulta; sin embargo, una proporción significativa fallece por hemorragia, infección, enfermedad maligna o complicaciones posteriores al trasplante de médula ósea. Hemos expuesto el caso clínico de un paciente mexicano con síndrome de wiskott-Aldrich, que se diagnosticó tempranamente; sin embargo, el trasplante de médula ósea se realizó cuando el paciente tenía cuatro años de edad. En síndrome de wiskott-Aldrich y en otras inmunodeficiencias primarias el pronóstico del trasplante de médula ósea depende de que éste se realice en etapas tempranas de la vida. Es importante comunicar a los médicos de primer contacto los signos y síntomas iniciales de las inmunodeficiencias primarias, como lo son las infecciones recurrentes y severas, para que sean diagnosticadas y tratadas oportunamente. REFERENCIAS 1. Bosticardo M, Marangoni F, Aiuti A, Villa A, Grazia RM. Recent advances in understanding the pathophysiology of Wiskott-Aldrich syndrome. Blood 2009;113(25):6288-6295. 2. Thrasher AJ. New insights into the biology of Wiskott-Aldrich syndrome (WAS). Hematology Am Soc Hematol Educ Program 2009;132-138. 3. Bouma G, Burns SO, Thrasher AJ. Wiskott-Aldrich syndrome: immunodeficiency resulting from defective cell migration and impaired immunostimulatory activation. Immunobiology 2009;214(9-10):778-790. 4. Mullen CA, Anderson KD, Blaese RM. Splenectomy and/ or bone marrow transplantation in the management of the Wiskott-Aldrich syndrome: long-term follow-up of 62 cases. Blood 1993;82(10):2961-2966. 5. Zhang J, Dong B, Siminovitch KA. Contributions of WiskottAldrich syndrome family cytoskeletal regulatory adapters to immune regulation. Immunol Rev 2009;232(1):175-194. 6. Imai K, Morio T, Zhu Y, Jin Y, et al. Clinical course of patients with WASP gene mutations. Blood 2004;103(2):456464. 7. Derry JM, Ochs HD, Francke U. Isolation of a novel gene mutated in Wiskott-Aldrich syndrome. Cell 1994;79(5):923973. 8. Ochs HD, Thrasher AJ. The Wiskott-Aldrich syndrome. J Allergy Clin Immunol 2006;117(4):725-738. 9. Dupuis-Girod S, Medioni J, Haddad E, Quartier P, et al. Autoimmunity in Wiskott-Aldrich syndrome: risk factors, clinical features, and outcome in a single-center cohort of 55 patients. Pediatrics 2003;111(5 Pt 1):e622-e627. 10. Park JY, Shcherbina A, Rosen FS, Prodeus AP, RemoldO’Donnell E. Phenotypic perturbation of B cells in the WiskottAldrich syndrome. Clin Exp Immunol 2005;139(2):297-305. 11. Conley ME, Saragoussi D, Notarangelo L, Etzioni A, Casanova JL. An international study examining therapeutic options used in treatment of Wiskott-Aldrich syndrome. Clin Immunol 2003;109(3):272-277. 12. Litzman J, Jones A, Hann I, Chapel H, et al. Intravenous immunoglobulin, splenectomy, and antibiotic prophylaxis in Wiskott-Aldrich syndrome. Arch Dis Child 1996;75(5):436439. 13. Kobayashi R, Ariga T, Nonoyama S, Kanegane H, et al. Outcome in patients with Wiskott-Aldrich syndrome following stem cell transplantation: an analysis of 57 patients in Japan. Br J Haematol 2006;135(3):362-366. 14. Pai SY, DeMartiis D, Forino C, Cavagnini S, et al. Stem cell transplantation for the Wiskott-Aldrich syndrome: a single-center experience confirms efficacy of matched unrelated donor transplantation. Bone Marrow Transplant 2006;38(10):671-679. 15. Ruiz-Delgado GJ, Gutiérrez-Riveroll KI, Gutiérrez-Aguirre CH, Gómez-Almaguer D, et al. A single apheresis procedure in the donor may be enough to complete an allograft using the “Mexican Method” of non-ablative allografting. Blood Transfus 2009;7(2):127-131. 16. Ruiz-Argüelles GJ, Gómez-Almaguer D, Ruiz-Delgado GJ, Del Carmen Tarin-Arzaga L. Eight years using the “Mexican method” for allogeneic hematopoietic stem cell transplants. Gac Med Mex 2007;143(3):231-235. 17. García-Cruz ML, Camacho R, Ortega-Martell JA, BerronPérez R y col. Registro de inmunodeficiencias primarias en pacientes mexicanos en una institución de tercer nivel: experiencia de 30 años. Alerg Asma Inmunol Pediatr 2002;11(2):48-66. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 175 Revista Alergia México 2010;57(5):176-181 Caso clínico Neutropenia congénita grave Wilmer Córdova Calderón,* Javier Pérez Rojas,* César Galván Calle,* Lizbeth Blancas Galicia** RESUMEN La neutropenia congénita grave es una inmunodeficiencia primaria que se distingue por falta de maduración de los precursores de los neutrófilos en la médula ósea. El cuadro clínico se caracteriza por una marcada susceptibilidad a infecciones severas y recurrentes causadas por bacterias y hongos. Se comunica el caso de una niña con neutropenia congénita grave que a los cuatro días de vida sufrió absceso perineal, septicemia, absceso hepático, gingivitis y úlceras orales. La paciente fue hospitalizada en varias ocasiones debido a la severidad de los cuadros infecciosos. Los microorganismos aislados fueron Pseudomonas aeruginosa, Staphylococcus hominis y Klebsiella sp. Un aspirado de médula ósea mostró detención en la maduración de las formas mieloides, con lo cual se confirmó el diagnóstico de neutropenia congénita grave. Se le administró tratamiento con factor estimulante de colonias de granulocitos. Debe considerarse este padecimiento en los pacientes con neutropenia que sufren infecciones durante el primer mes de vida. El diagnóstico temprano y el tratamiento oportuno incrementan la supervivencia y la calidad de vida de estos pacientes. Palabras clave: neutropenia, inmunodeficiencia primaria. ABSTRACT Severe congenital neutropenia is a primary immunodeficiency; the lack of maturation of neutrophil precursor in bone marrow and severe neutropenia are the subjacent characteristics which explain a marked susceptibility to severe and recurrent infections; bacteria and fungi are the most common etiologic agents. We report the case of an infant with severe congenital neutropenia that began at 4 days from birth with perianal abscess infections, sepsis, liver abscess, gingivitis and oral ulcers; she required multiple hospitalizations because of the severity of the infections. Isolated agents were Pseudomonas aeruginosa, Staphylococcus hominis and Klebsiella sp. The bone marrow examination showed maturation arrest of myeloid forms, thus confirming the diagnosis of severe congenital neutropenia. Granulocyte colony-stimulating factor was started. The severe congenital neutropenia should be considered in patients with neutropenia and infections in the first month of life. Early diagnosis and treatment improve survival and quality of life of these patients. Key words: neutropenia, primary immunodeficiency. L * ** os neutrófilos, conocidos también como granulocitos o leucocitos polimorfonucleares, son componentes del sistema inmunitario innato. Una de sus funciones es eliminar Unidad de Inmunología del Hospital Guillermo Almenara Irigoyen, Lima, Perú. Unidad de Investigación en Inmunodeficiencias, Instituto Nacional de Pediatría, México, DF. Correspondencia: Dra. Lizbeth Blancas Galicia. Instituto Nacional de Pediatría, piso 9, Torre de Investigación. Insurgentes Sur núm. 3700-C, colonia Insurgentes Cuicuilco, CP 04530, México, DF. Correo electrónico: [email protected] Recibido: agosto, 2010. Aceptado: septiembre, 2010. Este artículo debe citarse como: Córdova-Calderón W, PérezRojas J, Galván-Calle C, Blancas-Galicia L. Neutropenia congénita grave. Rev Alerg Mex 2010;57(5):176-181. www.nietoeditores.com.mx 176 bacterias y hongos a través de proteasas, péptidos antimicrobianos y metabolitos reactivos del oxígeno. También participan en la respuesta inflamatoria y producen citocinas, eicosanoides y otras moléculas que intervienen en la señalización celular.1 La neutropenia se define como la cuenta de neutrófilos en sangre periférica menor de 1,500/mm3. Se clasifica como: grave, cuando el número de neutrófilos es de 500/mm3 o menos; crónica, si se observa en todos los hemogramas realizados en un lapso mínimo de tres meses; intermitente, si existen periodos de corrección espontáneos; cíclica, si se manifiesta periódicamente cada 21 días; y central, si disminuye la reserva medular de los neutrófilos, lo que se aprecia en el mielograma como una reducción de los estadios tardíos de la maduración (disminución de la proporción de neutrófilos maduros menor a 10%). Se dice que la neutropenia es Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Neutropenia congénita grave periférica cuando la maduración de los neutrófilos es normal en la médula ósea.2 La neutropenia induce susceptibilidad a las infecciones, que es leve si el número de neutrófilos excede a 1,000/mm3; moderada si se encuentra entre 200 y 1,000/mm3; y grave cuando es menor a 200/mm3. Los sitios más propensos a infectarse son: la piel, las mucosas, las vías respiratorias altas y los pulmones. Las manifestaciones estomatológicas son casi constantes en los casos de neutropenia central grave y se manifiestan como gingivitis con periodontopatía concomitante con aftas. Los gérmenes aislados son bacterias y hongos. Prácticamente en todas las neutropenias la administración terapéutica de rhG-CSF (factor estimulante de colonias de granulocitos recombinante humano) aumenta el número de neutrófilos y elimina el riesgo infeccioso. En la neutropenia congénita, el esquema terapéutico es personalizado debido a que cada paciente responde de manera particular. Existen muy pocos casos resistentes a G-CSF; para ellos, se indica el trasplante de médula ósea.2 Para confirmar el carácter congénito de la neutropenia deben descartarse causas adquiridas (infecciosas, autoinmunitarias o malignas). Entre las neutropenias congénitas se encuentran: • Las vinculadas con un déficit funcional y cuantitativo de la línea linfocitaria. • Las relacionadas con un síndrome con malformaciones o una anomalía metabólica bien definida. En ellas, la neutropenia es uno de los componentes de un síndrome complejo. • Las congénitas o primarias. Este grupo se divide en dos: la neutropenia congénita grave, con neutrófilos permanentemente menores a 200/mm3, y la neutropenia cíclica, que se distingue por una fluctuación periódica (ciclo de 16 a 28 días) del número de neutrófilos.3 A continuación se describe el caso clínico de una paciente con neutropenia persistente. CASO CLÍNICO Se comunica el caso de una paciente de un año y seis meses de edad, sin antecedentes heredofamiliares de importancia ni consanguinidad. Su gestación transcurrió sin alteraciones y nació por parto eutócico en Lima, Perú, a las 40 semanas, con calificación Apgar de 8/9 y peso de 3,220 gramos; el cordón umbilical se le desprendió a los ocho días de nacida. Comenzó su padecimiento actual a los cuatro días de vida extrauterina con fiebre de 38.4°C, úlceras orales, ictericia, celulitis perineal caracterizada por lesión ulcerativa y granulomatosa e isquemia en la región perineal. La biometría hemática arrojó los siguientes resultados: 7,130 leucocitos y 355 neutrófilos/mm3 totales; el resto de los parámetros estuvo dentro de los límites normales. Se le hospitalizó e inició tratamiento con imipenem intravenoso durante 15 días, pero al no obtener mejoría se sustituyó por vancomicina y metronidazol durante 10 días. El hemocultivo fue positivo a Pseudomonas aeruginosa. Siete días después de su ingreso se le hizo limpieza quirúrgica de la úlcera perineal. Por persistir con neutropenia (Figura 1) y PCR elevada se agregó ciprofloxacino y amikacina. A los 45 días de vida, un frotis de sangre periférica mostró escasas células segmentadas, en tanto que el aspirado de médula ósea reveló detención de la maduración mieloide (células de estirpe mieloide, predominio de promielocitos, promonocitos, eosinófilos, mielocitos, interrupción de la maduración y linfocitos de aspecto maduro). Se administró rhG-CSF a dosis de 3 a 5 µg/kg/d, lo que aumentó la cuenta de neutrófilos a 1,700/mm3, y se realizó exéresis del granuloma perineal. La paciente evolucionó de manera satisfactoria. Se le hospitalizó por segunda vez a los cuatro meses de edad debido a gastroenteritis causada por Klebsiella sp. y se le dio tratamiento con ceftriaxona y amikacina. Durante su internamiento se le detectó hepatomegalia. En una ecografía abdominal se observó una colección heterogénea en la pared abdominal que afectaba la cápsula hepática; la TC abdominal reveló lesión de aspecto heterogéneo con áreas sólidas e hipodensas (Figura 2). Se sospechó inicialmente que se trataba de un hepatoblastoma. La alfa fetoproteína fue de 305 ng/ mL (valor de referencia menor de 10 ng/mL). Ocho días después se hizo aspiración de la lesión hepática con aguja guiada, y se obtuvo secreción purulenta, cuyo análisis microscópico fue positivo para bacilos gramnegativos y negativo para células neoplásicas; el cultivo del catéter fue positivo para Staphylococcus hominis. Se le prescribió meropenem, vancomicina y metronidazol. Por los Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 177 Córdova Calderón W y col. Figura 1. Cuenta absoluta en sangre periférica de leucocitos y neutrófilos. Figura 2. Imagen hipodensa correspondiente a absceso en el hígado en corte de TAC. 178 hallazgos previos se solicitó nuevamente medición de alfa fetoproteína, que resultó normal (<10 ng/mL), por lo que se descartó cualquier proceso neoplásico. A los nueve meses de vida se le hospitalizó por tercera ocasión debido a fiebre, gingivitis, adenomegalias submaxilares y neutropenia. La TAC abdominal no mostró lesión hepática (Figura 3). Recibió tratamiento con ceftazidima, amikacina y clindamicina. Se continuó su manejo con rhG-FSC, pero no se incrementó el número de neutrófilos, por lo que se elevó la dosis a 10 µg/kg/ día. Con excepción de la neutropenia, el resto de la evaluación fue normal. Debido a la respuesta terapéutica se estableció el diagnóstico de neutropenia congénita grave. Al año y dos meses de edad, la hospitalizaron nuevamente durante seis días por fiebre persistente y Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Neutropenia congénita grave Figura 3. Imagen hipodensa correspondiente a absceso en el hígado en resolución en corte de TAC. faringitis. Tuvo un tratamiento empírico con ceftazidima y amikacina, pero por la duración de la neutropenia grave se aumentó la dosis de rhG-FSC a 20 µg/kg/día, con lo cual evolucionó satisfactoriamente y fue dada de alta del hospital. En la actualidad se le da seguimiento en la consulta externa y continúa su tratamiento con rhG-FSC (10 µg/ kg/día, vía subcutánea) con neutrófilos en cifras adecuadas. Ha sufrido infecciones de las vías respiratorias altas y la piel, que se han aliviado con la administración ambulatoria de antibióticos. La determinación del defecto molecular aún está pendiente de efectuarse. DISCUSIÓN El caso que se comunica inició en el primer mes de vida con una infección en la región perianal, úlceras orales, PCR elevada, neutropenia grave y hemocultivo positivo para P. aeruginosa. Se necesitaron varios esquemas de antibióticos, drenaje quirúrgico y aplicación de rhGCSF para la remisión del cuadro infeccioso. Las otras hospitalizaciones se debieron a gastroenteritis por Klebsiella sp., absceso hepático por cocos gramnegativos, septicemia por Staphylococcus hominis y fiebre sin foco infeccioso. La paciente sufrió los primeros días de vida neutropenia grave e infecciones severas. El diagnóstico de neutropenia congénita grave se fundamentó en la ausencia de afectación de otras líneas celulares hema- tológicas; no tenía síndrome con malformaciones ni alteraciones metabólicas concomitantes. La neutropenia era congénita, crónica (más de tres meses de evolución), grave (menos de 500 neutrófilos totales/mm3) y central (detención en la maduración de los precursores mieloides en la médula ósea), y reaccionó favorablemente a la administración periódica de rhG-SCF. La evaluación de la inmunidad celular y humoral fue normal. La neutropenia congénita grave se conoce también como síndrome de Kostmann, puesto que fue descrita por Rolf Kostmann en una familia sueca con infecciones y neutropenia en 1956.4 En este padecimiento, la cifra de neutrófilos totales es menor a 200 mm3 desde el primer día de nacimiento. El análisis del aspirado de la médula ósea es normocelular, con detención en la maduración de las formas mieloides (promielocito-mielocito).5 Las infecciones bacterianas graves afectan a 50% de los casos durante el primer mes de vida; los agentes causales más frecuentes forman parte de la flora normal, como Staphylococcus aureus y microorganismos gramnegativos. Los pacientes con neutropenia congénita grave no son más susceptibles a infecciones por virus, bacterias o parásitos. Las infecciones fúngicas son raras, y casi siempre son ocasionadas por la administración prolongada de antibióticos.6,7 La onfalitis manifiesta poco después del nacimiento puede ser el primer signo, además de diarrea, neumonía, abscesos hepáticos, pulmonares y del tejido subcutáneo que no responden al tratamiento en el primer año de vida. Otros signos descritos son fiebre e inflamación orofaríngea con úlceras bucales y gingivitis, sinusitis, faringitis y adenopatía cervical. En 20% de los pacientes se ha descrito esplenomegalia.6 La neutropenia congénita grave se considera un síndrome preleucémico. En el curso de la enfermedad, algunos pacientes sufren síndrome mielodisplásico o leucemia mieloide aguda. Estas complicaciones se han relacionado con una mutación adquirida en el gen GCSF3R (factor estimulante de colonias de granulocitos).8 Este defectomutación se detecta en 80% de las personas con neutropenia congénita grave que padecen leucemia mieloide aguda.7 La neutropenia congénita grave puede provocar la muerte si no se trata. En la actualidad, el tratamiento consiste en la administración de antibióticos de amplio espectro, rhG-CSF y trasplante de médula ósea. El Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 179 Córdova Calderón W y col. rhG-CSF incrementa la cuenta de neutrófilos y previene las infecciones en 90% de los casos, con lo que la supervivencia y la calidad de vida son mayores. La dosis habitual del factor estimulante de colonias es de 3 a 5 µg/ kg/día; sin embargo, algunos pacientes requieren dosis superiores (más de 8 µg/kg/día). En los casos que no responden a rhG-CSF se debe descartar falta de apego terapéutico, síndrome mielodisplásico o leucemia mieloblástica aguda.9,10 La administración crónica y las dosis mayores a 8 µg/kg/día de rhG-CSF se han vinculado con el síndrome mielodisplásico y con leucemia aguda mieloide, por lo que se recomienda hacer cada año el análisis citogenético y el estudio molecular de la médula ósea de los pacientes tratados.7,11 Si el sujeto necesita dosis altas de rhG-CSF o no responde al tratamiento, debe considerarse el trasplante de médula ósea.12 En general, el éxito del trasplante en la neutropenia congénita grave se fundamenta en la elección de un donador compatible, la ausencia de leucemia mieloblástica aguda y la buena condición física.13 En la neutropenia congénita grave se han descrito patrones de herencia autosómico dominante y autosómico recesivo.10 Se han reportado diversas mutaciones en genes como ELANE, HAX1, GFI1, WAS, CSF3R y G6PC3, lo que refleja la heterogeneidad de este síndrome; sin embargo, dichas mutaciones sólo se encuentran en 60% de los casos; en el resto de los pacientes existen defectos moleculares aún desconocidos. Entre 50 y 80% de los sujetos con patrón autosómico dominante tienen mutación en el gen ELANE, el cual codifica para la elastasa de neutrófilos, cuya función es la de unirse a las bacterias y lisarlas.13 En los individuos con patrón autosómico recesivo se ha detectado mutación en el gen HAX1 que codifica para la proteína HS1, la cual participa en la apoptosis de los neutrófilos. La mutación en HAX1 es responsable del fenotipo clínico del síndrome de Kostman, algunos de estos individuos, además de la neutropenia, tienen alteraciones neurológicas que van desde retraso psicomotor leve a epilepsia de difícil control.7,14,15 La neutropenia congénita grave puede ser parte de un complejo sindromático como Shwchman-Diamon, Wiskott-Aldrich, Chediak-Higashi, disqueratosis congénita, síndrome de Griscelli y enfermedad de almacenamiento de glucógeno 1b.16 180 CONCLUSIÓN La neutropenia congénita grave es una inmunodeficiencia primaria que debe investigarse en el diagnóstico diferencial de niños con neutropenia e infecciones durante el primer año de vida. El diagnóstico es fundamentalmente clínico, sustentado en la historia clínica y la biometría hemática. El diagnóstico temprano realizado por médicos de primer contacto permite iniciar el tratamiento oportuno e incrementar la supervivencia y la calidad de vida de los pacientes. La primera indicación terapéutica eficaz contra la neutropenia congénita grave es el rhG-CSF. El trasplante de médula ósea es otra opción de tratamiento cuando fracasa la administración del estimulante de colonias. REFERENCIAS 1. Horwitz MS, Duan Z, Korkmaz B, Lee HH, et al. Neutrophil elastase in cyclic and severe congenital neutropenia. Blood 2007;109(5):1817-1824. 2. Donadieu J, Beaupain B, Bellanne-Chantelot C. Granulopoeisis and leukemogenesis: lessons from congenital neutropenia. Med Sci (Paris) 2008;24(3):284-289. 3. Mamishi S, Esfahani SA, Parvaneh N, Diestelhorst J, Rezaei N. Severe congenital neutropenia in 2 siblings of consanguineous parents. The role of HAX1 deficiency. J Investig Allergol Clin Immunol 2009;19(6):500-503. 4. Newburger PE. Disorders of neutrophil number and function. Hematology [Am Soc Hematol Educ Program] 2006:104110. 5. Donadieu J. Evaluation of neutropenia in children. Arch Pediatr 2003;10(Suppl 4):521s-523s. 6. Boxer LA. Severe congenital neutropenia: genetics and pathogenesis. Trans Am Clin Climatol Assoc 2006;117:1331. 7. Klein C. Congenital neutropenia. Hematology [Am Soc Hematol Educ Program] 2009:344-350. 8. Schaffer AA, Klein C. Genetic heterogeneity in severe congenital neutropenia: how many aberrant pathways can kill a neutrophil? Curr Opin Allergy Clin Immunol 2007;7(6):481494. 9. Dale DC, Link DC. The many causes of severe congenital neutropenia. N Engl J Med 2009;360(1):3-5. 10. Zeidler C, Germeshausen M, Klein C, Welte K. Clinical implications of ELA2-, HAX1-, and G-CSF-receptor (CSF3R) mutations in severe congenital neutropenia. Br J Haematol 2009;144(4):459-467. 11. Berliner N, Horwitz M, Loughran TP. Congenital and acquired neutropenia. Hematology [Am Soc Hematol Educ Program] 2004:63-79. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 Neutropenia congénita grave 12. Ferry C, Ouachee M, Leblanc T, Michel G, et al. Hematopoietic stem cell transplantation in severe congenital neutropenia: experience of the French SCN register. Bone Marrow Transplant 2005;35(1):45-50. 13. Dale DC, Bolyard AA, Schwinzer BG, Pracht G, et al. The Severe Chronic Neutropenia International Registry: 10-Year Follow-up Report. Support Canc Ther 2006;3(4):220-231. 14. Germeshausen M, Zeidler C, Stuhrmann M, Lanciotti M, et al. Digenic mutations in severe congenital neutropenia. Haematologica 2010;95(7):1207-1210. 15. Berliner N. Lessons from congenital neutropenia: 50 years of progress in understanding myelopoiesis. Blood 2008;111(12):5427-5432. 16. Stein SM, Dale DC. Molecular basis and therapy of disorders associated with chronic neutropenia. Curr Allergy Asthma Rep 2003;3(5):385-388. Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010 181 Normas para autores Los manuscritos deben elaborarse siguiendo las recomendaciones del Comité Internacional de Editores de Revistas Médicas (N Engl J Med 1997;336:309-15) y se ajustan a las siguientes normas: 1. El texto deberá entregarse impreso, por cuadruplicado, en hojas tamaño carta (21 × 27 cm), a doble espacio, acompañado del disquete con la cap­tura correspondiente e indicando en la etiqueta el título del artículo, el nombre del autor principal y el programa de cómputo con el número de versión. (Ejemplo: Estrógenos en el climaterio. Guillermo Martínez. Word 6.0). 2. Las secciones se ordenan de la siguiente manera: página del título, resumen estructurado, abstract, introducción, material y método, resultados, discusión, referencias, cuadros, pies de figuras. 3. La extensión máxima de los originales será de 15 hojas, de los casos clínicos 8 hojas y cuatro figuras o cuadros. Las revisiones no excede­rán de 15 hojas. En la primera página figurará el título completo del trabajo, sin superar los 85 caracteres, los nombres de los autores, servicios o departamentos e institución (es) a que pertenece (n) y la dirección del primer autor. Si todos los autores pertenecen a servicios diferentes pero a una misma institución el nombre de ésta se pondrá una sola vez y al final. La identificación de los autores deberá hacerse con uno hasta cuatro asteriscos (*,**,***,****); si son más autores utilice números en super­índice. 4. Para fines de identificación cada hoja del manuscrito deberá llevar, en el ángulo superior izquierdo, la inicial del nombre y el apellido paterno del primer autor y en el ángulo derecho el número progresivo de hojas. 5. Todo material gráfico deberá enviarse en diapositivas, en color o blanco y negro, nítidas y bien definidas. En el marco de cada diapositiva se anotará, con tinta, la palabra clave que identifique el trabajo, el número de la ilustración, apellido del primer autor y con una flecha se indicará cuál es la parte superior de la figura. Si la diapositiva incluyera material previamente publicado, deberá acompañarse de la autorización escrita del titular de los derechos de autor. 6. Las gráficas y dibujos deben elaborarse profe­sionalmente. Las ilustraciones (fotografías) deben entregarse en diapositivas o en un CD en formato TIF y con al menos 300 dpi de resolución (el material le será devuelto una vez que el artículo se publique). 7. Los cuadros (y no tablas) deberán numerarse con caracteres arábigos. Cada uno deberá tener un título breve; al pie del mismo se incluirán las notas explicativas que aclaren las abreviaturas poco conocidas. No se usarán líneas horizontales o verticales internas. Todos los cuadros deberán citarse en el texto. 8. Tipo de artículos: la revista publica artículos originales en el área de investigación clínica o de laboratorio, editoriales, artículos de revisión, biotecnología, comunicación de casos y cartas al editor. Se reciben artículos en los idiomas español e inglés. 9. Resumen. La segunda hoja incluirá el resumen, de no más de 250 palabras y deberá estar estructurado en antecedentes, material y método, resultados y conclusiones. Con esta estructura se deberán enunciar claramente los propósitos, procedimientos básicos, metodología, principales hallazgos (datos concretos y su relevancia estadística), así como las conclusiones más relevantes. Al final del resumen proporcionará de 3 a 10 palabras o frases clave. Enseguida se incluirá un resumen (abstract) en inglés. 10. Abstract. Es una traducción correcta del resumen al inglés. 11. Texto. Deberá contener introducción, material y métodos, resultados y discusión, si se tratara de un artículo experimental o de observación. Otro tipo de artículos, como comunicación de casos, artículos de revisión y editoriales no utilizarán este formato. a) Introducción. Exprese brevemente el propósito del artículo. Resuma el fundamento lógico del estudio u observación. Mencione las referencias estrictamente pertinentes, sin hacer una revisión extensa del tema. No incluya datos ni conclusiones del trabajo que está dando a conocer. b) Material y método. Describa claramente la forma de selección de los sujetos observados o que participaron en los experimentos (pacientes o animales de laboratorio, incluidos los testigos). Identifique los métodos, aparatos (nombre y dirección del fabricante entre paréntesis) y procedimientos con detalles suficientes para que otros investigadores puedan reproducir los resultados. Explique brevemente los métodos ya publicados pero que no son bien conocidos, describa los métodos nuevos o sustancialmente modificados, manifestando las razones por las cuales se usaron y evaluando sus limitaciones. Identifique exactamente todos los medicamentos y productos químicos utilizados, con nombres genéricos, dosis y vías de administración. c) Resultados. Preséntelos siguiendo una secuencia lógica. No repita en el texto los datos de los cuadros o figuras; sólo destaque o resuma las observaciones importantes. d) Discusión. Insista en los aspectos nuevos e importantes del estudio. No repita pormenores de los datos u otra información ya presentados en las secciones previas. Explique el significado de los resultados y sus limitaciones, incluidas sus consecuencias para la investigación futura. Establezca el nexo de las conclusiones con los objetivos del estudio y absténgase de hacer afirmaciones generales y extraer conclusiones que carezcan de respaldo. Proponga nueva hipótesis cuando haya justificación para ello. e) Referencias. Numere las referencias consecutivamente siguiendo el orden de aparición en el texto (identifique las referencias en el texto colocando los números en superíndice y sin paréntesis). Cuando la redacción del texto requiera puntuación, la referencia será anotada después de los signos pertinentes. Para referir el nombre de la revista utilizará las abreviaturas que aparecen enlistadas en el número de enero de cada año del Index Medicus. No debe utilizarse el término “comunicación personal”. Sí se permite, en cambio, la expresión “en prensa” cuando se trata de un texto ya aceptado por alguna revista, pero cuando la información provenga de textos enviados a una revista que no los haya aceptado aún, citarse como “observaciones no publicadas”. Se mencionarán todos los autores cuando éstos sean seis o menos, cuando sean más se añadirán las palabras y col. (en caso de autores nacionales) o et al.(si son extranjeros). Si el artículo referido se encuentra en un suplemento, agregará Suppl X entre el volumen y la página inicial. La cita bibliográfica se ordenará de la siguiente forma en caso de revista: Torres BG, García RE, Robles DG y col. Complicaciones tardías de la diabetes mellitus de origen pancreático. Rev Gastroenterol Mex 1992;57:226-9. Si se trata de libros o monografías se referirá de la siguiente forma: Hernández RF. Manual de anatomía. 2ª ed. México: Méndez Cervantes, 1991;pp:120-9. Si se tratara del capítulo de un libro se indicarán el o los autores del capítulo, nombre del mismo, ciudad de la casa editorial, editor del libro, año y páginas. 12. Transmisión de los derechos de autor. Se incluirá con el manuscrito una carta firmada por todos los autores, conteniendo el siguiente párrafo: “El/los abajo firmante/s transfiere/n todos los derechos de autor a la revista, que será propietaria de todo el material remitido para publicación”. Esta cesión tendrá validez sólo en el caso de que el trabajo sea publicado por la revista. No se podrá reproducir ningún material publicado en la revista sin autorización. 13. Se aconseja que en las referencias bibliográficas se incluyan citas de autores mexicanos o latinoamericanos. Revista Alergia México se reserva el derecho de realizar cambios o introducir modificaciones en el estudio en aras de una mejor comprensión del mismo, sin que ello derive en un cambio de su contenido. Los artículos y toda correspondencia relacionada con esta publicación pueden dirigirse al e-mail: [email protected] Revista Alergia México Volumen 57, Núm. 5, septiembre-octubre, 2010