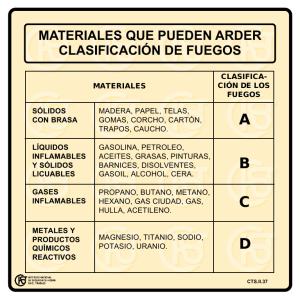
Documento a texto completo
Anuncio

REPÚBLICA BOLIVARIANA DE VENEZUELA UNIVERSIDAD RAFAEL URDANETA FACULTAD DE INGENIERÍA ESCUELA DE INGENIERÍA QUÍMICA S ADO V R E S E OS R DERECH VALIDACION EXPERIMENTAL DE LOS RIESGOS DE INFLAMABILIDAD DE MEZCLAS EXPLOSIVAS. TRABAJO ESPECIAL DE GRADO PARA OPTAR AL TÍTULO DE INGENIERO QUÍMICO PRESENTADO POR: BR. ARGÜELLO TORRES, KARINA ROSA C.I. 11.284.072 ASESORADO POR: ING. HUMBERTO MARTINEZ MARACAIBO, SEPTIEMBRE DE 2007 DEDICATORIA DEDICATORIA Le dedico a mi madre no solo este trabajo especial de grado sino todo lo que hago en mi vida porque ha hecho de mi la persona que hoy en día S soy, con su dedicación y devoción me ha enseñado que la verdadera ADO V R E S E OS R felicidad esta mucho mas cerca y es mucho mas simple de lo que creía. Por ERECH D en una familia unida. Por inculcarme que puedo llegar tan lejos como quiero. hacerme entender que ningún logro es más grande para mí que permanecer Por enseñarme que lo único que no me pueden quitar en la vida son mis estudios y conocimientos. v AGRADECIMIENTO AGRADECIMIENTOS Doy Gracias a Dios. A la persona mas importante en mi vida mi madre Edilia Torres; la luz que ilumina el camino que he recorrido desde que nací hasta el día de hoy, a S ADO V R E S E OS R quien debo todo su amor, oraciones, paciencia y sabiduría DERECH A mis hermanos: Roger, Ketty, Katty y Ronald que de una u otra manera han ayudado que esta meta en mi vida se cumpla. Mi profesor Humberto Martínez, por su participación en el trabajo de investigación ofreciéndome no solo su accesoria, si no también su amistad. Mi profesor Mauro Urdaneta, por haber participado y ayudado en la construcción del equipo, aportando su experiencia en el laboratorio. A mis amigas Heilyn, Yolimar y Joharlin por ayudarme y ser incondicionales conmigo Y a todas aquellas personas que han aportado su granito de arena. vi RESUMEN ARGUELLO TORRES, Karina Argüello C.I. 11.284.072 Validación experimental de los riesgos de inflamabilidad de mezclas explosivas. Trabajo Especial de Grado, Universidad Rafael Urdaneta, Facultad de Ingeniería, Escuela de Ingeniería Química. Maracaibo, Septiembre 2007. S ADO V R E S E R CHOS Resumen DERE El objetivo de validar experimentalmente los riesgos de inflamabilidad de las mezclas explosivas generadas por la vaporización de combustibles fósiles, es originado por la susceptibilidad de los materiales a quemarse los cuales se presentan dispersos tanto en la materia líquida o sólida como en el aire, por tal motivo, se definió las diferentes situaciones de riesgo de incendio desarrollando pruebas a escala en un banco de simulación para así diseñar una unidad experimental que permita implantar una metodología docente para la enseñanza de prevención de los riesgos asociados a la inflamabilidad de los vapores de combustible (gasolina). La metodología de investigación empleada de tipo descriptiva bajo la modalidad explicativa, ayudo a la técnica de colección, análisis y procesamiento de los datos, para así plantearse los resultados obtenidos de una manera cualitativa, debido, a la características de los materiales utilizados, cabe destacar que los recipientes contenedores de los líquidos son transparentes para poder visualizar mejor las simulaciones de riesgo Palabras claves: Simulación, combustible, riesgo, inflamabilidad, vapores, susceptibilidad. vii INDICE GENERAL ÍNDICE GENERAL Pág. DEDICATORIA…………………………………………………………………… v OS D A V R E AGRADECIMIENTOS…………………………………………………………… vi ES R S O H C DERE RESUMEN……………………………………………………………………….. vii ÍNDICE GENERAL………………………………………………………………. viii INTRODUCCIÓN.……………………………………………………………….. 1 CAPÍTULO I. EL PROBLEMA 1.1. PLANTEAMIENTO DEL PROBLEMA…………………………………….. 3 1.2. FORMULACIÓN DEL PROBLEMA………………………………………... 4 1.3. OBJETIVOS DE LA INVESTIGACIÓN……………………………………. 5 1.3.1. Objetivo General………………………………………………………… 5 1.3.2. Objetivos Específicos…………………………………………………... 5 1.4. JUSTIFICACIÓN DE LA INVESTIGACIÓN……………………………….. 6 1.5. DELIMITACIÓN DE LA INVESTIGACIÓN………………………………… 7 CAPÍTULO II. MARCO TEÓRICO 2.1. Antecedentes…………………………………………………………………. 9 viii INDICE GENERAL 2.2. Bases teóricas de la investigación………………………………………….10 2.2.1 Incendios y explosiones………..………………………………………...10 2.2.2. Situaciones de riesgo……………………………………………………11 2.2.2.1. Tipos de riesgos……………..………………………………………12 2.2.2.2. Riesgos de incendio…………………………………….…………. 12 OS D A V R E ES 2.2.3.4 Actos inseguros………………………………………………………14 R S O H C ERE 2.2.3.D Mezclas explosivas……………………………….…………….…….… 14 2.2.2.3 Condición Insegura……………………………………………..……13 2.2.3.1 Atmósfera explosiva…………………………….…………………….. 16 2.2.3.2. Atmósfera potencialmente explosiva……….………………………. 16 2.2.4. Límites de inflamabilidad………………………………………………. 16 2.2.4.1. Límite inferior de inflamabilidad o explosividad (L.I.I. o L.I.E.)... 19 2.2.4.2. Límite inferior de inflamabilidad de mezclas inflamables (Regla de Le Châtelier)…………………………………………………………20 2.2.4.3. Límite superior de inflamabilidad o explosividad (L.S.I. o L.S.E).21 2.2.5. Inflamabilidad……………………………………………………………. 22 2.2.6. Temperatura de inflamación o destello (Flash point, Point d'éclair)..24 2.2.7. Efecto de la presión sobre la temperatura de inflamación…………..26 2.2.8. Temperatura de autoignición o autoinflamación.……………………..26 2.2.9. Energía mínima de ignición (E.M.I.)……………………………………28 2.3. Liquido…………………………………………………………………………29 2.3.1. Líquidos inflamables……………………………………………………..30 2.3.1.1 Clasificación de los líquidos según su tipo de inflamación………30 2.3.1.2 Efecto de la temperatura y la presión sobre la peligrosidad de un líquido inflamable……………………………………………………..31 2.3.2. Líquidos combustibles…………………………………………………...35 2.3.2.1 Características más importantes de los líquidos combustibles....38 ix INDICE GENERAL 2.4. Prevención y extensión de incendio………………………………………..42 2.4.1. Método de la eliminación el incendio…………………………………..45 2.4.1.1. Enfriamiento…………………………………………………………45 2.4.1.2. Sofocamiento………………………………………………………..45 2.4.1.3. Eliminación…………………………………………………………..46 S 2.4.1.4. Inhibición de la reacción en cadena……………………………….46 ADO V R E S E OS R 2.5. UNIDADES EXPERIMENTALES DOCENTES…………………………...47 ERECH D 2.7. MAPA DE VARIABLES………………………………………………………52 2.6. TERMINOS BASICOS……………………………………………………….49 CAPÍTULO III. MARCO METODOLÓGICO 3.1. TIPO DE INVESTIGACIÓN……………………………….…………………54 3.2. DISEÑO DE INVESTIGACIÓN……………………………………………..55 3.3 POBLACION DE LA INVESTIGACION……………………………………..56 3.4. TÉCNICAS DE RECOLECCIÓN DE DATOS……………………………..56 3.5. FASES DE LA INVESTIGACIÓN…………………………………………...57 3.6. ANÁLISIS Y PROCESAMIENTO DE LOS DATOS………………………58 CAPÍTULO IV. ANÁLISIS DE LOS RESULTADOS 4.1. OBJETIVO I: DEFINIR SITUACIONES DE RIESGOS DE INCENDIO POR LA VAPORIZACION DE GASES INFLAMABLES……….………………60 4.2. OBEJTIVO II: DESARROLLAR PRUEBAS ESCALA BANCO PARA LA SIMULACION DE SITUACIONES DE RIESGO DE INCENDIO POR VAPORIZACION DE GASES INFLAMABLES DE COMBUSTIBLES FOSILES……………….…………………………………………………………...61 4.3. OBJETIVO III: DISEÑAR UNA UNIDAD EXPERIMENTAL DOCENTE PARA SIMULACIONES DE SITUACIONES DE RIESGOS DE INCENDIO x INDICE GENERAL POR VAPORIZACION DE GASES INFLAMABLES EN EL AMBIENTE……...………………………………………………………………….63 4.4. OBEJTIVO IV: IMPLANTAR LA UNIDAD EXPERIMENTAL DOCENTE DE SIMULACION DE SITUACIONES DE RIESGO POR VAPORIZACION DE GASES INFLAMABLES DE COMBUSTIBLES FOSILES PARA USO EN LAS OS D UNIVERSIDAD RAFAEL URDANETA. …………………………………………64 A V R E ES R S O H C DERE INSTALACIONES DE LA FACULTAD DE INGENIERIA DE LA CONCLUSIONES………………………………………..………………………..67 RECOMENDACIONES…………………………………………………………...69 BIBLIOGRAFÍA……………………………………………………………………72 ANEXOS……………………………………………………………………………74 xi INTRODUCCION INTRODUCCION En la actualidad existe una gran diversidad de riesgos de acuerdo con la susceptibilidad de los materiales a quemarse, debido que existen materiales que se vaporizan completa o rápidamente a la presión atmosférica S ADO V R E S E OS R y a las temperaturas ambientes normales, y que están bien dispersos en el DERECH aire; líquidos y sólidos que se pueden encender a las condiciones de temperatura ambiente. La Universidad Rafael Urdaneta no cuenta con un equipo a escala de laboratorio que demuestre experimentalmente los riesgos de inflamabilidad de mezclas explosivas (en este caso gasolina). Este trabajo tiene como principal objetivo validar experimentalmente los riesgos de inflamabilidad de mezclas explosivas generadas por la vaporización de combustibles fósiles, contribuyendo de esta manera en la formación académica de los estudiantes de Ingeniería Química. Dicho estudio está estructurado por cuatro capítulos: Capítulo I, el cual abarca el planteamiento y formulación del problema, el objetivo general y los objetivos específicos de la investigación, la justificación y la delimitación; el Capítulo II, en el cual se enfocan los estudios previos relevantes relacionados con el trabajo y la fundamentación teórica de los riesgos de inflamabilidad y mezclas explosivas generadas por vaporización de combustibles fósiles. El Capítulo III, el cual especifica los lineamientos metodológicos del trabajo como tipo, diseño y fases de la investigación, y técnicas de recolección, análisis y procesamiento de los datos; el Capítulo IV donde se plantea el análisis e interpretación se los resultados obtenidos en la investigación; y, finalmente, las Conclusiones pertinentes al caso. 1 y Recomendaciones CAPITULO I Capitulo I El problema 1.1. Planteamiento del Problema S ADO V R E S E OS R Muchos materiales que se quemarían bajo ciertas condiciones, no DERECH queman bajo otras. La forma o condición del material, como así también las propiedades inherentes afectan el riesgo. La cuantificación de los riesgos se efectuará de acuerdo con la susceptibilidad de los materiales a quemarse, debido que existen materiales que se vaporizan completa o rápidamente a la presión atmosférica y a las temperaturas ambientes normales, y que están bien dispersos en el aire; líquidos y sólidos que se pueden encender a las condiciones de temperatura ambiente. Estos materiales producen atmósferas riesgosas con el aire a cualquier temperatura, y si bien, no resultan afectadas por la temperatura ambiente, son igníferos bajo cualquier condición. El riesgo para la salud en la lucha contra el fuego u en otra condición de emergencia es mortal, de modo que una explosión simple puede durar desde unos pocos segundos hasta más de una hora. Además, es de esperar que el despliegue físico que demanda combatir un incendio y las condiciones de emergencia intensifiquen los efectos de cualquier exposición. Existen dos fuentes de riesgo para la salud, una tiene que ver con las propiedades inherentes del material y la otra con los productos de la combustión o de su descomposición. El grado de riesgo se asignará sobre la base del mayor peligro que pueda existir bajo el fuego o en otras situaciones de emergencia. 3 CAPITULO I No se incluyen los accidentes comunes derivados de los materiales combustibles. De manera particular, en la Universidad Rafael Urdaneta se considera necesaria la ejecución, por parte del alumnado, de prácticas de simulación S ADO V R E S E OS R del manejo de sustancias explosivas. Sin embargo, en el laboratorio son DERECH limitados los recursos didácticos que faciliten el aprendizaje de los alumnos, específicamente para el estudio de mezclas explosivas, éste no posee un equipo donde se puedan visualizar y apreciar las alteraciones que pueden presentarse con sustancias inflamables a la presión atmosférica y a las temperaturas ambiente normales y las situaciones de riesgos de incendio por vaporización de gases inflamables. 1.2. Formulación del problema Para la ejecución de prácticas de prevención y conocimiento de los factores de riesgos de incendio, un equipo de simulación de estas situaciones se convierte en una necesidad actual de la escuela de Ingeniería Química, como una forma de facilitar el aprendizaje práctico del alumno. El banco de pruebas a diseñar constituirá una unidad experimental docente que será implantada en los laboratorios de la facultad de Ingeniería de la Universidad Rafael Urdaneta. Para implementación de esta unidad será necesario realizar las siguientes actividades: Definir situaciones de riesgos de incendio que le pueden presentar por la vaporización de gases inflamables 4 desde combustibles fósiles CAPITULO I especialmente los que tengan un uso común en la industria y las actividades humana en genera. Desarrollar pruebas a escala banco para la simulación de situaciones de riesgos de incendio por vaporización de gases inflamables de OS D situaciones que se podrían presentar normalmente. A V R E ES R S O H C E unidad experimental docente para la simulación DERuna Diseñar combustibles fósiles. Estas pruebas deberían poder reproducir las de situaciones de riesgo de incendio por la vaporización de gases inflamables en el ambiente, que sea posible de movilizar por la universidad. Implantar la unidad experimental docente de simulación de situaciones de riesgo de incendio por vaporización de gases inflamables de combustible fósiles, para servicio de los profesores de la materia de seguridad industrial. 1.3. Objetivos 1.3.1. Objetivo General Validar experimentalmente los riesgos de inflamabilidad de mezclas explosivas generadas por la vaporización de combustibles fósiles. 1.3.2. Objetivos Específicos Definir situaciones de riesgo de incendio por la vaporización de gases inflamables. 5 CAPITULO I Desarrollar pruebas escala banco para la simulación de situaciones de riesgos de incendio por vaporización de gases inflamables de combustibles fósiles. Diseñar una unidad experimental docente para la simulación de situaciones de riesgo de incendio por la vaporización de gases S ADO V R E S E OS R inflamables en el ambiente DERECH Implantar la unidad experimental docente de simulación de situaciones de riesgo de incendio por vaporización de gases inflamables de combustible fósiles para uso en las instalaciones de la facultad de ingeniería de la URU. 1.4. Justificación e Importancia de la Investigación El presente estudio cuenta con relevancia científica, por cuanto aporta un modelo didáctico que permitirá visualizar experimentalmente la simulación de situaciones de riesgo de incendio por vaporización de gases inflamables de combustible fósiles, permitiendo resolver muchos problemas prácticos del ejercicio de la Ingeniería Química en conocer el área de combustión. Para la Universidad Rafael Urdaneta el modelo didáctico propuesto por este estudio representa una colaboración en sus esfuerzos por colocar a disposición del alumno todas las herramientas requeridas para un adecuado aprendizaje, proporcionando las condiciones óptimas para que pueda ser efectivo y significativo. 6 CAPITULO I En cuanto a los docentes de la Universidad Rafael Urdaneta responsables de la materia relacionada con la Seguridad Industrial y Ambiental, esta investigación representa un aporte, ya que podrá ser utilizado para demostrar experimentalmente las teorías que se desarrolla en clases S ADO V R E S E OS R En el aspecto económico se puede resaltar el ahorro que se genera ERECH D Universidad Rafael Urdaneta, en vista de que al realizar el proyecto la misma con la realización de este trabajo especial de grado enfocado a la no tendrá gastos referentes a los costos de adquisición que pudiera generar dicho banco de prueba. 1.5. Delimitaciones 1.5.1. Delimitación Espacial El presente trabajo de investigación se realizó en la Universidad Rafael Urdaneta específicamente en el área establecida para la realización de las prácticas de laboratorio, ubicada en la Ciudad de Maracaibo Estado Zulia. 1.5.2. Delimitación Temporal El estudio se elaboró en un período de seis meses consecutivos, a partir del mes de Marzo de del 2007 y el mes de Septiembre del 2007, tiempo en el cual se desarrollaron cada uno de los objetivos planteados. 7 CAPITULO II CAPITULO II MARCO TEORICO S ADO V R E S E OS R DERECH 2.1. Antecedentes de la investigación Esta investigación, tuvo como finalidad diseñar una unidad experimental escala banco para la simulación de situaciones de riesgo por la vaporización de gases inflamables en el ambiente Bomberos de Navarra, España (2005) este trabajo de investigación se tomó de un estudio realizado por estos bomberos y fue publicado en internet. Así como del Libro explosion and gaseous explosive por William A. Bone y Donald T. A. Downend (2004). De igual forma, de unas hojas técnicas publicada en internet por S&P. Saddawi (2003) publicó en Internet el Manual del Laboratorio de Ingeniería Química (Chemical Engineering Laboratory Manual), de la Universidad de Notre Dame. En éste se presentan diversos aspectos organizativos para el manejo de un laboratorio docente y un menú con los experimentos y prácticas de laboratorio que se realizan en el mismo. 9 CAPITULO II 2.2. Bases teóricas de la investigación 2.2.1. Incendios y explosiones S ADO V R E S E OS R Un incendio es una reacción química de oxidación - reducción ERECH D terminología de incendios, el reductor se denomina combustible y el oxidante, fuertemente exotérmica, siendo los reactivos el oxidante y el reductor. En comburente; las reacciones entre ambos se denominan combustiones. Para que un incendio se inicie es necesario que el combustible y el comburente se encuentren en espacio y tiempo en un estado energético suficiente para que se produzca la reacción entre ambos. La energía necesaria para que tenga lugar dicha reacción se denomina energía de activación; esta energía de activación es la aportada por los focos de ignición. La reacción de combustión es una reacción exotérmica. De la energía desprendida, parte es disipada en el ambiente produciendo los efectos térmicos del incendio y parte calienta a más reactivos; cuando esta energía es igual o superior a la necesaria, el proceso continúa mientras existan reactivos. Se dice entonces que hay reacción en cadena. Por lo tanto, para que un incendio se inicie tienen que coexistir tres factores: combustible, comburente y foco de ignición que conforman el conocido "triángulo del fuego"; y para que el incendio progrese, la energía desprendida en el proceso tiene que ser suficiente para que se produzca la 10 CAPITULO II reacción en cadena. Estos cuatro factores forman lo que se denomina el "tetraedro del fuego". Una explosión es la liberación en forma violenta de energía mecánica, química o nuclear, normalmente acompañada de altas temperaturas y de la liberación de gases. S ADO V R E S E OS R ERECH D produce. Las explosiones se pueden categorizar como deflagraciones si las Una explosión causa ondas expansivas en los alrededores donde se ondas son subsónicas y detonaciones si son supersónicas (ondas de choque). El efecto destructivo de una explosión es precisamente por la potencia de la deflagración que produce ondas de choque o diferencias de presión subyacentes de duración muy corta, extremadamente bruscas. 2.2.2. Situaciones de riesgo El riesgo se vincula habitualmente a la probabilidad de que ocurra un suceso no deseado. Generalmente la probabilidad de que ocurra dicho evento y algún asesoramiento sobre el daño que se espera de él deben ser unidos en un escenario creíble que combine el riesgo y las probabilidades de arrepentimiento y recompensa en un valor esperado. Hay muchos métodos informales que se usan para asesorar sobre el riesgo (o para "medirlo", aunque esto no suele ser posible) y otros formales. 11 CAPITULO II En el análisis de escenarios el "riesgo" es distante de lo que se llama "amenaza". Una amenaza es un evento grave pero de poca probabilidad pero cuya probabilidad puede no ser determinada por algunos analistas en un asesoramiento de riesgo porque nunca ha ocurrido, y para la cual ninguna medida preventiva está disponible. La diferencia está más claramente S ilustrada por el principio de precaución que busca disminuir la amenaza ADO V R E S E OS R reduciéndola a una serie de riesgos bien definidos antes de que un acción, DERECH proyecto, innovación o experimento sea llevado a cabo. 2.2.2.1Tipos de riesgos Los riesgos se pueden clasificar en: Riesgos Físicos Riesgos Químicos Riesgos Biológicos Riesgos Ergonómicos. Riesgos Psicosociales: Stress. 2.2.2.2Riesgos de incendio El Riesgo de Incendio está relacionado con cuatro Tipos de Fuego; 12 CAPITULO II A. Se inicia a partir de material con carbono: madera, papel, basura, tela, algunos plásticos, etc. B. Se suscita a partir de algunos líquidos y sólidos inflamables, que pueden ser solubles o insolubles en agua, tales como etanol (alcohol S corriente); metanol, gasolina, aguarrás y gases derivados del petróleo. ADO V R E S E OS R ERECH D combustión, sino la ignición. C. Lo genera la corriente eléctrica, siendo su mecanismo no la D. Producido por algunos metales (sodio, potasio, magnesio, etc.) al entrar en contacto con el agua bajo ciertas condiciones químicas y físicas. La mayor parte de los incendios se producen por fallas en instalaciones eléctricas y gas; combustión espontánea por exceso de basura o desorden; manejo inadecuado de líquidos inflamables; mantenimiento deficiente de tanques o cilindros de gas; riesgos externos, por descuidos o intencionalidad. 2.2.2.3 Condición Insegura Son aquellos factores físicos o circunstancias del medio ambiente de trabajo que pueden facilitar la ocurrencia de accidentes. Ejemplos de condiciones inseguras Falta de planificación Usar equipos de protección inadecuados Ausencia de guardas protectoras Exposición a atmósferas peligrosas 13 CAPITULO II Herramientas defectuosas Falta de orden y limpieza Iluminación inadecuada Superficies resbalosas, irregulares o con obstáculos. 2.2.3.4 Actos inseguros S ADO V R E S E OS R DERECH Son conductas por acción u omisión que conllevan a la violación de procedimientos, normas, reglamentos o prácticas seguras pre-establecidas. Algunos ejemplos de actos inseguros son: Comportamiento inadecuado Actuar sin autorización No usar equipo de protección personal Uso indebido de equipos y herramientas Desobedecer normas y/o procedimientos Exceso de confianza. 2.2.3. Mezclas explosivas Una mezcla explosiva es la mezcla de un comburente (producto oxidante) y de un combustible (producto oxidable) en proporciones tales que puedan dar lugar a una reacción de oxidación muy rápida y muy viva, liberando más energía de la que se disipa por conducción y convección. El comburente puede ser un gas (el oxígeno del aire), un liquido (peróxido) o un 14 CAPITULO II sólido (clorato, nitrato.). El combustible puede ser un gas (hidrógeno, vapores de gasolina etc.), un liquido (disolvente) o un sólido (azufre, madera, etc.). Todas las materias orgánicas son combustibles. En una atmósfera explosiva el comburente esta constituido por el aire o S una atmósfera enriquecida o empobrecida en oxígeno. El combustible puede ser: ADO V R E S E OS R ERECH D Gaseoso: la mezcla de aire y de gas es homogénea. Líquido: la mezcla es heterogénea y el liquido se dispersa en forma de góticas más o menos finas. Sólido: este se divide en partículas más o menos finas (humos, polvos, aserrín en suspensión en el aire. Tipo de productos que pueden producir una explosión: Gas de calefacción Hidrocarburos Disolventes de cola y de adhesivos Disolventes y diluyentes para pinturas Barnices y resinas Aditivos de fabricación de productos farmacéuticos, de colorantes, de aromas y de perfumes artificiales Agentes de fabricación de materias plásticas, cauchos, textiles artificiales y productos químicos de mantenimiento Elementos de tratamiento y de fabricación de alcoholes y derivados 15 CAPITULO II Esta lista no se limita a las formas líquidas o gaseosas. Es preciso no perder de vista que ciertos productos, utilizados en forma de polvo, pueden ser en ciertas condiciones agentes activos de una explosión. Son los polvos de: Aluminio, azufre, celulosa, almidón de trigo, resinas epóxidos, poli estireno, carbón, madera, trigo, leche, azúcar S ADO V R E S E OS R ERECH D 2.2.3.1 Atmósfera explosiva Es toda mezcla de aire en condiciones atmosférica, de sustancias inflamables en forma de gas, vapor, niebla o polvo en las que tras una ignición, la combustión se propaga a la totalidad de la mezcla no quemada. 2.2.3.2. Atmósfera potencialmente explosiva Se le llama así cuando el riesgo solo existe en estado potencial esto es que la atmósfera pueda derivar a explosiva debido a condiciones locales y de funcionamiento. 2.2.4. Límites de inflamabilidad Definen las concentraciones mínimas y máximas del vapor o gas en mezcla con el aire, en las que son inflamables. Establece la proporción de 16 CAPITULO II gas y aire necesario para que se produzca la combustión, Se expresan en tanto por ciento en el volumen de mezcla vapor de combustible-aire. Reciben también el nombre de límites de explosividad, ya que según las condiciones de confinamiento, cantidad, intensidad de la fuente de ignición, etc. varía la velocidad de la combustión y es común que se origine una explosión. Aunque S ambos términos son intercambiables para vapores y gases inflamables, es ADO V R E S E OS R más usual el de límites de inflamabilidad para estos dos y el de límites de DERECH explosividad para polvos combustibles. Los valores del límite inferior y superior de inflamabilidad nos delimitan el llamado Rango o Campo de Inflamabilidad o Explosividad. Los gases más inflamables son el H2 y el C2H2 (acetileno). Si se quiere determinar los límites de inflamabilidad de una mezcla gaseosa, se puede utilizar la siguiente ecuación: L= 1 Xi ∑ i =1 Li n Siendo: X i La fracción molar del componente i 17 CAPITULO II Li El límite de inflamabilidad de dicho componente. En la Tabla 1. Se muestran los límites inferiores y superiores de distintos gases combustibles. Por ejemplo, una mezcla de NH3 y aire es inflamable si contiene un porcentaje de NH3 comprendido entre 15.5 y 27% S ADO V R E S E OS R V/V. ERECH DGases Límites de inflamabilidad Fórmula (nombre) Inferior (% vol/ vol) H2 4.0 75.0 CH4 5.0 15.0 C2H6 3.2 12.45 C3H 8 2.4 9.5 i C4H10 1.8 8.4 n C4H10 1.9 8.4 CH12 (Pentano) 1.4 7.8 CH14 (Hexano) 1.25 6.9 C7H16 (Heptano) 1.0 6.0 C2H4 (Etileno) 3.05 28.6 C3H6 (Propileno) 2.0 11.1 C4H6 (Butadieno) 2.0 11.5 C2H2 (Acetileno) 2.5 81.0 C6H6 (Benceno) 1.4 6.75 CO 12.5 74.2 NH3 15.5 27.0 SH2 4.3 45.5 Superior (% vol/ vol) Tabla 1 Límites de inflamabilidad de sustancias gaseosas. 18 CAPITULO II 2.2.4.1. Límite inferior de inflamabilidad o explosividad (L.I.I. o L.I.E.) Se define como la concentración mínima de vapor o gas en mezcla con el aire, por debajo de la cual, no existe propagación de la llama al ponerse en S contacto con una fuente de ignición. Por ejemplo el límite inferior de ADO V R E S E OS R inflamabilidad del vapor de acetona en el aire es aproximadamente 2,6% en ERECH D combustible-aire hay 2,6 % de vapor de acetona y 100 - 2,6 = 97,4 % de aire. volumen. Esto significa que en 100 volúmenes de mezcla vapor de El límite inferior de inflamabilidad está relacionado con el punto de inflamación, de forma que este último se puede definir también como la temperatura mínima a la que la presión del vapor del líquido puede producir una mezcla inflamable en el límite inferior de inflamabilidad. En otras palabras, la temperatura mínima a la que se puede producir una concentración inflamable. La relación entre estos parámetros para la acetona y el alcohol etílico, se ve claramente en la figura 1. Se ha observado que al aumentar las masas moleculares, los límites interiores de inflamabilidad decrecen. Basándose en la masa, los límites inferiores de inflamabilidad de los hidrocarburos están aproximadamente a 45 mg por litro de aire en las condiciones normales de 0 ºC y 1 atm (101,325 KPa). Otros compuestos orgánicos como los alcoholes y otros que contengan oxígeno dan valores superiores, como en el caso del alcohol etílico (etanol C2H5OH) que necesita 70 mg por litro de aire. EI hidrógeno tiene un valor muy inferior y otras sustancias de baja masa molecular tienen valores ligeramente inferiores. 19 CAPITULO II Una consecuencia de lo anterior es que los caudales de ventilación para reducir las concentraciones de masas iguales de hidrocarburos distintos, a unos porcentajes determinados de los límites inferiores de inflamabilidad son aproximadamente iguales. Fig. 1: Relación entre el punto de inflamación, límites de inflamabilidad, temperatura y tensión (presión) de vapor de S ADO V R E S E OS R la acetona y del alcohol etílico. Resultados obtenidos en recipiente cerrado a presión atmosférica normal en DERECH equilibrio de fase líquida y sus vapores con el aire. 2.2.4.2. Límite inferior de inflamabilidad de mezclas inflamables (Regla de Le Châtelier) Para calcular el límite inferior de inflamabilidad de mezclas de vapores o gases inflamables se puede aplicar la regla de Le Chatelier: 20 CAPITULO II L.I.I. (mezcla) = 100 % / [(C1/L.I.I.1) + (C2/L.I.I.2) + ....+ (Cn /L.I.I.n )] Siendo: C1, C2, ..., Cn = concentración de cada combustible respecto al total de combustibles en porcentaje de volumen. S ADO V R E S E OS R DERECH Cumpliéndose C1 + C2 + ....+ Cn = 100 L.I.I.1, L.I.I.2, ..., L.I.In L.I.I.n = Límite inferior de inflamabilidad de cada combustible % v/v Esta regla es aplicable para mezclas de vapores o gases de compuestos similares. Así entre otras mezclas, funciona bien para calcular los límites inferiores de inflamabilidad de mezclas de disolventes, conteniendo metil etil cetona y tetrahidrofurano. Sin embargo, la regla no se cumple particularmente bien para los límites inferiores de inflamabilidad de algunas mezclas de sulfuro de hidrógeno (H2S) y disulfuro de carbono (CS2). Por lo tanto, la regla de Le Châtelier se debe aplicar con discreción, especialmente para compuestos de estructura química distinta. 2.2.4.3. Límite superior de inflamabilidad o explosividad (L.S.I. o L.S.E.) Se define como la concentración máxima de vapor o gas en aire, por encima de la cual, no tiene lugar la propagación de la llama, al entrar en contacto con una fuente de ignición. 21 CAPITULO II La prevención de explosiones se puede conseguir operando fuera del rango de inflamabilidad en procesos con aire. Sin embargo, son más seguros los procesos que se desarrollan por debajo del limite inferior de inflamabilidad, adoptando un factor de seguridad 4 ó 5 que equivale a estar en el 25 ó 20% del L.I.I., que los que se desarrollan por encima del límite S superior de inflamabilidad, ya que en caso de fuga, pérdida o disminución de ADO V R E S E OS R combustible podría aumentar el contenido de aire y se situarían dentro del ERECH D interviene el aire y el espacio de vapor está ocupado al cien por cien por campo de inflamabilidad. Otro caso distinto son los procesos en que no vapores o gases combustibles. A pesar de todo, por encima del límite superior de inflamabilidad pueden aparecer llamas frías, las cuales resultan de una reacción relativamente lenta y apenas visible. Son debidas a la descomposición de hidroperóxidos, los cuales se han formado por oxidación a baja temperatura. Las llamas frías no están asociadas normalmente con fuentes de ignición breves como las chispas. 2.2.5. Inflamabilidad La Inflamabilidad es la medida de la facilidad que presenta un gas, líquido o sólido para encenderse y de la rapidez con que, una vez encendido, se diseminarán sus llamas. Cuanto más rápida sea la ignición, más inflamable será el material. Los líquidos inflamables no lo son por si mismos, sino que lo son debido a que su vapor es combustible. 22 CAPITULO II Hay dos propiedades físicas de los materiales que indican su inflamabilidad: el punto de inflamación y la volatilidad (determinada por el punto de ebullición). El punto de inflamación de un material es la temperatura a la cual un S líquido (o sólido volátil) desprende vapor, en cantidades suficientemente ADO V R E S E OS R significativas, para formar una mezcla que puede encenderse en contacto DERECH con el aire. Cuando existe una fuente externa de ignición (como por ejemplo, chispas eléctricas, llamas) un material se puede encender a temperatura igual o superior a su punto de inflamación. La volatilidad de un material es un indicativo de la facilidad con que un líquido o sólido pasa al estado de vapor. La volatilidad se mide mediante el punto de ebullición del material (temperatura a la cual la presión de vapor del material es igual a la presión atmosférica). El término "volatilidad" se confunde con frecuencia y se utiliza como sinónimo de "inflamabilidad". Existen algunos materiales que son volátiles pero en cambio no son inflamables, como el agua, cloroformo y mercurio. Algunos materiales son pirofóricos, es decir, que pueden arder espontáneamente sin necesidad de que haya una fuente de ignición exterior. 23 CAPITULO II Por ejemplo, el sodio metálico puede reaccionar con la humedad del aire. Esta reacción produce hidrógeno gas y el calor generado por la reacción puede ser suficiente para hacer arder el hidrógeno con el oxígeno del aire. Entre los reactivos químicos comúnmente utilizados, que son S inflamables, se encuentran: hidrógeno, acetona, litio, acetileno, éter etílico, sodio, etanol, potasio. ADO V R E S E OS R DERECH 2.2.6. Temperatura de inflamación o destello (Flash point, Point d'éclair) Es la temperatura mínima a la cual un líquido inflamable desprende suficiente vapor para formar una mezcla inflamable con el aire que rodea la superficie del líquido o en el interior del recipiente empleado. En los ensayos para determinar ese punto se suele emplear una pequeña llama como foco de ignición. El líquido se calienta lentamente desde una temperatura supuestamente inferior y a incrementos crecientes de temperatura se aplica una llama de prueba a la cámara de vapor. El punto de inflamación es la temperatura a la cual se observa un destello (flash) al aplicarse la llama o fuente de ignición. Los ensayos están normalizados en vaso cerrado y en vaso abierto. Los de vaso cerrado pueden hervir como referencia de peligro para aquellos procesos realizados dentro de recipientes y los de vaso abierto para operaciones de manipulación, trasvases con recipientes abiertos, derrames, etc. La temperatura de inflamación en vaso abierto es un poco superior a la de vaso cerrado. La temperatura de inflamación o destello de un líquido inflamable o combustible se suele encontrar en manuales especializados 24 CAPITULO II sobre incendios o explosiones o sobre características de peligrosidad de productos. En caso de no disponer de la temperatura de inflamación ti de hidrocarburos en vaso cerrado, se puede estimar de forma orientativa a partir del punto de ebullición te mediante la siguiente fórmula: DERECH ti = 0,683 te -71,7 S ADO V R E S E OS R siendo: ti = temperatura de inflamación, º C te = temperatura de ebullición inicial, º C La temperatura de inflamación o destello de un líquido inflamable es una propiedad fundamental en relación con el peligro de incendio y explosión. Si la temperatura de un líquido está por debajo de su punto de inflamación, no puede existir suficiente concentración de vapor inflamable para que pueda ocurrir la ignición. Sin embargo debe observarse que en el caso de formarse nieblas de líquidos inflamables, pueden inflamarse al entrar en contacto con una fuente de ignición, por debajo de su punto de inflamación. Estas nieblas se pueden originar por enfriamiento de vapores o por medios mecánicos como en pulverizaciones o rociados. Se conoce un caso de accidente con lesiones de quemaduras, al encender un cigarrillo mientras se realizaba una operación de rociado de herbicida mediante una bomba de pulverización en una mañana fría de invierno. A pesar de que la 25 CAPITULO II temperatura ambiente era inferior al punto de inflamación del líquido, la llama de la cerilla generó la suficiente energía calorífica para crear una mezcla inflamable de vapor a partir de las minúsculas gotículas de la niebla pulverizada. Lo mismo puede ocurrir con espumas aunque estén por debajo de su punto de inflamación. S ADO V R E S E OS R DERECH 2.2.7. Efecto de la presión sobre la temperatura de inflamación Los valores de las temperaturas de inflamación, normalmente están determinados a nivel del mar y la variación de la presión atmosférica tiene influencia sobre los mismos. Un aumento de presión eleva el punto de inflamación y una disminución de la presión lo reduce. Esta segunda situación debe tenerse más en cuenta, ya que en zonas de mayor altitud, la concentración inflamable se alcanza con más facilidad. 2.2.8. Temperatura de autoignición o autoinflamación Es la temperatura mínima, a presión de una atmósfera, a la que una sustancia en contacto con el aire, arde espontáneamente sin necesidad de una fuente de ignición. A esta temperatura se alcanza la energía de activación suficiente para que se inicie la reacción de combustión. Este parámetro recibe también el nombre de temperatura o punto de autoencendido, temperatura de ignición espontánea o autógena y hasta puede aparecer solamente como temperatura de ignición. Es conveniente asegurarse la no-confusión con la temperatura de inflamación o destello, 26 CAPITULO II especialmente si no se dispone de ambos valores determinados por ensayo ó por tablas. En caso de no disponer de ellos se observará que la temperatura de autoignición tiene unos valores muy superiores a la de inflamación y para una mayoría de compuestos se encuentra entre 200 y 700 ºC. Este parámetro nos sirve de referencia para operaciones sin fuente S puntual de ignición pero con una elevación importante de la temperatura, ADO V R E S E OS R tales como tratamientos térmicos, intercambiadores de calor con aceites DERECH térmicos, motores eléctricos protegidos, etc. La temperatura de autoignición de hidrocarburos en aire disminuye al aumentar su masa molecular. Así por ejemplo: Metano ..........................................537 ºC n-butano........................................405 ºC n-decano.......................................208 ºC La temperatura de autoignición de hidrocarburos en aire disminuye al aumentar el tamaño del recipiente. Temperatura de autoignición del tolueno 580 ºC en recipiente de 0,05I. Idem del tolueno 480 ºC en recipiente de 15I. Idem del metanol 475 ºC en recipiente de 0,05I. Idem del metanol 375 ºC en recipiente de15l. 27 CAPITULO II La temperatura de autoignición puede disminuir sustancialmente ante la presencia de catalizadores como polvo de óxido de hierro, ante atmósferas ricas en oxígeno y ante presiones elevadas. 2.2.9. Energía mínima de ignición (E.M.I.) S ADO V R E S E OS R ERECH D Este parámetro indica la energía mínima necesaria para iniciar la combustión de una mezcla inflamable. Depende de la concentración del combustible en el aire. Los valores más bajos de la energía mínima de ignición se dan en las proximidades de la concentración estequiométrica y giran alrededor de 0,25 mJ a la presión del nivel del mar (1 atm). Algunos son inferiores como el del hidrógeno con un valor de 0,017 mJ. La concentración de oxígeno y la presión afectan a la energía mínima de ignici6n de mezclas de vapores o gases combustibles. El aumento de O2 reduce drásticamente la E.M.I. A la presión de 1 atmósfera (101,325 kPa) la menor E.M.I. de 0,26 mJ en aire, se reduce 0,002 mJ en oxígeno. AI disminuir la presión aumenta la E.M.I., en una proporción tal que reduciendo la presión a la mitad, la E.M.I. aumenta cinco veces. A efectos comparativos, una persona con una capacidad eléctrica de 200 pF (200 x10 -12 F) y cargada con electricidad estática a una tensión de 15 kV podrá originar una chispa con una energía igual a: 28 CAPITULO II CV2 /2 = (200x10 –12 )·x150002 /2 = 0,0225 J = 22,5 mJ. Como se observa, esta energía es más que suficiente para la ignición de una mezcla de vapores o gases inflamables con aire. De ahí la importancia de las S medidas adoptadas para evitar la generación de cargas electrostáticas en las ADO V R E S E OS R personas que trabajan en ambientes con líquidos y gases inflamables. La ERECH D transporte, trasvase, agitación, etc. de muchos líquidos inflamables. generación de cargas electrostáticas como es sabido, también ocurre en el 2.3. Liquido El líquido es uno de los cuatro estados de la materia, un líquido es un fluido cuyo volumen es constante en condiciones de temperatura y presión constante y su forma es definida por su contenedor. Los líquidos no arden, los que lo hacen son los vapores que se desprenden de ellos. Tales vapores son, por lo general, más pesados que el aire, y pueden entrar en ignición a considerable distancia de la fuente de emisión. Los parámetros de peligrosidad de los productos combustibles e inflamables afectan a una gran diversidad de procesos industriales y a operaciones de transporte y almacenamiento, comunes a todos ellos. A efectos de peligrosidad se suele distinguir entre líquido combustible e inflamable, basándose en el concepto de punto de inflamación o destello. 29 CAPITULO II 2.3.1. Líquidos inflamables Son líquidos con un punto de ignición menor del 105ºC. y una presión de gas no mayor de 40 libras por pulgadas cuadrada (Absoluta). S ADO V R E S E OS R La variedad de líquidos inflamables utilizados actualmente en distintas ERECH D aceites no arden a temperaturas ordinarias pero cuando se los calienta, actividades es muy grande. Los combustibles líquidos más pesados como los desprenden vapores que, en forma progresiva, favorecen la posibilidad de la combustión, cuya concreción se logra a una temperatura suficientemente alta. 2.3.1.1 Clasificación de los líquidos según su tipo de inflamación. Los líquidos inflamables se dividirán en tres grupos o clases, según el punto de ignición, así: CLASE I. Incluye aquellos productos inflamables cuyo punto de ignición no sea menor de 40ºC o mayor de 11ºC, tales como: Acetona, Senzol, Colodión, Eter, Gasolina, Parafina, Metil Acetato, Bisulfuro de Carbono, Cemento líquido o en pasta y todos los acetatos. CLASE II. Incluye aquellos productos inflamables cuyo punto de ignición esté sobre 7ºC y menor de 24ºC tales como Acetato de Amilo (grado comercial), Acetato de tilo, alcohol, Tolueno, (Toluol), Piridina, Disolvente, Thinner. 30 CAPITULO II CLASE III. Inclusive aquellos líquidos cuyo punto de ignición sea mayor de 24ºC sin exceder de 105ºC, tales como Kerosene, Aceite Combustible y Lubricante, Aceite Crudo, Solvente, Trementina (tupertina), Pintura, Laca Aguarrás, Alcohol Amílico. S ADO V R E S E OS R 2.3.1.2 Efecto de la temperatura y la presión sobre la peligrosidad de un DERECH líquido inflamable Tal como se ha visto existe relación entre el punto de inflamación y el límite inferior de inflamabilidad, de forma que combinando el efecto de la temperatura y la presión se tiene un gráfico como el de la figura 2 que nos da la variación del límite inferior de inflamabilidad según la temperatura y la presión. Este gráfico es aplicable únicamente a líquidos o gases inflamables en equilibrio y en el interior de un recipiente cerrado. Para interpretar el gráfico se puede tomar la línea del alcohol etílico (etanol) y observar que el punto de corte con la línea horizontal de 760 mmHg (1 atm) se da aproximadamente a unos 10 ºC que indica la temperatura de inflamación a la presión atmosférica. Las mezclas de vapor y aire serán demasiado pobres para entrar en ignición a temperaturas inferiores y a presiones superiores a los valores indicados por la línea correspondiente para cada producto. Así por ejemplo, el alcohol etílico a 5 ºC y 760 mmHg o a 20 ºC y 2000 mmHg no daría suficientes vapores para alcanzar el límite inferior de inflamabilidad. Las condiciones representadas por puntos a la izquierda y por encima de las respectivas líneas son por lo tanto no inflamables. 31 CAPITULO II S ADO V R E S E OS R DERECH Fig. 2: Variación del límite inferior de inflamabilidad según la temperatura y la presión. De forma similar en la figura 3 se representa el gráfico de la variación del límite superior de inflamabilidad según la temperatura y la presión. 32 CAPITULO II S ADO V R E S E OS R DERECH Fig. 3: Variación del límite superior de inflamabilidad según la temperatura y la presión. 33 CAPITULO II Igualmente este gráfico es aplicable solamente a los líquidos o gases inflamables en equilibrio en el interior de un recipiente cerrado. Las mezclas de vapor y aire son demasiado ricas para inflamarse a temperaturas más altas o presiones más bajas que los valores indicados por las líneas correspondientes a cada producto. Así por ejemplo, para el mismo alcohol S etílico considerado anteriormente a una presión absoluta de 1 atm (760 mm), ADO V R E S E OS R el límite superior de inflamabilidad corresponde aproximadamente a 42 - 43 ERECH D concentración máxima de inflamabilidad (límite superior de inflamabilidad). ºC. Como se ve, el gráfico indica la temperatura y la presión a que ocurre la Al aplicar estos gráficos debe tenerse en cuenta que representan condiciones de equilibrio y que los valores existentes en una fase del proceso o manipulación pueden ser diferentes antes de que se alcance el equilibrio. Por ejemplo, al introducir un liquido a una temperatura inferior a la que está el recipiente receptor a presión con aire, se puede creer que la mezcla vaporaire resultante estará a una concentración mayor que el límite superior de inflamabilidad de acuerdo con el gráfico, lo cual no ocurrirá hasta que pase cierto tiempo y se haya producido suficiente evaporación para alcanzar el punto de equilibrio. Mientras tanto, esta mezcla puede ser inflamable o explosiva. También debe recordarse que la presión que se origina en el interior de un recipiente depende de la presión inicial de la mezcla vapor-aire. A mayor presión inicial, se tiene mayor presión de explosión final y viceversa. Los gráficos anteriores son útiles para tratar de situar un proceso en la zona de condiciones no inflamables, en el campo de variación de temperaturas indicado. 34 CAPITULO II 2.3.2. Líquidos combustibles Aunque combustible es cualquier substancia que pueda arder, habitualmente se reserva esta denominación para aquellos materiales que son quemados para producir energía calorífica. S ADO V R E S E OS R ERECH D de 60.5°C (141°F) y menor a 93°C (200°F). El líquido combustible es un líquido cuyo punto de inflamación es mayor Entre los líquidos combustibles mas comunes podemos encontrar: gasolina, gasóleo, petróleo industrial (queroseno), fueil-oil, alcoholes. Alcoholes. En los últimos años se ha trabajado en el desarrollo de motores aptos para funcionar con metanol o etanol, productos obtenidos a partir de madera y cana de azúcar. En Brasil se ha llegado a comercializar un combustible liquido compuesto de etanol y gasolina. Petróleo bruto natural. Es un líquido viscoso y oscuro que se encuentra en el subsuelo, algunas veces a gran profundidad, de donde se extrae por medio de perforaciones. La producción mundial de petróleo puede llegar a 3 000 millones de Tm al año, de las cuales la mitad se produce en la zona de Oriente Medio y el resto, en orden decreciente, en URSS, EEUU, África, Amé rica del Sur, etc. El comercio internacional del petróleo utiliza como unidad el barril, que equivale a 159 litros. El petróleo crudo se somete a una destilación fraccionada o por etapas, que consiste en calentarlo a distintas temperaturas en orden creciente, con lo cual se consigue que se desprendan primero los vapores de los productos 35 CAPITULO II más volátiles. La gasolina, hasta 180 ºC; hasta 280 ºC se desprende el queroseno o petróleo industrial; el gasóleo a los 350 OC los aceites de engrase y el fuel-oil se obtienen utilizando temperaturas más elevadas y, por último, queda el alquitrán como subproducto final. S Como el porcentaje de gasolina que se obtiene de la destilación del ADO V R E S E OS R petróleo es relativamente pequeño, dado el gran consumo actual, en las ERECH D método llamado «crackingx., que los transforma en gasolina. refinerías se reprocesan los otros productos más densos mediante un Estos combustibles hidrocarburos de derivados moléculas del complejas petróleo que al son arder mezclas se de combinan químicamente con el oxigeno del aire desprendiendo energía calorífica, dióxido de carbono, vapor de agua y, en menor cantidad, otros gases que dependen de los aditivos del combustible y de las condiciones de su combustión. Los combustibles derivados del petróleo ocupan el primer lugar entre los que se emplean para la industria, el transporte y la calefacción. Gasolina. Es un combustible liquido, de densidad 0,75 y de potencia calorífica 32 000 Kcal/l, muy volátil. A la temperatura ordinaria ya emite vapores que forman mezclas explosivas con el aire, por lo que se prohibe a los automovilistas repostar con el motor en marcha, mantener las luces encendidas, fumar, etc. Se comercializan distintos tipos de gasolina: normal, de 91 octanos, y super, de 97 octanos. El llamado índice de octanos indica fundamentalmente su diferente capacidad para resistir las altas presiones y temperaturas, dentro 36 CAPITULO II del cilindro del motor, sin que se produzca detonación, es decir, autoencendido con anticipación al encendido por la chispa de la bujía. Por eso la gasolina normal es la adecuada para los motores de media compresión y para los que están algo desgastados por el uso, mientras que la gasolina super se emplea para los de alta compresión y prestaciones. S ADO V R E S E OS R Para mejorar su capacidad antidetonante y hacerlas menos corrosivas, ERECH D contaminante de la atmósfera, se está sustituyendo por otros más inocuos. las gasolinas contienen aditivos como el tetraetilo de plomo que, por ser Por esta razón ya se está comercializando otro tipo de gasolina, llamada sin plomo. Queroseno o petróleo industrial. Es un líquido transparente, algo más denso que la gasolina y menos inflamable, que se utiliza como combustible en los motores a reacción y de turbina de gas. Se utiliza también como disolvente y para calefacción doméstica. Gasóleo. Es un líquido de aspecto algo aceitoso, de densidad 0,85 y potencia calorífica de 42 000 Kcal/kg. Su principal aplicación es como combustible de los motores diesel gracias a su propiedad de inflamarse cuando se le somete a elevadas presiones y temperaturas. En la actualidad este combustible resulta más económico que las gasolinas y por eso se utiliza para motores medianos y grandes de coches, camiones, tractores y buques. Fuel-oil. Es un líquido espeso y oscuro que se utiliza para los hornos industriales y ara calefacción. Como su temperatura de inflamación es elevada es difícil mantener su combustión, por lo cual es necesario calentarlo 37 CAPITULO II previamente, y con frecuencia puede resultar contaminante debido al humo que desprende cuando las condiciones de su combustión no son las adecuadas. Es el combustible liquido más económico. La industria petroquímica extrae del petróleo una gama muy amplia de S productos: combustibles, disolventes, plásticos, abonos y otros productos ADO V R E S E OS R semielaborados que se utilizan como materia prima para la obtención de otros. DERECH Los combustibles tienen una importancia fundamental en el mundo actual y dan un gran poder económico a los países que los poseen. 2.3.2.1 Características más importantes de los líquidos combustibles Como derivados que son del petróleo crudo, los líquidos combustibles están formados básicamente por compuestos hidrocarbonados. Pueden contener, además, O2, S, N,.. Las principales características que identifican a un combustible líquido serán: Poder Calorífico: Es el calor de combustión. Energía liberada cuando se somete el combustible a un proceso de oxidación rápido, de manera que el combustible se oxida totalmente y que desprende una gran cantidad de calor que es aprovechable a nivel industrial. 38 CAPITULO II Se tratará de evaluar el rendimiento del combustible en una instalación industrial. Densidad específica o relativa: Fue la primera que se utilizó para catalogar los líquidos combustibles. Los combustibles se comercializan en S volumen, por ello es importante saber la densidad que tienen a temperatura ADO V R E S E OS R ambiente. ERECH D Se define la densidad específica como: γ λ Densidad específica o relativa = Donde: γ : Densidad absoluta de un producto (a una temperatura) λ : Densidad del agua líquida (a 4°C) La escala más comúnmente utiliza es la escala en grados API (a 15ºC) API definió sus densímetros perfectamente, estableciendo sus características y dimensiones en las especificaciones. Las densidades específicas o relativas de los combustibles líquidos varían, pero los más ligeros serán los que tengan menor contenido en átomos de carbono. De este modo, las gasolinas serán las que tengan menor densidad específica, mientras que los fuel-óleos serán los que mayor densidad específica tengan. Esto se comprueba con los siguientes datos: Gasolinas: 0,60/0,70 Gasóleos: 0,825/ 0,860 Fuelóleos: 0,92/1 39 CAPITULO II Es importante conocer la densidad específica y la temperatura a la que se midió, porque los líquidos combustibles, como ya dijimos, se comercializan midiendo su volumen, el cual va a variar con la temperatura. S Hay ecuaciones que correlacionan la variación de densidad con la ADO V R E S E OS R variación de la temperatura (tablas ASTM) ERECH D Viscosidad: Mide la resistencia interna que presenta un fluido al desplazamiento de sus moléculas. Esta resistencia viene del rozamiento de unas moléculas con otras. Puede ser absoluta o dinámica, o bien relativa o cinemática. La fluidez es la inversa de la viscosidad. Por ello la medida de la viscosidad es importante porque nos va a dar una idea de la fluidez del combustible; permite apreciar la posibilidad del bombeo de un producto en una canalización y de este modo nos permite saber si podemos tener un suministro regular. La viscosidad es muy importante en el caso de los fueloils, ya que éstos se clasifican siguiendo criterios de viscosidad a una determinada temperaturas. La unidad de la viscosidad es el Poise: g.cm-1.s-1 La viscosidad cinemática se define como: Viscosidad cinemática = α β Donde: α : Viscosidad dinámica 40 CAPITULO II β : Densidad a la misma temperatura La viscosidad relativa se define como: Viscosidad relativa = φ υ Donde: φ : Viscosidad Absoluta S ADO V R E S E OS R υ : Viscosidad agua a 20°C (1 Poise) DERECH Para medir la viscosidad en combustibles líquidos se emplean viscosímetro de vidrio. Es muy importante decir la temperatura a la cual se ha evaluado la densidad. Existen diversas escalas para expresar la viscosidad de un producto petrolífero y existen también ecuaciones de correlación entre ellas. El hecho de que un combustible (o un líquido en general) tenga la viscosidad muy alta quiere decir que es poco fluido. Volatilidad: Curva de destilación: La volatilidad se determina con la curva de destilación. Un combustible líquido es una fracción de la destilación del crudo de petróleo. Tendremos una u otra cosa dependiendo de donde cortemos en la destilación, es decir, de las temperaturas donde recojamos en el intervalo de destilación. No tendremos una temperatura única, sino que a medida que el volumen recogido va aumentando va variando la temperatura. La temperatura va a ascendiendo porque tenemos otros compuestos con más átomos de C en la cadena que se van evaporando poco a poco. Después se condensan al ponerse en contacto con las paredes frías y se recogen. Así, cuanto mayor sea la temperatura, se evaporarán los más pesados, los de mayor número de átomos de carbono en la cadena 41 CAPITULO II 2.4. Prevención y extensión de incendio Los incendios son una amenaza constante en el ámbito laboral, social y familiar, ya que son innumerables las pérdidas ocasionadas por este motivo. S La mayoría de las veces los incendios se deben a la falta de PREVENCIÓN. ADO V R E S E OS R Efectivamente, la prevención es la única arma útil de que disponemos para DERECH hacer frente a este enemigo tan temible. Los efectos del fuego dependerán de qué es lo que arde, cómo y en qué circunstancias se desarrolla. Según el control que tengamos sobre el fuego que se desarrolla, se puede considerar que el fuego es beneficioso (cocinas, chimeneas, …) o perjudicial (fuego no controlado). Los peligros del fuego para las personas son, básicamente, la generación de gases tóxicos, principal causa de las muertes producidas en los incendios la generación de humos y gases calientes que pueden producir quemaduras externas o internas por inhalación, además de dificultar la visión y la evacuación de personas el calor producido por las llamas puede causar extenuación, deshidratación y bloqueo respiratorio finalmente, el pánico puede alterar el comportamiento de las personas frente al fuego, llegando a producir comportamientos suicidas. Para poder atacar con eficacia el fuego se necesario conocer que la combustión es una reacción química que tiene lugar cuando los vapores desprendidos por una sustancia combustible se combinan con gran rapidez con el oxígeno del aire. Esta reacción se produce con desprendimiento de luz y calor, formando el fuego. 42 CAPITULO II Para que se produzca un fuego es necesario que coincidan los tres factores que conforman el “triángulo del fuego”: combustible, comburente y calor. S ADO V R E S E OS R DERECH Para un mejor resultado en el combate de un fuego incipiente, se debe considerar el material que está en combustión, ya que de allí se parte, en utilizar el extintor adecuado. Imaginémonos estar al frente de un pequeño incendio en un tablero eléctrico y por desconocimiento de la clase de fuego que se está iniciando tratemos de extinguir con agua ¿qué sucedería?, es por esto que a continuación se dan a conocer y se clasifican los diferentes tipos de fuegos para luego conocer sobre los diferentes tipos de agentes de extinción que podemos utilizar. Fuegos Clase" A" Es aquel fuego que se produce y desarrolla en materiales combustibles sólidos comunes, (madera, papel, trapos, cartón, algodón, formica, cueros, anime, plásticos, etc.>. Se representa con la letra "A" dentro de un triángulo color verde. 43 CAPITULO II Fuegos Clase "B" Este fuego que se produce y desarrolla sobre la superficie de líquidos inflamables y combustibles por la mezcla de vapores y aire, (derivados del petróleo, aceites, gasolina, kerosén, butano, pinturas, Acetona, etc.). Se representa con la letra "B" dentro de un cuadrado color rojo. DERECH Fuegos Clase "C" S ADO V R E S E OS R Es aquel que se produce en equipos o sistemas eléctricos energizados (TV., radio, licuadora, tostadoras, computadoras, etc.) Se representa con la letra "D" dentro de un círculo color azul. Fuegos Clase" D" Es aquel fuego que se produce y desarrolla en metales combustibles o reactivos (aluminio, magnesio, sodio, potasio, cobre, etc.), estos metales arden a altas temperaturas, y exhalan suficiente oxigeno para mantener la combustión. Pueden reaccionar violentamente con el agua u otros químicos y deben ser manejados con cautela. Se representa con la letra "D" dentro de una estrella de 5 puntas color amarillo. Fuegos Clase "K" Es aquel fuego que se produce y se desarrolla en los extractores y filtros de campanas de cocinas, donde se acumula la grasa y otros componentes combustibles que al alcanzar altas temperaturas produce combustión espontánea. Su símbolo es un cuadrado de color negro con una K de color blanco en su interior. 44 CAPITULO II 2.4.1. Método de la eliminación el incendio Si para producir un fuego es necesario reunir oxígeno, combustible y un foco de calor, es evidente que habrá que eliminar o reducir uno o más de estos factores para extinguir el fuego. S ADO V R E S E OS R DERECH Los métodos principales para combatir el fuego son: Enfriamiento Sofocación Eliminación Inhibición de la reacción en cadena 2.4.1.1. Enfriamiento. De todos los agentes extintores, el agua es el que más absorbe el calor por volumen que cualquier otro agente ya que hará que el punto de ignición del combustible, así como la liberación de los vapores calientes que son transmitidos, vayan enfriándose y el fuego se vaya extinguiendo. 2.4.1.2. Sofocamiento. En este método, se trata de reducir el oxígeno. Por esto se denomina sofocamiento y se hace tratando de cubrir la superficie del material combustible alguna sustancia no combustible como la arena, la espuma o el agua ligera; existen otros agentes sofocantes bien conocidos como el bióxido 45 CAPITULO II de carbono, los polvos químicos secos a base de bicarbonato de sodio, bicarbonato de potasio (Púrpura K), cloruro de potasio (super K) y fosfato monoamónico (uso múltiple). Por ello en este método se aconseja el uso de extinguidores basados en sustancias químicas, que pueden ya estar mezcladas o que deben mezclarse en el momento de su uso. S ADO V R E S E OS R DERECH 2.4.1.3. Eliminación. El fuego siempre necesita nuevo combustible para propagarse; si se elimina o retira el combustible de las proximidades de la zona del incendio, el fuego se extingue. Cortar el flujo de líquidos o gases combustibles que descargan en la zona de fuego y alejar los materiales combustibles, sólidos o líquidos de las proximidades del foco de ignición, son algunas de las alternativas que se pueden llevar a cabo para la eliminación del combustible. 2.4.1.4. Inhibición de la reacción en cadena La reacción de combustión se desarrolla a nivel molecular a través de un mecanismo químico de "radicales libres". Si éstos son neutralizados la combustión se detiene, extinguiéndose el fuego. El proceso de romper o detener la reacción se denomina inhibición. Algunos agentes extintores, como los halones principalmente, tienen la propiedad de liberar, bajo efectos térmicos radicales libres que al combinarse 46 CAPITULO II con los generadores por combustión, detienen la reacción en cadena extinguiendo el fuego. 2.5. Unidades experimentales docentes. OS D A V R E ESdel sistema Bases para el diseño e implementación R S O H C DERE Una vez formulado el problema a resolver con esta investigación, se procedió a la definición de las bases y los fundamentos necesarios para el diseño e implantación de la unidad experimental para simulaciones de riesgo por vaporización de gases. Como resultado del análisis integral del entorno ambiental en donde se operará la unidad experimental, se acordaron las siguientes bases y premisas de diseño. Éstas fueron las siguientes: Objetivos: Validar experimentalmente los riesgos de inflamabilidad de mezclas explosivas generadas por la vaporización de combustibles fósiles. Desarrollar pruebas escala banco para la simulación de situaciones de riesgos de incendio por vaporización de gases inflamables de combustibles fósiles. El experimento tendrá un enfoque práctico. Ubicación: La unidad de fluidización estará ubicada en las instalaciones del Laboratorio de Operaciones Unitarias de la Facultad de Ciencias de la Ingeniería, situado en la planta baja del Modulo 3 de la Universidad Rafael Urdaneta, sede Vereda del Lago. 47 CAPITULO II Usuarios: La unidad experimental para simulaciones de riesgo de vaporización de gases constituirá un valioso activo docente que estará disponible en las instalaciones del Laboratorio de Operaciones Unitarias. En términos generales, podrá ser utilizado por los alumnos de las carreras de Ingeniería Química, Ingeniería Industrial e Ingeniería Civil, cuyos pensums de S estudio contienen materias que ameritan utilizar dichas instalaciones para ADO V R E S E OS R complementar y facilitar la comprensión de los conceptos emitidos en las DERECH clases teóricas. Montaje: La unidad experimental será ensamblada sobre una mesa o mesón rodante del laboratorio dadas las limitaciones de espacio existente en el laboratorio para mejor prácticas, una vez finalizados los experimentos, la mesa pueda ser guardada en el depósito de materiales y equipos del Laboratorio de Operaciones Unitarias. Materiales de construcción: Se utilizaran materiales transparente tales como el vidrio y acrílico, que permitan ver a los alumnos cuando el combustible o liquido inflamable llegue al punto de inflamabilidad y como estos se convierten en un riesgo. Manual de Operación del equipo experimental de prácticas: Para la correcta operación de la unidad experimental se deberá contar con un manual de operación redactado de acuerdo con la metodología y formatos utilizados en equipos similares. Este manual suministrará a los estudiantes la mayor parte de la información necesaria para poder realizar los experimentos para la validación de los riesgos de inflamabilidad de mezclas explosivas. 48 CAPITULO II 2.6. Términos básicos Incendio: Un incendio es una reacción química de oxidación reducción fuertemente exotérmica, siendo los reactivos el oxidante y el reductor. En terminología de incendios, el reductor se denomina combustible S ADO V R E S E OS R y el oxidante, comburente; las reacciones entre ambos se denominan DERECH combustiones. Explosiones: Una explosión es la liberación en forma violenta de energía mecánica, química o nuclear, normalmente acompañada de altas temperaturas y de la liberación de gases. Riesgos: Son los eventos resultantes de la ocurrencia o materialización de una amenaza. Mezcla explosiva: es la mezcla de un comburente (producto oxidante) y de un combustible (producto oxidable) en proporciones tales que puedan dar lugar a una reacción de oxidación muy rápida y muy viva, liberando mas energía de la que se disipa por conducción y convección. Atmósfera explosiva: es toda mezcla de aire en condiciones atmosféricas, de sustancias inflamables en forma de gas, vapor, niebla o polvo en las que tras una ignición, la combustión se propaga a la totalidad de la mezcla no quemada. Atmósfera potencialmente explosiva: Se le llama así cuando el riesgo solo existe en estado potencial esto es que la atmósfera pueda derivar a explosiva debido a condiciones locales y de funcionamiento. 49 CAPITULO II Inflamabilidad: no son los líquidos inflamables o combustibles los que arden o explotan, sino los vapores inflamables procedentes de su evaporación cuando su temperatura se eleva por encima del punto de inflamación, al quedar expuestos a una fuente de ignición. Como la mayoría S de los líquidos inflamables se almacenan y se manipulan normalmente por ADO V R E S E OS R encima de su punto de inflamación, continuamente están produciendo ERECH D se definen las principales características de inflamabilidad de un líquido. vapores que, mezclados con el aire, pueden ser inflamables. A continuación Temperatura de inflamación: es la menor temperatura a la que hay que elevar un líquido combustible para que los vapores que se desprendan formen con el aire, una mezcla que se inflama al acercarle una fuente de ignición. La combustión no continúa al retirar la llama o fuente de ignición. Temperatura de combustión o ignición: temperatura mínima correspondiente a la iniciación de una combustión continuada y completa de los vapores desprendidos del líquido combustible, luego de retirar la fuente de ignición. Temperatura de autocombustión o autoignición: es la mínima temperatura a la cual debe elevarse una mezcla de vapores inflamables y aire para que se encienda espontáneamente sin necesidad de la presencia de una fuente de ignición externa. Líquidos inflamables: son líquidos, mezcla de líquidos, o líquidos que contienen sustancias sólidas, en solución o suspensión, que despiden vapores inflamables a una temperatura no mayor de 135ºC, en vaso abierto. Los líquidos inflamables se clasifican a su vez en: 50 CAPITULO II Inflamables de primera categoría: Son los líquidos inflamables cuyos puntos de inflamación son menores de 21ºC. Inflamables de segunda categoría: Son los líquidos cuyos puntos de inflamación no son menores de 21ºC pero no alcanzan a 40ºC. Inflamables de tercera categoría: Son los líquidos inflamables cuyos S puntos de inflamación están comprendidos entre 40 y 135ºC, determinados ADO V R E S E OS R con el aparato Tag, vaso abierto, cuando son menores de 80ºC. ERECH D Límites de inflamabilidad: definen las concentraciones mínimas y máximas del vapor o gas en mezcla con el aire, en las que son inflamables. Límite inferior de inflamabilidad o explosividad (L.I.I. o L.I.E.): Se define como la concentración mínima de vapor o gas en mezcla con el aire, por debajo de la cual, no existe propagación de la llama al ponerse en contacto con una fuente de ignición. Límite superior de inflamabilidad o explosividad (L.S.I. o L.S.E.): se define como la concentración máxima de vapor o gas en aire, por encima de la cual, no tiene lugar la propagación de la llama, al entrar en contacto con una fuente de ignición. Energía mínima de ignición (E.M.I.): Este parámetro indica la energía mínima necesaria para iniciar la combustión de una mezcla inflamable. Depende de la concentración del combustible en el aire 51 CAPITULO II MAPA DE VARIABLES OS D A V R E S HOS RE OBJETIVO GENERAL: DEREC Validar experimentalmente los riesgos de inflamabilidad de mezclas explosiva generada por la vaporización de combustibles fósiles OBJETIVO ESPECÍFICO VARIABLE DEFINICIÓN DE LA VARIABLE INDICADORES TÉCNICAS DE RECOLECCIÓN DE DATOS FASE Revisión bibliográfica. Entrevistas a operadores de plantas industriales I Definir situaciones de riesgo de Sistemas de riesgo que Actos y condiciones inseguras incendio por la vaporización de puedan causar incendios que puedan causar un incendio gases inflamables Selección del tipo riesgo Definición de condiciones inseguras Definición de actos inseguros Son experimentos hechos en laboratorios para simular las situaciones de riesgos de vaporización de gases inflamables mezclas explosivas Diseño conceptual del escenario operativo definido Selección del equipo experimental referido Desarrollar los procedimientos operacionales Observación Documental. Película. Revisión bibliográfica. Entrevistas Es el plan para construir el equipo de laboratorio utilizados para realizar un experimento o practicas docentes Base construcción del diseño. Arreglo de los componentes Observación directa Selección de los materiales y combustibles de ensayo. Planos de equipo. Ensamble del equipo experimental Manual de operación. Pruebas de simulación inicial puestas en funcionamiento en los laboratorios de ingeniería de la URU Validación de resultados experimentales. Desarrollar pruebas escala banco para la simulación de situaciones de riesgo de incendio por vaporización de gases inflamables de combustibles fósiles Diseñar una unidad experimental docente para simulación de situaciones de riesgo de incendio por la vaporización de gases inflamables en el ambiente Implantar la unidad experimental docente de simulación de situaciones de riesgo por vaporización de gases inflamables de combustibles fósiles para uso en las instalaciones de la facultad de ingeniería de la URU Prueba escala banco Diseño de la unidad experimental escala banco para simulaciones de riesgo por vaporización de gases Implantar el sistema experimental de riesgo Poner en servicio la unidad experimental docente utilizadas para simular y realizar diferentes procesos técnicos 52 Observación directa II III IV CAPÍTULO III CAPÍTULO III MARCO METODOLÓGICO OS D A V R E ESla validación experimental R metodológicos y la metodología para S O H C ERE riesgos D de inflamabilidad de mezclas explosivas. En esta fase se desarrollan los contenidos de los aspectos de los 3.1. Tipo de investigación Tal como lo explica, Hernández, Fernández y Baptista (2000, p. 62), señalan que la investigación descriptiva tiene como propósito describir situaciones y eventos; esto es, especificar cómo es y cómo se manifiesta determinado fenómeno. Así mismo, Hurtado (2000 p. 233), expresa que la investigación descriptiva, tiene como objetivo central lograr la descripción o caracterización del evento de estudio dentro de un contexto particular. Adicionalmente, Tamayo y Tamayo (2001 p. 264), la investigación descriptiva, comprende la descripción, registro, análisis e interpretación de la naturaleza actual y la composición o proceso de los fenómenos. El enfoque se hace sobre conclusiones dominantes o sobre como una persona, grupo o cosa se conduce o funciona en el presente 54 CAPÍTULO III Por otra parte, Arias (1997, p. 49), acota que las investigación explicativa se encarga de buscar el por que de los hechos mediante el establecimiento de relaciones causa-efecto. De acuerdo a lo antes planteado, se debe indicar que el presente trabajo se cataloga como una investigación descriptiva bajo la modalidad explicativa, debido a que se estudia la variable Unidad experimental para de D gases OS inflamables, A V R E ES y su desarrollo en el entorno determinando sus aspectos másR notables S O H C ERE la obtención de datos directamente. Dmediante estudiado simulaciones de riesgos por vaporización 3.2. Diseño de investigación El diseño de investigación es la estrategia que adopta el investigador para responder al problema planteado. Arias, (1997, p. 50) afirman que la investigación de tipo experimental se realiza con la manipulación y el control de las variables. El proceso consiste en someter a un objeto o grupo de individuos a determinadas condiciones o estímulos para observas los efectos que se producen. Por lo anteriormente expuesto, se puede afirmar que el diseño de la investigación utilizado es experimental, ya que la variable “Unidad experimental para simulaciones de riesgos por vaporización de gases”. Por otra parte, el diseño se cataloga como descriptivo longitudinal, por cuanto el estudio llevará a caracterizar la unidad experimental para simulaciones de riesgos por vaporización de gases inflamables, sus diversas mediciones y aplicaciones dentro del Laboratorio de Operaciones Unitarias. 55 CAPÍTULO III 3.3. Población de la investigación Según Morles (1994, p.17), la población o universo se refiere al conjunto el cual serán válidas las conclusiones que se obtengan: a los elemento o unidades (personas, instituciones o cosas) alas cuales se refiere la investigación, por tanto la población en este trabajo de investigación serán los combustibles fósiles. OS D A V R E ESque la muestra es un “subconjunto R Morles (1994 p.54) también acota S O H C DERdeEun universo o población.” representativo Por otra parte, Arias (1997 p.53) expresa que en un muestreo intencional u opinático la selección de los elementos con base en criterios o juicios del investigador. Por lo antes mencionado las muestras escogidas son del tipo intencional, estas muestras son: Gasolina, Kerosén, Gasoil. 3.4. Técnicas de recolección de datos Se contemplan como los instrumentos utilizados para facilitar la recolección y el análisis de los hechos observados. Dicha sección, según Tamayo (1998), es la expresión operativa del diseño de investigación. Por otra parte, se utilizó la técnica de la entrevista no estructurada al personal técnico y docente del Laboratorio de Operaciones Unitarias de la Facultad de Ingeniería de la Universidad Rafael Urdaneta, mediante la cual el encuestador, en este caso el investigador, elabora una lista de aspectos que le interesa explorar en función de los objetivos de la investigación, y va formulando las preguntas que van surgiendo al entrevistado durante la conversación (UNA, 1991, p.54). 56 CAPÍTULO III Así pues, la recolección de datos se realizó mediante una observación directa y a través de revisiones bibliográficas, para evaluar y caracterizar el sistema de experimental de simulaciones de riesgos por vaporización de gases inflamables de combustibles fósiles para uso en las instalaciones del Laboratorio de Operaciones Unitarias de la Universidad Rafael Urdaneta, efectuando el registro sistemático, válido y confiable del comportamiento manifestado. S ADO V R E S E 3.5. Fases de la investigación SR O H C E R DE Las fases de la investigación son los pasos que se siguieron de forma secuencial para la realización de este trabajo de acuerdo a los objetivos propuestos. Dicha investigación se desarrolló a través de las fases que se describen a continuación: FASE I: Definir sistema de riesgo: Consiste en definir los riesgos y actos inseguras que pueden causar incendios, para así poder hacer una análisis exhaustivo de las condiciones inseguras que se pueden presentar FASE II: Desarrollar pruebas: Se planearon pruebas escala banco para simular las situaciones de riesgos de vaporización de gases inflamables, En esta fase se juntaron todas las partes que conforman el equipo y se realizó el montaje del mismo de acuerdo al diseño conceptual del escenario operativo definido. FASE III: Diseñar unidad experimental: Con base en el diseño de construcción se arreglaron los componentes y se selecciono el equipo a utilizar para hacer las pruebas escala banco 57 CAPÍTULO III FASE IV: Implantación y validación. Se verificó el funcionamiento del equipo para poder realizar las pruebas de laboratorio y se diseñó un breve manual de operación siguiendo el formato y la metodología sencilla para que el mismo pueda ser entendido con facilidad por los estudiantes de la Escuela de Ingeniería Química de La Universidad Rafael Urdaneta. OS D A V R E EScondiciones de operación, R funcionamiento yHverificar las S O C DERE En esta fase se puso en marcha el equipo para observar directamente su para posteriormente hacer las simulaciones de situaciones de riesgo por vaporización de gases inflamables de combustibles fósiles para uso en las instalaciones de la facultad de ingeniería de la Universidad Rafael Urdaneta 58 CAPÍTULO IV CAPÍTULO IV ANÁLISIS DE LOS RESULTADOS OS D A V R E ES de desarrollar pruebas escala R mezclas explosivas y de plantear la necesidad S O H C E de situaciones de riesgo de vaporización de gases DElaRsimulación banco para Luego de estudiar todo lo referente a los riesgos de inflamabilidad de inflamables de combustibles fósiles que demuestren a los estudiantes de la Escuela de Ingeniería Química de la Universidad Rafael Urdaneta dicho fenómeno, se procedió a llevar a cabo los objetivos trazados en esta investigación obteniendo para cada una de las fases los resultados que se presentan a continuación. 4.1. OBJETIVO I: DEFINIR SITUACIONES DE RIESGOS DE INCENDIO POR LA VAPORIZACION DE GASES INFLAMABLES. A continuación se presentan las posibles situaciones de riesgos de incendio por la vaporización de gases inflamable asociadas a esta investigación: Incendio o fuego de CLASE B ya que estamos trabajando con combustible fósil inflamable como lo es la gasolina. Explosión por acumulación de gases inflamables. 60 CAPÍTULO IV Mal manejo de de la fuente de ignición a utilizar en el desarrollo de los experimentos. Manipulación indebida de la gasolina a utilizar. Para lograr este objetivo se tomaron lo siguientes indicadores: Selección del tipo riesgo, definición de condiciones inseguras, definición de S ADO V R E S E OS R actos inseguros. DERECH 4.2. OBJETIVO II: DESARROLLAR PRUEBAS ESCALA BANCO PARA LA SIMULACION DE SITUACIONES DE RIESGO DE INCENDIO POR VAPORIZACION DE GASES INFLAMABLES DE COMBUSTIBLES FOSILES. Las pruebas escala banco que se realizaron para la simulación de situaciones de riesgo de incendio por vaporización de gases inflamables de combustibles fueron las siguientes: PRUEBA 1: Para demostrar que la gasolina forma suficiente vapores combustibles condición esencial para producir el fuego en el RECIPIENTE 1 con gasolina se introdujo un encendedor de cocina en la gasolina liquida y se procedió a encender, con esto se demostró que la gasolina liquida no arde por la acción de la chispa producida PRUEBA 2: Se realizó el mismo procedimiento pero aplicada a mezclas de vapores de la gasolina para demostrar que son los vapores los que originan el fuego instantáneamente debido a que hay 61 CAPÍTULO IV una condición perfecta para el triangulo de seguridad (oxigeno, calor y combustible). PRUEBA 3: Se realizó el mismo procedimiento de la prueba 2, pero aplicada a mezclas de vapores del Kerosén para demostrar que las presiones parciales de los vapores del mismo son elevada y no arden a temperatura ambiente como la gasolina. OS D A V R E ESprocedimiento que en las pruebas 2 R PRUEBA 4: Se H realizó el mismo S O C ERE yD 3, pero aplicada a mezclas de Kerosén y gasolina para demostrar que los vapores de esta mezcla son tan inflamables a temperatura ambiento como la de la gasolina sola sin importar la proporción del mezclado. PRUEBA 5: Se tomó un paño seco y se pasó por la llama, éste no ardió, luego se humedeció un poco con gasolina y se coloco en el recipiente cilíndrico de acrílico bajando los vapores por la tubería de acrílico conectada en la parte inferior del cilindro, alcanzando estos la llama, luego los vapores ardientes encienden el paño. Una vez más con esto demostramos que hay que tener sumo cuidado con la circulación de los vapores de la gasolina. Además que los gases de la gasolina son mas pesados que el aire. PRUEBA 6: Se enciende los vapores de la gasolina contenido en el recipiente uno y se procedió a rociarlos con agua con esto se demostró que el rocío de agua es capaz de apagar los vapores de la gasolina inflamados debido a que las gotas enfriaran los vapores de combustible hasta un grado menor de la temperatura de inflamación y el vapor de agua producido tendrá un efecto flotante sobre el fuego. 62 CAPÍTULO IV PRUEBA 7: Se realizo un arreglo que asemejara un deposito de gasolina con la finalidad de demostrar como prevenir un incendio, se tomo un balón de vidrio con dos bocas y en una se coloco un pequeño tubo de vidrio con un tapón para simular el respiradero del tanque y por la otra boca se coloco un embudo de vidrio para poder llenar el tanque de gasolina, dentro del balón se coloca una pequeña porción de gasolina ya que por lo general estos tanques nunca están OS D A V R E ES y se noto que no es posible R tubo que representa el respiradero S O H C E ya que la mezcla de vapores es demasiado pobre para DERfuego producir completamente vacíos, en estos momentos se hace pasar fuego por el que pueda arder, se procede a llenar el tanque al mismo tiempo se paso la llama por el respiradero y en este momento se nota que los vapores arden, esto es debido a que la gasolina empuja los vapores de esta y los empuja por el respiradero haciéndola lo suficientemente rica para arder y seguirá ardiendo mientras se sigue llenando el deposito, tan pronto se detuvo el llenado de la gasolina en el deposito el incendio en el respiradero se detuvo esto debido a que ya no existe suficiente presión para expulsar los vapores por el respiradero, con esto se demostró que con suprimir uno de los tres elementos que conforman el triangulo de fuego podemos prevenir o para el fuego. Para el logro de este objetivo se tomaron en cuenta los siguientes indicadores: Diseño conceptual del escenario operativo definido, selección del equipo experimental referido, desarrollar los procedimientos operacionales 4.3. OBJETIVO III: DISEÑAR UNA UNIDAD EXPERIMENTAL DOCENTE PARA SIMULACIONES DE SITUACIONES DE RIESGOS DE INCENDIO POR VAPORIZACION DE GASES INFLAMABLES EN EL AMBIENTE. 63 CAPÍTULO IV Se tomó como base para el diseño y construcción de la Unidad experimental escala banco para simulaciones de riesgo por vaporización de gases un video documental presentado por RH representantes. Además, se consultó la bibliografía disponible en la biblioteca de la Universidad Rafael Urdaneta y se procedió a realizar el diseño del equipo de acuerdo con las S ADO V R E S E OS R necesidades y disponibilidades del Laboratorio, especificada como sigue: • ECH R E D Tamaño: el tamaño es de escala de laboratorio, fácil de transportar y manipular, ocupando poco espacio en las instalaciones, pero suficiente como para que la experiencia se pueda observar sin problema alguno. • Tipo de material: los contenedores son de acrílico y de vidrio lo cual nos permite ver el comportamiento de los vapores inflamables. • Líquidos inflamables: los líquidos inflamables son gasolina y kerosén. Para visualizar mejor el diseño obtenido en esta investigación ver el plano de equipo ubicado en el anexo. Para el logro de este objetivo se utilizaron los siguientes indicadores: base construcción del diseño, arreglo de los componentes. 4.4. OBJETIVO IV: IMPLANTAR LA UNIDAD EXPERIMENTAL DOCENTE DE SIMULACION DE SITUACIONES DE RIESGO POR VAPORIZACION DE GASES INFLAMABLES DE COMBUSTIBLES FOSILES PARA USO EN LAS INSTALACIONES DE LA FACULTAD DE INGENIERIA DE LA UNIVERSIDAD RAFAEL URDANETA. 64 CAPÍTULO IV Para implementar la unidad experimental se selecciono los tipos de fluidos con el cual se va a trabajar (Gasolina y Kerosén). Se realizaron: el plano del equipo, el ensamble de equipo experimental y el manual de operación. S ADO V R E S E validación de los resultados experimentales. SR O H C E R DE Se realizaron las pruebas de simulaciones y diseño, y se procedió a la 65 CONCLUSION CONCLUSIONES En el marco de este estudio se alcanzaron los siguientes objetivos: • S Se realizó un modelo experimental de los riesgos de inflamabilidad de ADO V R E S E OS R mezclas explosivas generadas por la vaporización de combustibles DERECH fósiles. • El equipo esta diseñado de una manera que se desplace fácilmente para realizar las pruebas en diferentes lugares y así cada grupo puede hacer las prácticas por separado. • La validación de los experimentos se realizó de forma cualitativa. • El material utilizado es de uso cotidiano y no es costoso para la elaboración de las prácticas. • El material de los contenedores del liquido inflamable son de acrílicos y vidrio lo que hace mas fácil la visualización de la inflamabilidad de los vapores. 67 RECOMENDACIONES RECOMENDACIONES Las recomendaciones mas importantes que se pueden resaltar son las siguientes: • S ADO V R E S E OS R El equipo será utilizado por los estudiantes bajo la supervisión del DERECH profesor de laboratorio o su asistente. • Leer el manual de operación antes de utilizar el equipo. • Encender el mechero solo cuando se hagan las demostraciones y luego apagarlo. • Manipular con cuidado los líquidos inflamables a ser utilizado. • Tener a mano un extintor de incendio por si se presenta alguna eventualidad en el momento de hacer los experimentos. • Hacer pruebas experimentales con otros tipos de materiales de uso cotidiano donde se demuestren los peligros de inflamabilidad que esto representan. • Colocar dentro del laboratorio de Operaciones Unitarias un extractor. • Colocar desagües, por medida de seguridad, ya que si existe algún derrame de un liquido que atente en contra de salud, no ocasione daños en los usuarios del laboratorio. 69 RECOMENDACIONES • Colocar salida de emergencia dentro de los laboratorios con su identificación. • Realizar un plan de evacuación en los laboratorios donde contemple S ruta de evacuación, sitio de concentración, y divulgarlo a los usuarios ADO V R E S E OS R de los laboratorios a comienzo de cada periodo de clase, por si se DERECH presenta alguna eventualidad, el usuario sepa como actuar y no entre en pánico. Por otro lado, para ampliar los conocimientos de los riesgos de los productos inflamables se recomienda en las refinerías e instalaciones de almacenajes de grandes cantidades de combustibles fósiles: • El uso constante del equipo de prueba de la presencia y concentraciones de vapores inflamables. • Colocar a tierra debidamente los camiones, depósitos, boquillas, rejas de carga y camiones cisternas para evitar la estática. 70 Laboratorio de Facultad de Ingeniería DEREC OS VAD R E S E R HOS Unidad experimental de simulaciones de situaciones de riesgo por vaporización de gases inflamables. Manual de Operación 1. OBJETIVO DEL MANUAL El objetivo principal de esta guía es proporcional a los estudiantes y personal docente que manipule u opere el equipo, con material que ayude a hacerlo de forma correcta y segura, para garantizar el buen funcionamiento del mismo DEREC OS VAD R E S E R HOS 2. PRECAUCIONES Y NORMAS DE USO. • Leer el manual antes de trabajar con el equipo. • El profesor encargado de la práctica debe ser quien autorice el inicio de las simulaciones. • El docente auxiliar debe asegurarse que todos los componentes estén es su lugar, supervisar que los alumnos estén haciendo buen uso de la unidad, además de garantizar el mantenimiento y buen funcionamiento de la misma. • Revisar que todos los contenedores de los líquidos inflamables estén en su sitio y de forma segura. • Antes de encender un cerillo, mechero o otra fuente que genere calor o combustión, asegurarse debidamente tapados. de que todos los contenedores estén • Es necesario tener en cuenta que hay un contenedor hecho de acrílico, el cual es un material frágil por lo que se debe manipular con delicadeza, evitando ralladuras y posibles fracturas. • Tener en cuenta que se esta trabajando con gases inflamables por lo tanto es necesario contar con un extintor de incendio cerca y en buenas condiciones. DEREC • OS VAD R E S E R HOS Evitar la exposición del equipo a materiales calientes o cerca de los mismos. 3. PRECAUCIONES Y NORMAS DE USO. PRUEBA 1: En un cilindrado graduado de vidrio se coloca gasolina se introduce un encendedor de cocina en la gasolina liquida y se procede a encender, con esto se demuestra que la gasolina liquida no arde por la acción de la chispa producida. PRUEBA 2: Se toma el mismo cilindro graduado de la prueba 1 y se pasa el encendedor por la mezcla de vapores de la gasolina, para demostrar que son los vapores los que originan el fuego instantáneamente debido a que hay una condición perfecta para el triangulo de seguridad (oxigeno, calor y combustible). PRUEBA 3: Se toma otro cilindro graduado y se agrega kerosén, realiza el mismo procedimiento de la prueba 2, para demostrar que las presiones parciales de los vapores del mismo son elevada y no arden a temperatura ambiente como la gasolina. PRUEBA 4: Al cilindro utilizado en la prueba 3 se le agrega gasolina, se procede a encender los vapores de la mezcla, con esto se demuestra que los vapores de esta mezcla son tan inflamables a temperatura ambiento como la de la gasolina sola, sin importar la proporción del mezclado. PRUEBA 5: Se toma un paño seco (preferiblemente gasa) y se pasa por la llama, éste no arderá por si solo, luego se humedece un poco con OS D A V R E S E bajen por la tubería de acrílico unos segundos para que los R vapores S O H C E R DE en la parte inferior del cilindro. Se coloca una llama en la conectada gasolina y se coloco en el recipiente cilíndrico de acrílico, se espera salida de la tubería para encender los vapores que salen de ella y una vez que estos se consuman la llama correrá a través de la tubería alcanzando el paño y quemándolo. Una vez más con esto demostramos que hay que tener sumo cuidado con la circulación de los vapores de la gasolina. Además que los gases de la gasolina son mas pesados que el aire. PRUEBA 6: Se enciende los vapores de la gasolina contenido en el cilindro graduado utilizado en la prueba uno y se procede a rociarlos con agua, con el fin de demostrar que el rocío de agua es capaz de apagar los vapores de la gasolina inflamados debido a que las gotas enfriaran los vapores de combustible hasta un grado menor de la temperatura de inflamación y el vapor de agua producido tendrá un efecto flotante sobre el fuego, creando una nube de vapor de agua que no permite que el oxigeno llegue hasta el fuego para así extinguirlo. PRUEBA 7: En el arreglo que asemeja un deposito de gasolina, el cual consta dos tanque, uno que simula un camión cisterna (tanque 1) y otro un tanque subterráneo (tanque 2), en el tanque 2 se coloca un tubo de vidrio como respiradero, se conecta los dos tanques por medio de una manguera con una válvula de paso. La prueba la comenzamos pasando una llama por el respiradero antes de comenzar la prueba, para demostrar que en ese momento los vapores de la gasolina que salen por él no se encienden ya que las presiones parciales de los vapores están en equilibrio con la presión atmosférica, se procede a abrir la válvula del tanque 1 llenando el tanque 2 y se pasa de nuevo la llama por el respiradero, en este momento los vapores arderán ya que las presiones parciales de los vapores de la gasolina vencen a la presión atmosférica saliendo por el respiradero, al cerrar la válvula de suministro de la gasolina, los vapores que salen por el respiradero se apagaran. De este modo se demuestra una manera muy simplemente de prevenir un OS D A V R E S gasolina al tanque subterráneo se E apagara en fuego una vez consumido SR O H C E R E D los vapores del respiradero, esto es debido a que los vapores dentro del incendio de grandes proporciones, ya que solo parando el bombeo de tanque subterráneo vuelven a estar en equilibrio con la presión atmosférica.