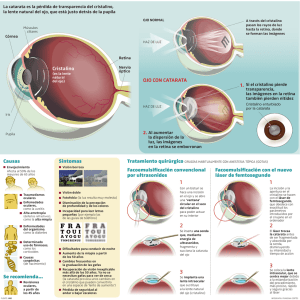
•090-cristalinos subluxados.qxd
Anuncio

90 Cirugía de catarata en cristalinos subluxados Javier Mendicute, Miguel Ruiz, Mayra López, Cristina Irigoyen, Sandra Sáez de Arregui INTRODUCCIÓN La subluxación del cristalino constituye una situación clínica que, actualmente, plantea ciertos retos al cirujano de segmento anterior. De una correcta orientación diagnóstica y de un adecuado planteamiento quirúrgico se conseguirán unos resultados óptimos. Ante una subluxación del cristalino, y una vez descartado el origen traumático, debe valorarse si su presentación es aislada, si coexiste como manifestación de otro cuadro ocular (síndrome de pseudoexfoliación, miopía magna, coloboma iridiano o catarata) o si constituye una alteración ocular de un cuadro sistémico (síndrome de Marfan, homocistinuria, síndrome de Weil-Marchesani, hiperlisinemia o deficiencia de sulfito oxidasa)1. También puede presentarse en el contexto de una historia familiar de ectopia lentis esencial2. Sin embargo, el origen traumático es el más frecuente. Existen otras situaciones (principalmente el síndrome de pseudoexfoliación) que predisponen a la posibilidad de presentación de una dehiscencia zonular intraoperatoria que requerirá un abordaje quirúrgico similar en algunos de los pasos quirúrgicos. No obstante, la subluxación intraoperatoria no será abordada en este capítulo, aunque sí mencionaremos algunas alternativas de tratamiento. La progresión de la subluxación del cristalino induce frecuentemente importantes cambios refractivos y elevados astigmatismos. Además, el eje visual puede comprometerse intermitentemente con los inconvenientes que ello supone. Hasta hace muy pocos años, la actitud conservadora-observadora era la más aconsejada, especialmente en base a los riesgos potenciales de la cirugía en dichas situaciones. Pero, la luxación completa, potencialmente grave, puede suceder y el abordaje quirúrgico es, en la mayor parte de los casos, la única alternativa terapéutica. Dicha luxación puede producirse a cámara anterior, pudiendo afectar al endotelio corneal o inducir glaucoma, o hacia el vítreo, pudiendo inducir una uveítis facolítica3 o un desprendimiento de retina4.Al plantearnos el abordaje quirúrgico se hace necesaria una correcta exploración oftalmológica. La subluxación del cristalino constituye una situación clínica que dificulta la cirugía de cataratas, especialmente cuando pretendemos practicar facoemulsficación. Ante la presencia de una subluxación del cristalino, objetivada por la facodonesis o por la visualización del ecuador cristaliniano, es necesario modificar nuestra forma de proceder y tomar ciertas precauciones durante los diferentes pasos quirúrgicos. Es aún reciente la fecha en la que la lensectmía vía pars plana era la técnica más aconsejada5 y la necesidad de corregir la afaquia con lente de contacto o gafa un hecho inevitable. Anteriormente, la extracción intracapsular, también utilizada en estos casos, se relacionó con una elevada incidencia de complicaciones como la vitreorragia (30%) o el desprendimiento de retina (15-20%)6,7. También fueron utilizados otro tipo de procedimientos, especialmente para posibilitar la apertura pupilar y permitir la corrección refractiva afáquica: midriáticos8, iridectomías quirúrgicas9 y fotocoagulación iridiana10. Otros han intentado desplazar el cristalino del eje visual con la utilización de láser Nd:YAG sobre las fibras zonulares residuales11,12, entendemos que con unos resultados más parecidos a los de la reclinación de cristalino que al que esperan de nosotros nuestros pacientes hoy en día. Es común a todos los procedimientos mencionados el escaso número de casos publicados, la transitoriedad de los resultados visuales obtenidos y el elevado número de complicaciones asociadas. Si consideramos exclusivamente los procedimientos quirúrgicos, de la práctica de extracción intracapsular a otros procedimientos, el salto cualitativo ha sido manifiesto. Entre éstos, los que se practican como sistemas cerrados (lensectomía vía pars plana o vía limbar y facoemulsificación) proporcionan un mejor control intraoperatorio y permiten una mejor recuperación funcional con mínimos riesgos quirúrgicos. Es necesario mencionar que los anillos de tensión capsular han supuesto una interesante aportación. Aunque originalmente13,14 fueron descritos con objeto de inhibir la proliferación de las células epiteliales ecuatoriales, ya Legler (1993)15 y Cionni (1995)16 aconsejaron su uso en las dehiscencias zonulares. Posteriormente, diferentes autores17,18 iniciaron la sutura transcapsular de los mismos, destacando Tokuda18 entre ellos; el mismo camino seguimos nosotros mismos19. Desde la descripción original de los anillos, han sido sugeridos diferentes materiales y modelos20,21, aunque los desarrollados por Witschel y comercializados por Morcher son, actualmente, los más extendidos. Morcher comercializa dos tipos de anillos con diámetros de 12,32 mm (modelo 14) y 14,5 mm (modelo 14ª, miopía), grosor de 0,17 y 0,20 mm y pesos de 0,80 y 1,30 mg; en ambos modelos, los extremos distales del anillo, que es abierto, presentan unos orificios de posicionamiento con objeto de facilitar la implantación. Posteriomente, existe gran número de casas comerciales que los fabrican con pequeñas variantes. 1039 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES A los anillos capsulares se les suponen múltiples ventajas en el manejo de estas situaciones y pocas son sus contraindicaciones y posibilidad de complicaciones, aunque estas existen22 tal y como comentaremos. Con la introducción de los anillos de tensión capsular el enfoque quirúrgico de las subluxaciones cristalinianas vivió cierta revolución y no sería exagerado afirmar que la facoemulsificación se ha convertido en la primera opción quirúrgica. La posibilidad de practicarla dependerá del grado de subluxación, de la presencia o no de vítreo en cámara anterior, de la naturaleza del cristalino y de otros factores de difícil valoración. Es cierto, como comentamos, que la facoemulsificación puede suponer ciertas ventajas: 1) El procedimiento se practica a cámara cerrada, con lo que supone de posibilidad de control durante la cirugía; 2) De ser posible, permite preservar un saco capsular que permitirá la implantación de una lente de cámara posterior; y 3) Ciertas ventajas refractivas como la corrección de la afaquia y la mínima inducción de astigmatismo. Con tal técnica, la posibilidad de complicaciones intraoperatorias como postoperatorias han disminuido, han mejorado las posibilidades de recuperación funcional, siempre y cuando no exista una ambliopía asociada, y ha abierto la posibilidad de una alternativa terapéutica eficaz en el manejo de este tipo de situaciones. ANATOMÍA E IMPORTANCIA QUIRÚRGICA DE LA BARRERA ZÓNULO-CAPSULAR El conocimiento de la anatomía básica de la cápsula y del aparato zonular es importante para entender no sólo los mecanismos de producción de la subluxación del cristalino sino también para afrontar los problemas que puede suscitar su cirugía. Sakabe23 observaron que el diámetro medio del cristalino era de 9,72 ± 0,31 (SD) mm con una zona libre de inserción zonular de 6,83 ± 0,35 mm. Este diámetro permanece constante independientemente de la edad y del diámetro del cristalino23. La cápsula cristaliniana se origina como una membrana basal para las células epiteliales de la vesícula primaria cristaliniana. Durante el crecimiento embrionario, la cápsula anterior permanecerá con esta función de membrana basal, quedando la cápsula posterior como una delgada membrana en la que no se reconoce dicha función. El ligamento suspensorio del cristalino o zónula de Zinn se proyecta desde el cuerpo ciliar hasta el ecuador del cristalino en fibras que se entrecruzan para abrazarlo anterior y posteriormente; tal anclaje es más firme en la zona anterior del cristalino y más superficial en su zona posterior24. Las fibras zonulares se originan en dos sitios diferentes del cuerpo ciliar: 1) Las fibras anteriores se origina en los valles de los procesos ciliares de la pars plicata o corona ciliaris, que se compone de 7080 procesos ciliares, y las posteriores en la pars plana o orbiculus ciliaris, formando los haces orbiculo-antero-capsulares y orbiculo-postero-capsulares, que se insertan a ambos lados de la región ecuatorial de la cápsula. La zona entre ambos haces zonulares se denomina canal de Hannover, mientras que la 1040 zona entre el haz orbiculo-postero-capsular y la cortical vítrea anterior se denomina canal de Petit. Aunque clásicamente se han buscado similitudes entre las fibras zonulares y las fibras vítreas de colágeno (se llamó, a las zónulas, vítreo terciario), hay estudios que indican que las zónulas tienen una semejanza estructural con las microfibrillas del tejido elástico, con una composición que recuerda más a la elastina que al colágeno25 Se ha demostrado que la cápsula del cristalino presenta una importante elasticidad26. La circunferencia de una capsulorrexis intacta puede ampliarse hasta un 62% antes de que se produzca un desgarro radial. La elasticidad capsular parece no guardar una relación significativa con la edad26. Para disminuir el riesgo de desinserción zonular durante la cirugía, es importante conocer el diámetro de cápsula anterior libre de inserciones zonulares, de manera que podamos determinar el diámetro máximo de una capsulorrexis o evaluar el posible daño zonular de un desgarro radial. El mantenimiento de la integridad del aparato cápsulo-zonular es de gran importancia en la prevención de complicaciones como la desinserción zonular o, incluso, la ruptura de la cápsula posterior, como extensión de, por ejemplo, un desagarro radial. Assia27 pudo demostrar que un desgarro radial raramente se extiende más allá del ecuador siempre que las zónulas que se encuentran encima y adyacentes al desgarro permanezcan intactas. La tensión zonular varía dependiendo de la edad. Nishikawa28 pudo comprobar que la fuerza necesaria para romper las zónulas era significativamente menor en los sujetos jóvenes que en los pacientes de más edad; además, el lugar de ruptura de las zónulas era diferente. En los individuos jóvenes la ruptura ocurrió en la región adyacente al cuerpo ciliar, mientras que los sujetos mayores la ruptura ocurría en la zona cercana a la inserción en el cristalino28. También la elasticidad zonular depende de la edad, al contrario de lo que ocurría con la elasticidad de la cápsula anterior. El estiramiento medio de una zónula antes de romperse es de 3,82 mm., cifra que se va reduciendo en 0,5 mm cada 5 años26. Del conocimiento de la anatomía de la barrera zónulo-capsular y de la constatación de la existencia de cambios erarios, cabe hacer algunas reflexiones en relación con la situación que se pueda plantear en el manejo de un cristalino subluxado. Si existe una debilidad o ausencia zonular, y dependiendo de su extensión, es la norma encontrar una cápsula anterior flácida que será difícil de penetrar para iniciar la capsulorrexis. Además, en la zona donde no exista soporte zonular existe un mayor riesgo de que, de producirse, un desagarro radial de la capsulorrexis se extienda posteriormente. Son reflexiones a tener en cuenta y sobre las que volveremos la comentar la técnica quirúrgica más recomendada para la práctica de la capsulorrexis en estas situaciones. ETIOLOGÍA DE LA SUBLUXACIÓN DE CRISTALINO Existen numerosas situaciones clínicas que se pueden asociar con una desestructuración del soporte zónulo-capsu- 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS lar y posterior subluxación del cristalino. Una vez detectada la subluxación es muy importante intentar averiguar la causa subyacente, ya que la subluxación puede asociarse a enfermedades sistémicas que pueden ser, incluso, potencialmente mortales. Existen múltiples clasificaciones en relación con la dehiscencia zónulo-capsular; no sabríamos decir cuál puede ser la más apropiada. Sí que consideramos muy importante saber si el fracaso zonular se produce en el contexto de una noxa puntual o en el contexto de una enfermedad ocular o sistémica. Es decir, sin en el origen de la subluxación existiera un traumatismo, lo más probable es que la subluxación no se extienda, en general, una vez finalizada la cirugía. Por el contrario, si en el origen se encontrara una enfermedad degenerativa, puede ser que la cirugía sea un éxito pero la tendencia a la extensión de la desinserción zonular puede ser la norma. En el primer caso, un traumatismo con una desinserción parcial; en el segundo, un síndrome de pseudoexfoliación, con la “epidemia” de luxaciones tardías del complejo zónulo-capsular que estamos viendo en el momento actual. Es evidente que la actuación debe ser diferente según la causa y la evolución esperada del remanente zónulo-capsular intacto. Por lo mencionado, consideramos que la primera clasificación debería considerar la siguiente división: 1) Traumáticas; 2) No traumáticas. Las primeras pueden tener múltiples presentaciones, tantas como la variedad de los traumatismos, pero serán relativamente estables: finalizada la causa, no tienen porqué progresar; entre las segundas también caben múltiples presentaciones, pero pueden subclasificarse, como veremos. Rosenthal29 sugiere dividir las alteraciones del aparato zónulo-capsular en las siguientes categorías: 1. Zónulas histológicamente normales pero que presentan defectos en su inserción; puede ser el caso de las diálisis zonulares traumáticas y de las iatrógenas, muchas veces traumáticas. 2. Zónulas normalmente insertadas pero con alteraciones histológicas, en general en sus propiedades elásticas; sería, por ejemplo, la situación observable en el síndrome pseudoexfoliativo. Zónulas histológicamente anormales, asociadas a una dehiscencia traumática; por ejemplo, el mayor riesgo de desinserción intraoperatoria, ante el mínimo trauma quirúrgico, que se presenta en el síndrome de pseudoexfoliación. Una clasificación para la subluxación del cristalino por dehiscencia zonular que nos parece aceptable, con utilidad clínico-quirúrgica, puede ser la que proponemos y que queda recogida en la Tabla I. Dehiscencia zonular traumática Es, probablemente, la causa más frecuente de inestabilidad zonular y subluxación de cristalino. El cristalino se ve afectado con frecuencia en los traumatismos oculares en for- Tabla I. Subluxación de cristalino por deshiscencia zonular: clasificación 1. Dehiscencia zonular traumática 2. Dehiscencia zonular endógena: – Por enfermedades congénitas y/o hereditarias – Por enfermedades adquiridas, locales o sistémicas – Síndrome de pseudoexfoliación del cristalino – Otras: uveítis crónica, miopía, glaucoma,… 3. Dehiscencia zonular iatrógena ma de cataratas, luxación o subluxación, o de ambas al mismo tiempo. Los traumatismos pueden provocar una rotura zonular por múltiples mecanismos, tantos como la propia naturaleza de los traumatismos. Han sido descritas en el contexto de traumatismos mecánicos, accidentes eléctricos, físicos y químicos, siendo los traumatismos contusos y las heridas perforantes las causas más frecuentes. Un traumatismo contuso en el globo ocular causa el acortamiento del ojo en el meridiano afectado con el consiguiente estiramiento en el meridiano ecuatorial. Este estiramiento causa la ruptura de las zónulas, quedando el cristalino sin su soporte normal, y resultando en la subluxación o, incluso, en la luxación completa del mismo. Es común en estos casos la poca tendencia a la evolución: la desinserción observada será más o menos estable y si logramos una cirugía satisfactoria cabe esperar poca progresión respecto a la inestabilidad zónulo-capsular. Dehiscencia zonular endógena En este grupo destacan las enfermedades congénitas y/o hereditarias, asociadas muchas de ellas a desinserciones zonulares. También otras enfermedades, locales o sistémicas, pueden provocar tal complicación; dentro de ellas puede ser englobado el síndrome de pseudoexfoliación pero dada su importancia preferimos tratarlo en grupo aparte. Es común a estos grupos que sean evolutivas antes de la cirugía e, incluso, después de ella. Se pueden lograr una cirugía satisfactoria pero cuyo pronóstico a largo plazo sea reservado e impredecible: dependerá de la extensión progresiva de la dehiscencia zonular. 1. Por enfermedades congénitas y/o hereditarias Dentro de este grupo se incluirían: síndrome de Marfan, homocistinuria, síndrome de Weill-Marchesani, síndrome de Ehlers-Danlos, osteogénesis imperfecta y un numeroso grupo de raros síndromes y dismorfismos craneofaciales, La mayoría tienen patrones hereditarios bien definidos. Pero hay otras enfermedades que también se pueden incluir en este grupo y en los que su carácter hereditario está peor definido; entre estas enfermedades incluiríamos, por ejemplo, la ectopia len1041 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES tis esencial. Es imposible describir todas ellas y nos referiremos a las más frecuentes. • Síndrome de Marfan. Enfermedad hereditaria, autosómica dominante de penetrancia completa, del tejido conectivo. Su origen se encuentra en mutaciones en el gen de fibrilina del cromosoma 15. Como se ha comentado en el capítulo sobre herencia, diferentes autores han descrito la localización de dicho gen en el cromosoma 15q21.130,31, así como otras posibles formas de herencia. Las manifestaciones clínicas son muy variables en los pacientes, destacando por su frecuencia la subluxación del cristalino, la aracnodactilia y el prolapso de la válvula mitral y dilatación de la raíz aórtica. Estas complicaciones cardiacas son las responsables de la prematura mortalidad del 90% de estos pacientes, por lo que la realización de una ecocardiografía es obligatoria. Además de la subluxación del cristalino, el síndrome de Marfan se asocia a otras complicaciones oculares como la miopía, el desprendimiento de retina, el glaucoma, la catarata presenil y la microesferofaquia, el estrabismo, las anormalidades del iris y, menos frecuentemente, el aplanamiento de la córnea. • Homocistinuria. Es una enfermedad genética autosómica recesiva, por déficit de la cistationina ‚-sintetasa, que asocia hábito marfanoide, retraso mentarl y enfermedad tromboembólica. Los síntomas predominantes son: miopía, luxación del cristalino y una tendencia a desarrollar trombosis venosas y arteriales; a los 10 años la ectopia lentis (subluxación del cristalino) es prácticamente constante junto con la miopía32. Usualmente, se observa algún grado de retardo mental, pero algunas personas afectadas tienen un coeficiente intelectual normal. El diagnóstico se confirma mediante el test de nitroprusiato sódico en orina. El tratamiento dietético y los suplementos vitamínicos reducen la incidencia de complicaciones oculares si se administran en las primeras seis semanas del nacimiento33. La valoración quirúrgica debe incluir la adopción de medidas para prevenir el riesgo de accidentes tromboembólicos y la hipoglucemia34. • Síndrome de Weill-Marchesani. Enfermedad transmitida de forma autosómica recesiva, aunque se han demostrado casos de transmisión autosómica dominante. Se caracteriza por estatura corta, braquidactilia y braquicefalia, engrosamiento de la piel y rigidez articular. Las manifestaciones oculares posibles son la microesferofaquia, la miopía y la ectopia lentis. El riesgo de subluxación de cristalino es algo más frecuente en la forma dominante que en la recesiva. • Ectopia lentis y ectopia lentis et pupillae. En la ectopia lentis, se observa una subluxación bilateral y simétrica durante la primjera infancia, de localización superotemporal y de herencia autonómica dominante. La primera es una enfermedad de transmisión autosómico dominante y el desplazamiento del cristalino puede ser 1042 la única manifestación de la misma. La ectopia lentis et pupillae se transmite de modo autosómica recesivo y al desplazamiento del cristalino y la pupila se pueden asociar miopía severa, desprendimiento de retina, aumento de los diámetros corneales, catarata, mala dilatación pupilar, transiluminación anormal de iris, persistencia de membrana pupilar, adhesiones iridohialoidea y procesos irídeos prominentes en el ángulo de la cámara anterior35. • Otras. Otras muchas enfermedades de carácter hereditario asocian subluxación del cristalino; su detallada descripción resultaría redundante. Destacaríamos. Síndrome de Ehlers-Danlos, hiperlisienmia, déficit de sulfito oxidasa, esclerodermia y retinosis pigmentaria, entre otras muchas. 2. Por enfermedades adquiridas, locales o sistémicas La subluxación de cristalino ha sido relacionada con la presencia de otra patología ocular o sistémica; tal vez su asociación a glaucoma congénito36, glaucoma de ángulo abierto y glaucoma de ángulo cerrado37, así como a uveítis38 sean las formas de manifestación más frecuentes. 3. Síndrome de pseudoexfoliación Probablemente es, en nuestro medio, la causa más frecuente de inestabilidad zonular. El síndrome de pseudoexfoliación se caracteriza por el depósito de un material blanquecino sobre el cristalino y el borde pupilar. Aunque se desconoce el origen del material pseudoexfoliativo, los agregados proceden del epitelio cristaliniano en la región preecuatorial, emergen a través de la superficie capsular e invaden las fibras zonulares, contribuyendo a su inestabilidad. Se asocia con la posibilidad de desarrollar diversas complicaciones oculares: elevada prevalencia de hipertensión ocular y glaucoma, mala dilatación pupilar, alta incidencia de ángulos estrechos y cierre angular, así como una tendencia a la subluxación e, incluso luxación, de cristalino tanto posterior como anterior, prequirúrgico o intraquirúrgica y, recientemente, también se ha asociado con el riesgo de luxación diferida del complejo zónulo-capsular, con lente intraocular incluida, a los años de la cirugía de catarata39. Es un hecho también bien conocido que los ojos con síndrome de pseudoexfoliación presentan un mayor riesgo de complicaciones quirúrgicas en la cirugía de la catarata, siendo la pérdida de vítreo cuatro veces más frecuente en estos ojos que en los ojos sin pseudoexfoliación40. La causa de esta complicación parece radicar, además de en la mala dilatación pupilar, en la presencia de unas zónulas más friables, ya que no existen diferencias ni en el grosor41 ni en la elasticidad26 de la cápsula del cristalino entre ojos normales y ojos con esta alteración. El material de pseudoexfoliación produce alteraciones a nivel zonular en 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS tres niveles: 1) En el origen y anclaje en el cuerpo ciliar; 2) En la pars plicata; y 3) En su inserción en la cápsula anterior del cristalino. En los agregados de material pseudoexfoliativo se ha demostrado la actividad de enzimas lisosomales cuya actividad proteolítica facilita la desintegración zonular26. Dehiscencia zonular iatrógena Existen diferentes procedimientos médicos y quirúrgicos que pueden provocar la deseinserción parcial del ecuador cristaliniano. Entre ellos se destacan las iridotomías con diferentes tipos de láseres sobre la periferia iridiana37, las trabeculectomías y otras cirugías endo-oculares. En estos casos, es prudente una exhaustiva exploración en la lámpara de hendidura con objeto de hacer patente tal diagnóstico y poder actuar en consecuencia. MANIFESTACIONES CLINICAS Los cambios en la posición del cristalino en la cámara posterior se pueden manifestar en forma de facodonesis, subluxación o luxación de la lente cristaliniana1,35. Como en cualquier otra situación clínica, en primer lugar deberemos realizar una exploración ocular detallada. Es necesario practicar una primera exploración con lámpara de hendidura sin dilatar la pupila; de esta forma la facodonesis, la iridodonesis y el aumento de profundidad de la cámara anterior son más evidentes que con la dilatación42. Al dilatar la pupila, se produce una retracción del iris y del cuerpo ciliar, siendo ésta la causa de que, bajo dilatación pupilar, se manifiesten con menor intensidad los movimientos y desplazamientos del iris y del cristalino. La confirmación diagnóstica más evidente de una subluxación es el desplazamiento del cristalino del eje pupilar (Fig. 1). Esta situación se evidencia mejor con la pupila dilatada. Además, deberíamos cuantificar, en grados, la extensión de la pérdida de inserción zonular así como su localización, signos clínicos importantes a la hora de elaborar el plan quirúrgico. También deberíamos anotar en qué dirección se encuentra desplazado el cristalino. En los traumatismos puede desplazarse en cualquier dirección. En el Síndrome de Marfan, la desviación es, en general, hacia arriba y hacia la zona temporal. Si el desplazamiento es hacia abajo y nasal deberíamos pensar en una homocistinuria. En los casos de traumatismos hay un dato que nos confirma la diálisis zonular, es la aparición de vítreo en la cámara anterior. Habitualmente se conserva la hialoides y el vítreo no sobrepasa el márgen pupilar. Se asocia generalmente a un síndrome contusivo del polo anterior, no siendo extraña la coexistencia de midriasis arrefléxica, lesiones del esfínter y alteraciones angulares. Una subluxación cristaliniana puede estar asociada a otras alteraciones oculares como el síndrome de pseudoexfo- Fig. 1. Subluxación de cristalino. La visualización del ecuador del cristalino es una manifestación evidente de la presencia de una subluxación de cristalino. liación, la miopía magna, las cataratas y, menos frecuentemente, los los colobomas cristalinianos. Es interesante, desde un punto de vista clínico, descartar dichas entidades pues su presencia nos obligará a modificar el plan quirúrgico. Si la subluxación es una manifestación más de un cuadro sistémico o de un síndrome, puede presentar algunas características específicas: se producen en pacientes jóvenes, el cristalino se va desplazando paulatinamente con el tiempo y mantienen intacta la barrera zónulo-capsular. MANIFESTACIONES INTRAOPERATORIAS La facoemulsificación se ha convertido en la técnica de elección en la cirugía de la catarata. Una de las complicaciones de esta técnica, sobre todo en la fase de aprendizaje, es la diálisis zonular iatrógena. Esta se puede producir con mayor facilidad si trabajamos con niveles altos de aspiración en el ecuador del saco capsular, ya sea durante la facoemulsificación del núcleo o en la irrigación-aspiración del córtex. El cirujano debe de estar alerta cuando existan factores predisponentes: no olvidemos que la mayor incidencia de complicaciones intraoperatorias se da en la asociación de catarata y síndrome de pseudoexfoliación 43,44. Aunque pensemos, con Osher45, que con la facoemulsificación la incidencia de complicaciones ha disminuido respecto a la cirugía extracapsular, hay que extremar las precauciones en presencia de un cuadro de pseudoexfoliación capsular. En el cirujano que practica facoemulsificación, su experiencia con la diálisis zonular iatrógéna hace que se encuentre familiarizado con aquéllos signos, directos o indirectos, que sugieran la presencia de una desinserción zonular. La presencia de una subluxación cristaliniana preoperatoria no hace sino anticipar la posible aparición de dichos signos. 1043 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES Tanto si la subluxación ha sido diagnosticada preoperatoriamente como si no, existen signos que deben hacernos sospechar una subluxación cristaliniana: • Dentro de los signos directos podemos encontrarnos con: 1) Visualización de la desinserción que, habitualmente, produce un incremento en la profundidad de la cámara anterior, sobre todo si se produce una hernia o pérdida vítrea; 2) El cristalino presenta tendencia a la inclinación sobre la zona de desinserción; y 3) También observaremos que con los cambios de presión en cámara anterior la dehiscencia zonular tiende a incrementar su extensión. • Existen también signos indirectos que nos deben hacer sospechar sobre la presencia de una dehiscencia zonular: 1) La aparición de pliegues radiales en la cápsula anterior dirigidas al sitio de la punción capsular (anuncia una pérdida de contratracción capsular periférica) (Fig. 2); 2) Otro signo puede aparecer en fases más avanzadas de la cirugía: si producimos una desinserción durante la facoemulsificación vamos a notar una pérdida de eficacia y cierto temblor en el núcleo, hechos que se agravan según la cantidad de vítreo interpuesto; 3) La infusión invertida (síndrome de mala dirección o mysdirection síndrome) que se manifiesta intraoperatoriamente en forma de aplanamiento de la cámara anterior por paso de fluidos a espacio vítreo a través de la zona de dehiscencia zonular; y 4) Aleteo iridiano, expresión del paso incontrolado de fluidos en ausencia de barrera zonular. MATERIALES Cuando sospechamos la presencia de una subluxación es necesario ir preparados a quirófano con algunos medios que nos facilitarán la cirugía (Tabla II). Mencionaremos algunos modelos y algunas casas comerciales pero sin pretender ser exhaustivos; en general, mencionaremos el material quirúrgico con el que tenemos experiencia. Destacaremos entre ellos: • Triamcinolona. Ha demostrado ser útil para teñir el vítreo46 y asegurar su completa eliminación de la cámara anterior antes de iniciar la cirugía. Fig. 2. Signos intraoperatorios. Algunos son evidentes y otros indirectos. 2.1. Visualización del ecuador del cristalino. Es un signo evidente. 2.2. Pliegues sobre la cápsula al iniciar la capsulorrexis. Es un signo indirecto de subluxación de cristalino. 1044 • Tinciones capsulares. El azul de metileno (Vison Blue®, D´Orc, Holanda) ha demostrado ser útil en la tinción de la cápsula anterior del cristalino cuando la densidad de la catarata no permite la visualización de dicha cápsula utilizando la retroiluminación47 • Ganchos de iris. Inicialmente descritos para favorecer la dilatación pupilar de forma instrumental y visualizar mejor el segmento posterior, encontraron su uso en la cirugía del segmento anterior y especialmente en la de la catarata48. Pueden utilizarse para mantener el saco capsular durante la facoemulsificación de un cristalino subluxado; sin embargo, para tal fin, Mackool desarrolló unos ganchos específicos con una angulación diferente de su zona proximal para adaptarse mejor a la cápsula anterior (Mackool Cataract Support System®; ref. MH-1005; FCI, EEUU). • Anillos capsulares. Los anillos capsulares convencionales pueden estabilizar el saco capsular durante la cirugía y en subluxaciones leves o moderadas pueden asegurar el correcto posicionamiento del saco capsular y el centrado de la lente intraocular. Siempre es necesario disponer de ellos bien para su uso aislado o para su uso combinado con otros anillos de sujeción. Existen diferentes modelos; los más habituales son los de la casa Morcher (Alemania): 1) Modelo 14 (12,30 mm de diámetro expandido y 10 mm contraído; se recomienda su uso para ojos de menos de 24 mm de longitud axial); 2) Modelo 14A (14,50 mm expandido y 12 mm contraído; se recomienda su uso para ojos de más de 28 mm de longitud); y 3) Modelo 14C (13 mm expandido y 11 mm contraído). A la utilización de los anillos capsulares se le suponen diferentes ventajas, entre ellas: 1) Mantienen el contorno circular del saco, incluso en presencia de una dehiscencia zonular; 2) Previenen la retracción asimétrica del saco y pueden evitar el descentramiento de las lentes intraoculares; 3) Aumentan la seguridad y eficacia de la facoemulsificación, evitando incluso la pérdida vítrea si coexiste dehiscencia zonular; 4) Inhiben la proliferación de células sobre la cápsula posterior pudiendo proporcionar una mayor calidad de visión; y 5) Pueden prevenir el síndrome de contracción de la capsulorrexis cuando dicha apertura sea pequeña. • Anillos de fijación. No sólo estabilizan el saco capsular sino que también lo aseguran para permitir un adecuado posicionamiento de la lente intraocular a medio-largo plazo. Entre ellos, destacan los anillos de Cionni (Fig. 3), existiendo diferentes variantes; las más habituales son los modelos 1L (MR-1L) y 2C (MR-2C) con un gancho, a la derecha (1L) o a la izquierda (2C), y el modelo 2L (MR-2L) con dos ganchos, uno a cada lado. Sus ventajas: 1) Pueden ser fijados a esclera; 2) Permite la expansión circular del saco capsular; 3) Estabilizan el cristalino durante la cirugía; 4) Mejoran el centrado de la lente; 5) Reducen el riesgo de fibrosis 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS Fig. 3. Anillos de Cionni. Además de expandir el saco permiten la fijación transescleral al poder suturar los pequeños ganchos laterales. 3.1. Anillo de Cionni 1L. Tiene un gancho de fijación. 3.2. Anillo de Cionni 2L. Tiene dos ganchos, enfrentados en 180°. capsular; y 6) Resisten la contracción capsular. Posteriormente describiremos sus usos. • Sutura de polipropileno. Es conveniente disponer de una sutura con una aguja larga, preferiblemente con dos agujas; hoy se recomienda utilizar suturas de 9/0 aunque las de 10/0 se han venido utilizando en los últimos años. • Lentes intraoculares. Dependiendo de la estabilidad capsular y de la conservación adecuada del saco capsular, podría implantarse cualquier tipo de lente. Hoy, recomendamos las lentes plegables pues pueden ser implantadas a través de incisiones de 3 mm. Si existiera cierta inestabilidad capsular serían más recomendables las de tres piezas. Siempre el material debe ser un material contrastado y altamente biocompatible; creemos que las lentes acrílicas hidrófobas cumplen tales criterios. fracaso de la misma, sería necesario plantear la cirugía49. La utilización de cicloplégicos nos permitirá utilizar la correccion óptica de la zona pupilar afáquica; sin embargo, esto no es válido en pacientes con mala dilatación como es el caso de los pacientes con pseudoexfoliación del cristalino. El efecto estenopeico de los mióticos puede servir para mejorar la visión del paciente y eliminar algunas molestias visuales. Hay autores12,50 que crean una iridotomía o iridoplastia óptica, con láser de argón o de Nd:YAG, con el fin de incrementar el tamaño del eje visual. Otros autores11 realizan una zonulolisis con láser de Nd:YAG con el fin de desplazar la lente del eje visual. Estas técnicas, inicialmente pensadas para evitar la cirugía, deben recurrir ocasionalmente a técnicas quirúrgicas ya que existe el riesgo de que se produzca un incremento de la presión intraocular, una luxación anterior de la lente con posibilidad de daño endotelial y glaucoma por bloqueo pupilar. La cirugía del cristalino debe ser planteada cuando existe riesgo de luxación, alteración funcional visual o catarata asociada. La técnica quirúrgica ha ido evolucionando a lo largo de los años. En la época de la cirugía intracapsular existía un alto porcentaje de complicaciones (desprendimiento de retina, glaucoma secundario, vitreorragia, edema corneal, hifema recurrente, etc.)51,52. La aparición de la lensectomía por vía pars plana o limbo, con instrumentos automáticos de corte y aspiración del vítreo53,54 mejoró el pronóstico funcional y anatómico de estos pacientes55-57. Con esta técnica se eliminan el cristalino y el vítreo anterior y con ello la reacción plástica e inflamatoria del polo anterior disminuyen considerablemente, circunstancia a considerar especialmente en niños. En éstos, al mejorar la transparencia de medios, podremos realizar una refracción y corrección óptica precoz, importante aspecto en la lucha contra la ambliopía. El aspecto negativo de esta técnica es que no deja soporte para la futura implantación de una lente intraocular. ESTRATEGIAS TERAPÉUTICAS En los casos en los que observemos que el cristalino presenta mínimos signos de subluxación, sin sintomatología, la actitud debe de ser expectante. Si se produce un cambio miópico, por el cambio en el radio de curvatura, corregiremos la refracción del paciente así como el astigmatismo y el posible efecto prismático que puedan provocar alteraciones visuales49 La corrección refractiva es especialmente importante en niños, ya que si se observara tendencia a la ambliopía, por Tabla II. Material quirúrgico recomendable en el manejo de la subluxación de cristalino • Tinciones: – Triamcinolona – Tinciones capsulares • Ganchos de iris • Anillos capsulares • Anillos de fijación • Sutura de polipropileno • Lentes intraoculares CONCEPTOS ACTUALES El objetivo básico de la cirugía extracapsular, con o sin facoemulsificación, es mantener la cápsula posterior como una barrera frente al vítreo; es decir, mantener la compartimentalización ocular. Además, si mantenemos el saco capsular abierto a través de una capsulorrexis e introducimos la lente intraocular dentro del mismo, aislamos la lente de otras estructuras oculares. Estos conceptos, universalmente aceptados, deben ser también los objetivos perseguidos cuando nos planteamos el abordaje quirúrgico de un paciente con una dehiscencia zonular: deberíamos intentar mantener el saco cristaliniano para mantener la barrera frente al vítreo e implantar la lente dentro del saco. Los principios en los que nos vamos a centrar son dos (Tabla III): 1. Asegurar la estabilización del cristalino intraquirúrgicamente como para poder practicar capsulorrexis, facoemulsificación e implantación de lente en saco. 2. Asegurar que la estabilidad capsular se mantendrá postoperatoriamente para mantener la lente centrada, 1045 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES Tabla III. Objetivos en el manejo quirúrgico de la subluxación de cristalino 1. Asegurar la estabilización del cristalino intraquirúrgicamente 2. Asegurar la estabilidad del saco capsular y el centrado de la lente a largo plazo evitar los fenómenos disfotópsicos y asegurar una buena función visual a largo plazo. Pude ser que tales objetivos no puedan ser conseguidos; es necesario acudir a quirófano pensando en posibles alternativas. Las alternativas a la pérdida de soporte capsular son las lentes de cámara anterior, que hoy debería ser de asas abiertas y flexibles, las lentes de cámara anterior fijadas en iris (tipo Artisan®), las lentes de cámara posterior suturadas a iris y las lentes de cámara posterior suturadas a sulcus. Unas y otras presentan sus ventajas e inconvenientes, que es necesario conocer. De variables como el remanente capsular, la edad del paciente, el estado del endotelio y la experiencia del cirujano tomaremos la decisión sobre una u otra opción. Dichas alternativas son tratadas en otros capítulos. Siguiendo con la idea desarrollada en este capítulo, estabilizar saco capsular y facoemulsificación, revisemos las claves para recomendar tal proceder: • Hara13 introduce el concepto de «anillo ecuatorial», «anillo endocapsular» o «anillo de tensión capsular» como la forma de evitar la contracción del saco capsular al introducir en el mismo un anillo de PMMA en un intento de prevenir el descentramiento de la lente intraocular. Este anillo ejercería una compresión mecánica sobre las células epiteliales del ecuador, evitando su proliferación y manteniendo el contorno del saco capsular en forma circular, independientemente del tamaño del mismo. • Legler58 describe la utilización de un anillo capsular, en casos de dehiscencia zonular, para estabilizar el saco durante el acto quirúrgico. • Tales conceptos se aplican también al manejo de los cristalinos subluxados parcialmente para poder asegurar su estabilización tras la cirugía de catarata. • El problema sigue siendo, y estamos a mediados de los 90, estabilizar el saco durante la cirugía para poder practicar una facoemulsificación exitosa. Diferentes autores5961 reconocen la utilidad de los ganchos de iris para tal menester; los mencionados anillos habían sido descritos para mejorar la visualización retiniana, manteniendo la pupila en cierto nivel de dilatación, durante la vitrectomía62. • Nosotros mismos19, reconocimos la necesidad no sólo de utilizar los ganchos de iris para estabilizar el cristalino tras la capsulorrexis sino también la de asegurar su estabilidad a largo plazo; para ello, sugeríamos el uso de ganchos para estabilizar el cristalino y la sutura transcapsular y transescleral de los anillos, técnica que consiguió adecuadamente tales objetivos. • También son varios los autores16,63-66 que señalan el interés de implantar estos anillos en casos de subluxación 1046 cristaliniana, donde la estabilización del saco capsular permitiría realizar la facoemulsificación del cristalino y posteriormente implantar la lente en el saco capsular. Dicho anillo estabiliza el contorno circular del saco tensándolo e impidiendo la herniación del vítreo, por un lado, y el colapso capsular durante la facoemulsificación cuando ya existe poco núcleo que lo contornee, por otro. Además, en el postoperatorio inhibiría la proliferación de células epiteliales evitando la contracción irregular del saco y el descentramiento de la lente intraocular. • Los anillos modificados, conocidos como anillos de Cionni, fueron la última sofisticación para asegurar los anillos a sulcus y evitar los descentramientos67. CRITERIOS EN LA TOMA DE DECISIONES Existen diferentes factores que deben ser valorados preoperatoriamente; de ellos, se derivará la decisión de alternativa quirúrgica que nos planteemos. Revisaremos algunos de los criterios que consideramos básicos. Extensión de la subluxación Como hemos mencionado, es imprescindible valorar la extensión de la subluxación preoperatoriamente; sin dilatación y con dilatación, por signos directos y por signos indirectos, con el paciente sentado y con el paciente tumbado. En base a la extensión de la subluxación, recomendaríamos (Tabla IV): 1. Desinserción menor de 90º. Puede ser resuelta con un anillo convencional sin suspensión a sulcus. Lo normal es que no sea necesario suspender el cristalino con ganchos de iris. En ojos de longitud axial normal, un anillo Morcher 14, en un ojo de longitud axial larga, un anillo Morcher 14. Es conveniente implantar el anillo después de la capsulorrexis y antes de la facoemulsificación. 2. Desinserciones de 90 a 180º. El planteamiento debe ser intentar implantar un anillo de Cionni 1L: es decir, suturaremos un anillo con un soporte. Es conveniente implantarlo tras suspender el cristalino con unos ganchos de iris; la implantación en esa fase hace que el gancho del anillo pueda dificultar la facoemulsificaTabla IV. Extensión de la subluxación y recomendación quirúrgica Extensión Recomendación Menor de 90° De 90 a 180° • • • • • Mayor de 180° Anillos convencionales, Morcher 14 ó 14A Anillo Cionni 1L Sutura transcapsular de anillo 14 ó 14A Anillo Cionni 2L ¿Lensectomía pars plana? 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS ción. Otras alternativa es implantar un anillo normal, practicar la facoemulsificación y después implantar el Cionni 1L, retirando el anillo normal (habrá sido necesario enhebrar su extremo) o sin retirarlo. En estos casos, la sutura transcapsular de anillos convencionales (14 ó 14A) es una opción a no descartar19. 3. Desinserciones mayores de 180º. Primero hay que estabilizar el saco capsular tras la capsulorrexis con 2 ó 4 ganchos de iris; después implantar el anillo de Cionni 2L, lo que dificultaría sobremanera la facoemulsificación o implantar inicialmente un anillo convencional y actuar según hemos descrito en el párrafo anterior. implantar, etc. No creemos que estos casos sean los ideales para plantear lentes de ópticas especiales tipo asféricas o difractivas pues los riesgos de descentamiento son elevados. Plan básico de actuación Es difícil prever todas las circunstancias que pueden suceder durante la cirugía de un cristalino subluxado, probablemente una de las cirugías de cristalino menos previsibles. En la Fig. 4, recogemos un plan básico de actuación, plan que explicaremos en los siguientes apartados. Dureza de la catarata y otras condiciones del cristalino TÉCNICA QUIRÚRGICA En cataratas muy duras, cualquier procedimiento puede estar comprometido, de forma más acusada en presencia de una subluxación de cristalino. En cataratas de gran dureza y gran subluxación, sería conveniente valorar otras alternativas sin poder descartar la cirugía intracapsular in toto. En algunos casos, la lensectomía pars plana puede ser considerada. Una consideración especial merecen: 1. La catarata blanca o negra que requieran tinción capsular para practicar la capsulorrexis. En estos casos existe riesgo de paso de colorante a cámara vítrea y dificultará la visualización de todos los pasos quirúrgicos al perder los beneficios de la retroiluminación durante la cirugía. 2. La catarata infantil dado que su elasticidad capsular también puede comprometer la cirugía. 3. La catarata muy descentrada, que dificultará una rexis centrada. 4. La microesferofaquia, patología en la que no tendría no tendría mucho sentido centrar el saco capsular con un anillo de Cionni: el ecuador seguiría quedando lejos del sulcus como para permitir su sutura. 5. Otras. Cualquier situación imaginable tendrá sus propias lecturas que exigirán una valoración personalizada. Respecto al tipo de anestesia a utilizar, es necesario hacer algunas consideraciones. Tanto la anestesia general como la loco-regional (retrobulbar, peribulbar y subtenoniana) pueden ser buenas opciones. La anestesia general retrasará el momento del alta y limitará la posibilidad de practicar el procedimiento en cirugía ambulatoria. Tanto la general como la loco-regional permitirán, de ser necesaria, la práctica de ventanas esclerales y la sutura transescleral del anillo capsular o de la lente intraocular cuando sea necesario. Una consideración aparte merece la anestesia tópica en estas situaciones. De utilizar lidocaína intracamerular al 1%, existe riesgo de paso de la misma a través de las zonas carentes de fibras zonulares y la pérdida transitoria de visión por toxicidad retiniana, descrita en casos de roturas capsulares, es, al menos teóricamente, posible. En cualquier caso, la anestesia tópica presenta el inconveniente de que la analgesia que proporciona puede ser insuficiente si es necesario recurrir a suturas transesclerales bien del anillo capsular o de la lente intraocular. Presencia de vítreo El vítreo en cámara anterior exige actuar sobre él antes de iniciar la cirugía de cristalino. Debe plantearse una vitrectomía por cámara anterior o si puede resultar más razonable una vitrectomía vía pars plana; el planteamiento será diferente y si la vitrectomía necesaria fuera extensa, puede agravar la subluxación antes de la cirugía. Otras consideraciones Caben muchas: estado refractivo del ojo contralateral, edad del paciente y necesidades visuales, tipo de lente a Fig. 4. Plan básico de actuación en subluxación de cristalino. Se describe una rutina básica en estas situaciones. 1047 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES Incisión De ser posible, la incisión debería ser practicada en la zona opuesta a la subluxación (Fig. 5). Con dicho proceder, minimizaríamos las tracciones sobre la zona de desinserción zonular, tanto durante la realización de la capsulorrexis como durante la facoemulsificación del núcleo, el aspirado del córtex o la implantación de la lente intraocular. Las limitaciones a este proceder son, habitualmente, anatómicas; difícilmente será posible practicar un incisión nasal inferior cuando la subluxación sea temporal superior, o nasal superior cuando la subluxación sea temporal inferior. Existen otros condicionantes que es necesario mencionar: presencia de cirugías previas de glaucoma, por ejemplo, o cicatrices corneales, presencia de sinequias periféricas en la hipotética zona de incisión, circunstancias que pueden condicionar el abordaje quirúrgico mencionado. De no ser posible el proceder descrito, en función de la localización de la subluxación, la incisión puede ser practicada a 90º de la misma. Como norma, debe evitarse la práctica de incisión en la zona de subluxación debido a sus riesgos inherentes: agrandamiento de la subluxación o vitreorragia, entre otros. El abordaje puede ser escleral o corneal. En ambas situaciones se aconseja, de forma previa a la cirugía, pretallar una ventana escleral, por si fuera potencialmente necesaria la sutura de la lente intraocular o del anillo capsular al sulcus. Hay que tallar una ventana escleral siempre que nos planteemos suturar un anillo de Cionni. Dicha ventana escleral debe practicarse en la zona de la desinserción zonular, zona en la que previsiblemente será necesario practicar la sutura transescleral, y de forma previa a completar la entrada intraocular debido a la conocida dificultad que entraña su tallado una vez abierto el globo ocular cuando el mismo se encuentra hipotónico. Manejo del vítreo Su presencia es más frecuente en casos de subluxación tras traumatismos. Fig. 5. Incisión y suspensión cristaliniana. Son claves para el éxito. 5.1. Incisión y preparación. Lo ideal, la incisión en la zona opuesta a la desinserción; respecto al viscoelástico, primero un viscoelástico dispersivo para alejar el vítreo. 5.2. Estabilización capsular. Los ganchos de iris suspenden y estabilizan al cristalino, facilitando la facoemulsifica1048 Una maniobra útil es la tinción de la cámara anterior con triamcinolona: identifica el vítreo que penetra en cámara anterior, facilita el control de la vitrectomía y, además, es un potente antiinflamatorio. Si se objetivara su presencia, es conveniente la vitrectomía tras tallar la ventana escleral. Si la cantidad de vítreo es autolimitada, vitrectomía por cámara anterior a dos vías y en cantidad suficiente para liberar el ecuador cristaliniano pero no en cantidad excesiva como para permitir que se extienda la subluxación. La misma debe practicarse, preferentemente, con irrigación a través de una vía de asistencia alejada de la zona, es decir: vitrectomía con dos vías. Los sistemas coaxiales de vitrectomía, habituales aún en algunso equipos de facoemulsificación, hidratan el vítreo a nivel de la dehiscencia zonular y posibilitan la vitreorragia interminable. Los sistemas de dos vías permiten el aislamiento del vítreo a eliminar. Existiendo diversas opciones, la más sencilla es separar el manguito de irrigación del sistema de corte-aspiración e introducir ambos por incisiones separadas, bien sean las existentes (incisión de entrada en cámara anterior y paracentesis de servicio) o nuevas. Viscoelásticos Ciertas variantes de las técnicas en escudo68 pueden resultar de gran utilidad en estos casos. Inicialmente, la zona de deficiencia zonular se cubre con un viscoelástico dispersivo (Fig. 5). A continuación, se inyecta un cohesivo o un viscoadaptativo. De esta forma se evita el paso de vítreo hacia cámara anterior. Capsulorrexis De existir vítreo en cámara anterior, ya hemos comentado que la primera maniobra a practicar sería la vitrectomía. Eliminado el vítreo de la cámara anterior o cuando su presencia a través de la dehiscencia zonular no es evidente, se procede a introducir viscoelástico taponando en primer lugar dicha zona. Estabilizadas la zona de dehiscencia zonular y el diafragma irido-cristaliniano es el momento de practicar la capsulorrexis. La capsulorrexis, especialmente dificultosa en estas situaciones, debe practicarse de forma que se minimicen las tracciones no sobre la dehiscencia zonular, donde ya se han perdido las fibras zonulares, sino sobre los extremos de la misma con objeto de no extenderla. Especialmente difícil resulta el iniciar la capsulorrexis debido a la inestabilidad capsular. Es por ello especialmente útil iniciarla en una zona donde la zónula se encuentre íntegra y la cápsula ofrezca suficiente resistencia. Es frecuente la formación de pliegues en la cápsula anterior al intentar abrir la misma (Fig. 2); es difícil dar consejos: intentarlo, con delicadeza pero con decisión, y nunca antes de reponer cámara an- 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS terior con abundante viscoelástico que tensará ligeramente la cápsula anterior y facilitará el inicio de la capsulorrexis. La combinación de aguja y pinza y la ejecución de movimientos controlados, iniciados preferentemente alejados de la zona de desinserción, como se ha comentado, permitirán completar tan crucial paso. Las tracciones sobre la cápsula en dicha zona deben ser practicadas, de ser necesarias, hacia la dehiscencia zonular y nunca en sentido contrario. La práctica de capsulorrexis es condición previa si consideramos utilizar posteriormente un anillo capsular. Añadiríamos que la capsulorrexis ideal debe ser lo más amplia posible con objeto de posibilitar la luxación anterior del núcleo si fuera necesario; entendemos que no siempre es posible practicarla del tamaño deseado. Sujeción con ganchos de iris Completada la capsulorrexis procederemos a suspender el saco con 2 ganchos en la zona de la deseinserción zonular si ésta es menor de 180º (Fig. 5) y con 3, 4 ó 5 si fuera mayor. No deben ser retiradas hasta suturar el anillo e implantar la lente intraocular. Existen unos anillos específicos diseñados por MacKool (Fig. 6) que tienen una pequeña angulación para facilitar la suspensión del cristalino y facilitar la facoemulsificación. También, Ahmed diseñó un dispositivo, que puede considerarse un sector de anillo, que permite suspender el saco (Fig. 6). Hidrodisección-hidrodelaminación La hidrodisección-hidrodelaminación debe ser meticulosa y asegurar la correcta liberación del núcleo cristaliniano. Utilizamos una cánula de 27 G introducida bien a través de la incisión o a través de la paracentesis de servicio; en cualquier caso, es útil dirigirla hacia la zona de la desinserción y no en sentido contrario, circunstancia que ampliaría la desinserción. Una vez practicada, el núcleo debe girar libremente dentro del saco capsular. Con ello, se minimiza la transmisión de los movimientos rotacionales que sean necesarios realizar durante la facoemulsificación del núcleo al saco capsular, li- Fig. 6. Sistemas de suspensión cristaliniana. Son alternativas a los ganchos convencionales. 6.1. Ganchos de Mackool. Presentan una angulación que facilita la suspensión con menor tracción sobre el cristalino. 6.2. Anillo de Ahmed. Permite suspender también el cristalino. mitando así el riesgo de aumentar la dehiscencia zonular. En algunas ocasiones es necesario practicar viscodisección separando el núcleo del material cortical; también puede ser necesario el viscoelástico para separar el córtex de la cápsula cristaliniana. Implantación de anillo capsular Si en este momento observamos que el cristalino es manifiestamente inestable y que la facoemulsificación del núcleo no es posible con un mínimo de seguridad, podemos plantearnos la implantación de un anillo capsular67,69,70. Recomendamos hacerlo de rutina si la desinserción es superior a 90º. Es condición imprescindible el haber practicado una correcta hidrodisección cristaliniana. Si el cristalino es moderadamente inestable puede ser suficiente la implantación del anillo capsular; si la inestabilidad es mayor, lo correcto puede ser necesitar un anillo que pueda ser suturado a sulcus. El anillo puede ser uno convencional (14 ó 14A, en función de la longitud axial) o el definitivo (1L, 2L). Si se utiliza un anillo de Cionni, éste debería ya llevar pasadas las suturas, teniendo cuidado de evitarlas durante todas las manipulaciones en segmento anterior. Hoy recomendaríamos suturar el anillo de Cionni ya en esta fase, antes de proceder a la facoemulsificación: la estabilización capsular facilita la facoemulsificación. Ahmed, basado en estudios en ojos de cadáver, sugiere que sería mejor implantar los anillos tras la extracción del cristalino dado que así existiría menor riesgo de desestabilización capsular70. Somos partidarios de implantarlos en esta fase (Fig. 7); estabilizan el saco capsular e impiden su colapso en las últimas fases de la facoemulsificación del núcleo. Los anillos convencionales (14 ó 14A) pueden ser implantados directamente en el saco capsular con la ayuda de una pinza tipo Kelman-McPherson o con una inyector; los anillos de Cionni hay que implantarlos, en general, con pinzas, aunque existe algún modelo implantable con inyector. El anillo debe ser implantado centrífugamente hacia la zona de la inserción (Fig. 8); es práctico posicionar su primer Fig. 7. Implantación de anillos. Existe la opción de implantarlos antes de la facoemulsificación o al acabarla. 7.1. Implantación antes de la facoemulsificación. Pensamos que es la mejor opción pues estabiliza el cristalino y evita el colapso del saco al final de la facoemulsificación. 7.2. Implantación tras la facoemulsificación. En este caso se completó la facoemulsificación antes de implantar el anillo. 1049 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES Fig. 8. Implantación de anillo capsular. En este caso se implanta el anillo tras la facoemulsificación del cristalino. 8.1. Reposición capsular con viscoelástico. Se expande el saco para facilitar la implantación del anillo. 8.2. Inicio de la implantación. Se busca uno de los extremos de la subluxación (superior derecha). 8.3. Avance. Se sigue rotando el anillo, apoyándolo contra la deseinserción. 8.4. Finalización. El anillo se posiciona finalmente con pinzas. extremo en uno de los extremos de la desinserción y seguir inyectándolo contra la desinserción hasta que se posicione en toda su extensión. Por ejemplo, ojo derecho y desinserción de 4 a 9,00 horas; practicada la incisión a las 12,00 horas, el extremo del anillo se apoyará a las 9,00 horas y se iniciará la implantación con el anillo corriendo en sentido horario y desplazando el extremo del inyector en sentido antihorario. Esta maniobra sirve tanto para anillos convencionales como para anillos de Cionni. Para los anillos convencionales existe la posibilidad de plegarlos, introducir la zona de flexión en la zona de desinserción y liberarlo; esta maniobra permite posicionar sus extremos casi sin necesidad de rotar el anillo. Esta maniobra exigiría mayor manipulación del Cionni, comprometer el paso de los ganchos de posicionamiento por la incisión y aumenta la posibilidad de romperlos. Facoemulsificación del núcleo La facoemulsificación del núcleo puede ser practicada dentro o fuera del saco según la preferencia del cirujano; en esta última situación sería necesario haber practicado una extensa capsulorrexis que permitiera el prolapso del núcleo, bien por hidrodisección o por viscoexpresión. Es poco probable conseguir una capsulorrexis de tamaño suficiente, en estos casos, como para luxar el cristalino fuera del saco. Si la desinserción fuera pequeña, un anillo convencional no permitirá una facoemulsificaicón sin sorpresas. Si la desinserción fuera grande, la sutura del anillo de Cionni estabilizará el saco como para practicar la facoemulsificación; hay que advertir que, en estos casos, cualquier tracción provocaría la rotura de la sutura del anillo y la complicación de la cirugía. Si el núcleo fuera blando y existiera la posibilidad de practicar facoaspirado o chip&slip71, el anillo puede ser implantado tras la facoemulsificación del núcleo, tal y como describiremos, de forma previa al aspirado del córtex. Como técnica de facoemulsificación, lo deseable sería practicar una facoaspiración del núcleo, posibilidad por otro lado infrecuente. En núcleos blandos, la técnica de chip&flip permite limitar las tracciones sobre el saco capsular. En núcleos moderados o 1050 duros, donde es necesario utilizar técnicas de fractura (cracking), la técnica en V de Kelman limita la necesidad de rotación del núcleo y puede ser especialmente útil. Esta técnica consiste en tallar dos surcos con vértice a nivel subincisional; con la incisión supuestamente posicionada en la zona opuesta a la inserción, todos los movimientos irían hacia la subluxación siendo los movimientos que menos pueden ampliar la dehiscencia zonular. En otras técnicas de cracking deben minimizarse las tracciones zonulares, aunque el anillo capsular puede proporcionar suficiente estabilidad capsular. Es útil practicar la facoemulsificación a bajo nivel de flujo de infusión, flujo y vacío en una técnica muy parecida al «slow-motion phacoemulsification» de Osher72. Hoy, las técnicas de chop provocan menos tracciones sobre la zónula que las técnicas de fractura; serían, por ello, las más recomendables en estas situaciones. Proporcionan menores tracciones, son más eficaces en la destrucción de cataratas de dureza modera y permiten un mayor ahorro de energía 73. Serían las técnicas a recomendar. Aspiración del córtex Con el saco capsular asegurado, practicamos aspiración automática. Los movimientos de la punta de aspiración deberían ser tangenciales y no radiales. Capturada la masa en el ecuador del cristalino se tracciona tangencialmente llevando la punta del facoemulsificador hacia el centro (nunca debe llegar a esta zona) controlando que el anillo no se desplace centralmente. Si por casualidad no hubiéramos seguido las recomendaciones comentadas como la implantación previa del anillo, deberíamos hacerlo ahora para asegurar que el saco seguirá estable una vez retiremos los ganchos de iris. Estabilización capsular Ya hemos comentado que preferimos implantar el anillo antes de la facoemulsificación. Si hemos optado por un anillo de Cionni, su sutura puede ser practicada antes de iniciar 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS la facoemulsificación. Si vamos a suturar un anillo convencional transcapsularmente, tal maniobra no puede hacerse hasta finalizar la facoemulsificación del cristalino por motivos evidentes. 1. Sutura transcapsular de anillo convencional Si vamos a suturar un anillo transcapsularemente, hemos tenido que completar antes la facoemulsificación (Fig. 9). Se repone el saco capsular con viscoelástico, se posiciona la zona de la lazada a la altura de la ventana escleral, se pasa la aguja a través del ecuador del cristalino hasta espacio escleral y se anuda. Implantada la lente, se pueden retirar los ganchos. 2. Estabilización de anillos de Cionni En este caso puede suturarse el anillo antes de la facoemulsificación, técnica recomendable si la subluxación es amplia pues estabiliza el cristalino, o después de la facoemulsificación cuando, por diferentes circunstancias no se haya podido hacerlo antes. Para ello, se repone espacio retroridiano y precristaliniano con viscoelástico y se guía la sutura hasta la ventana escleral, se pasan las agujas por pars plana y se anuda (Fig. 10). Implantación de lentes intraoculares Lo deseable sería implantar una lente de diámetro grande (mayor de 6 mm) con objeto de minimizar los síntomas si se produjera descentramiento de la misma. La lente puede ser implantada en el saco o en el sulcus; en ambos casos, deben evitarse las maniobras de rotación. Algunos autores, aconsejan apoyar los hápticos en el sulcus, donde aún exista soporte zonular, capturando la óptica de la lente a través de la capsulorrexis al igual que se pasa un botón por un ojal. Es necesario decir que, completada la facoemulsificación y la aspiración del córtex, el anillo proporciona suficiente estabilidad al saco capsular como para implantar una lente in- tracapsularmente aunque lo correcto sigue siendo apoyar los hápticos de la misma en la zona de la desinserción. En sacos especialmente inestables, la sutura transcapsular del anillo proporciona la estabilidad necesaria como para soportar una lente dentro del saco (Fig. ). Si por cualquier motivo no procediera la implantación intracapsular de la lente intraocular, la misma puede implantarse a nivel del sulcus, suturada o no, y se le puede proporcionar una mayor estabilidad capturando la óptica dentro de la capsulorrexis, como se ha mencionado. Alternativas Pensamos que en estas situaciones debemos acudir a quirófano con un plan alternativo; no siempre es posible cumplir nuestros objetivos. Cuando la complejidad del caso o el devenir de la cirugía nos impiden conservar el saco capsular, pensamos que la lensectomía refractiva vía pars plana puede ser la mejor alternativa (Fig. 11). En estos casos, el problema es decidir qué tipo de lente intraocular implantaremos en ausencia de soporte capsular. Hoy nuestro estilo de práctica, en estos casos, contempla dos alternativas: 1) Lentes de cámara anterior; y 2) Lentes suturadas a iris. Las lentes suturadas a iris las contemplamos en ausencia de remanente iridiano o cuando los antecedentes (glaucoma e inflamación, por ejemplo) lo contraindiquen. Para pacientes de más de 70-80 años y con una buena reserva endotelial, las lentes de cámara anterior de asas abiertas y flexibles siguen siendo una buena opción. Las lentes suturadas a iris son otra alternativa que ha sido tratada en otro capítulo. COMENTARIOS El uso de anillos capsulares cambió sustancialmente la forma de abordar la cirugía del cristalino subluxado en la pasada década Los usos clínico-quirúrgicos de tal tipo de dispositivos han sido ampliamente debatidos en los últimos años73-78 y su uso extendido tanto al manejo de subluxaciones adquiridas en edad adulta73,77,78 como en edad pediátrica74-76. Fig. 9. Sutura transcapsular del anillo. Se presentan diferentes detalles. 9.1. Posicionamiento de la sutura. Se posiciona el hilo a nivel de la ventana escleral. 9.2. Sutura transcapsular. Se pasa el primer cabo de la sutura a través del ecuador del cristalino. 9.3. Sutura transcapsular del segundo extremo. Se pasa el segundo cabo de la misma forma, también transcapsularemente, y se anuda en la esclera. 9.4. Finalización. Tras implantar la lente, se retira el gancho y se comprueba la estabilidad del saco capsular. 1051 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES Fig. 10. Subluxación de cristalino con anillo Cionni 1L. Subluxación de cristalino en zona temporal (izquierda de la imagen) y muy mala dilatación pupilar. 10.1. Aspecto preoperatorio. Máxima dilatación bajo midriáticos; se abrió la pupila con ganchos de iris que tras la capsulorrexis se resuspendieron sobre ella. 10.2. Preparación del anillo. Se pasa la sutura por el orificio del gancho. 10.3. Implantación de anillo Cionni 1L. Se inicia la implantación contra la desinserción. 10.4. y 10.5. Posicionamiento del gancho. Se posiciona el gancho en la zona en la que va a ser suturada. 10.6. Implantación de la lente intraocular. Se implanta una lente acrílica con inyector. 10.7. Posicionamiento de la lente intaocular. La lente se estabiliza en su posición final. 10.8. Finalización. Se retiran los ganchos y se sutura la ventana escleral y la conjuntiva. Estamos en condiciones de afirmar que de poder estabilizar adecuadamente el cristalino, su facoemulsificación es posible. No obstante, también sería necesario fijar el saco caspsular para que permanezca estable: ello exige suturar el anillo, bien transcapsularmente o con un anillo especial tipo Cionni. Las incisiones en la zona opuesta a la desinserción, los viscoelásticos dispersivos para compartimentalizar la cámara anterior, la posterior y la cámara vítrea, y el uso de ganchos para sujetar el cristalino a través de la capsulorrexis, son motivo de consenso. Existen ciertas dudas sobre el momento óptimo para implantar el anillo: pensamos que, de ser posible, antes de la facoemulsificación sigue siendo la mejor opción a pesar de voces en contra que consideran sería mejor hacerlo tras facoemulsificar el cristalino70. Esta actitud hace que las últimas fases de la facoemulsificación, con un cristalino realmente suelto y el saco capsular con tendencia al colapso, sean un momento de riesgo para la cápsula posterior. Los anillos de Cionni han desplazado a otras opciones. Las suturas transcapsulares que hemos practicado con asiduidad en los últimos diez años nos han permitido observar una gran estabilidad del saco capsular a largo plazo; un único caso presentó un desgarro de la cápsula intraoperatoriamente y el contorno de la rexis y el centrado de la lente se mantienen a largo plazo. Los anillos de Cionni presentan algunos inconvenientes; técnicamente son más complejos de 1052 implantar y cuando se produce una fibrosis de la cápsula anterior pueden desplazar excéntricamente la capsulorrexis (especialmente el modelo 1L) (Fig. 12.1), además de la posibilidad de captura pupilar que presentan los ganchos de sujeción82,84. Por otro lado, numerosos casos nos hablan de la bondad de tal procedimiento, proporcionando excelentes resultados estéticos y funcionalres (Fig. 12.2). Es motivo de consenso, que en estas situaciones el objetivo no es solo practicar facoemulsificación sino también asegurar la posición del saco a largo plazo. Por ello, es importante diferenciar si se trata de un caso con una desinserción estable y no progresiva o si, por el contrario, el problema puede ser progresivo. En esta situación, la estabilidad de hoy no puede ser asegurada para mañana. En base a tales criterios (no progresivo o progresivo) se pueden dar unas recomendaciones que quedan recogidas en la Tabla V y que completan las recogidas en la Tabla IV. También es cierto que aunque el cuadro no sea progresivo, sí lo puede ser la degradación de la sutura; de ahí que hoy se recomiende utilizar mejor polipropilenos de 9/0 frente a 10/0. Respecto a los resultados con el proceder aquí sugerido, la rehabilitación refractiva y visual con estos procedimientos mejora notablemente respecto a otras técnicas del pasado7981 y el adecuado posicionamiento de la lente es posible en la mayor parte de los casos. 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS Tabla V. Cristalinos subluxados: recomendaciones actuales Desinserción No progresivo Progresivo <45° 45°-90° Anillo 14/14C/14A Anillo 14/14C/14A 90°-180° Cionni 1L/2C Transcapsular Cionni 2L Transcapsular (2) Cionni 1L/2C Cionni 1L/2C Sutura transcapsular Cionni 2L Transcapsular (1) Lente iris >180 Sin embargo, la técnica quirúrgica es compleja y no está exenta de complicaciones70,80,82-84; como siempre, el tiempo determinará la gravedad de las mismas. En cualquier caso, existen alternativas a la afaquia que abren nuevas esperanzas a los pacientes con cristalinos subluxados. CONCLUSIONES Fig. 11. Catarata subluxada y vitrectomía pars plana. En este caso, la dureza de la catarata y la extensión de la subluxación recomiendan la lensectomía pars plana. 11.1. Aspecto intraoperatorio. Se observa una subluxación superior a 180° y una catarata blanca. 11.2. Lensectomía. Se decide la práctica de lensectomía pars plana. 11.3. Luxación de cristalino. Con mínimas maniobras, el cristalino se luxa a cámara vítrea. 11.4. Vitrectomía. Lensectomía y vitrectomía para adecuada eliminación de todos los restos cristalinianos. 11.5. Afaquia. Tras la lensectomía, la pupila tiene una forma normal que permitirá implantar una lente en cámara anterior. 11.6. Implantación de lente de cámara anterior. Se decide implantar una lente en cámara anterior que se posiciona adecuadamente. Las técnicas quirúrgicas actuales utilizadas en el manejo de las subluxaciones cristalinianas permiten conservar el diafragma capsular y la compartimentalización normal del globo ocular, implantar la lente intraocular en cámara posterior y posibilitan una mejor recuperación funcional evitando ciertos riesgos inherentes a otras técnicas. Hace aún pocos años, diferentes cirujanos preferían practicar extracción intracapsular del cristalino cuando la desinserción se extendía más allá de 4-5 horas. En cualquier caso, es necesario recordar que una diálisis zonular hace que tanto la facoemulsificación, el aspirado del córtex como la implantación de la lente intraocular pueden ser difíciles incluso para las manos más expertas. En los úl- Fig. 12. Casos de catarata subluxada implantados con anillos de Cionni 1L. Buena recuperación funcional en ambos casos. 12.1. Contracción capsular asimétrica. A pesar del buen aspecto, en la zona superior de la pupila se intuye el borde de la rexis (el gancho del anillo de Cionni está suturado inferiormente). 12.2. Excelente evolución estética y funcional. Esta imagen corresponde al aspecto postoperatorio, tras cirugía de catarata con implantación de un anillo de Cionni 1L, del caso presentado en la Fig. 1. 1053 IV. CIRUGÍA DE LA CATARATA: CATARATAS EN SITUACIONES ESPECIALES timos 10 años, la utilización de anillos se ha convertido en una rutina en el manejo de este tipo de pacientes Es difícil precisar la extensión de la desinserción zonular que puede ser manejada con el proceder descrito en este capítulo. Es difícil precisar cuándo puede ser necesario practicar una extracción intracapsular o una lensectomía vía pars plana. El cirujano que intente la aproximación quirúrgica que sugerimos debería estar los suficientemente familiarizado con la práctica de capsulorrexis y facoemulsificación en ausencia parcial de zónula. De estarlo, debería intentar preservar saco capsular para posibilitar la implantación de un lente de cámara posterior, bien dentro del anillo capsular o fuera de él, bien con un anillo suturado o con una lente suturada. En cualquier caso, la decisión dependerá de la experiencia del cirujano. BIBLIOGRAFÍA 1. Nelson LB, Maumenee IH. Ectopia lentis. Surv Ophthalmol 1982; 27: 143-160. 2. Merin S. Inherited Eye Diseases. New York: Marcel Dekker; 1991: 131-132. 3. Halpert M, BenEzra D. Surgery of the hereditary subluxated lens in children. Ophthalmology 1996; 103: 681-686. 4. Roussat B, Chiou AG, Quesnot S, Hamard H, Godde-Jolly D. Chirurgie de l´ectopic cristallinienne dans la maladie de Marfan chez l´enfant et l´adulte jeune. J Fr Ophtalmol 1995; 18: 170-177. 5. Hakin KN, Jacobs M, Rosen P, Taylor D, Cooling RJ. Management of the subluxed crystalline lens. Ophthalmology 1992; 99: 542-545. 6. Jarrett WH. Dislocation of the lens: A study of the 166 hospitalized cases. Arch Ophthalmol 1967; 78: 289. 7. Cross HE, Jensen AD. Ocular manifestations in the Marfan syndrome and homocystinuria. Am J Ophthalmol 1973; 75: 405-420. 8. Nelson LB, Szmyd SM. Aphakic correction in ectopia lentis. Ann Ophthalmol 1985; 17: 445-447. 9. Whiting M. Congenital dislocation of the lens. Br J Ophthalmol 1963; 47: 54-56. 10. Lamba PA, Kumar DS, Arora A. Xenon arc photocoagulation for treatment of subluxation of lens. Br J Ophthalmol 1985; 69: 291-293. 11. Rosen PH, Dart JK, Turner GS. Neodymium-YAG laser zonulotomy. Arch Ophthalmol 1987; 105: 892-893. 12. Tchah H, Larson RS, Nichols BD, Lindstrom RL. Neodymium:YAG laser zonulolysis for treatment of lens subluxation. Ophthalmology 1989; 96: 230-234. 13. Hara T, Hara T, Yamada Y. "Equator ring" for maintenace of the completely circular contour of the capsular bag equator after cataract removal. Ophthalmic Surg 1991; 22: 358-359. 14. Hara T. Equator ring to obtain complete circular contour of the capsular bag equator and to prevent postoperative posterior capsule opacification. 3rd American-International Congress on cataract, IOL and Refractive Surgery, Seattle, May 1993. 15. Legler U, Witschal B. The capsular ring_ A new device for complicated CataractSurgery. Flim presented at the 3rd American Congress on Cataract, IOL and Refractive Surgery. Seattle, May.1993 16. Cionni RJ, Osher RH. Endocapsular ring approach to the subluxed cataractous lens. J Cataract Refract Surg 1995; 21: 245-249. 17. Lanzetta P, Bandello FM, Virgili G, Crovato S, Menchini U. Is scleral fixation a safe procedure for intraocular lens implantation? Doc Ophthalmol 1999; 97: 317-324. 18. Tokuda Y. In-the-bag IOL suture fixation represents a new approach to zonular dehiscence. Ocular Surgery News, February 1997: 8-9. 19. Orbegozo J, Mendicute J, Sáiz A. Phacoemulsification and management of the subluxated crystalline lens. Agarwal A, ed. Phacoemulsification, laser cataract surgery and foldables IOLs. Delhi: Jaypée, 1998: 174-187. 1054 20. Nagamoto T, Bissen-Miyajima H. A ring to support the capsular bag after continous curvilinear capsulorhexis. J Cataract Refract Surg 1994; 20: 417-420. 21. Hara T.akanishi Y, Yamada Y. Efficacy of equator rings in an experimental rabbit study. Arch Ophthalmol 1995; 113: 1060-1065. 22. Moreno-Montañes J, Rodríguez-Conde R. Capsular tension rings in eyes with pseudoexfoliation. J Cataract Refract Surg 2002; 28: 2241-2242. 23. Sakabe Y, Lim SJ, Apple DJ. Anatomical evaluation of the anterior capsular zonular fee zone in the human crystalline lens. Nippon Ganka gakkai Zasshi 1995; 99: 1119-1122. 24. Davanger M. The suspensory apparatus of the lens. The surface of the ciliary body. A scanning electron microscopic study. Acta Ophthalmol 1975; 53: 19-33. 25. Wheatly HM, Traboulsi EI, Flowers BE. Inmunohistochemical localization of fibrillin in human ocular tissues. Relevance to the Marfan syndrome. Arch Ophtalmol 1995; 113: 103-109. 26. Assia EI, Apple DJ, Morgan RC, Legler UF, Brown SJ. The relationship between the stretching capability of the anterior chamber and zonules. Invest Ophthalmol Vis Sci 1991; 32: 2835-2839. 27. Assia EI, Apple DJ, Tsai JC, Morgan RC. Mechanism of radial tear formation and extension after anterior capsulectomy. Ophthalmology 1991; 98: 432-437. 28. Nishikawa S, Okisaka S. The tension of zonule and aging changes of ciliary bodies. Nippon Ganka gakkai Zasshi 1992; 96: 721-730. 29. Rosenthal KJ. Improving outcomes with capsular tension rings. Rev Ophthalmol 2001; 47-55. 30. Magenis RE, Maslen CL, Smith L, Allen L, Sakai LY. Localization of the fibrillin (FBN) gene to chromosome 15, band q21.1. Genomics 1991; 11: 346-351. 31. Lee B, Godfrey M, Vitale E, Hori H, Mattei MG, Sarfarazi M. Linkage of Marfan syndrome and a phenotypically related disorder to two different fibrillin genes. Nature 1991; 352: 330-334. 32. Mudd SH. Vascular disease and homocysteine metabolism. N Engl J Med 1985; 313: 751-753. 33. Burke JP, O´Keefe M, Bowell R, Naughten ER. Ocular complications in homicystinuria--early and late treated. Br J Ophthalmol 1989; 73: 427-431. 34. Lowe S, Johnson DA, Tobias JD. Anesthetic implications of the child with homocystinuria. J Clin Anesth 1994; 6: 142 - 144. 35. Goldberg MF. Clinical manifestations of ectopia lentis et pupillae in 16 patients. Ophthalmology 1988; 95: 1080-1087. 36. Zetterström C, Kugelberg M. Paediatric cataract surgery. Acta Ophthalmol Scand 2007; 85: 698-710. 37. Häberle H, Pham DT, Weller A. Lens subluxation and glaucoma: indications and hazards of cataract surgery. Ophthalmologe 2000; 97: 47-50. 38. Roesel M, Heinz C, Koch JM, Heiligenhaus A. Cataract surgery in uveitis. Ophthalmology 2008; 115: 1431-1431. 39. Höhn S, Sparaul CW, Buchwald HJ, Lang GK. Spontaneous dislocation of intraocular lens with capsule as a late complication of cataract surgery in patients with pseudoexfoliation síndrome: five cases report. Klin Monatsbl Augenheilkd 2004; 221: 273-276. 40. Lumme P, Laatikainen L. Exfoliation syndrome and cataract extraction. Am J Ophthalmol 1993; 116: 51-55. 41. Ruotsalanainen J, Tarkkanen A. Capsule thickness of cataractous lenses with and without exfoliation syndrome. Acta Ophthalmol 1987; 65: 444-9. 42. Jofe M:Detection of lens subluxation in pseudoexfoliation. Arch.Ophthalmol 1988; 106: 1032. 43. Guzek J.P, Holm.M.Cotter J.B., Cameron J.A. Rademaker W.J., Wisinger D.H, Tonjum A.M, Sleeper L.A. Risk factors for intraoperative complications in1000 extracapsular cataract cases. Ophthalmol 1987; 97: 461-466. 44. Naumann G, Kuchle M, Schonheu U. Pseudoexfoliation Syndrome as a risk factor for vitresus loss in extracapsular cataract extraction. Fortschr. Ophthalmol 1989; 86: 543-545. 45. Osher RH, Cionni RI, Gimbel HV, Crandall AS: Cataract Surgery in patients with Pseudoexfoliation Syndrome: Eur J. Implant Ref Surg 1993; 5: 46-50. 46. Schmidt JC, Chofflet J, Hörle S, Mennel S, Meyer CH. Three simple approaches to visualize the transparent vitreous cortex durin vitreoretinal surgery. Dev Ophthalmol 2008; 42: 35-42. 90. CIRUGÍA DE CATARATA EN CRISTALINOS SUBLUXADOS 47. Kazem MA, Behbehani JH, Uboweja AK, Paramasivam RB. Traumatic cataract surgery assisted by trypan blue. Ophthalmic Surg Laser Imaging 2007; 2007; 38: 160-163. 48. Goldman JM, Karp CL. Adjunct devices for managing challenging cases in cataract surgery: pupil expansion and stabilization of the capsular bag. Curr Opin Ophthalmol 2007; 18: 44-51. 49. Nelson LB, Szmyd SM: Aphakic correction in ectopia lentis. Ann Ophthalmol 1988; 106: 1032. 50. Straatsma BR, Allen RA, Pettit TH. Subluxation of the lens treated with iris phtocoagulation Am. J Ophthalmol 1996; 61: 1312. 51. Jarret WH: Dislocations of the lens: A study of the 166 hospitalized cases. Arch Opthalmol 1967; 78: 289. 52. Jensen AD, Cross HE. Surgical treatment of dislocated lenses in the Marfan syndrome and Homocistinuria. Trans. Am.Acad.Ophthalmol Otolaryngol 1972; 76: 1491-1499. 53. Peyman GA, Raichard M, Goldberg MF: Management of the subluxated and dislocated lenses with the vitrophage. Br J Ophthalmol 1979; 63: 771-778. 54. Girard LJ. Pars plana sensectomy for subluxated and dislocated lenses. Ophthalmic Surg 1981; 12: 491-5. 55. Plager DA, Parks MM, Helveston EM, Ellis FD. Surgical treatment of subluxated lenses in children. Ophthalmology 1992;99:1018-23. 56. Hakin KN, Jacobs M, Rosen P, Taylor D, Cooling RJ. Management of the subluxed cristalline lens. Ophthalmol 1992; 99: 542-545. 57. HalpertM, Ben Ezra D. Surgery of the hereditary subluxated lens in children. Ophthalmology 1996; 103: 681-686. 58. Legler U, Witschal B. The capsular ring_ A new device for complicated Cataract Surgery. Flim presented at the 3rd American Congress on Cataract, IOL and Refractive Surgery. Seattle, May 1993. 59. Merriam JC, Zheng L, iris hooks for phacoemulsification of the subluxated lens. J Cataract Refract Surg 1997; 23: 1295-1297. 60. Novak J. Flexible iris hooks for phacoemulsification. J Cataract Refract Surg 1997; 23: 828-831. 61. Santoro S, Sannace C, Cascella MC, Lavermicocca N. Subluxated lens: phacoemulsification with iris hooks. J Cataract Refract Surg 2003; 29: 2269-2273. 62. De Juan E Jr, Hickingbotham D. Flexible iris retractor. Am J Ophthalmol 1991; 11: 776-777. 63. Colin J. Endocapsular PMMA rings may help prevent some complications in Catarct surgery. Ocular Surgery News. Oct. 1995; 6: 17. 64. Mendicute J, Orbegozo J, Sáiz A, Eder F. Phacoemulsification and capsular rings in the management of subluxated cataracts (video). ASCRS meeting. Boston; 1997. 65. Gimbel HV, Sun R, Heston JP: Management of zonular dialisys in Phacoemulsification and IOL implantation using the capsular ring. Ophthalmic Surg Lasers 1997; 28: 273-281. 66. Fine HI, Hoffman RS: Phacoemulsification in the presence of pseudoexfoliation:Challenges and options. J.Cataract Refract Surg 1997; 23: 160-165. 67. Cionni RJ, Osher RH. Management of profound zonular diálisis or weakness with a new endocapsular ring designed for scleral fixation. J Cataract Refract Surg 1998; 24: 1299-1306. 68. Arshinoff SA. Dispersive-cohesive viscoelastic soft shell technique. J Cataract Refract Surg 1999; 25: 167-173. 69. Cionni RJ, Osher RH, Marques DM, et al. Modified capsular tension ring for patients with congenital loss of zonular support. J Cataract Refract Surg 2003; 29: 1668-73. 70. Ahmed, II, Cionni RJ, Kranemann C, Crandall AS. Optimal timing of capsular tension ring implantation: Miyake-Apple video analysis. J Cataract Refract Surg 2005; 31: 1809-1813. 71. Fine IH. Chip and flip phacoemulsificaction technique. J Cataract Refract Surg 1991; 17: 366-371. 72. Osher RH. Slow motion phacoemulsification approach. J Cataract Refract Surg 1993; 19: 667. 73. Debry P, Olson RJ, Crandall AS. Comparison of energy required for phaco-chop and divide and conquer phacomeulsification. J Cataract Refract Surg 1998; 24: 689-692. 74. Gimbel HV, Sun R. Clinical applications of capsular tension rings in cataract surgery. Ophthalmic Surg Lasers 2002; 33: 44-53. 75. Praveen MR, Shah AR, Jani UD, et al. Management of congenital bilateral subluxated cataract with Cionni ring. Indian J Ophthalmol 2006; 54: 39-41. 76. Roussel B, Billotte C. [Advantages of the Cionni modified capsular tension ring with scleral fixation in large zonular dialysis]. J Fr Ophtalmol 2006; 29: 564-567. 77. Bahar I, Kaiserman I, Rootman D. Cionni endocapsular ring implantation in Marfan's Syndrome. Br J Ophthalmol 2007; 91: 1477-1480. 78. Dietlein TS. Cionni capsular tension ring implantation in Marfan's syndrome. Br J Ophthalmol 2007; 91: 1419-1420. 79. Konradsen T, Kugelberg M, Zetterstrom C. Visual outcomes and complications in surgery for ectopia lentis in children. J Cataract Refract Surg 2007; 33: 819-824. 80. Aldakaf A, Bakir H, Almogahed A, Carstocea B. Evaluation of different surgical techniques in the management of subluxated cataractous lens. Ophthalmol 2007; 51: 80-84. 81. Kohnen T, Baumeister M, Buhren J. Scheimpflug imaging of bilateral foldable in-the-bag intraocular lens implantation assisted by a scleral-sutured capsular tension ring in Marfan's syndrome. J Cataract Refract Surg 2003; 29: 598-602. 82. Moreno-Montañes J, Sainz C, Maldonado MJ. Intraoperative and postoperative complications of Cionni endocapsular ring implantation. J Cataract Refract Surg 2003; 29: 492-497. 83. Marques DM, Marques FF, Cionni RJ, et al. Evaluation of the modified capsular tension ring in cases of traumatic lens subluxation. Arq Bras Oftalmol 2007; 70: 746-751. 84. Moreno-Montañes J, Fernandez-Hortelano A, Caire J. Entrapment of a Cionni ring hook by the pupil after suture rupture. J Cataract Refract Surg 2008; 34: 1047-1048. 1055