Ejemplo de índice del contenido del archivo del investigador
Anuncio
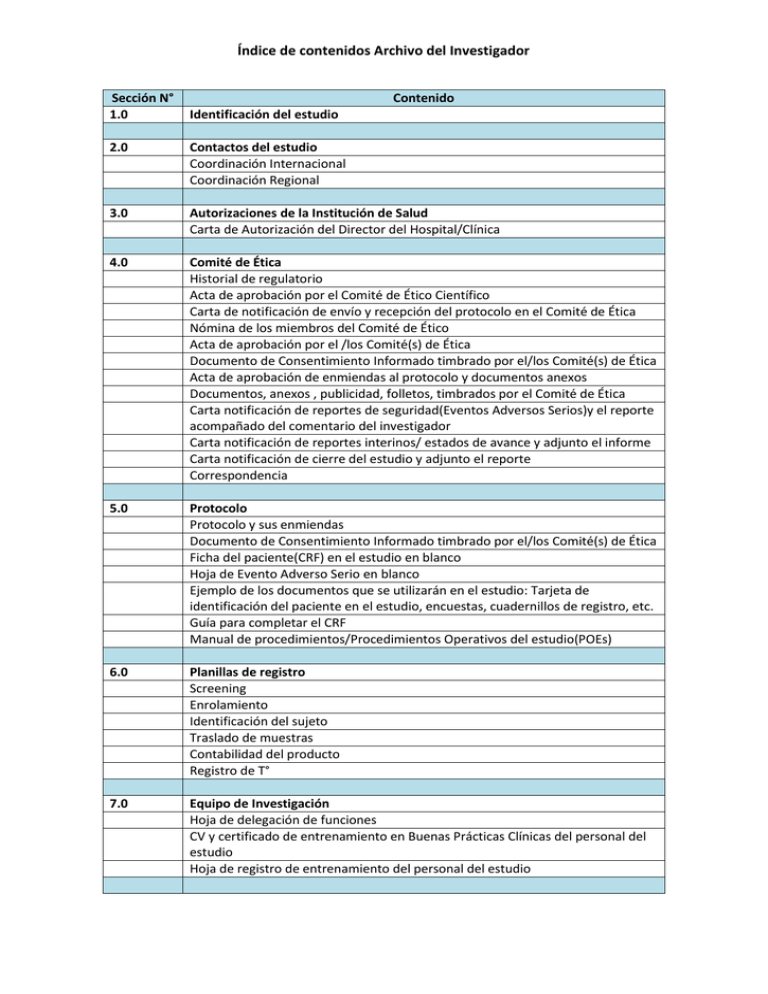
Índice de contenidos Archivo del Investigador Sección N° 1.0 Contenido Identificación del estudio 2.0 Contactos del estudio Coordinación Internacional Coordinación Regional 3.0 Autorizaciones de la Institución de Salud Carta de Autorización del Director del Hospital/Clínica 4.0 Comité de Ética Historial de regulatorio Acta de aprobación por el Comité de Ético Científico Carta de notificación de envío y recepción del protocolo en el Comité de Ética Nómina de los miembros del Comité de Ético Acta de aprobación por el /los Comité(s) de Ética Documento de Consentimiento Informado timbrado por el/los Comité(s) de Ética Acta de aprobación de enmiendas al protocolo y documentos anexos Documentos, anexos , publicidad, folletos, timbrados por el Comité de Ética Carta notificación de reportes de seguridad(Eventos Adversos Serios)y el reporte acompañado del comentario del investigador Carta notificación de reportes interinos/ estados de avance y adjunto el informe Carta notificación de cierre del estudio y adjunto el reporte Correspondencia 5.0 Protocolo Protocolo y sus enmiendas Documento de Consentimiento Informado timbrado por el/los Comité(s) de Ética Ficha del paciente(CRF) en el estudio en blanco Hoja de Evento Adverso Serio en blanco Ejemplo de los documentos que se utilizarán en el estudio: Tarjeta de identificación del paciente en el estudio, encuestas, cuadernillos de registro, etc. Guía para completar el CRF Manual de procedimientos/Procedimientos Operativos del estudio(POEs) 6.0 Planillas de registro Screening Enrolamiento Identificación del sujeto Traslado de muestras Contabilidad del producto Registro de T° 7.0 Equipo de Investigación Hoja de delegación de funciones CV y certificado de entrenamiento en Buenas Prácticas Clínicas del personal del estudio Hoja de registro de entrenamiento del personal del estudio Índice de contenidos Archivo del Investigador 8.0 Producto en Investigación (PI)/Intervención Descripción de las características de la intervención (producto, dispositivo u otra intervención) Registro de embarque del producto de investigación (PI) documentando la fecha de recepción cantidad y el nº del lote de todos PI en el archivo Muestra de la etiqueta (rotulado) del PI Están las instrucciones (en el MOP o en Procedimientos específicos) para el almacenamiento, preparación y manejo del PI Planilla de registro de contabilidad del PI Descripción los procedimientos de decodificación para los casos enmascarados Lugar y condiciones de almacenamiento del PI Planilla de registro de Temperatura Sistema de respaldo (back up) del método de almacenamiento en caso de falla o problema Manual de emergencias médicas disponible Algoritmo de emergencia médica 9.0 Reportes de Seguridad Definición de: Desviación de protocolo y Evento Adverso Serio(EAS) de acuerdo al estudio Hojas de desviación de protocolo, evento adverso y EAS en blanco 10.0 Laboratorio Certificado de acreditación del laboratorio de la institución de salud Rangos normales de los exámenes de laboratorio 11.0 Equipos Médicos Certificados de mantención de los equipos médicos que se utilizan en el estudio 12.0 Monitorizaciones Hoja de registro de monitorizaciones Carta de notificación de monitorizaciones interinos/ supervisiones/auditorías Reportes de monitoreo/ supervisiones/auditorías Correspondencia 13.0 Documentos financieros Convenio/acuerdo firmado Seguro Índice de contenidos Archivo del Investigador

