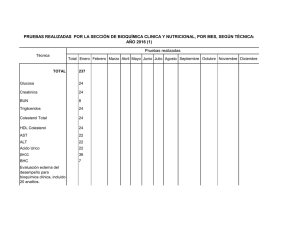
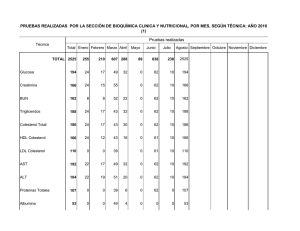
PRÁCTICAS DE EMPRESA: LABORATORIOS DE ANÁLISIS
Anuncio

PRÁCTICAS DE EMPRESA: LABORATORIOS DE ANÁLISIS CLÍNICOS DEL HOSPITAL DE TXAGORRITXU- VITORIA VÍCTOR FERNÁNDEZ ORELL 5º BIOLOGIA JULIO 2007 INDICE: 1- DATOS DE LAS PRÁCTICAS 2-LABORATORIO DE BIOQUÍMICA 2.1-BIOQUIMICA GENERAL. 2.1.1-ANÁLISIS DE MUESTRAS. 2.1.2-TRATAMIENTOS DE FERTILIDAD. 2.2-PROTEÍNAS. INMUNOLOGÍA. 2.3-HORMONAS. 2.4-URGENCIAS. 3-LABORATORIO DE BACTERIOLOGÍA 3.1-ESPUTOS, HERIDAS, Etc… 3.2-URINOCULTIVOS, L.C.R.,HEMOCULTIVOS Y COPROCULTIVOS. 3.3-MICOBACTERIAS. 4-LABORATORIO DE HEMATOLOGÍA 4.1-HEMOGRAMAS, HEMOGLOBINA GLICOSILADA, V.S.G. 4.2-COAGULACIÓN. 4.3-CITÓMETRO DE FLUJO. 5-RESULTADO DE LAS PRÁCTICAS 1-DATOS DE LAS PRÁCTICAS LUGAR: Laboratorios de análisis clínicos del Hospital Txagorritxu de Vitoria. PERÍODO:: Julio 2007 HORARIO: De lunes a viernes de 8:00-15:00. TUTORA: Carmen Zugaza (responsable del laboratorio de bioquímica). OBJETIVO DE LAS PRÁCTICAS: Aprender el funcionamiento general de los laboratorios de análisis clínicos de bioquímica, bacteriología y hematología. Familiarizarme con los aparatos y técnicas que se utilizan rutinariamente en dichas áreas. 2-LABORATORIO DE BIOQUÍMICA. En los laboratorios se recogen muestras procedentes del propio hospital (de pacientes que están ingresados, de consultas, y de urgencias) También se reciben muestras procedentes del ambulatorio, del hospital Santiago de Vitoria, y de hospitales de localidades cercanas, como el de Mondragón.. Algunas pruebas no se podían realizar en Txagorritxu y se enviaban a laboratorios de Barcelona. La transmisión de datos (nombre de los pacientes, historial médico, etc..) entre los diferentes hospitales se realizaba a través de internet mediante la utilización de diversos programas informáticos. En el laboratorio de análisis clínicos de bioquímica trabajan médicos, enfermeras, técnicos y auxiliares de laboratorio, un bioquímico, un químico, una FIR y secretarias. El laboratorio se divide en diferentes áreas: bioquímica general, proteínas e inmunología y hormonas. 2.1-Bioquímica general Se realizan análisis de muestras y tratamientos de fertilidad. 2.1.1 Análisis de muestras Primero se recogen los volantes de los pacientes. En el volante se indican los parámetros que se quieren determinar. Se introducen los datos en el ordenador e inmediatamente se identifica a cada paciente con un código de barras que se le pega a su informe. Este código puede ser detectado por cada lector de los diferentes ordenadores del hospital y de otros hospitales, así queda grabado en forma de imagen, permitiendo una transmisión de datos y una coordinación más eficaz. Después, las enfermeras extraen sangre a los pacientes de planta y de urgencias. Además, se recibe sangre y orina de los pacientes de otros hospitales o ambulatorios. Después, se pega a los tubos su respectivo código de barras. 20 minutos después de extraer la sangre, se centrifuga y se destaponan los tubos. A continuación, un robot se encarga de preparar las diferentes alícuotas a partir de una sola muestra del paciente. Por ejemplo, prepara una alícuota para detectar la concentración de glucosa, otra para detectar la concentración de urea, etc..Este aparato agiliza el proceso, evitando los errores de la manipulación humana. También se disminuyen las molestias al paciente ya que a partir de una sola muestra, se preparan los diferentes tubos. Posteriormente, cada tubito irá al laboratorio clínico correspondiente (por ejemplo, si se quiere valorar la velocidad de sedimentación globular, ese tubito se llevará al laboratorio de hematología.). Las alícuotas que se han preparado se corresponden con las pruebas pedidas en los volantes. Después, los tubos destinados a bioquímica general se introducen en el espectrofotómetro. Este aparato, determinará la concentración de cada parámetro a partir de la absorbancia que detecte. Antes de utilizar cualquier aparato, hay que llevar a cabo un control de calidad. A primera hora de la mañana, se calibra el espectrofotómetro utilizando unos diluyentes que funcionan como controles. Y a media mañana se vuelve a repetir el proceso. Los resultados de los controles se analizan en un ordenador, de tal forma que si sus valores están dentro del intervalo ±2 s.d.. respecto al valor medio, se pueden introducir las muestras. Este control de calidad se lleva a cabo en todos los aparatos de los laboratorios de análisis clínicos y son esenciales para dar valores fiables. Las muestras analizadas se guardan en gradillas durante un tiempo. Se pasan por un lector de código de barras que indicará la posición exacta. De esta forma se acelera la búsqueda de una muestra en caso de que fuera necesario hacer más pruebas. Después, el jefe del área se encarga de interpretar los resultados, de repetir las pruebas en caso de que aparecieran valores extraños y de avisar a los médicos si algún valor se sale de los intervalos críticos.(se comprueban sobre todo los valores de glucosa, urea, iones (k+, Na+, Cl-, Ca 2+ ), bicarbonato, osmolaridad, lactato, pH , pCo2, pO2 .. A la hora de interpretar los resultados hay que tener en cuenta la edad, sexo, historial médico del paciente, y otros aspectos, como que los valores de los parámetros en orina son más amplios que en sangre, o que los valores de las personas de la U.C.I. están cambiando constantemente. Posteriormente se realiza una validación de los datos. Es la última comprobación de que los informes son correctos. Son diferentes dependiendo del departamento, y del hospital, pero siempre son llevadas a cabo por los facultativos. La validación de los resultados en el área de bioquímica general de Txagorritxu es la siguiente: 1- Revisión de los resultados de la bilirrubina total y directa. Hay que corregir el resultado si los valores de la bilirrubina directa son mayores que los de la bilirrubina total. 2- Validación de los resultados por prueba y en grupos (los de rutina y los de modular). 3- Consulta de peticiones pendientes, para actualizarlos. También se comprueba si la hemólisis ha interferido en algún parámetro de los análisis. El segundo día que estuve en esta área, dos otorrinolaringólogas le dieron a la doctora Carmen Zugaza una muestra espumosa que le habían extraído a una mujer del cuello. No sabían si se trataba de una acumulación de saliva o de linfa. Para resolverlo, se consultó la bibliografía. Estos fluidos tienen diferentes concentraciones de proteínas, lípidos (colesterol y ácidos grasos), amilasa y diferente pH. Se hicieron diferentes pruebas para cada parámetro, y los resultados indicaron que el fluido tenía poca concentración de proteínas, alta en lípidos, un pH de 7 y poca amilasa. Por tanto, el fluido podría ser linfa. En el área de bioquímica general, está todo totalmente robotizado e informatizado para reducir errores y optimizar el tiempo. 2.1.2. Tratamiento de fertilidad Consiste en capacitar el semen del individuo para enriquecerlo y aumentar el número de espermatozoides móviles. Se analiza el volumen, pH, número de espermatozoides, morfología, tipo de movilidad. Se toman 10 µL de semen con una pipeta y se añade en una cámara de contaje. Se utiliza el objetivo de 100x con aceite de inmersión. Además de contar el número de espermatozoides vivos, se realizan tres pruebas para determinar la calidad del semen. Si los resultados son satisfactorios, se llevará a cabo la inseminación artificial. Las pruebas son las siguientes: -observar morfología de los espermatozoides mediante la tinción fresca. -prueba de motilidad. -MAR-TEST. Mediante la tinción en fresco, se observa el porcentaje de espermatozoides normales y anormales. La mayoría de los anormales tienen defectos en la cabeza. La prueba de motilidad se realiza sobre la cuadrícula de contaje. Se trata de calcular qué porcentaje hay de cada tipo: Los espermatozoides de “motilidad a” recorren perfectamente todas las cuadrículas, sin embargo, los de “motilidad b” se mueven poco. (la mayoría de las muestras recibidas tenían poca “motilidad de tipo a” y mucha de “tipo b”). La prueba del MAR-TEST consiste en mezclar bolitas de látex con los espermatozoides. Posteriormente se observan al microscopio. Si la cola de los espermatozoides no coge las bolas, se trata de buenos espermatozoides, sería un MAR-TEST negativo Por tanto, si la cantidad de espermatozoides no es muy baja (lo normal son 80 millones, pero estos individuos suelen tener menos de 50 millones), si los espermatozoides tienen una morfología normal, presentan un alto porcentaje de “motilidad de tipo a” y son MAR negativos, se podría llevar a cabo la inseminación artificial. Para ello, la mujer debe ser previamente estimulada con hormonas para favorecer la producción de folículos. Antes de inseminar, hay que separar los espermatozoides móviles de los inmóviles. Esto se hace a través de gradientes de densidad del 80% y del 20%. Después, se centrifuga el tubo. Se extraen los espermatozoides móviles que estaban en el fondo del tubo y se les añade un medio que facilitará la introducción del semen en la vagina. Mediante la capacitación, se consiguió un semen con un número cercano a los 50 millones de espermatozoide, muy superior al original. 2.2 Proteínas e inmunología Se realizan proteinogramas, ELISAs, inmunoelectroforesis… Proteinograma: se impregna una tira en el suero del paciente y posteriormente se mete en un medio. Después se tiñe la tira y una vez seca, el aparto envía unas señales al ordenador, el cual representará una gráfica con diferentes picos. Cada pico se corresponde con una proteína plasmática. La gráfica, se compara con el control y si se observan diferencias, se analizan los valores anormales. Si es oportuno, se consulta la bibliografía para diagnosticar la enfermedad. Proteinograma normal Por ejemplo, se analizó el suero de un paciente cuyo proteinograma era característico de una cirrosis hepática, ya que tenía bajos los niveles de alfa-1 globulina. Para asegurar este diagnóstico, se mandó la muestra a hematología, para que le hicieran una prueba de coagulación (la sangre de estos enfermos suelen tener dificultades en coagular.). Las pruebas indicaron que el paciente tenía cirrosis hepática. ELISAS (ensayo inmunoabsorbente con enzimas): Tradicionalmente utilizados para pruebas de detección de VIH. En este departamento se utilizan para detectar enfermedades autoinmunes. Para diagnosticar el lupus eritematoso sistémico, entre otras pruebas se realiza un ELISA indirecto que se encarga de poner de manifiesto la presencia de ANAs (anticuerpos antinucleares). Se fija al soporte insoluble ADN, que es el antígeno específico frente a los ANAs. Se hace un lavado para eliminar el ADN que no se fija. Luego se añade el suero del paciente y se lava para eliminar los anticuerpos que no reaccionaban. Se añaden anti-anticuerpos conjugados con una enzima. Posteriormente se lava para eliminar los que no reaccionan. Se añade un sustrato que pueda ser degradado por la enzima marcadora. Luego, se hace, una lectura visual o colorimétrica del producto final coloreado. (a microscopio de fluorescencia se observaban de color verde la mitocondria y el núcleo de las células afectadas por esta enfermedad) Inmunoelectroforesis: Lo utilizan para detectar enfermedades autoinmunes como la esclerosis múltiple. En un medio que contiene concentraciones conocidas del antígeno frente al cual se va a unir el anticuerpo buscado, se añade el suero del paciente y se somete a una electroforesis. Se forman diferentes bandas de precipitados en aquellas zonas donde la concentración del anticuerpo sea igual a la del antígeno. En las primeras bandas hay mayor concentración y en las bandas que más se han desplazado, menos. Es un método que permite detectar la presencia de anticuerpos específicos de ciertas enfermedades, y determinar su concentración mediante controles. 2.3 Hormonas: En este área, los tubos con las muestras se introducen en el detector y se determina la presencia y concentración de hormonas, fármacos, marcadores tumorales, drogas de abuso. También se realizaban test de embarazo y una vez por semana análisis de cálculos renales y salivares. Las principales hormonas que se detectan son: -Hormonas sexuales: progesterona, LH, FSH. -Hormonas del tiroides: TSH, T3 y T4. -Hormonas de la glándula suprarrenal. Si los valores hormonales se salen de los niveles críticos, puede ser sinónimo de patología. En estos casos, se le comunica al médico del paciente, para orientarle en un posible diagnóstico. Fármacos: Se controla que la concentración de los fármacos que está tomando el paciente no se salga de los niveles críticos establecidos. Se presta más atención a aquellos fármacos cuyos rangos de actuación son más estrechos. Los que más se analizan son: la amikacina, la digoxina, la feniotoina, la gentamicina, el metatraxato, la teofilina, la tobramina, el valproico, la vancomicina y la ciclosporina. (la ciclosporina es un inmunosupresor que se administra a pacientes que van a sufrir un trasplante, para evitar o disminuir los rechazos). Para estudiar la digoxina, se emplea una técnica de ensayo específica, la MEIA (enzimoinmunoensayo de micropartículas La técnica FPIA (inmunoensayo de fluorescencia polarizada) se utiliza para analizar el resto de fármacos. Combina 2 tecnologías para detecta la concentración de analito: - enlace competitivo a las proteínas. - fluorescencia polarizada. El enlace competitivo requiere de 2 sistemas de antígenos (analitos): - el analito contenido en la muestra. - el analito marcado con un trazador. El analito presente en la muestra y el trazador del analito compiten por ocupar puntos de unión de las moléculas del anticuerpo. Cada sistema de analito se une a los puntos de unión en función de su concentración relativa. Si la muestra presenta una alta concentración de analito, se une más analito al anticuerpo, dejando libre el trazador del analito. Si la muestra presenta una baja concentración de analito, se une menos analito al anticuerpo, dejando que el trazador del analito pueda unirse al anticuerpo. Además, la luz polarizada puede utilizarse para producir una emisión fluorescente polarizada del trazador del analito. Se mide el cambio de polarización de la fluorescencia emitida a medida que se forma el complejo analito-anticuerpo. También se suele utilizar la técnica REA (tecnología de atenuación de la energía de radiación). Se usa cuantitativamente para valorar analitos específicos, basados en el principio de la intensidad de la fluorescencia. Esa medida es inversamente proporcional a la cantidad de cromóforo presente. Marcadores tumorales: Se analiza la presencia de AFP, CEA, CA125, CA 15.3, CA 19.9, alfa cetoproteína, PSA total y libre y la FPSA. Análisis de cálculos renales: No es específica de esta área. Utilizan un método de determinación cualitativa (también se podría hacer mediante análisis fluorescentes).El sistema utilizado es el siguiente: PARA CÁLCULOS URINARIOS: I CARACTERES MACROSCÓPICOS: La mayor parte de los cálculos son mixtos, aunque generalmente están formados por un componente principal que es el que interesa determinar. Las variedades más frecuentes son: Oxalato: de color verde oscuro. Son generalmente de oxalato cálcico y duros. Fosfatos: de color blanco o blanco grisáceo, de consistencia más o menos blanda. Los más frecuentes son los de fosfato cálcico. Ácido úrico y uratos: de aspecto granuloso y color amarillo o anaranjado. De consistencia dura al pulverizarlos. Carbonato cálcico: de apariencia negruzca, son poco frecuentes. Es importante esta forma de clasificarlos, ya que el aspecto sirve de orientación, ya que a veces la muestra es muy pequeña y es importante pensar cuidadosamente la marcha a seguir. II :MARCHA ANALÍTICA: Se coge el cálculo y se pulveriza (se seca antes si está húmedo). A continuación se coge un poco de polvo con la espátula y se calcina con el mechero. Se anota el olor que se produce. Se preparan 2 tubos por cada cálculo para analizar la presencia de oxalato y fosfatos. Oxalatos: Añadir 1 mL de agua destilada a un tubo de plástico. Añadir una gota de clorhídrico concentrado. Si se observan burbujas, hay oxalato. Fosfatos: se coge una porción del cálculo y se calcina. Se echa en un tubo de vidrio que contenga 0,5 mL de ácido nítrico diluido, junto con 1,5 ml de reactivo molibdico, y se calienta. Si hay fosfatos se formará un precipitado amarillo. Ácido úrico y uratos: se coloca una porción de polvo del cálculo sin calcinar en una cápsula de porcelana, se añaden 2 gotas de nítrico concentrado, y se calienta todo. Aparecerá un color rojo que indica la presencia de úrico o uratos. Se confirma añadiendo unas gotas de amoniaco. Pasará a violeta. Carbonatos: Se coloca una porción del cálculo sin calcinaren un tubo con 1 ml de agua. Se deja resbalar por la pared del tubo una gota de clorhídrico concentrado, si se produce efervescencia, son carbonatos. PARA CÁLCULOS SALIVARES: Pueden originarse como consecuencia de procesos infecciosos de los canales excretores. Son pequeños, de 1 o 2 gramos, y están constituidos fundamentalmente por fosfatos y carbonatos cálcicos, y pocas veces por ácido úrico. Su examen químico se efectúa como el de los cálculos. Contienen principalmente: - 65% de fosfato cálcico. - 6% de fosfato amónico magnésico - 6% de carbonato cálcico. - 12% de materia orgánica. - 10% de otros componentes. 2.4. Laboratorio de análisis clínicos de urgencias: Es un departamento independiente del de bioquímica. En él trabajan diferentes médicos, enfermeras y auxiliares de laboratorio. Funciona ininterrumpidamente todos los días del año. Todos los aparatos están por duplicado. No realizan todos los análisis clínicos, sólo los más importantes. Al igual que todos los departamentos, antes de utilizar los aparatos, éstos deben pasar su respectivo control de calidad. Los principales aparatos que se utilizan son: - Centrifugadoras. - Espectrofotómetros. - Citómetros de flujo: cuantifica las células sanguíneas, determina el fenotipo de las células sanguíneas a partir de anticuerpos que se unen a sus proteínas de membrana. - Medidores de gases o gasómetros: miden las presiones parciales de oxígeno y dióxido de carbono. - Bilirrubiómetro: analiza los niveles de bilirrubina en sangre de neonatos (la sangre se extrae en capilares). - Medidor de troponina: la troponina es un marcador bioquímico específico del infarto de miocardio. 3-LABORATORIO DE BACTERIOLOGÍA: Este departamento está menos robotizado que el de bioquímica. También trabajan médicos, enfermeras, técnicos de laboratorio y una secretaria. Está dividido en diferentes áreas que se especializan en: - Esputos, heridas, etc... - Urinocultivos, líquido cefalorraquídeo, hemocultivos, y coprocultivos. - Micobacterias. En este departamento se utilizan medios de enriquecimiento que permiten el crecimiento de Estreptococos, Neumococos, Gonococos, bacterias Hemófilas (en enfermedades faríngeas) y otras que no crecen bien en los medios usuales. Además, en los medios con sangre se puede observar si alrededor de la colonia se ha producido un halo de hemólisis por acción de las hemolisinas liberadas por las bacterias. En la hemólisis de tipo beta, las colonias pueden producir una hemólisis total de modo que el agar se observa transparente alrededor de la colonia. La hemólisis de tipo alfa, es una hemólisis parcial, se forma un halo verdoso alrededor de la colonia. Todas estas características de tamaño, forma, hemólisis permiten detectar la presencia de diversos tipos de colonias y orientar sobre el microorganismo que la forma. También se utilizan medios de aislamiento como: -Agar chocolate: para aislar microorganismos anaerobios, es más específico que el agar sangre. También sirve para aislar Hemófilos, Gonococos y Meningococos.. -Agar sangre (COLSB): para aislar anaerobios de las vías respiratorias o de cualquier parte. También para comprobar si crecen microorganismos en las puntas de los catéteres. (suelen crecer Cargnebacterium). No crecen Hemófilos. -Agar Bilis Esculina: para aislar Enterobacterias. Si el medio se pone de color negro, los microorganismos se han comido la bilis, y serán Bilis esculina positivos. También sirve para aislar anaerobios que crecen en las heridas, como Clostridium, por eso es aconsejable limpiar las heridas con agua oxigenada. -BHI: es un medio líquido que se utiliza para aislar microorganismos del líquido cefalorraquídeo. -LKU: para aislar anaerobios. -CNA: para aislar anaerobios, también inhiben a Gram negativos. -Medio granada: se pone un cubre encima de la placa y se observa el crecimiento. Sirve para aislar microorganismos que pueden producir sepsis en recién nacidos. Se toman muestras del canal de la vagina y del recto. -Medio para la Legionella (GVPC): en esputos. La Legionella también se puede detectar en orina. -Mc Conkey: es un medio selectivo para bacilos Gram negativos no exigentes (Enterobacterias y Pseudomonas). -Medio de Chapman: es un medio cromogénico para aislar Estafilococos aureus. -Medio CHROMAgar MRSA: medio cromogénico para la detección de Staphylococcus aureus meticilin resistentes. -Mueller-Hinton: utilizado para hacer antibiogramas y determinar la CMI (concentración mínima inhibitoria). -Sobouraud: Para aislar hongos. -S.S: para aislar Salmonella y Shigella. -Tioglicolato: es un medio líquido en el que crecen aerobios y anaerobios. Pruebas para identificar miroorganismos: Pruebas sencillas: Atienden al aspecto de la colonia, nutrición, el tipo de respiración (aeróbios estrictos o facultativos), el crecimiento en medio selectivo, la producción de enzimas como la catalasa (para Estreptococos (catalasa negativos) y Estafilococos (catalasa positivo)), la beta – galactosidasa, la citocromo oxidasa (para Pseudomonas y otros bacilos gram negativos no fermentadores), la coagulasa, (para determinar la presencia del patógeno Staphylicoccus aureus, éste es coagulasa positivo y DNAasa positivo), la prueba de la PYR (para detectar Streptococcus Beta hemolíticos de grupo alfa, el resto de beta hemolíticos son PYR negativos), la posesión de flagelos, la formación de esporas… Pruebas convencionales: metabólicas, auxonograma y de determinación de la temperatura óptima. Paneles de identificación de Gram positivos y negativos. Tienes diferentes pocillos dependiendo del tipo de Gram que se vaya a analizar. Se cargan y después el lector de paneles determina la especie. Por ejemplo, para Pseudomonas, el panel se tiñe de verde. Se analizó Tatumella, un Gram negativo sensible a todos los antibióticos. Después se validan los resultados y se informa al médico. Galería de identificación API20E: se rellenan los pocillos con el microorganismo disuelto. En los pocillos deshidratados se le añade agua, y aquellas pruebas que requieran anaerobiosis, se les añade parafina. Se observan los colores que salgan en cada pocillo para determinar si las pruebas salen positivas o negativas. Luego se consultan los resultados obtenidos en unas guías en las que aparece una relación de los microorganismos y sus actividades metabólicas, y así se determina qué microorganismo está presente en la muestra. Medios cromogénicos de identificación de microorganismos: -CAN2: si se observan formas azules, ha crecido Candida albicans. -Cándida ID2: sirve para identificar a Cándida albicans (es una levadura dimórfica que cuando crece en forma de micelio produce candidiasis en las mujeres). -CPS ID3: Para identificar E.coli, Enterococos, Proteus… -SM ID2: identificación de Salmonella. Prueba de aglutinación: para Staphylococcus aureus meticilin resistentes. Con el asa se coge un poco del microorganismo y se mete en un eppendorf. Se agita, se atemperan los reactivos, se mezclan. Se centrifuga y se observa si hay aglutinación. En caso de que haya, se tratará de un Staphylococcus aureus meticilin resistente. Antibiogramas: se utilizan para determinar a qué antibióticos son resistentes y sensibles los microorganismos patogénicos del paciente. Hay que partir de colonias aisladas para poder hacer esta prueba. Se utilizan diferentes medios dependiendo del microorganismo (diferentes tipos de ATB para Enterobacterias,). Para los antibiogramas el medio más utilizado es el Mueller- Hinton. En el medio de cultivo con antibiótico, se inoculan pocillos con diferentes microorganismos. Se dejan 24 horas en la estufa y se observan los resultados. Si alrededor del microorganismo se observa un halo de inhibición de crecimiento, este microorganismo será sensible al antibiótico Por ejemplo: los neumococos son sensibles a la optoquinina. Y si no aparece este halo, el microorganismo será resistente. Por ejemplo: Klebsiella pneumoniae es resistente a las penicilinas (ampicilina, amoxicilina). Para determinar la CMI (concentración mínima inhibitoria), la técnica más sencilla y eficaz es el E-test. Se basa en una gradiente decreciente de concentración de antibiótico en una matríz de plástico. La cepa del microorganismo debe encontrarse en una concentración estandarizada. Se coloca en forma confluente sobre un medio de cultivo (agar sangre o agar chocolate con una base de Mueller Hinton) y luego se coloca una tira de Etest que contiene un antibiótico determinado. Tras un periodo de incubación de 24 horas máximo, se lee la CMI. Será aquella que se encuentra sobre el punto de inserción de la elipse formada por la difusión del antibiótico, desde la tira plástica. Identificación de hongos: se utiliza el medio de cultivo Sobouraud. Con un trozo de celo se coge una muestra de la placa, para que se queden pegadas las esporas y conidios. Se coloca en el porta, se añade colorante y se observa al microscopio la morfología del hongo, sus estructuras reproductoras, etc…Se consulta la bibliografía y se intenta identificar el tipo de hongo. 3.1 Esputos, heridas, etc… Esputos: se obtienen por expectoración. Se realizan diferentes tratamientos: Un frotis del esputo, se le realiza la tinción de Gram y posteriormente se observaba al microscopio. Con el objetivo 10x se observa el número de leucocitos por campo, y también sirve para determinar si la muestra está contaminada o no (si está contaminada aparecerán muchas células epiteliales.). Con el objetivo 100X y aceite de inmersión, se observan los tipos de microorganismos presentes en la muestra. Se observó una levadura que se correspondía con Candida albicans. En el caso de sospecha de tuberculosis, se le hace la tinción ácido-alcohol resistente, para observar la presencia de Micobacterium tuberculosis. Si salen micobacterias, se mandaba la muestra a dicha área, para un estudio más profundo. El resto de la muestra se siembra en medios de cultivo (Mc Conkey,, CNA, Sobouraud (si se sospecha la presencia de hongos). El resultado se observa a las 24 horas, pero las muestras no se tiran hasta las 6 semanas, porque hay microorganismos que tardan en crecer. Heridas superficiales, úlceras vasculares, o de decúbito, fístulas y heridas postoperatorias: Se siembra la muestra en placas de Agar Sangre, CLED, LKU, CNA y caldo Tioglicolato. En las úlceras se busca sobretodo microorganismos del grupo B y Staphylococcus aureus. También se observan microorganismos típicos de la piel, pero esos no interesan porque no son infecciosos. Para abscesos cerrados, heridas profundas y heridas de quirófano (llegan en jeringa): Se hace una extensión en portaobjetos para tinción de Gram. Se siembra la muestra en Agar Sangre, Agar Chocolate, CLED, LKU, CNA y Tioglicolato. Si se buscan hongos, se siembra en Sobouraud sin actidiona. Después, se incuba a 35º-37º: el Agar Sangre, CLED y el Thioglicolato aeróbicamente; el Agar Chocolate en atmósfera de 5-7% de CO2 ; y el LKU y el CNA en anaerobiosis. Si se siembra Sobourand se incuba hasta un mes antes de descartar como negativo. En esta área se hacían otras pruebas como son las de controlar la esterilidad de las leches producidas en farmacias. También se realizan cultivos vaginales (para detectar sobre todo C. albicans en su forma micelar), exudados faríngeos, óticos y oculares (para conjuntivitis), etc… 3.2. Urinocultivos, L.C.R., Hemocultivos, y Coprocultivos: Se trataba de identificar enteropatógenos como Salmonella, S. Typha, Shigella utilizando diferentes pruebas como la de Kliegler, urea, Indol, Lisina ONPG y movilidad. Urinocultivos y L.C.R. Se preparaba la muestra, identificando con un número el informe del paciente y la muestra. Se informa sobre microbiota urogenital (Estreptococcus grupo viridans, Neisseria, Corineformes, Lactobacillus, anaerobios… La microbiota habitual de piel está formada por Corineformes y Staphylococcus, se informa de microbiota habitual a no ser que sean 10 veces mayor en número que el resto de la microbiota. En este caso se tratan como uropatógenos. Para casi todos los patógenos urinarios (Bacilos Gram positivos, Staphylococcus, levaduras. Estreptococcus, beta hemolíticos, Enterococcus, G. vaginalis, Aerococos urinae, Corynebacterium (Ues ureasa positivo) se hacen las pruebas de ID y ATB. Además, se hacen análisis cuantitativos en la orina para determinar infecciones. Generalmente, más de 100.000 es infección y menos de 100.000 es contaminación. Los valores intermedios han de valorarse teniendo en cuenta la clínica y el enfermo. También se hacen discos para antibiogramas de enterococos en orina. Se analiza la sensibilidad frente a Fosfoeina, Teicoplanina, Vancomicina, Mitrofurantoina y Ampicilina. Para identificar Legionella y Streptococcus pneumoniae en orina se aplica una técnica llamada Inmunocromatografía rápida (es una antigenuria). Es un método sencillo y rápido de diagnóstico de neumonía producida por neumococos en orina. (También sirve para diagnosticar la meningitis neumocócica cuando se analiza el LCR.) Se introduce un palillo en la orina y después se coloca en una tapa que recuerda a una piruleta. Posteriormente, se le añade un reactivo y si tras 15 minutos, se forma color, la prueba será positiva. (se ha detectado antígeno neumocócico en orina y LCR humanos. Para comprobar que el reactivo no está deteriorado, se hace un control positivo, si no vira de color, el reactivo está en malas condiciones y habría que utilizar otro. Hemocultivos: Se toma sangre del paciente y se siembra en diferentes medios dependiendo de que el microorganismo sea aeróbico o anaeróbico. Para aeróbicos se utilizaban caldo infusión cerebro-corazón. Para anaerobios se utilizaba el medio líquido de tioglicolato con SPS, vacío y CO2., se metía en jarra de anaerobios. También se hacían discos para antibiograma de Enterococos en sangre. Se analizaba la sensibilidad a Ampicilina, Penicilina, Vancomicina, Gentamicina, Streptomicina. Esto se acompañaba de una prueba de betalactamasa en todos los aislamientos de Enterococos. En los urinocultivos y hemocultivos, se realizan antibiogramas cada día, en el que se indica el diámetro en mm. del antibiograma y la CMI (concentración mínima inhibitoria.). Coprocultivos: Para diagnosticar diferentes tipos de diarrea, interesa saber qué microorganismo la producen. Se sembraba las muestras en medios como Campylobacter, Selenito, SS, MC, y CIN (para Yersinia). También se diagnosticaban rectorragias, gastroenteritis agudas, síndromes febriles y colitis. 3.3.Micobacterias: Análisis en profundidad de los diferentes tipos de Micobacterias y en especial, el bacilo de Koch, responsable de la tuberculosis. El último día que estuve en el laboratorio de Bacteriología, recibieron muestras procedentes de un cazador de Palencia. Podría padecer Tularemia, enfermedad que se contagia por vía aérea y que la suelen transmitir los conejos y los topos (que han destruido la cosecha de muchos campos de cultivo este verano). La enfermedad se trata con antibióticos. Utilizarían campanas extractoras para hacer los estudios. 4-LABORATORIO DE HEMATOLOGÍA: Este laboratorio también está altamente robotizado y trabaja coordinadamente con el Banco de Sangre . Trabajan hematólogos, varias enfermeras y técnicos de laboratorio. Está dividido en 3 secciones: -Hemogramas, Hemoglobina Glicosilada, y V.S.G. -Coagulación. -Citometría de flujo. 4-1 Hemograma, Hemoglobina Glicosilada y V.S.G: Al comienzo, se ajustan los diferentes aparatos con diluyentes para que los resultados que se obtengan sean fiables. A primera hora, sólo se analizan las muestras más urgentes como son las de pacientes con cánceres que están recibiendo quimioterapia. Posteriormente se informa al médico de los resultados de las pruebas. Estos resultados se dan sin validar, pero les sirven a los médicos para que tengan una idea del estado del paciente. Posteriormente se analizarán el resto de las muestras recibidas. Éstas se introducirán en los diferentes aparatos dependiendo de los parámetros que se quieran analizar. Para obtener hemogramas se utiliza el Coulter. El de este laboratorio sólo analiza las células presentes en la sangre, sin embargo, el de Urgencias analiza también las presentes en otros líquidos (peritoneal, sinovial…) En el hemograma se expresa el número, proporción y variaciones de los elementos sanguíneos. Las enfermedades que más se diagnostican con este método son las leucemias, anemias, talasemias y aplasias. El siguiente hemograma corresponde a un paciente con leucopenia. Los valores de sus leucocitos están por debajo de lo normal, además también tiene anemia (niveles de eritrocitos bajos). Ese día también se analizó la sangre de un prematuro y de un niño de 14 días. Estos hemogramas siempre van acompañados de un gráfico en la parte de abajo que representa la población de reticulocitos. Si los valores de los parámetros se salen de los intervalos críticos, se hacen frotis sanguíneos. Después, las extensiones se tiñen: 1ª) Con manitol durante 5 minutos. 2ª) Con May-Grünwald durante 5 minutos. 3º) Con Giemsa y lavar posteriormente. Ahora ya se analiza la fórmula leucocitaria en el microscopio. En ésta se diferencian los siguientes tipos celulares: Granulocitos (eosinófilos, basófilos y neutrófilos (fragmentados o cayados)), linfocitos y monocitos. La mayor parte está formada por eritrocitos, (las plaquetas se encuentran rodeando a los eritrocitos, a veces en forma de agregados). Por ejemplo, observé la muestra de un individuo que tenía anemia. Su médula ósea produjo muchas células sanguíneas jóvenes. Por eso, en estas muestras se observarán un gran número de eritroblastos, cayados, metas y mielos. También observé la de un bebé, la cual presentaba células sanguíneas en estadíos tempranos, y la de un paciente con leucemia mieloblástica aguda (tenía muchos blastos). En caso de duda, se recurre a tablas que ilustran la morfología de las células de la seria roja y blanca. Por ejemplo, los esferocitos son hematíes pequeños, densos y teñidos. Los espiculados tienen forma de estrella…. También tienen guardados portas con diferentes cortes de médula ósea de pacientes, para poder hacerles un seguimiento más individualizado a lo largo del tiempo. También se hacían pruebas para detectar alergias. A veces, también se realizan otras pruebas que están totalmente automatizadas como son las de la hemoglobina glicosilada y la de la velocidad de sedimentación globular (v.s.g.). La primera permite determinar la diabetes de una forma más fiable que con el análisis de la concentración de la glucosa en sangre. La prueba de la v.s.g. se emplea principalmente para: detectar procesos inflamatorios e infecciosos . También para detectar y controlar el progreso de algunas enfermedades y neoplasias. Como valor clínico es poco sensible y específico, su utilidad radica en ser una herramienta de apoyo clínico en el momento del diagnóstico. 4.2-Área de coagulación: Se hacen estudios de hipercoagulabilidad. Para ello se realizan diferentes pruebas como son: La determinación de: factores anticoagulantes lípicos, antitrombina III, proteína C y S, resistencia a la proteína C, proteína S libre. También se hacían las pruebas de la anticardiolipina, homocisteina, lipoproteína A. Además, se hacia un seguimiento de los pacientes que tomaban Sintrom. (se toma la muestra, se centrifuga y se introduce en el aparato ACL2 para analizarlo). 4.3-Citómetría de flujo: El citómetro de flujo se utiliza en este laboratorio para: - contar el número de células sanguíneas. - determinar diferentes tipos celulares atendiendo a parámetros como el FSC (da una idea del tamaño de la célula) y el SSC (da una idea de la complejidad, del número de gránulos que poseen las células en su citoplasma). - determinar qué proteínas expresa una célula en superficie (entre otras cosas para detectar las proteínas de membrana de los linfocitos T CD4 y CD8 y así determinar enfermedades como el SIDA, leucemias, etc...). El citómetro de flujo utiliza luz láser, la cual va incidiendo sobre un hilo fino de células. Dependiendo de la cantidad de luz y de la orientación del reflejo, diferentes detectores determinarán los valores de FSC y SSC. Posteriormente, enviará la información al ordenador y en la pantalla se observarán diferentes gráficos. Antes de comenzar a analizar los marcadores (de CD4 y CD8), se introducen unos controles para ajustar el aparato. Si los valores no se salen de los intervalos críticos, se podrá comenzar a analizar la muestra. En el ordenador aparecerán los datos del paciente: nombre, diagnóstico, edad, historial médico, procedencia de la muestra, fecha, el número y el tipo de células que se van analizar… Por ejemplo, se analizó la muestra de un paciente que tenía leucemia linfoide crónica de tipo B (LLC-B). Tenía 153.800 leucocitos y un 74% eran linfocitos. Este es un número demasiado alto para que lo lea el aparato, Por eso, se diluyó 20 veces utilizando PBS. Posteriormente se centrifugó. Estos procesos se repiten hasta obtener una concentración que el aparato lo pueda leer. Después de centrifugar, se tira el sobrenadante y nos quedamos con el sedimento, que son los leucocitos. Ahora, a esto, se le añaden los diferentes marcadores: (simples: FITC, PE; dobles: FITC/PE; triples… se pueden utilizar hasta 5 marcadores diferentes). Después, se dejan las muestras en oscuridad durante 15 minutos. Posteriormente se añade un lisador de hematíes. Se centrifuga a 1.500 G durante 5 minutos. Se tira el sobrenadante y se añade PBS. Después, se lee la muestra en el citómetro de flujo. El médico pondrá las conclusiones y el diagnóstico. (en este caso, el paciente había recaído y volvían a aparecer valores excesivamente altos de linfocitos). Aquí represento los gráficos de la Leucemia Linfoide Crónica de tipo B (L.L.C.-B) obtenidos con la técnica de la citometría de flujo. 5-RESULTADOS DE LAS PRÁCTICAS: La estancia en los laboratorios clínicos del Hospital de Txagorritxu de Vitoria ha sido totalmente satisfactoria. He aprendido el funcionamiento de los aparatos más característicos de cada área, las técnicas utilizadas y su fundamento teórico. Me he dado cuenta lo importante que es una buena coordinación entre los diferentes laboratorios para que todo salga bien. A pesar de que este hospital no había recibido nunca a un alumno de biología, los responsables de las áreas me han tratado muy bien Ha faltado tiempo para afianzar mejor los conocimientos y haber podido ver el funcionamiento del Banco de Sangre y el área de Micobacterias. Ha sido una buena experiencia y me ha servido para conocer de cerca el mundo laboral y darme cuenta de que una parte de los contenidos teóricos que se aprenden en la Universidad son útiles. Lo más duro ha sido el madrugar todos los días y tenerme que desplazar a Vitoria desde Miranda, recorriendo 70 Kms (ida y vuelta) en coche particular con los consiguientes gastos de gasolina.