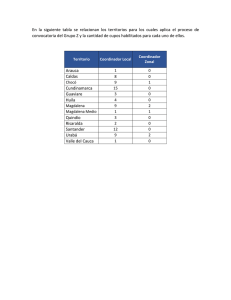
Capítulo 6 - The Nature Conservancy
Anuncio

The Nature Conservancy PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO Sandra Hernández B., María Pinilla V. y Mauricio Valderrama B. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 445 Presiones ejercidas por los motores de cambio Si bien las actividades económicas generan empleo y mejoran la calidad de vida de una parte de la población, también ejercen presión sobre los recursos naturales y el medio ambiente, alterando su estado y produciendo al menos doce impactos significativos en el ámbito social y económico. El pesquero es uno de estos recursos afectados en la cuenca. La pesca provee sustento a las comunidades de pescadores y proteína animal a todo el país. Se trata de la fuente de nutrición de cientos de miles de personas en Colombia. Los peces, especialmente vulnerables a los cambios en los ecosistemas acuáticos, son particularmente sensibles a las presiones de pesca, a la minería, la agricultura, la ganadería, la explotación de hidrocarburos, la expansión urbana, la construcción de infraestructura, la competencia con especies exóticas y al cambio climático. ALTERACIÓN DE LOS ECOSISTEMAS ACUÁTICOS Los ecosistemas acuáticos son muy susceptibles a los cambios en los sistemas circundantes, ya que reciben los contaminantes y sedimentos generados por las actividades en tierra (Carpenter et al. 2011). Debido a esto, pueden ser alterados con facilidad, afectando la integridad del hábitat y sus especies. El impacto sobre los ecosistemas acuáticos se refiere al cambio o degradación impulsado por los motores de cambio. Cada motor ejerce presiones sobre estos ecosistemas; pueden ser compartidos o PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 446 específicos de cada actividad productiva; pueden alterar la conectividad lateral y longitudinal, la calidad del agua, el ensamblaje de especies y las dinámicas ecológicas de los cuerpos de agua. Deforestación, erosión y sedimentación La deforestación es una presión común y una de las más importantes. La minería, la agricultura, la ganadería, la expansión urbana, la construcción de infraestructura vial y de regulación hídrica y la explotación petrolera contribuyen en mayor o menor medida a la modificación de las coberturas vegetales naturales. En la Figura 1 se observa la tendencia histórica de la deforestación. En los últimos 10 años disminuyó a nivel nacional, pre- sentando una tasa menor de conversión de las coberturas durante la segunda mitad de la década. Sin embargo, en el área de influencia de la macrocuenca, es decir en las regiones Andina y Caribe, la deforestación aumentó entre 2000-2010 en comparación con la década anterior. Varios sectores coinciden con que el mayor motor de transformación es la ampliación de la frontera agropecuaria, ya que gran parte de los terrenos deforestados son convertidos en pastos para la ganadería (55,5 %) (González et al. 2011). De acuerdo con Grajales–Quintero (2008), la cuenca posee 2,8 millones de hectáreas de bosque protector natural, es decir, el 10% de su extensión total (27,4 millones de hectáreas) una cifra menor a la recomendada por la FAO quien indica que una cuenca debe contar al menos con un 30% de bosque natural (Grajales–Quintero 2008). En la cuenca hay tres frentes de deforestación localizados en los Santanderes, el Magdalena Medio-Nechí y la vertiente occidental de la Cordillera Central ( Fig. 2). El frente Santanderes está ubicado principalmente en los municipios de Lebrija, Rionegro, El Playón, Cáchira y La Esperanza. En el Magdalena Medio y Nechí, la deforestación está localizada en las estribaciones de la Serranía de San Lucas en Montecristo, San Pablo, Cáceres, Remedios y El Bagre. Por último, el tercer frente se encuentra en los departamentos del Valle del Cauca, Quindío, Risaralda y Caldas, en los municipios de El Cerrito, Buga, Tuluá, Sevilla, Salento, Santa Rosa de Cabal y Villamaría (IDEAM 2013). 3.000.000 2.500.000 Área deforestación (ha) 2.000.000 1.500.000 1.000.000 500.000 0 Andes 1990 - 2000 Caribe Nacional 2000 - 1010 Figura 1. Deforestación histórica a nivel nacional y en la cuenca Magdalena-Cauca (Fuente: IDEAM 2013). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 447 Santa Marta N Barranquilla W E S Deltas Valledupar Cartagena Cesar Sincelejo Bajo Magdalena y Cauca Montería Cúcuta Porce Nechi Arauca Bucaramanga Medio Magdalena Medellín Quibdó Tunja Manizales Pereira Cauca Armenia Bogotá D.C. Ibagué Alto Magdalena Cali FRENTES DE DEFORESTACIÓN 2013 Frente Santander Neiva Frente Magdalena Medio - Nechí Frente Cordillera Central Popayán Macrocuenca Magdalena - Cauca Subunidades Macrocuenca 0 45 90 135 Kilómetros Figura 2. Frentes de deforestación en la cuenca en el año 2013 (Fuente: Sistema de Monitoreo de Bosques y Carbono IDEAM). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 448 PROCESOS DE SEDIMENTACIÓN Y EROSIÓN Se refiere a la cantidad, calidad y régimen del flujo hídrico necesario para la preservación de los ecosistemas y servicios que estos proveen al hombre. El caudal ambiental asigna a los ecosistemas el agua suficiente para mantener cierto grado de integridad ecológica En Colombia se deforestan entre 1,5 y 2,2 millones de ha/año (Grajales-Quintero 2008). La eliminación del bosque, especialmente de los márgenes de los ríos, influye negativamente en la calidad del hábitat disponible para los peces. La transformación de las coberturas naturales, particularmente del bosque ripario, causa un aumento del flujo térmico, de nutrientes y de sedimentos hacia los cuerpos de agua (Rabeni y Smale 1995, Casatti et al. 2006). Esta presión, sumada a la desprotección de los drenajes naturales es la principal causa de erosión en el país. Tras reemplazar la cobertura natural de la red hidrográfica por cultivos o pastos, se altera el ciclo hidrológico y se modifican las propiedades físicas y químicas del suelo; se pierde la capacidad de disipación de la energía de las crecientes y la absorción del agua por parte de las raíces, dando como resultado el socavamiento de los cauces y la desestabilización de las bases de las laderas (Salazar e Hincapié 2006). Adicionalmente, el suelo pierde la protección y estabilidad al retirar las raíces de los ár- en base a una visión de manejo apropiado (Poff y Zimmerman 2010). La sedimentación es un fenómeno natural a lo largo de los ríos que influye en su morfología y en la formación de diques, bancos, meandros y planicies de inundación.Las planicies se forman por la deposición de mediante el movimiento lateral del agua desde el canal principal del río y al disminuir la velocidad. La sedimentación natural queda compensada por la erosión, en un estado de equilibrio en regímenes de inundación y sequía. En este equilibrio ocurre la sucesión de las tierras inundadas en cuyos estados avanzados las lagunas o canales viejos se llenan gradualmente de sedimentos y vegetación, que serán posteriormente substituidos por otros nuevos producidos por la erosión y la socavación (Welcomme, 2008). boles que sirven de refuerzo y anclaje, aumentando el riesgo de derrumbes. La combinación de estos procesos causa erosión y contribuye a la carga de sedimentos de los cuerpos de agua, alterando las condiciones de vida de los peces. En la cuenca Magdalena-Cauca, los puntos críticos de erosión se encuentran en las zonas de ladera de las tres cordilleras, principalmente en la cuenca del Magdalena y las cuencas de los ríos Nechí, Sogamoso y Cesar. Gran parte de las zonas de erosión muy severa están en las cercanías de las principales ciudades del país: Bogotá, Tunja, Neiva, Medellín y Valledupar (Fig. 3). La erosión puede medirse como la pérdida del horizonte A del suelo, el cual corresponde a la capa superior en el que la materia orgánica se encuentra mezclada con el suelo mineral. Al retirar la capa vegetal natural y exponer el suelo, la precipitación, el viento y la gravedad van removiendo la capa orgánica y con ella los nutrientes. Por tanto, como el agua se mueve por toda la superficie o el subsuelo de una cuenca hidrográfica hasta llegar a formar la red de canales que constituye el sistema fluvial, todo cambio en el uso de la tierra o el agua dentro de la cuenca lo acusa rápidamente el río (Welcomme 1980). La producción de sedimentos promedio para la cuenca del Magdalena se estimó en 689± 527 t/km2 al año, valor que se considera alto en relación con otras cuencas (> 500 t/km2 al año) a nivel global (Restrepo y Restrepo 2005). En la cuenca, los ríos Coello, La Miel, Negro, Carare y Opón son los mayores aportantes de sedimento (1125 t/km2 y 3415 t/km2 al año) (Kettner et al. 2010). Grajales-Quintero (2008) indica que en 1921 el río Magdalena transportaba 60 millones de toneladas de sedimento a la altura de Puerto Berrio (Magdalena medio), valor que en 1986 alcanzó los 220 millones de toneladas. Según Restrepo y Restrepo (2005) “los efectos de conversión de bosques sobre el transporte de sedimentos se reflejan con mayor eficacia en pequeñas cuencas, debido a que la relación entre las áreas intervenidas con respecto al área de drenaje es más alta y existe PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 449 N W Santa Marta Barranquilla E S Cartagena Deltas Valledupar Cesar Sincelejo Bajo Magdalena y Cauca Montería Cúcuta Porce Nechi Bucaramanga Arauca Medio Magdalena Medellín Quibdó Tunja Manizales Cauca Pereira Armenia Bogotá D.C Ibagué erosión en la macrocuenca (2003) Alto Magdalena Cali Sin erosión Baja <25% Neiva Moderada 25 - 75% Severa >75% Popayán Muy severa 100% Macrocuenca Magdalena - Cauca Subunidades Macrocuenca 0 45 90 135 Kilómetros Figura 3. Mapa de distribución de la erosión en la macrocuenca Magdalena-Cauca en el año 2003 (Fuente: IGAC 2003). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 450 a. Río Carare 70 Transporte sedimentos x 103 (t/d) 60 50 40 30 20 10 0 1975 1980 b. 1985 1990 1995 2000 1990 1995 2000 Río Opón 30 25 Transporte sedimentos x 103 (t/d) 20 15 10 5 0 1975 1980 1985 PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 451 c. Río Sogamoso 60 Transporte sedimentos x 103 (t/d) 50 40 30 20 10 0 1975 1980 d. 1985 1990 1995 2000 1990 1995 2000 Río Cauca Transporte sedimentos x 103 (t/d) 250 200 150 100 50 0 1975 1980 1985 Figura 4. Tendencias del transporte de sedimentos en cuatro cuencas tributarias del río Magdalena según Restrepo y Restrepo (2005). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 452 una menor probabilidad de que los sedimentos sean almacenados dentro de la cuenca”. Se explica así la tendencia en la mayor producción de sedimentos de los ríos Sogamoso, Carare, Cauca y Opón (Fig. 4); resaltando que entre 1990 y 1998 el río Sogamoso transportó tres veces más sedimentos, el río Cauca 2,2 veces entre 1980 y 2000, el río Carare tres veces entre 1991 y 1998 y el río Opón 1,8 veces entre 1985 y 1995 (Fig. 4), situación que de acuerdo con Restrepo y Restrepo (2005) coincide con el descenso de la superficie de bosques en un 18% en el Cauca y un 25% en el Soga- moso. Estos autores junto con Restrepo et al. (2006) muestran que el aumento significativo en la carga de sedimentos se ha producido en el 68% de la zona de influencia de la cuenca del Magdalena, mientras que solo un 31% ha experimentado tendencia negativa. Los cambios del uso del suelo (1970-1990) señalan que estas tendencias podrían vincularse a la reducción del 17% de las áreas de bosque y al incremento del 16% de zonas dedicadas a la agricultura y ganadería, de modo que las actividades antrópicas han incidido en los procesos erosivos de la cuenca en los últimos 10-20 años. Interrupción del cauce del río y modificación en la dinámica de caudales Para que los procesos reproductivos de los peces sean exitosos, se requiere sincronía entre los reproductores (fracción desovante de una población) y determinadas variaciones en factores ambientales tales como caudales, niveles, temperatura, oxígeno y fotoperiodicidad. La migración reproductiva anual es parte de la historia de vida de muchos peces teleósteos y ocurre cuando las zonas de residencia y de reproducción están separadas. Los adultos perciben el factor ambiental (nivel Área embalsada en el país 100000 90000 80000 70000 Área en ha 60000 50000 40000 30000 20000 10000 0 1938 1947 1951 1965 1971 1973 1976 Figura 5. 1984 1987 1987 1990 1997 2001 2002 2014 Año Histórico de área embalsada en el país, considerando las principales represas hidroeléctricas y reservorios para acueductos. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO - Área + 453 CAUDAL AMBIENTAL Se refiere a la cantidad, calidad y régimen del flujo hídrico necesario para la preservación de los ecosistemas y servicios que estos proveen al hombre. El caudal ambiental asigna a los ecosistemas el agua suficiente para mantener cierto grado de integridad ecológica en base a una visión de manejo apropiado (Poff y Zimmerman 2010) del río) que les induce al comportamiento migratorio, habilidad que determinará en parte, el éxito del potencial reproductivo de una población (Sánchez 2012). El hábitat de los peces puede verse alterado por la construcción de diques y represas. En los últimos 50 años se han construido embalses en los principales ríos del país, alcanzando un área embalsada de alrededor de 87.179 ha (Fig. 5). Las principales especies de peces migratorios en la cuenca, se movilizan hasta los 800 m s.n.m. para desovar. Enseguida las larvas viajan a través del río para establecerse aguas abajo en las diferentes ciénagas, donde se alimentan hasta alcanzar la edad reproductiva. His- tóricamente, las represas en Colombia se construyeron a alturas superiores a los 800 msnm. Durante los últimos treinta años esta tendencia se ha transformado, dando inicio a la construcción de represas a menor altitud (Fig. 6). Los organismos que viven en los ríos están adaptados a sus caudales, de modo que los cambios en la modalidad de los pulsos de inundación repercutirán en el componente biótico del ecosistema (Welcomme 1980). Las represas y desviaciones de agua para diferentes usos, ocasionan este tipo de cambios. Esta situación se agrava en función del crecimiento de la población humana y su demanda de agua y energía. El ritmo 25 Número de embalses 20 15 10 5 0 1930 1940 1950 1960 1970 1980 1990 2000 2010 Década Embalses a alturas menores a 800 msnm Embalses a alturas mayores a 800 msnm Figura 6. Curva histórica de acumulación de embalses por altitud. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 454 y la intensidad de las alteraciones fluviales exige desarrollar estándares de manejo de caudal ambiental para preservar los ecosistemas (Anderson et al. 2010). De acuerdo a Ramírez et al. (2010) con la operación del embalse Salvajina, el régimen natural de carácter aluvial del río Cauca -hasta el año 1985-, se transformó en uno de tipo pulsátil en escala horaria, en el cual los caudales máximos calculados para el período post-salvajina (1986-1996) disminuyeron en promedio en un 30% con relación a los caudales máximos calculados para el período pre-salvajina (1947-1985). El río Magdalena drena más de 150 cuencas alcanzando un caudal promedio de 7.100 m 3/seg a la altura de Calamar (Banco de Occidente 2003). De acuerdo a los registros históricos, el río Magdalena refleja pérdida de su caudal (promedio multianual) a la altura de Puerto Salgar, pasando de 4.400 m3/seg en la década de 1950, a 3.671 m3/seg en la década 1990 (17% menos) (Fig. 7). Esta situación ha sido analizada por Velasco y Díaz-Granados (2006) a lo largo del alto y medio Magdalena; señalando tendencias generales de disminución de caudal más intensas durante los meses de octubre y noviembre; 12 de las 40 estaciones analizadas, presentaron una pendiente negativa de la serie de tendencia para todos los meses del año. Entre estas cabe destacar la estación de Puerto Salgar que cuenta con la mayor pendiente negativa durante todos los meses del año, lo cual sugiere la disminución de la disponibilidad hídrica y la previsión de escasez a largo plazo. También los registros de nivel reportados por Cormagdalena (2014), muestran una tendencia negativa durante los últimos tres años (2011- 2014) (Fig. 8). COMPETENCIA POR NICHOS CON ESPECIES EXÓTICAS Algunas de las especies introducidas en esta cuenca son calificadas de alto riesgo, pues ya se consideran invasiones o presentan antecedentes de invasión en otros países o en ecosistemas similares. La presencia de la tilapia nilótica (Oreochromis niloticus) se ha vuelto cada vez más importante comercialmente. Sus desembarques pasaron de cerca 200 toneladas en el 2001 a 1.000 toneladas en el 2013 (5 veces más en 12 años). A lo largo de la última década, las capturas de tilapia han aumentado mientras que las de bocachico han disminuido de 12.682 toneladas en el 2001 a 1.370 en el 2013 (Fig. 9). En el embalse del Guájaro la tendencia es similar; las tilapias superaron el volumen de captura de otras especies en sólo diez años. Esta observación nos permite inferir que la tilapia nilótica está compitien- 4600 4400 Caudal (m3/seg) 4200 4000 3800 3600 3400 3200 50 60 70 80 90 Años Figura 7. Dinámica del caudal promedio multianual del río Magdalena a la altura de Puerto Boyacá. (Adaptado del Plan Básico de Ordenamiento Territorial Puerto Boyacá 2004-2012, Consultor HyM Ltda. Estación Puerto Salgar). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 455 9 8 7 Nivel del río (m) 6 5 4 3 2 1 jul-14 may-14 mar-14 ene-14 nov-13 sep-13 jul-13 may-13 mar-13 ene-13 nov-12 sep-12 jul-12 may-12 mar-12 ene-12 nov-11 sep-11 0 Figura 8. Comportamiento del nivel del río Magdalena a lo largo del tiempo en diferentes estaciones de la cuenca media y baja (Fuente: Base de datos Cormagdalena 2014). a. San Pablo Puerto Berrío Gamarra Barrancabermeja Tilapia nilótica 1400 1200 Toneladas 1000 800 600 400 200 0 2001 2002 2003 2005 2006 2007 2008 2009 2010 2013 Años PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 456 b. Bocachico Toneladas 15000 10000 5000 0 2001 2002 2003 Figura 9. 2005 2006 2007 2008 2009 2010 2013 Años Capturas comerciales de tilapia y bocachico en la cuenca Magdalena-Cauca (Fuente: AUNAP 2013 y AUNAP-Universidad del Magdalena 2014). do con las especies nativas por alimento y hábitat, especialmente con las que comparten nicho trófico, como la arenca (Triportheus magdalenae) (Caraballo 2009). EVENTOS CLIMÁTICOS EXTREMOS En distintas escalas de tiempo, el clima ha variado y lo continuará haciendo. Sin embargo, la alteración de la composición atmosférica a través de la actividad industrial en los últimos 150 años, ha alterado el curso normal de la temperatura global del planeta (Montecinos 2012). Uno de los fenómenos sobresalientes del cambio climático es la intensidad y recurrencia de El Niño-Oscilación del Sur, que afecta enormemente a las precipitaciones en los Andes tropicales. La región es por tanto, no solo susceptible a un futuro cambio climático, sino que ya está experimentando variaciones significativas en la temperatura, regímenes de precipitación y patrones climáticos estacionales (Herzog et al. 2012). El cambio climático ejerce una presión directa sobre el recurso pesquero al alterar los ciclos meteorológicos normales por medio de eventos climáticos extremos. A estos eventos se suman cambios en la intensidad de los fenómenos del Niño y la Niña, modificando los patrones de precipitación y por tanto de los caudales. Los procesos migratorios de los peces con fines reproductivos coinciden con el período de subienda que generalmente corresponde a los meses secos de diciembre a marzo (Zárate et al. 1983). En este intervalo los peces buscan las rutas migratorias para desovar aguas arriba, dando el tiempo para que el momento del desove coincida con el período de lluvias, caudales y niveles altos, lo que permitirá conducir a las larvas hacia las zonas de crecimiento y alimentación, es decir los cuerpos cenagosos aguas abajo. Esta etapa de migración es aprovechada por los pescadores (Fig.10). El fenómeno de El Niño puede acentuar el bajo nivel del río y el volumen de pesca. En la Figura 11 se observa la relación entre los desembarcos de subienda CS y los totales anuales (CS/CT) siendo mayor en la medida que el nivel del río es más bajo. En la Figura 12 se observa el comportamiento de las capturas en el período de subienda durante la última década, resaltando los años con El Niño con rojo y La Niña con azul. Durante los años Niño las capturas son superiores, con una proporción cercana al 75%, mientras que en los años Niña, disminuye. Tras un año Niño las capturas del año siguiente disminuyen y tras un año Niña aumentan. LA PESCA COMO ACTIVIDAD EXTRACTIVA La pesquería involucra varios estados de desarrollo desde su descubrimiento, el crecimiento del esfuerzo pesquero, un pico máximo en dicho esfuerzo hasta la reducción del stock. Esta última étapa ira acompañada de la competencia entre pescadores por el recurso remanente, y de acuerdo a las medidas de manejo PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 457 Río Magdalena 7000 Número de canoas/día 6000 5000 4000 3000 2000 1000 0 Subienda Bajanza Mitaca Figura 10. Comportamiento del esfuerzo pesquero (N° canoas/día) y las fluctuaciones propias para cada Años 70 época de pesca en el río Magdalena (Tomado de Zárate et al. 1983). Años 80 MOVIMIENTOS QUE HACEN ALGUNAS ESPECIES DE PECES ENTRE DIFERENTES SISTEMAS ACUATICOS Y ASOCIADO CON CAMBIOS EN EL NIVEL DEL AGUA: La subienda es la migración de los peces contra corriente. Las especies migratorias salen de las ciénagas hacia el cauce principal y viajan río arriba. Este movimiento migratorio sucede durante los meses de diciembre a febrero, cuando el río tiene los menores niveles de agua, en el cual participan preadultos y adultos. La bajanza es la migración a favor de la corriente. Este recorrido comienza desde los sitios a donde lograron llegar los peces durante la subienda hacia las zonas bajas. Aunque la bajanza no es tan visible para los pescadores como la subienda, también hay presión por sobrepesca, especialmente en los caños que conectan las ciénagas con los ríos, por donde obligatoriamente pasan los peces. Se sucede una vez los niveles del agua comienzan a ser más altos, entre mayo y junio. En esta migración viajan adultos, embriones y larvas (provenientes de desoves). La mitaca es similar a la subienda, pero aquí la migración es menor; probablemente porque la reducción en el nivel de los ríos no es tan drástica como a comienzos de año. Se sucede entre agosto y septiembre. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 458 0,6 y= 0,0017x + 0,7619 R2 = 0,8875 Captura subienda/captura Total 0,58 0,56 0,54 0,52 0,5 0,48 0,46 100 120 140 160 Nivel río (cm) Figura 11. Relación entre la proporción de la captura en subienda y la captura total con el nivel del río Magdalena. 0,87 1 0,79 0,9 0,76 0,74 0,8 0,7 0,57 0,54 0,53 0,53 0,45 0,48 0,49 2008 2009 CS/CT 0,6 0,5 0,4 0,3 0,2 0,1 0 2001 2002 2003 2004 2005 2006 2007 2010 2011 2012 2013 Figura 12. Proporción entre desembarcos de subienda CS a desembarcos totales CT durante el periodo 2001 a 2013. En rojo años con El Niño, en azul años con La Niña (Fuente: AUNAP 2013 y AUNAP-Universidad del Magdalena 2014). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 459 para cada pesquería, continuará ejercerciendo o no presión sobre el recurso (Hilborn y Walters 1992). La presión sobre los recursos pesqueros ha aumentado con el tiempo a causa de la persistente tendencia mundial al alza en el consumo de pescado y productos pesqueros, especialmente entre la clase media. A esto se suma el continuo crecimiento de la población humana (FAO 2000, Godfray et al. 2010) y el estancamiento del suministro de pescado procedente de la pesca de captura (Grajales-Quintero 2008). En Colombia el ingreso per cápita ha aumentado en los últimos años, lo cual se refleja en el mayor consumo de peces, crustáceos y moluscos por persona (Fig. 13). También ha habido un incremento significativo en las importaciones de pescado y marisco en los últimos años (Fig. 14) ya que la demanda nacional de pescado no es suplida por la producción local. Este aumento en la demanda, supone una actividad pesquera mas intensa que pone en riesgo la disponibilidad del recurso a futuro. En el río Magdalena el volúmen de captura ha disminuido cerca del 50%, pasando de 64.945 a 39.000 toneladas en el 2010 (ver capítulo sobre el estado de la pesca) por la combinación de muchos factores, específicamente por una capacidad pesquera excesiva frente a un conjunto de recursos finitos. Efectivamente ha disminuido el rendimiento pesquero. En el caso de la atarraya paso de 25,5 a 12,1 kg/día/uep en 1977 y 2010 respectivamente. Una gran variedad de artes de pesca tanto legales como ilegales (atarraya, chile, chinchorro, chinchorra, nasa, calandrio, lanza, arpón, trasmallo con toda su variedad entre otros) se emplean comúnmente, incursionando en todos los hábitats de los peces, desde el estrato superficial, la columna media hasta el fondo. De igual forma, se ha estimado un número de pescadores relativamente igual al de la década de 1970 (35.000 pescadores), es decir que la biomasa actual de peces está siendo extraída por el mismo número de pescadores que faenaban cuando la producción era el doble de la actual. Todos estos factores conducen a la sobrepesca. Esta presión actúa principalmente sobre las especies de interés comercial, pero los efectos abarcan todo el ecosistema. La sobrepesca se manifiesta en la disminución en la abundancia de especies, y posterior introducción al mercado de otras que antes no eran explotadas. En la cuenca del Magdalena-Cauca las especies de interés pesquero han aumentado en el tiempo (Tabla 1). En 1978 se explotaban comercialmente 26 especies, principalmente el bocachico y el bagre rayado. En 2010 se aprovechaban 45 especies, incluyendo especies exóticas que anteriormente estaban ausentes en la cuenca. 7,0 6,0 Kilos/habitante/año 5,0 4,0 3,0 2,0 1,0 0,0 1989 1994 1999 2004 2009 2014 Figura 13. Consumo histórico de peces, crustáceos y moluscos per cápita en Colombia (Fuente: Base de datos DANE). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 460 130.000 Kilogramos 120.000 110.000 100.000 90.000 80.000 2002 2003 2004 2005 2006 Figura 14. Importaciones de pescado, crustáceos y moluscos en Colombia (Fuente Bases de datos del DANE). % Especie 1978 2010 Bocachico Bagre rayado 25 23 32 14 Blanquillo 6 9 Mojarra lora o tilapia 0 8 Doncella 6 7 Pacora 6 6 Nicuro, Barbul 5 4 Otras 20 31 Total 100 100 Número de especies 26 45 Tabla 1. Composición de la captura (%) en la macrocuenca (Chapman 1977 y Fundación Humedales 2010). Número de especies actualizado a la fecha. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO - % 2010 + % 1978 + 461 En la cuenca del Magdalena se emplean diversas artes de pesca, en su mayoría tradicionales. Sin embargo, el pescador ha innovado en las técnicas dependiendo de la zona, las especies y su abundancia. A medida que el recurso escasea, los pescadores emplean artes prohibidas para pescar la misma cantidad que antes lograban con métodos permitidos (Pachón 2000). LA CONTAMINACIÓN CON MERCURIO El mercurio es un elemento que se encuentra de manera natural en el ambiente, aunque en concentraciones bajas. Sus fuentes naturales son la desgasificación de la corteza terrestre, las emisiones volcánicas y la evaporación de los cuerpos de agua. Cuando se trata de altas concentraciones, estas provienen siempre de la actividad antrópica (Lancheros-Ascencio 2014). La minería, una actividad creciente en la cuenca, libera vapores de mercurio y en su condición elemental puede producir problemas de salud graves y diversos (PNUMA 2008). Los vapores provenientes de la actividad minera llegan a los cuerpos de agua junto con los residuos de mercurio vertidos por la producción minera. Todas las formas de este metal pesado que entran en los sistemas acuáticos son susceptibles de convertirse en metilmercurio, una forma más tóxica que el metal su estado elemental. El metilmercurio es bioacumulado por organismos acuáticos y biomagnificado a través de la cadena trófica (Renzoni et al. 1998). Se estima que en Colombia se liberan entre 80 t y 100 t de mercurio anualmente. El límite de presencia de mercurio en agua para consumo humano es de 0,002 mg/l, valor que se excede en ciertos tramos de los ríos Cauca, Magdalena y Yaguará, según las mediciones del IDEAM del 2011 (IDEAM et al. 2013). Gran parte de este mercurio proviene de las zonas mineras del Bajo Magdalena- Cauca en los municipios de Caucasia, Tarazá, El Bagre, Zaragoza, Remedios y Segovia en el departamento de Antioquia. La concentración de mercurio en sedimentos aumenta dramáticamente a partir de la depresión Momposina, patrón que se ha confirmado examinando peces de estas áreas (Mancera-Rodríguez y Álvarez-León 2006) (Fig. 15). El mercurio es un contaminante que permanece en los ecosistemas y se acumula en las partes más profundas de los cuerpos de agua en condiciones de poca luz y oxígeno. Esto determina su permanencia en las cadenas tróficas hasta por décadas (Harris et al. 2007). En respuesta a esta problemática, el congreso de Colombia decretó la Ley 1658 del 15 de julio de 2013, por medio de la cual se pretende erradicar el uso del mercurio en la minería en los próximos cinco años y en la industria en los próximos 10 años (Congreso de Colombia 2013). 140 120 Mercurio en kg/día 100 80 60 40 20 0 Barranquilla Figura 15. Calamar Regidor-Bolívar SitionuevoMagangé Nariño El banco Puerto Salgar Natagaima Guaduas Puerto Berrío Municipios Concentración de mercurio en sedimentos en el río Magdalena (kilogramos/día) medido en estaciones del IDEAM a lo largo del cauce (Fuente: IDEAM et al. 2013). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 462 PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 463 Impactos sobre el recurso pesquero El aumento de la carga de sedimento causado por los cambios en el uso de la tierra o del agua altera el sistema fluvial y causa diversos problemas: modifica la calidad de agua, aumenta su turbidez, afecta la conectividad entre el río, las ciénagas y caños aledaños y aisla a las poblaciones de peces. Disminución de la abundancia de peces La producción pesquera ha disminuido en las últimas décadas y se estima que actualmente corresponde a la mitad de la producción de hace 30 años. La alteración de los ecosistemas acuáticos como consecuencia del cambio del uso del suelo, la sobrepesca, la introducción de especies exóticas y la contaminación con mercurio son los principales causantes de esta situación. Esta disminución tiene repercusiones en la viabilidad de las poblaciones ya que restringe la disponibilidad de individuos en edad reproductiva, reduce el acervo genético y el tamaño de las poblaciones y desestabiliza entre otros la composición de las comunidades de peces y demás organismos acuáticos. Impactos por aumento de sedimento El aumento de la carga de sedimento causado por los cambios en el uso de la tierra o del agua, altera el sistema fluvial y causa diversos problemas: modifica la calidad de agua, aumenta su turbidez, afecta la conectividad entre el río, las ciénagas y caños aledaños y aisla a las poblaciones de peces. Adicionalmente, un aumento repentino en la carga de sedimentos puede reducir el tamaño de los cauces y ocasionar inun- PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 464 daciones (Restrepo et al. 2005) También puede bloquear pequeños ríos e incluso desviarlos por nuevos cauces. En las zonas de inundación, la acentuada sedimetación puede hacer que se rompa la orilla y que el río se salga del cauce; en las llanuras inundables hace desaparecer las aguas permanentes (Welcomme 1980) con consecuencias para los organismos acuáticos que los habitan. Se ha establecido que la carga excesiva de sedimentos en los cuerpos de agua produce graves impactos sobre la fauna acuática con repercusiones en las poblaciones de peces (Henley et al. 2000) tales como la reducción en la producción de fitoplancton por incremento de la turbidez. También puede sofocar a los organismos reófilos que habitan los tramos de ritron (zonas del río con caudales turbulentos), reduciendo el alimento disponible y alterando las cadenas tróficas acuáticas; el exceso de sedimentos puede inutilizar el substrato para el desove de las especies que necesitan aguas rápidas bien ventiladas y fondos limpios de piedras, aumentando la mortalidad de los alevinos (Welcomme 1980). Impactos por la alteración del caudal Los caudales adecuados son esenciales para la cría y las migraciones de muchas especies entre las cuales se encuentra muchas de importancia para la pesca regional (bocachico Prochilodus magdalenae, dorada o mueluda Brycon moorei, pataló Icthyoelephas longirostris y bagre rayado Pseudoplatystoma magdaleniatum entre otras). Los peces reaccionan fisiológicamente a los pulsos de inundación madurando sexualmente y desplazándose a los lugares de reproducción; pulsos que permiten mantener tales lugares en buenas condiciones tanto para el desove como para la supervivencia de los jóvenes. Sin embargo, los proyectos hidroeléctricos han alterado el régimen del caudal en su magnitud, ritmo, frecuencia, duración y tasa de cambio. Como el caudal determina el hábitat físico y la composición biótica de los ríos, su alteración pone en riesgo la conservación de las especies de agua dulce (Anderson et al. 2012). Welcomme (1980) indica que dichas alteraciones pueden influir en la historia de vida, en la frecuencia y tiempo de la reproducción y en el momento de la eclosión, teniendo en cuenta que los peces se han adaptado a reproducirse en un momento determinado, para lo cual requieren como ya hemos mencionado, sincronía entre factores, uno de los cuales es el caudal. En ese sentido, si los pulsos de inundación ocurren en otro momento del año, los procesos reproductivos serán poco efectivos o si por ejemplo, las planicies no se inundan, equivaldrá a un año sin reclutamiento. Por otra parte, las subidas y bajadas inesperadamente rápidas del nivel del agua pueden dejar en seco los sustratos de desove y nidos en momentos críticos. También puede ocurrir que la corriente arrastre los huevos y alevinos. La disminución repentina de la inundación, puede dar como resultado que los peces queden atrapados en lagunas por falta de tiempo para encontrar el paso al canal principal del río. De igual forma, muchos peces se alimentan de macroinvertebrados, fauna fluvial susceptible a las alteraciones de caudal y a la estacionalidad, factores que inciden en su densidad y diversidad. La disminución de la abundancia de peces afecta no solo a sus poblaciones sino a todo el ecosistema, incluidas las comunidades humanas, especialmente las que obtienen su sustento de la extracción y comercialización del pescado. La alteración del régimen de caudal amenaza la integridad de los ecosistemas acuáticos. Impacto por el fraccionamiento del hábitat Las represas generan un efecto fragmentador del hábitat fluvial (pérdida de conectividad), impidiendo o limitando el libre flujo de organismos asociados al mismo. El bloqueo de la libre movilidad de los peces aguas arriba de una represa impacta significativamente la biodiversidad y la dinámica poblacional. Estos efectos de disrupción de los ciclos biológicos (principalmente los reproductivos) merman las poblaciones ícticas. Existe una correlación entre la presencia de represas y la disminución de la diversidad de especies en los ríos (Santucci et al. 2005, Fukushima et al. 2007, Wang et al. 2011) al cambiar el río por hábitats semilacustres, inadecuados para especies de aguas corrientes. Este impacto es especialmente agudo sobre especies migratorias que se movilizan aguas arriba para desovar y cuyas larvas dependen del flujo continuo del río para alcanzar sus lugares de crecimiento aguas abajo, en las ciénagas y áreas inundables (Ferguson et al. 2011, Ziv et al. 2012). En la Figura 16 se observa el cambio en el comportamiento de los desembarques de cuatro de las especies migradoras del río Magdalena entre 1975 y 2008. La dinámica anual en cada una de las especies se ha mantenido a pesar de que los volúmenes de captura se han reducido drásticamente. Adicionalmente algunas especies como el bocachico han perdido capacidad de engorde durante su crecimiento, lo que se traduce en una menor biomasa. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 465 a. Bagre Rayado 4.500,000 4.000,000 3.500,000 Desembarcos (ton) 3.000,000 Periodo de Veda 2.500,000 1975 2.000,000 1.500,000 1.000,000 500,00 2008 2004 0,00 Ene b. Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic 1975 1976 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 Bocachico 7.000,000 Desembarcos (ton) 6.000,000 5.000,000 1978 4.000,000 3.000,000 2.000,000 2008 1.000,000 1997 0,00 Ene Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic 1975 1976 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 466 c. Capaz 140,00 Desembarcos (ton) 120,00 100,00 1975 80,00 60,00 40,00 2008 20,00 2007 0,00 Ene d. Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic 1975 1976 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 Nicuro 5.000,000 4.500,000 4.000,000 Desembarcos (ton) 3.500,000 3.000,000 2.500,000 2.000,000 1975 1.500,000 1.000,000 500,00 2008 0,00 Ene Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic 1975 1976 1977 1978 1979 1980 1981 1982 1983 1984 1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 Figura 16. Comportamiento de las capturas de cuatro especies migratorias del río Magdalena entre 1975 y 2008 (Fuente: C. Barreto, datos no publicados). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 467 La Figura 17 muestra como en 1965 los ejemplares de bocachico por encima de los 26 cm (LE) alcanzaban pesos mayores a los que actualmente adquieren (ahora son más livianos). Esto obedece al conjunto de factores que alteran el ciclo vital de la especie. Igualmente, la fragmentación del hábitat fluvial genera un ambiente compartimentado en el que las poblaciones quedan aisladas en los diferentes tramos (aguas arriba y aguas abajo del embalse). Alterando todo el ensamblaje de peces aguas arriba, desapareciendo todas aquellas que no se adaptan al nuevo ecosistema semilacustre y las que no pueden migrar. Para las especies aguas abajo, la limitación de movimiento se traduce en pérdida de hábitat y disminución de la diversidad genética. Aguirre-Pavón et al. (2012) mencionan la importancia ecológica, social y pesquera que tiene el bocachico. Dadas las amenazas que enfrenta, el bocachico ha sido considerado especie objeto de repoblamiento; pero surgen dudas sobre el éxito de esta medida, pues los programas anteriores no se han basado en criterios técnicos ni científicos. La mala práctica y el desconocimiento han incidido en la variabilidad genética de la población de bocachico en el Magdalena y Sinú. El déficit de heterocigotos, probablemente por eventos de cuello de botella en las localidades naturales y el efecto fundador en las estaciones piscícolas han limitado la variabilidad genética de la población. Como consecuencia de repoblamientos arbitrarios desde las estaciones piscícolas, existe una subdivisión de la población de esta especie en el río Magdalena (introgresión). En relación a estas especies importantes para las pesquerías, la FAO/PNUMA (1984) señalan que si bien una población que ha recolonizado natural o artificialmente un ambiente, puede adaptarse tan bien como el stock original, siempre es importante optimizar las condiciones de recolonización o refuerzo de las poblaciones, tomando en cuenta todas las variables genéticas y ecológicas. Bocachico 1000 900 800 700 Peso (g) 600 500 400 300 200 100 0 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 Longitudes estándar (cm) 1965 2011 Figura 17. Relación peso (g) y longitud estándar del bocachico en 1963 (Fuente:Dahl et al. 1963) y 2011 (Datos recopilados del río La Miel y río Magdalena a la altura de Neiva por la Fundación Humedales). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 468 VARIABILIDAD GENÉTICA DE LOS PECES La variación genética es una medida de la capacidad de una población para adaptarse a cambios o presiones medioambientales y por tanto de sobrevivir. La homocigocidad produce pérdida de variación genética, afectando la salud poblacional y su fecundidad. Una disminución del 5 al 10% en la fecundidad puede no parecer muy seria (especialmente cuando se trata de animales tan fecundos como los peces) pero si también se consideran los efectos de la depresión endogámica en otros rasgos, como la viabilidad, el potencial reproductivo total puede disminuir en un 25 % Impactos por la actividad pesquera La pesca tiene efectos sobre la comunidad de peces y sobre otras especies. La sobrexplotación pesquera está induciendo cambios en las cadenas tróficas al modificar la composición específica de las comunidades, su estructura, función, productividad y resiliencia (Cerdenares-Ladrón de Guevara et al. 2014). La sobrepesca tiene impactos en los tres niveles de la biodiversidad: genética, específica y ecosistémica. A nivel genético, la pérdida de variación por deriva génica o por modificación de la estructura genética poblacional se traduce en pérdida de la capacidad de adaptación de las poblaciones naturales o en cambios en las características de historia de vida y comportamiento de las especies. Esto altera la dinámica de las poblaciones explotadas, los flujos de energía de los ecosistemas y produce pérdida de productividad (Cerdenares-Ladrón de Guevara et al. 2014). La sobrepesca tiende a reducir la edad media de los peces. Los más jóvenes crecen más rápido por su eficacia en la utilización del alimento. Esto tiene consecuencias en el crecimiento individual y en la talla de maduración de las especies sujetas a explotación por tiempo prolongado. Cuando se intensifica la pesca, las especies grandes, longevas y de crecimiento lento, tienden a ser sustituidas por otras más capaces 20,00 y= 0,2738x + 20,687 R2 = 0,759 Aporte Tilapia (5) 15,00 10,00 5,00 0,00 0,00 20,00 40,00 60,00 80,00 Bocachico aporte (%) Figura 18. Relación entre los aportes a la captura comercial de la cuenca Magdalena de bocachico y de tilapia, en el periodo 2001- 2013 (Fuente: AUNAP 2013 y AUNAP-Universidad del Magdalena 2014) PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 469 de aprovechar los nutrientes y aumentar la productividad (Welcomme 1980, Cerdenares-Ladrón de Guevara et al. 2014). Por tanto, el efecto inmediato de la sobrepesca es la reducción de la talla promedio de captura (sobrepesca por crecimiento), debido a la selección de organismos de tallas mayores (ejemplares maduros). El cambio significativo en la estructura de tallas puede ser un indicador de pesca excesiva. En el caso del bocachico, la talla media de captura pasó de 26,7 cm a 23,4 cm de longitud estándar (LE) entre 1966 y 2007. La talla media de captura del bagre rayado en 1973 era 89 cm LE, en 2013 se capturaban ejemplares 23 cm más pequeños (61 cm LE) (ver capítulo Estado del recurso pesquero). Welcomme (1980) indica que la pesquería se basa en una sucesión de especies cada vez más pequeñas. A nivel específico, la actividad pesquera incide en la abundancia y estructura de las comunidades, lo que implica cambios en la cadena trófica, por extracción de determinadas especies (Cerdenares-Ladrón de Guevara et al. 2014). En el río Magdalena Mojica (1999) estima una riqueza de 190 especies, de las cuales 40 son de interés pesquero (Lasso et al. 2011). Sin embargo, quedan vacíos sobre la relación de especies incidentales en la pesca artesanal (cangrejos, camarones, aves, tortugas, peces sin interés comercial, etc.). La sobrepesca de algunas especies genera vacíos en las cadenas tróficas, alterando su equilibrio (sobrepesca ecológica). En el caso de las especies carnívoras, se induce al crecimiento de sus presas, afectando a su vez a los productores primarios (Murawski 2000). La actividad pesquera puede alterar las funciones, bienes y servicios de los ecosistemas. Por una parte es capaz de ejercer cambios físicos en los ambientes con los equipos y métodos de pesca comerciales, tales como dragas, redes de arrastre, redes de enmalle, explosivos. La mayoría de los cuales, entre ellos la red de arrastre y las dragas, afecta el fondo del río que es el hábitat de gran cantidad de organismos. Los escasos estudios sobre el impacto real de todas las artes empleadas en la cuenca, los impactos antrópicos y la dinámica pesquera cada vez más intensa ponen en peligro los ambientes proveedores de este recurso. La estructura de un ecosistema es el resultado de la combinación de especialización morfológica, depredación y competencia (Cerdenares-Ladrón de Guevara et al. 2014). Impacto por competencia de nichos con las especies exóticas Las especies exóticas o introducidas rara vez han ocupado un nicho íntegramente vacante, especialmente en los trópicos, por lo que las introducciones casi siempre suponen cambios en las poblaciones endémicas (FAO/PNUMA 1984). La tilapia nilótica (Oreochromis niloticus) es una de las especies que impacta negativamente a la ictiofauna nativa en los lugares donde ha sido introducida. En la Fig. 18 se aprecia la relación inversa en la dinámica de dos pesquerías. Mientras que los aportes de la tilapia aumentan, los del bocachico disminuyen. Es decir que el establecimiento de la tilapia ha supuesto un impacto para las poblaciones de bocachico de las planicies inundables. Existe evidencia de los efectos nocivos de esta especie en el lago Victoria en África en donde extinguió a varias especies de peces; también en Nicaragua eliminó el hábitat de las especies nativas al alimentarse de las plantas acuáticas. Esta especie se relaciona además con la competencia por lugares de desove y la trasmisión de parásitos (Leal-Flórez 2008). En la cuenca del Magdalena-Cauca, la tilapia nilótica se ha establecido en las planicies inundables, donde compite por hábitat y alimento con especies nativas pero también se ha documentado su presencia en ciénagas de las cuencas de los ríos San Jorge, Sinú y en algunos embalses (Aguirre-Pavón et al. 2005). Impactos generados por eventos climáticos extremos Estos impactos son diversos y abarcan desde la distribución espacial de los ambientes, la geomorfología fluvial, el flujo de energía de los ecosistemas terrestres hacia los acuáticos, los bosques y llanuras de inundación y la función de los ecosistema entre otros. Los efectos son notables en la abundancia y distribución de las especies (Maldonado et al. 2012). En el caso de la ictiofauna, este factor agravaría la vulnerabilidad del hábitat de los peces, ya alterado por las actividades de producción no sostenible que se llevan a cabo en la cuenca. Los años con El Niño (secos) y La Niña (lluviosos) tienen repercusiones en el reclutamiento de nuevos individuos, debido a la variación en el número de adultos que llegan a desovar o la disminución en el número de larvas que alcanzan las zonas de crecimiento durante una época de lluvias reducida. El cambio climático puede traer alteraciones en los regímenes de lluvias en la cuenca, afectando el tamaño de los caudales en época de subienda. A causa de esto, las poblaciones de peces pueden volverse más vulnerables a PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 470 Concentración de mercurio en peces de la macrocuenca a través del tiempo 2013 2012 2008 2007 2004 2001 1997 1995 1983 0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 Concentración de Hg en ug/g de peso fresco Bocachico Bagre Rayado Capaz Cucha Moncholo Yalua Blanquillo Doncella Nicuro Arenca Mojarra amarilla Liseta Pacora Figura 19. Comparación histórica de la concentración de mercurio en especies de interés pesquero en la cuenca (Fuente: Cala 2000, Olivero et al. 2002, Marrugo et al. 2007, Marrugo-Negrete et al. 2008, Olivero- Verbel et al. 2011, Álvarez et al . 2012, Marrugo-Negrete et al. 2013 y Lancheros 2014). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 471 la pesca durante las temporadas secas en los años Niño, afectando su dinámica poblacional. Restrepo y Kjerfve (2000) indican que las series de tiempo de descarga de agua del río Magdalena confirman que los eventos de La Niña están asociados al aumento en la proporción de sedimentos, lo cual afecta de forma drástica a las poblaciones de peces. ALTERACIONES FISIOLÓGICAS CAUSADAS POR MERCURIO Parte del mercurio depositado en los sedimentos es transformado por los microorganismos en metilmercurio. Esta forma tóxica, se incorpora y biomagnifica a lo largo de la cadena trófica. Las especies filtradoras que lo ingieren al alimentarse y sus depredadores pueden llegar a presentar concentraciones altas de metilmercurio en sus tejidos (Harris et al. 2007). La concentración de metilmercurio en el músculo de las especies carnívoras de esta cuenca, es más alto que en el resto de organismos, por ser el último eslabón de la cadena trófica, antes del hombre. En la Figura 19 se observan las concentraciones en aumento desde la década 1980 para gran parte de las especies. Los peces contaminados con metilmercurio experimentan mortandades mayores y alteración de su capacidad reproductiva. Los ejemplares expuestos a una dieta contaminada con metilmercurio tienen una mayor tasa de mortalidad de machos y una menor tasa de fertilización de los huevos. Además, los efectos de la contaminación se trasmiten a la siguiente generación, la cual presenta cambios en la proporción de machos y hembras, transtornos conductuales y menor éxito reproductivo. La variación en el comportamiento se manifiesta en la pérdida de la habilidad para alimentarse y del interés reproductivo en los machos (Fjeld et al. 1998, Matta et al. 2001, Sandheinrich y Miller 2006). Por lo tanto es importante resaltar el impacto que tiene este agente tóxico sobre la supervivencia de los individuos y la estabilidad de las poblaciones de peces. IMPACTOS SOBRE EL SECTOR PESQUERO Y LAS COMUNIDADES Vulnerabilidad de los pescadores Ingresos económicos. La pesca a pequeña escala, constituye una alternativa al desempleo y contribuye a reducir la pobreza en América Latina (Soto y Quiñonez 2013). Las presiones sobre la integridad del hábitat de los peces y sobre sus poblaciones, han disminuido la producción pesquera, afectando el sustento de las comunidades de pescadores. Además, cerca de la mitad de los ingresos anuales de los pescadores se obtie- % principal fuente de ingresos Actividad laboral Neiva La Dorada Barrancabermeja Magangué Nechí Pesca 45,7 37,6 39,3 51,4 50,7 Pesca y agricultura 54,3 39,8 19,5 7,8 13,1 22,8 11,6 36,2 Pesca y negocios Pesca y minería 20,1 26,1 Pesca y otros 9,6 14,7 100 100 100 100 Tabla 2. Principal fuente de ingresos de los pescadores en la macrocuenca 100 - % Ingresos + (Fuente: Fundación Bosques y Humedales 2014). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 472 nen en la época de subienda, cuando la pesca es más abundante, pero los eventos climáticos extremos han modificado la duración de estos periodos, haciendo que estas temporadas sean menos predecibles. Tales reducciones representan menos ingresos mensuales para los pescadores y más competencia y esfuerzo para reunir el dinero suficiente cada mes. Actualmente los pescadores bagreros en el Magdalena han tenido que diversificar su actividad productiva. La pesca, que antes era la principal fuente de recursos económicos, aporta hoy día entre el 37 y 51% del ingreso (Tabla 2). Es alarmante que solo el 13% de los pescadores, obtengan de esta actividad ingresos superiores (2014: $ 616.000/ mes) a un salario mínimo mensual (Fundación Bosques y Humedales et al. 2014). Para los pescadores del Bajo Magdalena – Sector Mompox, el ingre- so promedio mensual es de apenas $ 315.000 (Fundación Humedales 2010). Seguridad alimentaria.El pescado es una fuente importante de proteína animal, vitaminas y micronutrientes. Es un alimento muy valioso para las comunidades más pobres y se ha consolidado como la principal fuente de proteína animal para un billón de personas en el mundo (Tidwell y Allan 2001, García y Rosenberg 2010). Es un recurso clave para la seguridad alimentaria global, especialmente porque gran parte de la población en los países en desarrollo basan su dieta en el pescado, una fuente asequible de proteína animal que no solo es más barata sino que es preferida en las dietas locales y tradicionales (Grajales-Quintero 2008). En la cuenca del Magdalena- Cauca, la pesca garantiza la seguridad alimen- taria a unos dos millones de personas. Considerando que el 36% de la población nacional tiene una ingesta de proteína deficiente (Chamorro 2014), es un dato valioso el que en la cuenca no existan niveles de desnutrición entre los pescadores y sus familias, quienes consumen un promedio per cápita de 36.5 kg de pescado/persona/año o 97 g/día (Fundación Humedales 2010), superior a los 65 g para hombre y 55 g para mujeres recomendados (ICBF 1992). La Figura 20 muestra la proporción de venta y consumo en algunas poblaciones de la cuenca. La ventaja de tener la fuente del recurso disponible es notable; si el pescador tuviese que comprar este pescado, tendría que pagar precios muy altos y sería entonces en muchos casos, inaccesible (Fig. 21). La actual disminución de la producción pesquera es una amenaza a PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 473 3 23 23 Frecuencia (%) 97 97 77 63 San Miguel / Atarraya Habana Venta (%) Buenavista Consumo (%) Figura 20. Proporción venta/ consumo en distintas poblaciones del sector del río la Miel y Magdalena en la cuenca Magdalena Cauca (Fuente: Encuestas Fundación Humedales 2014). 6000 5.500 5.000 Valor ($/libra) 5000 4.750 4000 3.500 3000 2.500 2000 1000 0 Carne de res Carne de cerdo Pescado Pollo Huevos Figura 21. Precio por libra de distintas fuentes de proteína animal en el municipio de La Dorada, Caldas (Fuente: Encuestas Fundación Humedales 2014). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 474 la seguridad alimentaria de la población de la cuenca y del país. Se estima que en el sector de la Isla de Mompox el aporte de la pesca a la seguridad alimentaria pasó de 36,5 kg/persona/año a 24,6 kg/persona/año entre 2010 y 2014 (Fundación Humedales-AUNAP 2014) lo que representa una disminución del 32%. Esta cifra indica el impacto directo de la reducción de la producción pesquera sobre el bienestar del pescador y sus familias. Eventos climáticos extremos. La capacidad de alimentar a una población creciente dependerá de la eficiencia y sostenibilidad de los métodos de producción de alimentos. El cambio climático, según los pronósticos más recientes, afectará negativamente a todo tipo de cosechas. No obstante, los efectos sobre la producción pesquera apenas han sido tenidos en cuenta en comparación con los demás sectores productivos primarios (FAO 2013). El crecimiento poblacional, la pobreza y el ordenamiento territorial improvisado, ha llevado a la población a asentarse en zonas propensas a inundaciones o sequías. La deforestación y la explotación de la tierra, particularmente en áreas lluviosas, han acelerado la erosión, la evapotranspiración y la sedimentación fluvial, condiciones que favorecen las inundaciones y los deslizamientos de tierra (CEPAL 2012). También las comunidades pesqueras son vulnerables al cambio climático, y sus efectos se miden de acuerdo a su capacidad de adaptación y al tipo de cambios que ocurran en los ecosistemas locales (Grajales-Quintero 2008). En Colombia han ocurrido anomalías climáticas extremas, por lo que debemos afinar nuestra comprensión del comportamiento hidrológico para emplearlo en modelos y previsiones que reduzcan el riego durante las inundaciones y sequías (Restrepo y Kjerfve 2000). VULNERABILIDAD DEL SECTOR PESQUERO El sector pesquero comprende al medio ambiente, al gremio de pescadores, trabajadores, negociantes y empresas relacionadas con la pesca, la provisión de equipos e insumos y la comercialización. Incluye también la institucionalidad y todo el marco normativo que lo rige. Gran parte de este sector en la cuenca del Magdalena-Cauca se encuentra en la informalidad y su valor comercial no ha sido cuantificado. Debido a esto, el gremio pesquero es vulnerable y desestimado en la toma de decisiones oficiales. Adicionalmente, carece de organización y de capacitación adecuada para llevar a cabo sus labores. La representación de este sector incluye diversos componentes, los fundamentales son el ecosistema, la economía, la sociedad, la tecnología y el gobierno. El ecosistema incluye los recursos pesqueros que sustentan la actividad y los aspectos relativos al control de la productividad del recurso, incluyendo las especies dependientes y asociadas. La economía es el sistema de costos y beneficios, así como los flujos monetarios hacia y desde el sector pesquero; la contribución general de la pesca al desarrollo sostenible, se reflejará en un flujo económico neto desde el sector pesquero. El componente sociedad consiste en aquellos costos y beneficios no monetarios que son importantes para el bienestar humano. El gobierno incluye las instituciones y las normas que rigen el sistema (FAO 2000). Frente a la alteración climática, la vulnerabilidad del sector se agudiza principalmente debido a su escasa resiliencia y a la precaria atención que recibe por parte de los gobiernos (Flores 2013). El aprovechamiento de los recursos pesqueros genera conflictos entre otros sectores de la población, por lo cual es necesario avaluar, hacer seguimiento, administrar y vigilar su aprovechamiento. Sin la participación y el compromiso de los involucrados en el manejo de los recursos será poco probable alcanzar dicho objetivo. La carencia de instrumentos eficientes de administración y el incumplimiento de las normas, son factores que inciden negativamente en esta situación (SEMARNAT 2000). Los nueve factores principales que inciden en la vulnerabilidad del sector pesquero en la cuenca son: 1. Crisis ambiental. 2. Bajo nivel de asociatividad de los pescadores. 3. Desprotección social y económica de las comunidades (políticas de estado ajenas a la realidad social particular). 4. Invisibilidad de los pescadores ante los administradores y tomadores de decisiones. 5. Gran informalidad en la intermediación comercial y mercadeo. 6. Debilidad institucional (cambio de autoridades, baja inversión y escasa presencia local) 7. Desactualizacion de la política pesquera. 8. Bajos niveles de gobernanza y participación local en la toma de decisiones. 9. Complejidad en sus relaciones con otros ámbitos (ambientales, productivos, sociales) que obli- PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 475 ga grandes costos de intermediación y transacción. Para eliminar el 50% del metilmercurio presente en el cuerpo de una persona, son necesarios alrededor de 54 días, lo cual significa que los bebés cuyas madres han sido expuestas durante el embarazo seguirán recibiendo este compuesto en la leche materna (Olivero et al. 2002). La exposición al metilmercurio en humanos proviene casi exclusivamente del consumo de peces y sus productos derivados. En los peces, la concentración de mercurio depende de varios factores como la edad, el nivel que ocupa en la cadena trófica y las condiciones fisicoquímicas del cuerpo de agua que habita (Álvarez et al. 2012). Adicionalmente, se considera que el límite máximo de ingestión de mercurio en humanos debe ser de 0,1 µg por kg ENVENENAMIENTO POR METILMERCURIO El metilmercurio tiene una estructura CH3HgX, donde X puede ser un ion de cloro, bromo, acetato, entre otros. Esta característica le permite atravesar las membranas celulares y alojarse en las células (Marrugo-Negrete et al. 2008). El metilmercurio puede acumularse en los glóbulos rojos y afectar el desarrollo del feto en madres gestantes. Estos compuestos producen efectos neurotóxicos prenatales, provocando retardo y parálisis cerebral. de peso corporal para evitar sus efectos adversos. El consumo de altas cantidades de pescado contaminado supone un riesgo permanente para las comunidades ribereñas, ya que la mayor parte de su consumo de proteína proviene de la pesca. De tal modo que estas comunidades, especialmente las más pobres, ponen en grave riesgo su salud al alimentarse de peces contaminados con mercurio. Entre los riesgos conocidos de la intoxicación con pescado contaminado están: • La ataxia o inhabilidad para controlar los movimientos musculares. • L o s t e m b l o r e s a n o r m a l e s repetitivos. • La parestesia o percepción de sensaciones anormales en la Concentración de mercurio en el pelo de los habitantes de los municipios de Bolívar 6 4 3 2 1 Embalse de Urrá La raya Montecristo Mina Santa Cruz Simití Morales Achí Pinillos Altos de Rosario San Martín de Loba Hastillo de Loba Magangué 0 Soplaviento Concentración de Hg en ug/g 5 Municipios Figura 22. Concentración de mercurio en el pelo de habitantes de diversos municipios de Bolívar, comparados con habitantes del embalse de Urrá (Fuente: Olivero-Verbel et al. 2011). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 476 • • • piel, tales como adormecimiento, punzaciones y quemaduras. La disminución de la capacidad visual y auditiva. La parálisis cerebral. La teratogenia durante la gestación. Las personas con concentraciones de mercurio en sangre mayores a los 0,04 µg/ml o de 25µg/l en la orina están en alto riesgo. La USEPA a su vez considera valores por encima de 1µg/g en el pelo como poco recomendables para la salud (Olivero-Verbel et al. 2011). Adicionalmente se ha encontrado que la exposición a altas concentracio- nes de mercurio atmosférico produce alteraciones en las funciones cognitivas de niños en edad escolar. En el municipio de Segovia en Antioquia se realizó un estudio evaluando las habilidades cognitivas de los estudiantes, en el que se encontraron alteraciones neuropsicológicas relacionadas a la exposición a los vapores de mercurio (Vargas y Quiroz 2012). En la cuenca del Magdalena-Cauca se han encontrado concentraciones elevadas de mercurio en los sedimentos, de modo que este metal seguramente se ha movilizado ya a través de las cadenas tróficas acuáticas. En los últimos 10 años se ha registrado un incremento en la concentración de mercurio en especies de peces de interés pesquero (Fig 19). Se considera que peces con concentraciones superiores a los 0,2 µg por gramo de peso fresco no son aptos para el consumo humano y pueden generar graves problemas de salud. Especies como el bagre rayado, la mojarra amarilla, la doncella, la arenca, el capaz, el nicuro y el moncholo presentan concentraciones de mercurio superiores a las recomendadas por la Organización Mundial de la Salud y su consumo en estas condiciones debe ser reducido. En algunos municipios ya se han registra- Intoxicación por metales pesados 200 Reportes 150 100 50 0 2007 Atlántico 2008 Bogotá 2009 Bolívar 2010 Caldas Cundinamarca 2011 2012 Tolima 2013 Valle Antioquia Figura 23. Reportes históricos de intoxicación por metales pesados en los departamentos de la cuenca (Fuente: Ministerio de Salud). PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 477 do concentraciones de mercurio en pelo humano superiores a 1 ug/g. En el departamento de Bolívar, los municipios de La Raya, Achí, Montecristo, Mina Santa Cruz, Simití, Pinillos, Altos del Rosario, Hatillo de Loba y Magangué presentan niveles altos de contaminación por mercurio en sus pobladores (Fig 22).Estas altas concentraciones pueden ser atribuidas al consumo de pescado contaminado por las actividades mineras de aguas arriba (Olivero-Verbel et al. 2011). En la ciénaga de Ayapel también se encontró una concentración media de 2,18±1,77 µg/g de mercurio en el pelo de sus pobladores (Gracia et al. 2010). En Caimito, Sucre, en la cuenca del río San Jorge, el promedio de contenido de mercurio en pelo es de 4,91±0,55µg/g para hombres y mujeres entre los 15 y 65 años, valor también muy por encima de lo recomendado por la USEPA (Olivero et al. 2002). Por otra parte, se ha registrado un aumento dramático en los reportes de intoxicación por metales pesados en los departamentos de la cuenca, especialmente en Antioquia, donde los casos pasaron de menos de cincuenta en 2007 a más de doscientos en el 2009 (Fig. 23). Esta tendencia se relaciona con el auge de la minería de oro en este de- partamento a partir del 2008, tras la política de promoción del país minero y el incremento del precio del oro. Afortunadamente, el número de casos ha disminuido en Antioquia gracias a la implementación de técnicas que evitan la liberación de gases a la atmósfera. Para concluir, la presencia de niveles tan altos de mercurio en el pelo y la prevalencia de casos de intoxicación con metales pesados sustentan el hecho de que existe una exposición al mercurio peligrosa con repercusiones graves en la salud pública de la región. Esta tendencia es especialmente visible en municipios mineros o aguas abajo de las zonas de producción de oro. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 478 PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 479 Bibliografía Aguirre-Pabón, J., Narváez Barandica, J., Castro García, L., 2013. Mitochondrial DNA variation of the bocachico Prochilodus magdalenae (Characiformes, Prochilodontidae) in the Magdalena River Basin, Colombia. Aquatic Conserv: Mar. Freshw. Ecosyst. 23, 594–605. doi:10.1002/aqc.2339 Álvarez, S., A. M. Jessick, J. A. Palacio, A. S. Kolok. 2012. Methylmercury concentrations in six fish species from two colombian rivers. Bulletin Environmental Contamination and Toxicology 88: 65–68. doi:10.1007/s00128-011-0458-x. Anderson, E. P., A. C. Encalada, J. A. Maldonado-Ocampo, M. E. Mc Clain, H. Ortega y B. B. Wilcox. 2012. Caudales ambientales: un concepto para el manejo de los efectos de las alteraciones fluviales y el cambio climático en los Andes: Pp. 387-400 En: Herzog, S. K., R. Martínez, P. M. Jørgensen, H. Tiessen (Eds.). Cambio Climático y Biodiversidad en los Andes Tropicales Instituto Interamericano para la Investigación del Cambio Global (IAI). Sao José dos Campos y Comité Científico sobre Problemas del Medio Ambiente (SCOPE) Paris. Banco de Occidente 2003. El río Grande de la Magdalena http://imeditores.com/banocc/rio/presentacion.htm Cala, P. 2001. Occurrence of Mercury in some commercial fish species from the Magdalena and Meta Rivers in Colombia. Dahlia. Revista Asociación Colombiana Ictiología 4: 15–19. Caraballo, P. 2009. Efecto de la tilapia Oreochromis niloticus sobre la producción pesquera del embalse el guájaro Atlántico-Colombia. Revista MVZ Córdoba 14: 1796-1802 Carpenter, S. R., E. H. Stanley y M. J. van der Zanden. 2011. State of the world’s freshwater ecosystems: physical, chemical, and biological changes. Annual Review of Environment and Resources 36: 75– 99. doi:10.1146/annurev-environ-021810-094524. Casatti, L., F., A.M. Langeani, A. M. Silva y R.M. Castro. 2006. Stream fish, water and habitat quality in a pasture dominated basin, southeastern Brazil. Brazilian Journal of Biology 66: 681–696. doi:10.1590/S1519-69842006000400012 CEPAL. 2012. Valoración de daños y pérdidas: Ola invernal en Colombia 2010 - 2011. Bogotá, Misión BID – CEPAL, 240 p. En línea http://www. cepal.org/publicaciones/xml/0/47330/OlainvernalColombia2010-2011.pdf (consultado julio 2014). Cerdenares-Ladrón de Guevara, G. E. Ramírez-Antonio, S. Ramos-Carrillo, G. González-Medina, V. Anislado-Tolentino, D. López-Herrera y S. Karam-Martínez. 2014. Impacto de la actividad pesquera sobre la diversidad biológica Revisión para el Pacífico sur de México. Revista Iberoamericana de Ciencias 1:95-114 ReIbCi – www.reibci.org Chamorro, A. M. 2014. Desarrollo y crisis alimentaria: el caso de la seguridad alimentaria en Colombia. (Development and food crises: the case of food security in Colombia). Revista CES Derecho 5: 57–65. Chapman, W. D. 1977. Total harvest and economic value of the fishery in the río Magdalena and floodplain system. Final Report to FAO/Col/552. Cartagena, 66 p. Cochrane, K.; De Young, C.; Soto, D. y Bahri, T. (eds). Consecuencias del cambio climático para la pesca y la acuicultura: visión de conjunto del estado actual de los conocimientos científicos. FAO Documento Técnico de Pesca y Acuicultura. No 530. Roma. FAO. 2012. 237 p PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 480 Congreso de Colombia, 2013. Ley 1658 del 15 de julio de 2013 “Por medio de la cual se establecen disposiciones para la comercialización y el uso de mercurio en las diferentes actividades industriales del país, se fijan requisitos e incentivos para su reducción y eliminación y se dictan otras disposiciones”. República de Colombia. Cormagdalena 2014. Niveles del Río Magdalena. http://niveles.cormagdalena.gov.co/ finición de escenarios de ordenación pesquera y sostenibilidad. Informe Final. Bogotá, 57 p. anexos 10. Fundación Humedales. 2010. Diseño del programa regional pesquero y piscícola en la depresión Momposina de los municipios de Cicuco, Talaigua Nuevo y Mompox, departamento de Bolívar. Informe Final para Fundescat-Ecopetrol. Bogotá. 345 p. Dahl, G., F. Medem y A. Ramos Henao. 1963. El Bocachico: Contribución al estudio de su biología y de su ambiente. Corporación Autónoma Regional de los Valles del Magdalena y del Sinú (CVM). Bogotá. 144 p. Fundación Humedales - AUNAP. 2014. Seguimiento al proceso de ordenación pesquera en el sector noroccidental de la depresión Momposina y evaluación del estado de la dorada, Brycon moorei. Convenio AUNAP-Fundación Humedales 0040- 2013. Informe Final. Montería. 79 p. FAO. 2000. Indicadores para el desarrollo sostenible de la pesca de captura marina. Dirección de Recursos Pesqueros. FAO Orientaciones Técnicas para la Pesca Responsable. Nº. 8. Roma, FAO. 2000. 68 p. Fukushima, M., S. Kameyama, M. Kaneko, K. Nakao y E. Ashley Steel. 2007. Modelling the effects of dams on freshwater fish distributions in Hokkaido, Japan. Freshwater Biology 52: 1511–1524. doi:10.1111/j.1365-2427.2007.01783.x. FAO/PNUMA. 1984 Conservación de los recursos genéticos de los peces: problemas y recomendaciones. Informe de la Consulta de Expertos sobre los recursos genéticos de los peces. FAO Documento Técnico Pesca 217: 42. García, S. M. y A. A. Rosenberg. 2010. Food security and marine capture fisheries: characteristics, trends, drivers and future perspectives. Phil. Trans. R. Soc. B 365, 2869–2880. doi:10.1098/rstb.2010.0171. Ferguson, J. W., M. Healey, P. Dugan y C. Barlow. 2011. Potential Effects of Dams on Migratory Fish in the Mekong River: Lessons from Salmon in the Fraser and Columbia Rivers. Environmental Management 47, 141–159. doi:10.1007/s00267-010-9563-6. Godfray, H. C. J., J.R. Beddington, I. R. Crute, L. Haddad, D. Lawrence, J. F. Muir, J. Pretty, S. Robinson, S. M. y C. Thomas, C. Toulmin. 2010. Food Security: The Challenge of Feeding 9 Billion People. Science 327: 812–818. doi:10.1126/science.1185383. Fjeld, E., Haugen, T.O., Vøllestad, L.A., 1998. Permanent impairment in the feeding behavior of grayling (Thymallus thymallus) exposed to methylmercury during embryogenesis. Science of The Total Environment 213: 247–254. doi:10.1016/S0048-9697(98)00097-7. González, J. J., A. Etter, A. H. Sarmiento, S. A Orrego, C. Ramírez, E. Cabrera, D. Vargas, G. Galindo, M. C. García, M.F. Ordoñez. 2011. Análisis de tendencias y patrones espaciales de deforestación en Colombia. Instituto de Hidrología, Meteorología y Estudios Ambientales-IDEAM. Flores, R., Espino, M., Luque, G., & Quispe, J. (2013). Patrones de variabilidad ambiental en el mar peruano. Revista Peruana de Biología, 20(1), 21-28. Gracia, L., Marrugo, J. L., & Alvis, E. M. ., 2010. Contaminación por mercurio en humanos y peces en el Municipio de Ayapel, Córdoba, Colombia, 2009. Revista Facultad Nacional Salud Pública 28: 118–124. Fundación Bosques y Humedales, AUNAP, Universidad Sur Colombiana y ECOPETROL 2014. Estado de conservación de la población del bagre rayado (Pseudoplatystoma magdaleniatum) en la cuenca Magdalénica, valoración de implicaciones ambientales y socioeconómicas y de- Grajales-Quintero, A. (2008). Pesca y acuicultura: efectos y consecuencias de los impactos ambientales globales y situación actual y perspectivas de los ecosistemas piscícolas. Los nuevos conceptos sobre “agua virtual” y “huella hídrica” PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 481 aplicados al desarrollo sostenible: implicaciones de la agricultura en el consumo hídrico, Agronomía 16(1): 53 – 62. Harris, R. C., J. W. Rudd, M. Amyot, C. L. Babiarz, K. G. Beaty, P. J. Blanchfield, R. A. Bodaly, B. A. Branfireun, C. C. Gilmour, J. A. Graydon, A. Heyes, H. Hintelmann, J. P. Hurley, C. A. Kelly, D. P. Krabbenhoft, S. E. Lindberg, R. P. Mason, M. J., Paterson, C. L. Podemski, A. Robinson, K.A. Sandilands, G.R. Southworth, V.L. Louis y M.T. Tate. 2007. Whole-ecosystem study shows rapid fish-mercury response to changes in mercury deposition. PNAS 104: 16586–16591. doi:10.1073/pnas.0704186104. Henley, W. F., M. A. Patterson, R. J. Neves y A. D. Lemly. 2000. Effects of Sedimentation and Turbidity on Lotic Food Webs: A Concise Review for Natural Resource Managers. Reviews in Fisheries Science 8: 125–139. doi:10.1080/10641260091129198. Herzog, S. K., R. Martínez, P. M. Jørgensen y H. Tiessen. 2012. Cambio Climático y Biodiversidad en los Andes Tropicales Instituto Interamericano para la Investigación del Cambio Global (IAI), Sao José dos Campos y Comité Científico sobre Problemas del Medio Ambiente (SCOPE). Paris. 426 p. Hilborn, R., & Walters, C. J. (Eds.). (1992). Quantitative Fisheries Stock Assessment: Choice, Dynamics and Uncertainty/Book and Disk. Chapman & Hall. 570 pp. ICBF (Instituto Colombiano de Bienestar Familiar) 1992. Recomendaciones de consumo diario de calorías y nutrientes para la población Colombiana. Bogota. 50pp. Kettner, A., J. D. Restrepo y J. P. M. Syvitski. 2010. A spatial simulation experiment to replicate fluvial sediment fluxes within the Magdalena River Basin, Colombia. The Journal of Geology 118 (4): 363-379. Lancheros-Ascencio, L. J. 2014. Contenido de mercurio en músculo de algunas especies ícticas de interés comercial presentes en ocho sitios de muestreo de la cuenca (baja, medio y alta) del rio Magdalena. Universidad Militar Nueva Granada, Bogotá, Colombia. 14 pp. Lasso, C. A., F. de Paula Gutiérrez, M. A. Morales-Betancourt, E. Agudelo, H. Ramírez -Gil y R. E. Ajiaco-Martínez (Eds.). 2011. II. Pesquerías continentales de Colombia: cuencas del Magdalena-Cauca, Sinú, Canalete, Atrato, Orinoco, Amazonas y vertiente del Pacífico. Serie Editorial Recursos Hidrobiológicos y Pesqueros Continentales de Colombia. Instituto de Investigación de los Recursos Biológicos Alexander von Humboldt. Bogotá, D. C., Colombia, 304 p. Leal-Florez, J., 2008. Impacts of non-native fishes on the fish community and the fishery of the cienaga grande de Santa Marta estuary, northern Colombia. Universität Bremen. 133pp IDEAM. 2013. Reporte de alertas tempranas de deforestación para Colombia. Segundo semestre de 2013. Sistema de Monitoreo de Bosques y Carbono para Colombia. Instituto de Hidrología, Meteorología y Estudios Ambientales-IDEAM. 6p. Maldonado, M., J. A. Maldonado-Ocampo, H. Ortega, A. C. Encalada, F.M. Carvajal-Vallejo, J. F. Rivadeneira, F. Acosta, D. Jacobsen, A. Crespo y C. A. Rivera-Rondon. 2012. Diversidad en los ecosistemas acuáticos. Pp. 325-348 En: Herzog, S. K., R. Martínez, P. M. Jørgensen y H. Tiessen. (Eds.). Cambio Climático y Biodiversidad en los Andes Tropicales Instituto Interamericano para la Investigación del Cambio Global (IAI). Sao José dos Campos y Comité Científico sobre Problemas del Medio Ambiente (SCOPE). Paris. IDEAM, IAvH, Invemar, SINCHI e IIAP. 2013. Tomo 3: Contaminación del aire y agua en Colombia e Impactos sobre la salud. Informe del estado del Medio Ambiente y los Recursos Naturales Renovables 2011.Bogotá, D.C. 164 p. Mancera-Rodríguez, N. J. y R. Álvarez-León. 2006. Estado del conocimiento de las concentraciones de emrcurio y otros metales pesados en peces dulceacuícolas de Colombia. Acta Biológica Colombiana 11: 3–23. IGAC 2003. Zonificación de los niveles de Erosión del suelo a nivel municipal. Sistema de Información Geográfica para la Planeación y el Ordenamiento Territorial. Bogotá Marrugo, J., E. Lans e I. Benítez. 2007. Hallazgo de mercurio en peces de la ciénaga de ayapel, córdoba, Colombia. Revista MVZ Córdoba 12 (1): 878-886. Hinton, J., M. Veiga y T. Veiga. 2003. Clean artisanal gold mining: a utopian approach?. Journal of Cleaner Production 11: 99–115. PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 482 Marrugo-Negrete, J., J. O. Verbel, E. L. Ceballos y L. N. Benitez. 2008. Total mercury and methylmercury concentrations in fish from the Mojana region of Colombia. Environmental Geochemistry and Health 30: 21–30. doi:10.1007/s10653-007-9104-2 Marrugo-Negrete, J.L., J. A. Ruiz-Guzmán y S. Díez. 2013. Relationship Between Mercury Levels in Hair and Fish Consumption in a Population Living Near a Hydroelectric Tropical Dam. Biological Trace Elements Reseach 151: 187–194. doi:10.1007/s12011-012-9561-z Matta, M.B., J. Linse, C. Cairncross, L. Francendese y R.M. Kocan. 2001. Reproductive and transgenerational effects of methylmercury or Aroclor 1268 on Fundulus heteroclitus. Environmental Toxicology and Chemistry 20: 327–335. doi:10.1002/etc.5620200213 Montecinos, A. 2012 Cambio climático en la región del Biobío: recurso agua. En: Rojas H. J. (Ed.) Cambio climático global: vulnerabilidad, adaptación y sustentabilidad: experiencias internacionales comparadas. Editorial Universidad de Concepción. Chile. 433pp. Mojica, J. I. 1999. Lista preliminar de las especies de peces dulciacuícolas de Colombia. Revista Academia Colombiana Ciencias 23: 547-566. Suplemento especial. Murawski, S. A. 2000. Definitions of overfishing from an ecosystem perspective. ICES Journal Marine Science 57: 649–658. doi:10.1006/jmsc.2000.0738 Olivero, J., B. Johnson y E. Arguello, E., 2002. Human exposure to mercury in San Jorge river basin, Colombia (South America). Science of The Total Environment 289: 41–47. doi:10.1016/S0048-9697(01)01018-X. Olivero-Verbel, J., K. Caballero-Gallardo, J. Negrete-Marrugo. 2011. Relationship Between Localization of Gold Mining Areas and Hair Mercury Levels in People from Bolivar, North of Colombia. Biological Trace Elements Research 144: 118–132. doi:10.1007/s12011-011-9046-5. Pachón, M. 2000. ¿Degradación inevitable? Un análisis de la cuenca del Magdalena desde los dilemas de acción colectiva. Revista de estudios sociales N°6. Univ. De Los Andes. Colombia. http:// www.redalyc.org/articulo.oa?id=81500609 PNUMA. 2008. El uso del mercurio en la minería del oro artesanal y en pequeña escala. Programa de las Naciones Unidas para el Medio Ambiente. 12 p. Poff, N. L. y J. K. Zimmerman. 2010. Ecological responses to altered flow regimes: a literature review to inform the science and management of environmental flows. Freshwater Biology, 55(1): 194-205. Rabeni, C. F. y M. A. Smale. 1995, Effects on siltation on stream fishes and the potential mitigating role of the buffering riparian zone. Hydrobiology 303: 211-219. Ramírez-Callejas, C., S. Santacruz, R. A. Bocanegra y M. C. Sandoval, 2010. Incidencia deL Embalse de Salvajina sobre el régimen de caudales del Río Cauca en su valle alto. Facultad de Ingeniería - Escuela de Ingeniería de los Recursos Naturales y del Ambiente Rev. EIDENAR: Ejemplar 9: http:// revistaeidenar.univalle.edu.co/revista/ejemplares/9/l.htm Renzoni, A., F. Zino y E. Franchi. 1998. Mercury Levels along the Food Chain and Risk for Exposed Populations. Environmental Research 77: 68–72. doi:10.1006/enrs.1998.3832 Restrepo J.D. y B. Kjerfve. 2000. Magdalena river: interannual variability (1975–1995) and revised water discharge and sediment load estimates. Journal of Hydrology 235: 137–149. Restrepo, J. D., B. Kjerfve, M. Hermelin, J. C. Restrepo. 2006. Factors controlling sediment yield in a major South American drainage basin: the Magdalena River, Colombia. Journal of Hydrology 316: 213–232. doi:10.1016/j.jhydrol.2005.05.002 Restrepo, J. C. y J. D. Restrepo. 2005. Efectos naturales y antrópicos en la producción de sedimentos de la Cuenca del río Magdalena. Revista Academia Colombiana Ciencias 29(11): 239-254. Salazar, L.F. y E. Hincapié. 2006. Causas de los movimientos masales y erosión avanzada en la zona ca- PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 483 fetera colombiana. Avances Técnicos 348 Cenicafé. Federación Nacional de Cafeteros de Colombia. Sánchez, R 2012. Modelo de estrategias reproductivas en peces que forman agrupaciones de desove. Tesis Doctoral. Instituto Politécnico Nacional. Centro Interdisciplinario de Ciencias Marinas. La Paz. BCS. 348 p. Sandheinrich, M. B. y K. M. Miller. 2006. Effects of dietary methylmercury on reproductive behavior of fathead minnows (Pimephales promelas). Environmental Toxicology and Chemistry 25: 3053–3057. doi:10.1897/05-641R.1 Santucci, V. J., S.R. Gephard y S.M. Pescitelli. 2005. Effects of Multiple Low-Head Dams on Fish, Macroinvertebrates, Habitat, and Water Quality in the Fox River, Illinois. North American Journal of Fisheries Management 25: 975–992. doi:10.1577/M03-216.1 SEMARNAT. 2000 Indicadores para la evaluación del desempeño ambiental. Instituto Nacional de Ecología. Dirección General de Gestión e Información Ambiental. 184 p Soto, D. y R. Quiñones, 2013. Cambio climático, pesca y acuicultura en américa latina: Potenciales impactos y desafíos para la adaptación.Taller FAO/Centro de Investigación Oceanográfica en el Pacífico Sur Oriental (COPAS), Universidad de Concepción, Concepción, Chile. FAO Actas de Pesca y Acuicultura. No. 29. Roma, FAO. 335 p. Tidwell, J. H. y G.L. Allan. 2001. Fish as food: aquaculture’s contribution. EMBO reports 2: 958– 963. doi:10.1093/embo-reports/kve236. Vargas, M. y C. Quiroz. 2012. Alteraciones neuropsicológicas en escolares de un municipio con niveles elevados de vapor de mercurio medioambiental, Colombia, 2008-2009. Revista Facultad. Nacional Salud Pública 29: 461–468. Velasco-Rivera A. y M. Díaz-Granados 2006 Tendencias e incidencia de los fenómenos macroclimáticos en la hidrología del alto y medio Magdalena (Tendencies and incidence of macroclimatic phenomena in the hydrology of the high and middle magdalena basins). Universidad Militar Nueva Granada. Ciencia e Ingeniería Neogranadina, ISSN-e 0124-8170, Vol. 16 (2): 29-44. Wang, L., D. Infante, J. Lyons, J. Stewart y A. Cooper 2011. Effects of dams in river networks on fish assemblages in non-impoundment sections of rivers in Michigan and Wisconsin, USA. River Res. Applic. 27: 473–487. doi:10.1002/rra.1356 Welcomme, R.L.,1980 Cuencas fluviales. FAO, Doc, Téc.Pesca, (202):62 p. Zárate, M., S. Arboleda, M. Barrios, P. Arias y G. Vera. 1983. Situación actual de las pesquerías de la cuenca Magdalena con base en datos de captura y esfuerzo entre 1977-1982 INDERENA. Centro de Biología Pesquera y Limnología. San Cristóbal. 38 p. Ziv, G., Baran, E., Nam, S., Rodríguez-Iturbe y I., Levin, S.A., 2012. Trading-off fish biodiversity, food security, and hydropower in the Mekong River Basin. PNAS 109: 5609–5614. doi:10.1073/pnas.1201423109 PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 484 PRESIONES E IMPACTOS DE LOS MOTORES DE TRANSFORMACIÓN SOBRE EL RECURSO PESQUERO 485