Tabla Periódica de los Elementos
Anuncio
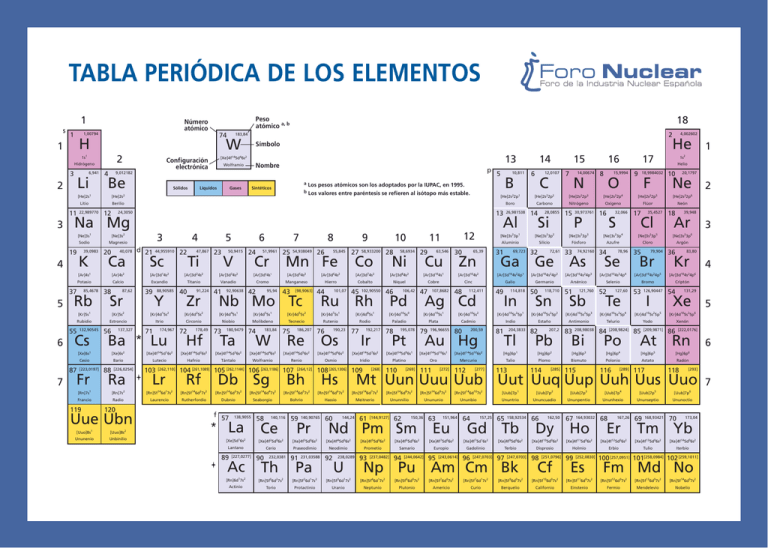
TABLA PERIÓDICA DE LOS ELEMENTOS 1 s 1 74 H 1 2 Hidrógeno 3 6,941 Li 2 4 Sólidos Líquidos Gases a Los pesos atómicos son los adoptados por la IUPAC, en 1995. b Los valores entre paréntesis se refieren al isótopo más estable. Sintéticos 4 12 K 20 Boro 40,078 Ca [Ar]4s2 Potasio 85,4678 Rb Sr [Kr]5s2 Rubidio 132,90545 Cs 137,327 [Xe]6s2 Cesio Bario Fr 88 Francio 119 22 39 88,90585 Y Itrio 71 174,967 Lu [Xe]4f145d16s2 103 [262,110] Lr 47,867 Ti [Ar]3d24s2 Titanio 40 91,224 Zr [Kr]4d25s2 5 23 178,49 Hf 50,9415 V 24 51,9961 92,90638 25 54,938049 43 [98,9063] [Kr]4d55s1 Niobio 73 180,9479 Ta 183,84 W 186,207 Re [Xe]4f145d26s2 [Xe]4f145d36s2 [Xe]4f145d46s2 [Xe]4f145d56s2 Hafnio Tántalo Wolframio Renio 104 [261,1089] 105 [262,1144] 106 [263,1186] 107 Rf Db Sg [264,12] Bh 28 102,90550 Rh [Kr]4d75s1 [Kr]4d85s1 Rutenio Os 77 Pd 47 [Xe]4f145d76s2 Osmio Iridio 79 Galio 112,411 114,818 In Cadmio 196,96655 [Xe]4f145d106s1 80 81 204,3833 Tl [Hg]6p1 Mercurio [272] 112 Carbono 14 28,0855 Si [Ne]3s23p2 Silicio 32 14,00674 N [He]2s22p3 Nitrógeno 15 30,973761 P [Ne]3s23p3 Fósforo 72,61 [Ar]3d104s24p2 Germanio 50 Talio [277] 113 118,710 Sn [Kr]4d105s25p2 Indio 200,59 [Xe]4f145d106s2 Oro 111 49 [Kr]4d105s25p1 Au Hg [269] 69,723 [Ar]3d104s24p1 [Kr]4d105s2 Plata [Xe]4f145d96s1 110 48 [He]2s22p2 15 7 33 74,92160 Ga Ge As [Ar]3d104s2 [Kr]4d105s1 195,078 31 Cinc 107,8682 C Aluminio 65,39 Ag Cd [Kr]4d105s0 Platino [268] [Ne]3s23p1 Zn Cobre Pt Ir [Xe]4f145d66s2 30 [Ar]3d104s1 106,42 78 63,546 Cu Paladio 192,217 108 [265,1306] 109 29 Níquel 46 Rodio 190,23 58,6934 [Ar]3d84s2 Cobalto 45 12 11 Ni [Ar]3d74s2 101,07 76 58,933200 Co Ru Tecnecio 75 27 Hierro [Kr]4d55s2 Molibdeno 74 55,845 44 10 9 [Ar]3d64s2 Manganeso 95,94 Nb Mo Tc [Kr]4d45s1 26 [Ar]3d54s2 Cromo 42 8 Mn Fe [Ar]3d54s1 Vanadio 41 7 Cr [Ar]3d34s2 Circonio 72 6 12,0107 Estaño 82 207,2 Pb [Hg]6p2 Plomo 114 [Ar]3d104s24p3 Arsénico 51 121,760 Sb [Kr]4d105s25p3 15,9994 O [He]2s22p4 208,98038 Bi [Hg]6p3 115 17 9 18,9984032 F [He]2s22p5 Oxígeno 16 32,066 S 35,4527 [Ne]3s23p5 Azufre 34 Se [Ar]3d104s24p4 35 127,60 Te [Kr]4d105s25p4 79,904 Br [Ar]3d104s24p5 Selenio 52 [208,9824] Po [Hg]6p4 Polonio 116 [289] 20,1797 Ne 126,90447 I [Kr]4d105s25p5 Neón 18 [209,9871] 39,948 Ar Argón 36 83,80 Kr Criptón 54 131,29 Xe Xenón 86 [222,0176] Radón 118 [293] [Rn]5f146d27s2 [Rn]5f146d37s2 [Rn]5f146d47s2 [Rn]5f146d57s2 [Rn]5f146d67s2 [Rn]5f146d77s2 [Rn]5f146d87s2 [Rn]5f146d97s2 [Rn]5f146d107s2 [Uub]7p1 [Uub]7p2 [Uub]7p3 [Uub]7p4 [Uub]7p5 [Uub]7p6 Radio Laurencio Rutherfordio Dubnio Seaborgio Bohrio Hassio Meitnerio Ununnilio Unununio Ununbio Ununtrio Ununcuadio Ununpentio Ununhexio Ununseptio Ununoctio 59 60 [Uuo]8s 2 Unbinilio f 57 138,9055 La 58 140,116 Ce 140,90765 Pr 144,24 61 [144,9127] 62 150,36 Nd Pm Sm 63 151,964 Eu 64 157,25 65 158,92534 Gd Tb 66 162,50 Dy 67 164,93032 Ho 68 167,26 Er 69 168,93421 70 173,04 Tm Yb [Xe]5d16s2 [Xe]4f25d06s2 [Xe]4f35d06s2 [Xe]4f45d06s2 [Xe]4f55d06s2 [Xe]4f65d06s2 [Xe]4f75d06s2 [Xe]4f75d16s2 [Xe]4f95d06s2 [Xe]4f105d06s2 [Xe]4f115d06s2 [Xe]4f125d06s2 [Xe]4f135d06s2 [Xe]4f145d06s2 Lantano Cerio Praseodimio Neodimio Prometio Samario Europio Gadolinio Terbio Disprosio Holmio Erbio Tulio Iterbio 89 [227,0277] Ac 90 232,0381 Th 91 231,03588 Pa 92 238,0289 U 93 [237,0482] 94 [244,0642] 95 [243,0614] 96 [247,0703] 97 [247,0703] Np Pu Am Cm Bk 98 [251,0796] Cf 99 [252,0830] Es 6 [Hg]6p6 Mt Uun Uuu Uub Uut Uuq Uup Uuh Uus Uuo Hs 5 [Kr]4d105s25p6 Astato 117 4 [Ar]3d104s24p6 At Rn [Hg]6p5 3 [Ne]3s23p6 Yodo 85 2 [He]2s22p6 Bromo 53 Telurio 84 Helio 10 Cloro 78,96 1 1s2 Flúor 17 Cl [Ne]3s23p4 Antimonio 83 Bismuto [285] 16 8 He [Rn]5f146d17s2 Uue Ubn Ununenio 4 14 6 4,002602 [Rn]7s2 120 1 Sc Lutecio [226,0254] Ra [Rn]7s1 44,955910 [Kr]4d15s2 Ba [223,0197] d 21 Estroncio 56 [Xe]6s1 [Uuo]8s 3 Escandio 87,62 26,981538 Al [Ar]3d14s2 Calcio 38 [Kr]5s1 87 B 13 [Ne]3s2 [Ar]4s1 55 10,811 [He]2s22p1 24,3050 Magnesio 39,0983 37 5 Berilio 22,989770 Sodio 7 p Na Mg 19 6 Nombre Wolframio [He]2s2 [Ne]3s1 5 13 [Xe]4f145d46s2 Configuración electrónica Be Litio 3 Símbolo 9,012182 [He]2s1 11 2 183,84 W 1s1 18 Peso atómico a, b Número atómico 1,00794 100 [257,0951] 101[258,0984] 102 [259,1011] Fm Md No [Rn]6d17s2 [Rn]5f06d27s2 [Rn]5f26d17s2 [Rn]5f36d17s2 [Rn]5f46d17s2 [Rn]5f66d07s2 [Rn]5f76d07s2 [Rn]5f76d17s2 [Rn]5f96d07s2 [Rn]5f106d07s2 [Rn]5f116d07s2 [Rn]5f126d07s2 [Rn]5f136d07s2 [Rn]5f146d07s2 Actinio Torio Protactinio Uranio Neptunio Plutonio Americio Curio Berquelio Californio Einstenio Fermio Mendelevio Nobelio 7 ¿Qué es la Tabla Periódica? Es una ordenación sistemática de los elementos químicos, que ofrece una valiosa información sobre la estructura de los mismos. La Tabla Periódica expone una periodicidad (una cadena regular) de las propiedades de los elementos cuando están dispuestos según su número atómico. La Tabla Periódica consiste en disponer los elementos en periodos recurrentes, según sus números atómicos crecientes. Los elementos que caen en una columna vertical tienen propiedades comunes. Existen distintas formas para la Tabla Periódica. Sin embargo, todas coinciden en que los elementos están dispuestos en el orden creciente de sus números atómicos. La más común de las tablas, es la que presenta 18 columnas verticales llamadas grupos. Cada grupo contiene todos aquellos elementos que poseen propiedades semejantes, debido a la estructura electrónica común de su nivel más externo. Por ejemplo, la columna vertical 18 comprende al grupo de gases nobles. Además, la Tabla Periódica contiene siete filas horizontales, llamadas periodos. Los elementos de un periodo poseen el mismo número de niveles de electrones. LA TABLA PERIÓDICA ESTÁ SIEMPRE SUJETA A REVISIÓN, EN ESPERA DE NUEVOS ELEMENTOS. Mendelevio 101[258,0984] Md Mendelevio, de símbolo Md, es un elemento radiactivo creado artificial[Rn]5f136d07s2 Mendelevio mente, de número atómico 101. El mendelevio es uno de los elementos transuránicos del grupo de los actínidos del sistema periódico, nombrado por Dimitri Mendeleiev. El mendelevio 256 fue descubierto en 1995, en la Universidad de California, Berkeley; fue obtenido bombardeando el einstenio 253 con partículas alfa aceleradas en un ciclotrón. El isótopo producido tenía una vida media de unas 1,3 horas. El isótopo más estable, el mendelevio 258, tiene una vida media de 54 días. APUNTES DE HISTORIA • Gracias a los descubrimientos sobre la teoría atómica de la materia del primer cuarto del siglo XIX, los científicos pudieron determinar las masas atómicas relativas de los elementos conocidos. • En 1829, el químico alemán Johann W. Döbereiner reconoció la existencia de ciertos elementos que tenían propiedades muy similares. • En 1859, con el desarrollo del espectroscopio, fue posible descubrir nuevos elementos. Un año más tarde, en el primer congreso mundial de química, el italiano Stanislao Cannizzaro puso de manifiesto el hecho de que algunos elementos poseen moléculas que contienen dos átomos, por ejemplo el oxígeno. • En 1864, el químico británico John A.R. Newlands clasificó los elementos por orden de masas atómicas crecientes y observó que después de cada siete elementos, en el octavo, se repetían las propiedades del primero. • En 1869, D. I. Mendeleiev publica la primera versión de la Tabla Periódica. DIMITRI IVANOVICH MENDELEIEV (1834-1907) Químico ruso conocido por haber elaborado la Tabla Periódica de los elementos químicos. La clave de su éxito fue comprender que todavía quedaban cierto número de elementos por descubrir, y había que dejar los huecos para esos elementos en la Tabla. Nació en Tobolsk (Siberia), estudió química en la Universidad de San Petersburgo y, en 1859, se trasladó a Heidelberg, donde conoció a Stanislao Cannizzaro. Mendeleiev regresó a San Petersburgo para dedicarse a la docencia y escribir uno de los primeros libros de texto sobre química, que se convirtió en un clásico. Durante la elaboración del libro, Mendeleiev intentó clasificar los elementos según sus propiedades químicas. Así en 1869, publica la primera versión de la Tabla Periódica y dos años más tarde la primera revisión. Entre las investigaciones de Mendeleiev hay que destacar el estudio de la teoría química de la disolución, la expansión térmica de los líquidos y la naturaleza del petróleo.







