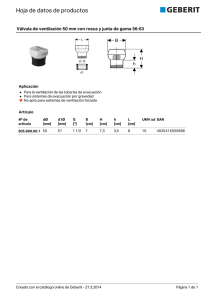
manejo integral final.indd
Anuncio

MANEJO INTEGRAL DEL PACIENTE CRÍTICO Manejo Integral del paciente crítico 1 2 Manejo Integral del paciente crítico Una colección de sortilegios en el antiguo Egipto fue recogida finalmente en el Libro de los muertos, mejor identificado como el Libro de La Salida al Día. El acontecimiento más importante y trascendental para el paso a la otra vida era el juicio de Osiris. Cuando llegaba este momento el Dios Anubis guiaba al fallecido ante el tribunal de los dioses; allí, extraía mágicamente el corazón (que representa la conciencia y la moralidad) y lo depositaba sobre uno de los dos platillos de una balanza. Entonces, el corazón era contrapesado con una pluma de avestruz (símbolo de la verdad y la justicia universal) que se depositaba en el otro platillo. Si la pluma pesaba más que el corazón quería decir que la persona había estado plena de bondad, de respeto y de justicia. Osiris dictaba entonces sentencia y la persona viviría eternamente en medio de la tranquilidad Si el corazón pesaba más que la pluma, quería decir que el individuo había vivido sin honestidad, sin criterios sanos, sin justicia. Osiris le condenaba entonces a un castigo eterno. Finalmente, si la balanza permanecía invariable, si el corazón y la pluma pesaban lo mismo, la persona debía responder catorce preguntas que mostrarían cómo fue vivida su vida. Dependiendo de sus respuestas el corazón disminuía o aumentaba de peso. Dyehuty, actuando como escriba, anotaba los resultados y los entregaba a Osiris. Al final del juicio, Osiris dictaba sentencia: Si el veredicto era negativo, su corazón era arrojado a Ammit, la devoradora de los muertos (un ser con cabeza de cocodrilo, melena de león, torso y brazos humanos y piernas de hipopótamo), que acababa con él. Esto se denominaba la segunda muerte y suponía para el difunto el final de su condición de inmortal. Todos los días en las Unidades de Cuidado Intensivo cada paciente está a las puertas de un juicio final. Cada ser humano enfermo críticamente plantea preguntas definitivas a todos aquellos que están a cargo de la Unidad. De las respuestas correctas y de las decisiones apropiadas del equipo de salud que abrigue cada turno, dependerá si el paso por la Unidad es el camino al libro de los muertos o el camino a la Salida al Día.. La responsabilidad sigue siendo infinita cuando se nos confía el cuidado de pacientes cuya condición amerita hospitalización en uno de los lugares de mayor complejidad institucional. Quizás cuando pesen nuestro corazón y evalúen qué tan juiciosos fuimos al atender cada ser humano críticamente comprometido, la pluma de avestruz sea la que incline la balanza. No podemos esperar hasta entonces para ofrecer conductas intachables frente a nuestros pacientes. Cada día, cada noche difícil, cada madrugada reclamarán siempre la mejor preparación de todos los equipos de salud. LAUREANO QUINTERO B. Manejo Integral del paciente crítico 3 4 Manejo Integral del paciente crítico Laureano Quintero B. MANEJO INTEGRAL del paciente crítico Editores Asociados: Olga Lucía Pérez Elías Vieda Silva Santiago de Cali, 2009 Manejo Integral del paciente crítico 5 Manejo integral del paciente crítico / editor y compilador Laureano Quintero Barrera. -- Cali: Fundación Salamandra, Laureano Quintero Barrera, 2009. 336 p.; 28 cm. ISBN 978-958-44-4824-8 1. Enfermería de cuidados intensivos. 2. Unidad de cuidados intensivos. 3. Respiración artificial. 4. Ventilación mecánica. 5. Enfermedades cardíacas. I. Quintero Barrera, Laureano, comp. Ficha catalográfi ca pendiente 616.028 cd 21 ed. A1218509 CEP-Banco de la República-Biblioteca Luis Ángel Arango © Fundación Salamandra © Laureano Quintero Barrera ISBN 978-958-44-4824-8 Manejo integral del paciente crítico Derechos Reservados Santiago de Cali, Colombia Fundación Salamandra En Colombia Cali Calle 18 No. 122 Casa 03 Pance PBX: (57) (2) 684 83 83 Telefax: (57) (2) 682 7039 Medellín Medellín Carrera Carrera 45 No. 45 No. 6-806-80 PBX:PBX: (57) (57) (4) 268 (4) 9455 268 9455 Telefax: Telefax: (57) (57) (1) 311 (1) 1953 311 1953 Bogotá Carrera 45A No. 91-25 PBX: (57) (1) 236 3651 Telefax: (57) (1) 758 8425 Barranquilla Barranquilla PBX:PBX: (57) (57) (5) 373 (5) 8798 373 8798 Cels.: Cels.: 320 677 320 8954 677 8954 - 320- 677 320 8450 677 8450 Correo electrónico [email protected] Página Web: www.salamandra.com.co En Costa Rica San Rafael Escazu 50m Oeste Restaurante Maestranza Barrio Maynard Telefax: (50) (6) 228 2484 Carátula y Contracarátula Imagen del Libro de los muertos del escriba Ani, hacia 1300 a.C. Edición Consejos para llegar al más allá: Pretenden familiarizar al difunto con el inframundo, ayudarlo a superar las Laureano Barrera, MD. pruebas para poder salir sin grandes dificultades deQuintero las oscuras profundidades a la luz del sol. Por eso, los egipcios llamaban a estas orientaciones “El libro de la salida al día” Diagramación e impresión Edición Impresora FerivaBarrera, S.A. MD. Laureano Quintero PBX: 524 9009 www.feriva.com Cali - Colombia, 2009 Diagramación e impresión Impresora Feriva S.A. PBX: 524 9009 www.feriva.com Cali - Colombia, 2009 6 Manejo Integral del paciente crítico Contenido Autores............................................................................................9 Introducción ................................................................................. 11 1. MET. Medical Emergency Team ..........................................15 ISABEL CRISTINA ARIAS VILLEGAS 2. Conceptos de fisiología respiratoria en UCI ......................21 BEATRIZ ELVIRA ENDO ABELLA LINDA CECILIA GUTIÉRREZ MÉNDEZ 3. Manejo de la vía aérea en eventos no traumáticos durante la reanimación cardiopulmonar ...........................31 MAURICIO VASCO RAMÍREZ 4. Manejo de vía aérea en trauma ............................................41 MELINA AMAYA PANIAGUA MAURICIO VASCO RAMÍREZ 5. Diagnóstico y manejo de la falla ventilatoria ....................65 ISABEL CRISTINA ARIAS VILLEGAS 6. Principios de la ventilación mecánica.................................71 OLGA LUCÍA PÉREZ O. 7. Ventilación mecánica no invasiva .......................................79 JAIME ANDRÉS GIRÓN BANGUERO 8. Estrategias de protección pulmonar ...................................89 MARTHA VIVIANA PINEDA VÉLEZ 9. Síndrome de distrés respiratorio del adulto ....................101 MAURICIO SALDARRIAGA L. LIDY SOLEY GUTIÉRREZ 10. Patologías obstructivas de la vía aérea Crisis asmática...................................................................... 113 EDUARDO CONTRERAS ZÚÑIGA 11. Edema agudo de pulmón ...................................................127 SANDRA MILENA CARVAJAL GÓMEZ Manejo Integral del paciente crítico 7 12. Patologías obstructivas de la vía aérea. .................................. Enfermedad pulmonar obstructiva crónica 135 13. Tromboembolismo venoso ....................................................... 157 14. Inotrópicos y vasopresores en cuidado intensivo ................. 189 15. Terapia dirigida por metas en sepsis y choque séptico “Desde el servicio de urgencias a la unidad de cuidado intensivo” ............................................................... 199 16. Monitorización cardiorrespiratoria en terapia intensiva ..... 209 17. Arritmias cardiacas.................................................................... 219 18. Secuencias críticas en reanimación cardiopulmonar ............ 237 19. Anormalidades electrolíticas que amenazan la vida. Aproximación diagnóstica y terapéutica ............................... 259 20. Hemodiálisis en reanimación................................................... 283 21. Transfusiones sanguíneas ......................................................... 291 22. Soporte nutricional enteral ....................................................... 303 EDUARDO CONTRERAS ZÚÑIGA LAUREANO QUINTERO BARRERA GUILLERMO AGAMENÓN QUINTERO VILLARREAL JUAN KARLO URREA ZAPATA JUAN KARLO URREA ZAPATA ELÍAS VIEDA SILVA OLGA LUCÍA PÉREZ LAUREANO QUINTERO B. LAUREANO QUINTERO BARRERA GUILLERMO AGAMENÓN QUINTERO VILLARREAL MELINA AMAYA PANIAGUA ELÍAS VIEDA SILVA LIDY SOLEY GUTIÉRREZ MAURICIO SALDARRIAGA L. GUISET CARVAJAL BEDOYA MARÍA CRISTINA DOMÍNGUEZ DANIEL ROMERO URREA 8 Manejo Integral del paciente crítico Autores Melina Amaya Paniagua: Médico y Cirujano. Universidad Pontificia Bolivariana, UPB, Medellín. Instructor Fundación Salamandra. Actualmente Subgerente Unidad de Terapia Intensiva del Hospital Universitario del Valle. Cali. Isabel Cristina Arias Villegas: Médica CES Medellín. Especialista en Anestesiología, Reanimación y Cuidados Intensivos, UPB, Medellín. Intensivista Clínica del Country, Bogotá. Martha Viviana Pineda Vélez: Fisioterapeuta Universidad del Cauca. Instructora Fundación Salamandra. Coordinadora de Rehabilitación Unidades de Terapia Intensiva Hospital Universitario del Valle. Sandra Milena Carvajal Gómez: Médica y Cirujana Universidad Tecnológica de Pereira. Especialista en Medicina de Urgencias, CES, Medellín. Emergencióloga Hospital Universitario del Valle y Fundación Clínica Valle del Lili. Guiset Carvajal Bedoya: Médica y Cirujana Universidad del Valle. Equipo Médico Fundación Salamandra Laureano Quintero Barrera: Cirujano de Urgencias, profesor del Departamento de Cirugía de la Universidad del Valle, Director Científico Fundación Salamandra, Jefe Unidad Reanimación y Trauma Hospital Universitario del Valle. Eduardo Contreras Zúñiga: Médico y Cirujano, Universidad Libre Cali. Medicina Interna, CES. Especialista en Cardiología, Universidad del Valle, Cali. Instructor Fundación Salamandra. María Cristina Domínguez Villegas: Médica y Cirujana Universidad Libre. Equipo Médico Fundación Salamandra Beatriz Elvira Endo Abella: Médica y Cirujana Universidad Libre. Residente Medicina Interna CES. Instructora Fundación Salamandra. Jaime Andrés Girón Banguero: Fisioterapeuta de la Universidad del Valle, Cali. Instructor Fundación Salamandra Linda Cecilia Gutiérrez Méndez: Médica y Cirujana Universidad Libre. Instructora Fundación Salamandra Olga Lucía Pérez: Médica Universidad del Cauca. Especialista en Cirugía de la Universidad de la Frontera en Chile. Intensivista de la Universidad del Valle. Guillermo Agamenón Quintero Villarreal: Especialista en Medicina Crítica y Cuidado Intensivo del Hospital Mocel, México. Universidad de la Sabana, Bogotá. Jefe de la Unidad de Terapia Intensiva del Imat, Coordinador de enseñanza del Imat. Montería. Daniel Romero Urrea: Médico y Cirujano Universidad del Valle. Equipo Médico Fundación Salamandra. Mauricio Saldarriaga Londoño: Médico general del CES, Médico especialista en Medicina de Emergencias de la Universidad de Costa Rica, Coordinador Médico del Servicio de Emergencias Hospital CIMA San José, Director General del Centro Internacional de Entrenamiento en Emergencias SMI. Lidy Soley Gutiérrez: Médico general de la Universidad de Ciencias Médicas de Centro América, médico especialista en Medicina de Emergencias de la Universidad de Costa Rica, Médico Asistente especialista del Servicio Emergencias Hospital CIMA San José, Directora Científica del Centro Internacional de Entrenamiento en Emergencias SMI. Manejo Integral del paciente crítico 9 Juan Karlo Urrea Zapata, Md Facc Faha: Médico y Cirujano, Universidad Libre Cali. Medicina Interna, Pontificia Universidad Javeriana, Bogotá. Especialista en Cardiología, Pontificia Universidad Javeriana, Bogotá. Coordinador Código Azul, Hospital Universitario de San Ignacio, Bogotá. Instructor Fundación Salamandra Mauricio Vasco Ramírez: Especialista en Anestesiología, Cuidado Intensivo y Reanimación, Universidad Pontifica Bolivariana, UPB, Medellín. Anestesiólogo Clínica Colsanitas Bogotá. 10 Manejo Integral del paciente crítico Elías Vieda Silva: Médico Cirujano Universidad Juan N. Corpas. Especialista en Medicina Interna Universidad del Cauca. Especialista en Medicina Crítica y Terapia Intensiva Universidad de la Sabana. Magíster en Salud Pública Universidad del Valle. Profesor hora-cátedra Departamento de Medicina Interna Área Cuidado Crítico Universidad del Valle. Profesor Programa de especialización de Enfermería en Cuidados Intensivos Universidad del Valle. Coordinador Médico Unidad de Terapia Intensiva Hospital Universitario del Valle. Coordinador Médico Unidad de Terapia intensiva Clinica Rey David, Cali. Introducción El enfermo en condición crítica es quizá uno de los retos más complejos para el equipo de salud. Las decisiones y las intervenciones que se ejecuten frente a cada situa- ción deben ser llevadas a cabo con los máximos patrones de seguridad para el paciente. Todo el equipo que labora en Uni- dades de Cuidado Intensivo requiere de procesos de educación continua que garanticen un desempeño acorde con el permanente cambio del conocimiento y de la evidencia. Este documento es un aporte a esa necesidad. LAUREANO QUINTERO B. Manejo Integral del paciente crítico 11 12 Manejo Integral del paciente crítico Manejo Integral del paciente crítico 13 En el corazón reside la personalidad No es la persona al completo la que se mide con la pluma de avestruz, símbolo del orden mundano, sino aquella parte de su ser que constituía para los egipcios el verdadero centro de la personalidad, la sede del entendimiento, la voluntad y la conciencia. (Fragmento del Libro de los muertos, del escriba Ani, hacia 1300 a. C.) 14 Manejo Integral del paciente crítico 1. MET Medical Emergency Team ISABEL CRISTINA ARIAS VILLEGAS 1. Definición MET: Por sus siglas en inglés Medical Emergency Team. Es un programa intrahospitalario de manejo de pacientes críticos, dedicado a detectar y tratar a aquellos con deterioro fisiológico o psicológico agudo antes de que desarrollen un paro cardíaco. A escala intrahospitalaria la mayoría de los pacientes que desarrollan un paro cardíaco presentan variaciones fisiológicas previas que pueden ser detectadas tempranamente para mejorar el pronóstico. Código azul El manejo por un grupo multidisciplinario de los pacientes que desarrollan paro cardíaco intrahospitalario se conoce como Código Azul. Cuando en un hospital se genera una llamada de Código, o un Código Azul, el personal entrenado se desplaza hacia donde se halla el paciente en paro y brinda la atención indicada. Aunque este concepto está ampliamente difundido y la mayoría de los hospitales han desarrollado equipos de Código Azul, la mortalidad del paro cardíaco intrahospitalario persiste sorpresivamente alta con el paso del tiempo. En una excelente revisión de la historia de la reanimación en el mundo,1 se recoge el promedio de sobrevida de los pacientes que desarrollan paro intrahospitalario. A pesar de los avances, éste persiste entre el 0% y el 29%. El promedio de la sobrevida es del 17.6%. Los estudios más relevantes se resumen en la Tabla 1:2, 3 4 y 5 Tabla 1. Tasa de supervivencia posterior al paro cardiorrespiratorio en pacientes hospitalizados y no hospitalizados Cardio Ubicación Datos incluidos Total No. (% de supervivencia) % Fv o Tv % AESP de supervivencia % Asistolia % de supervivencia Ritmo desconocido Hospitalizados7 Estados Unidos, Canadá 1/OD-3/4 36.902 (17.6%) No hospitalizados Estados Unidos, Canadá, Inglaterra, Noruega, Suiza 2/98 - 6/02 3/02 - 10/03 1/99 - 12/00 5.234 (6.4%) 22.7 (36.0 %) 32.4 (11.2%) 33.2 (16.1%) 24.7 (2.7%) 35.3 (10.6%) 39.0 (0.9%) 9.6 3.0 Manejo Integral del paciente crítico 15 2. Paro cardíaco intrahospitalario La American Heart Association creó un registro nacional para reportar todos los paros intrahospitalarios (conocido como NRCPR, por sus siglas en inglés) y encontró cambios importantes en la etiología y el pronóstico de los paros respecto a los datos históricos. (3 °° ).* Los datos aquí mostrados son extraídos de esta recopilación. Primer ritmo de paro intrahospitalario La prevalencia de asistolia fue de 40% en pediatría y 35% en adultos. La prevalencia de AESP fue de 24% en pediatría y 32% en adultos. La prevalencia de TV/FV fue de 14% en pediatría y 23% en adultos. En el estudio hubo un porcentaje de pacientes en paro cardíaco con ritmo no documentado. Esto cambia el concepto clásico de enseñanza en reanimación. Debemos enfatizar que en lo intrahospitalario muchos niños desarrollan ritmos que son candidatos a terapia eléctrica, y la mayoría de los adultos presentan ritmos que no son desfibrilables. Prevalencia de ritmo cardíaco inicial en paro cardíaco intrahospitalario Ritmo Pediatría Adultos Asistolia 40% 35% AESP 24% 32% TV/FV 14% 23% Sobrevida de los pacientes según grupo etario y ritmo de paro Existen varios parámetros para evaluar la sobrevida al paro cardíaco; algunos en cantidad y otros en calidad. * Estos resultados fueron publicados en la revista Jama en el 2006 16 Manejo Integral del paciente crítico La cantidad se puede evaluar con estos parámetros: Retorno a la circulación espontánea (ROSC, por sus siglas en inglés): pacientes en los que se obtiene pulso después de una reanimación, ROSC mayor de 20 minutos, sobrevida a las 24 horas. Sobrevida al alta hospitalaria y sobrevida al año del evento. Se muestran en gráficas ROSC y alta hospitalaria. La calidad de la reanimación se mide generalmente con parámetros de función neurológica en los sobrevivientes. ROSC según ritmo y edad en paro cardíaco intrahospitalario Ritmo Pediatría Adultos Asistolia 52.6% 45% AESP 57.7% 52.4% TV/FV 66.7 67.3 Sobrevida al alta hospitalaria según ritmo y edad en paro cardíaco intrahospitalario Ritmo Pediatría Adultos ASISTOLIA Y AESP 24% 11% TV/FV 29% 36% TOTAL 27% 18% Estos datos generan un análisis interesante. Se encontró mayor sobrevida al alta de los niños que de los adultos con ritmos no desfibrilables. La sobrevida de los ritmos desfibrilables es prácticamente igual. Intrahospitalariamente la asistolia y la actividad eléctrica sin pulso no son ritmos fútiles. Su prevalencia es alta y su sobrevida (11-24%), mayor que lo tradicionalmente enseñado ( 0-2%). Factores asociados con sobrevida Se encontraron los siguientes factores asociados a un mejor pronóstico: • Intervenciones realizadas antes del momento del paro, como catéteres centrales, arteriales, ventilación mecánica o uso de vasoactivos. • • • • • Paciente vigilado. Paciente monitorizado. Tiempo de la descarga, si aplica. Localización intrahospitalaria en UCI. Duración de la reanimación: Los pacientes que sobrevivieron fueron sometidos a reanimaciones más cortas. Condiciones preexistentes al paro cardíaco Las patologías documentadas en la historia clínica de los pacientes que llegaron a paro cardíaco intrahospitalario fueron: • Insuficiencia respiratoria. • Hipotensión e hipoperfusión. • Falla cardiaca congestiva. • Neumonía, septicemia o infección. • Arritmias. • Trastornos hidroelectrolíticos. • Alteraciones del SNC. • Insuficiencia renal. • Trauma mayor. • Falla hepática. • Enfermedad metastásica. • Infarto agudo del miocardio. • Intoxicaciones. • Diabetes mellitus. En lo intrahospitalario sólo un 8% de los niños y 5 % de los adultos no reportaron enfermedades preexistentes en su historia clínica. La mayoría de los paros intrahospitalarios se presentan en pacientes seriamente enfermos. 3. Implementación de MET Con los datos expuestos previamente se generó una corriente mundial para la creación de los MET. La base racional para ello se deriva de observar que las alteraciones fisiológicas previas al paro cardíaco intrahospitalario son comunes en múltiples enfermedades y pueden ser detectadas por todo el personal médico y paramédico que trabaja en un hospital. Se crea entonces un sistema de respuesta de alto nivel frente a un paciente críticamente inestable, donde se empodera al servicio de enfermería y se autoriza expresamente a llamar a todo el equipo MET cuando un paciente cumple los requisitos. Esto tiene varias implicaciones. Se está cambiando el esquema de atención del paciente de hospitalización. Cuando éstos se deterioraban, eran evalua- dos por enfermería, que llamaba a médicos de bajo nivel de entrenamiento (junior staff, internos o residentes menores). Este grupo de médicos generalmente no tiene la formación suficiente para manejar a estos pacientes, y se perdía tiempo valioso mientras médicos altamente entrenados conocían el caso. Ahora se cambia el esquema, y el pri- mero en atender al paciente inestable es el médico de mayor entrenamiento. Y todo esto antes del paro cardíaco. Los MET, como tal, forman parte de todo un sistema de respuesta rápida para la atención del paciente crítico. Con variadas denominaciones según el país de origen, el concepto ha tenido gran acogida mundial. En el 2006 la revista Critical Care Medicine publicó el primer consenso en MET( 6°) En general, los australianos fueron los primeros en implementar los MET. Aunque los criterios de activación aún no están estandarizados, los más frecuentemente citados son los tomados del estudio MERIT.7 4. Evaluación de MET Los parámetros que se han creado para evaluar el impacto de los MET han intentado medir costos y la disminución en morbilidad y en mortalidad. Aún no está probado que la implementación de MET disminuya la mortalidad hospitalaria. Manejo Integral del paciente crítico 17 5. Por qué implementar MET Además de los paros cardíacos intra hospitalarios por enfermedades de base, muchos pacientes fallecen en los hospitales como consecuencia del error humano.8,9 La implementación de un sistema de atención MET se encuentra dentro de las seis estrategias que se han generado en USA con la campaña de las cien mil vidas. Cómo salvar al año a cien mil pacientes que se están muriendo en hospitales americanos por error humano.8 18 Manejo Integral del paciente crítico Campaña de las cien mil vidas Manejo adecuado del IAM Prevenir errores de medicación Disminuir la neumonía asociada al ventilador Disminuir la infección del sitio operatorio Prevenir infecciones de catéter venoso central Crear MET Bibliografía 1. 3. 4. 5. Cooper, JA.; Cooper, JD.; Cooper, JM: Cardiopulmonary resuscitation history, current practice, and future direction. Circulation 2006; 114: 2839-2849. Steill, IG; Well, GA; Field, B; Spaite, DW et al: Advance cardiac life support in out of hospital cardiac arrest. N Engl J Med. 2004; 351:647-656. Nadkarni, VM; Larkin, GL; Peberdy, MA; Carey, SM; Kaye, W; Mancini, ME; Nichol, G; Lane, Truitt T; Potts, J; Ornato, JP; Berg, RA. First documented rhythm and clinical outcome from in hospital cardiac arrest among children. JAMA. 2006;295:50-57 Wilk, L; Kramer-Johansen, J; Myklebust, H; Sorebo; H; Svensson, L; Fellows, B; Steen, PA. Quality of cardiopulmonary resuscitation durind out of hospital cardiac arrest. JAMA. 2005;293:299-304. 6. Cobb, LA; Fahrenbrunch, CE; Olsufka, M; Copass, MK. Changing incidence of out of hospital ventricular fibrillation, 1980-2000. JAMA. 2002; 288:3008-3013. 7. De Vita, MA; Bellomo, R; Hillman, K; Kellum, J, et al: Findings of the first consensus conference on medical emergency teams. Crit Care Med 2006;34: 2463-2478 8. Cretikos M, et al., The objetive medical emergency team activation criteria: a case control study, RESUSCITATION 2007 in press. 9. Berwick, DM; Calkins, DR; McCannon, CJ; Hackbarth, AD. The 100000 lives campaign. 10. Kohn, KT; Corrigan, JM; Donaldson, MS. To err is human: bulding a safer system. Washington, DC: National Academies Press; 1999. Manejo Integral del paciente crítico 19 20 Manejo Integral del paciente crítico 2. Conceptos de fisiología respiratoria en UCI BEATRIZ ELVIRA ENDO ABELLA LINDA CECILIA GUTIÉRREZ MÉNDEZ Estructura y función del pulmón El pulmón es el órgano encargado de realizar el intercambio gaseoso, tomar oxígeno del aire y eliminar dióxido de carbono hacia el exterior, además de metabolizar determinados compuestos, filtrar materiales tóxicos y hacer las veces de depósito de sangre. Los pulmones consisten en tubos ramificados cada vez más estrechos, más cortos a medida que aumenta la distancia desde la tráquea. La ramificación prosigue hasta llegar a los bronquiolos terminales (generación 16) que son las vías aéreas más pequeñas carentes de alvéolos. Esta zona corresponde al espacio muerto anatómico sin incluir los alvéolos. Por último llega a los conductos alveolares que se encuentran totalmente tapizados de alvéolos. La respiración externa es la principal función del sistema respiratorio, Se define como el proceso fisiológico por medio del cual los organismos vivos toman oxígeno del medio circundante (oxigenación) y desprenden dióxido de carbono hacia el mismo (ventilación). Este intercambio de gases entre la atmósfera y el ser vivo requiere de la interacción armoniosa de todos los componentes que hacen parte del sistema respiratorio: pulmones, sistema nervioso central, vasos pulmonares, vías aéreas superior e inferior, caja torácica y músculos. Finalmente, el sistema respiratorio interacciona con el sistema cardiovascular para el transporte de estos gases hacia la célula y desde ella. De esta manera se obtiene y transporta el oxígeno necesario para la producción de energía mitocondrial y se remueve el dióxido de carbono producto del metabolismo celular. La difusión del oxígeno y del dióxido de carbono tiene lugar a través de la interfase sangre-gas, en la que la membrana alvéolo capilar representa la separación entre el aire de los alvéolos y la sangre de los capilares. El pulmón del adulto contiene alrededor de 300 millones de alvéolos, que ocupan una superficie aproximada de 85 m2 y un volumen pulmonar cercano a los 4,25 litros. Volúmenes pulmonares • • Capacidad Pulmonar Total (TLC): Es el volumen de aire que hay en el pulmón después de una inspiración máxima voluntaria. Capacidad Vital (VC): Es el máximo volumen que puede ser exhalado Manejo Integral del paciente crítico 21 • • después de una inspiración completa. Es decir, la diferencia entre Capacidad Pulmonar Total y el Volumen Residual (RV). Volumen Residual (RV):Volumen que queda en el pulmón después de una espiración máxima. Volumen corriente (VC):Volumen que fluye en un ciclo ventilatorio (500 ml). Ventilación alveolar Es la cantidad de aire inspirado fresco disponible para el intercambio gaseoso. Se calcula multiplicando (volumen corriente – espacio muerto) x la frecuencia respiratoria = (500-150) x 15 = 5.250 ml/ min. 22 Manejo Integral del paciente crítico El gas alveolar no se renueva completamente con cada inspiración; es decir, lo hace de una manera gradual y progresiva. Esto se explica porque el aire que ingresa durante la inspiración hasta la zona de intercambio gaseoso (350 ml) se mezcla con el gas de la capacidad funcional residual, es decir, con el gas que se encuentra en el pulmón luego de cada espiracion (2.300 ml); por lo tanto, con cada ciclo respiratorio sólo se renueva la séptima parte del gas alveolar. Este fenómeno evita aumentos o descensos bruscos en la oxigenación de los tejidos cuando la respiración se modifica temporalmente, y se constituye en un factor de protección frente a la hipoxia. Por lo anterior, en la práctica clínica cuando se administra oxígeno suplementario y se desea medir el impacto de la intervención a través del análisis de los gases en una muestra de sangre arterial, se debe esperar 20 minutos para que todo el gas alveolar sea reemplazado por esta nueva mezcla de oxígeno. Difusión de membrana Proceso por el cual un gas pasa a través de la barrera hematogaseosa. El gas se desplaza desde una zona de presión mayor a una zona de presión más baja. La velocidad de difusión depende del área de superficie, del grosor de la membrana y de las propiedades tanto del tejido como del gas. El tiempo disponible para que se produzca el intercambio depende del flujo sanguíneo capilar pulmonar y del volumen sanguíneo capilar pulmonar. El tiempo que pasa un hematíe en intercambio oscila entre 0,75 seg y 1,2 seg. Por el ejercicio y por algunas patologías el volumen y el flujo en el capilar aumentan, por lo que el tiempo de permanencia del hematíe en el capilar puede descender hasta 0,4 seg. La cantidad total de sangre que existe en los capilares pulmonares en un momento determinado es de unos 60 - 140 ml. Ahora, si se considera el espesor de la membrana y además en forma hipotética se intenta esparcir este volumen de sangre en un área de 160 m2, se entenderá lo fácil que es para cualquier gas pasar a través de la membrana alvéolo capilar. Proceso por el cual un gas pasa a través de la barrera hematogaseosa Superficie del tejido 50-100 m2 Diferencia de presión parcial O2 40-100mmHg Espesor de la donde la ventilación excede la perfusión, las presiones parciales del gas alveolar se acercarán al gas inspirado y la relación estará encima de uno. En contraste, si la perfusion excede la ventilación, la composición del gas se parecerá más estrechamente a la de la sangre venosa mixta. Por consiguiente, en una relación VA/Q cercana de la unidad, el intercambio de O2 y CO2 está óptimamente equilibrado y el alvéolo mantendrá un estado llamado “ideal” para el intercambio gaseoso. En resumen, cuando la relación VA/Q excede el valor ideal ( >1) la composición de gas en cada alvéolo se parece a la del gas inspirado; cuanto más baja relación VA/Q (< 1) se parecerá al de la sangre venosa mixta. membrana 3 Um La velocidad de difusión es directamente proporcional a la superficie y a la diferencia parcial del gas e inversamente proporcional al grosor de la membrana. En consecuencia, cuanto más grande sea el área para la difusión y más corta la distancia del recorrido, mayor será la difusión del gas, y cuanto menos peso molecular tenga la molécula, mayor será su movimiento cinético y más fácil su difusión. Relación ventilación-perfusión Para que haya un buen intercambio gaseoso la ventilación y el flujo sanguíneo deben concordar dentro de las diversas regiones del pulmón. Si no concuerdan, ello da origen a la mayoría de las enfermedades pulmonares; fundamentalmente se trastorna la transferencia de O2 y de CO2, lo cual puede ocurrir en un alvéolo, en un grupo de alvéolos o en todo el pulmón. La composición de gas en cada alvéolo determinará los valores del gas de la sangre arterial en una dependencia directa entre ventilación y perfusión. En las regiones pulmonares La falta de concordancia entre ventilación y flujo sanguíneo originan la mayoría de los defectos en las enfermedades respiratorias (hipoxemia; 0.8 normalmente). • El pulmón es incapaz de mantener una PO2 y P CO2 • La relación V-P disminuye del vértice a la base • Relación baja: Causa hipoxemia porque la sangre circula por zonas del pulmón mal ventiladas, como en la bronquitis crónica, la neumonía o el edema pulmonar. • Relación alta: Zonas bien ventiladas, pero mal perfundidas como el tromboembolismo pulmonar. Manejo Integral del paciente crítico 23 El diagrama de PO2-PCO2 de Rahn y Farhi explica gráficamente los conceptos teóricos de distribución de la ventilación/perfusión y el intercambio de gas pulmonar. Algunos autores han establecido cuatro estados fisiológicos posibles en la relación V/Q. Tales estados se fundamentan en el funcionamiento de la unidad respiratoria básica, o sea el alvéolo con su capilar pulmonar. Ellos son: a. Unidad normal: Cuando la perfusión y ventilación alveolar son normales (V/Q = 1). b. Unidad de espacio muerto: Aquí el alvéolo ventila pero no es perfundido. Esto produce un desperdicio del proceso respiratorio, pues el aire alveolar no difunde hacia la sangre. El volumen de aire de este alvéolo pasa a aumentar el volumen de aire del espacio muerto (V/Q > 1). c. Unidad con shunt: Está formada por un alvéolo colapsado u obstruido con una perfusión normal. Aquí la sangre pasará por un alvéolo sin gas y saldrá hacia la circulación sistémica sin haberse oxigenado. En cierta forma se puede expresar que la sangre pasa por un atajo, o por un puente; es decir, se desvía sin ponerse en contacto con el ambiente que le facilita la toma de 24 Manejo Integral del paciente crítico oxígeno. Esta situación es grave, ya que la administración de oxígeno no soluciona el problema, pues la sangre no podrá ponerse en contacto nunca con este gas (V/Q < 1). d. Unidad no funcional o silenciosa: En ella el alvéolo está colapsado, sin ventilación y tampoco tiene perfusión. El 98% de la sangre pasa por los capilares alveolares donde es oxigenada hasta una PaO2 de 100 mm Hg. Como puede verse, la presión sanguínea de oxígeno no alcanza a igualar la presión alveolar del mismo (105 mm Hg). La razón para esta diferencia es la baja solubilidad de este gas. El 2% de sangre restante no es oxigenada, ya que pasa por la circulación bronquial que irriga el espacio muerto anatómico. Por lo tanto, este 2% representa un flujo de sangre desviado de la zona de intercambio gaseoso conocido con el nombre de Shunt intrapulmonar anatómico. Esta sangre no oxigenada tendrá una presión arterial de oxígeno igual a la venosa (40 mm Hg). Luego, al salir del pulmón la sangre oxigenada con 100 mm Hg (98%) y la sangre desviada con 40 mm Hg (2%) se mezclan y finalmente la sangre que llega a la aurícula izquierda tiene una presión de oxígeno de 95 mm Hg. Esta es la presión de oxígeno que genera gradiente de presión para la difusión hacia las células. Shunt Otra fuente de hipoxemia. Shunt significa que la sangre regresa al sistema arterial sin haber pasado por áreas del pulmón ventiladas. Las fuentes de shunt existentes son varias; de forma práctica las podemos clasificar como fisiológicas y patológicas. Las primeras incluyen la sangre proveniente de las venas pulmonares y las venas de tebesio. El shunt patológico es el que se produce cuando la sangre pasa por un alvéolo colapsado. En los pacientes con patologías cardiacas puede haber una adición directa de sangre venosa a la sangre arterial por medio de una comunicación entre los ventrículos derecho e izquierdo del corazón; ejemplo: CIV, CIA, o transposición de vasos o ventrículo único en pacientes pediátricos. Cualquiera que sea la causa, el efecto de la adición de sangre venosa (no oxigenada) al sistema arterial es la depresión de la PO2. Transporte de gas hacia la periferia En condiciones normales la sangre que llega a los tejidos periféricos tiene una presión parcial de PO2 de 95 mmHg, lo que permite un gradiente de presión entre la sangre y la mitocondria. De esta manera la PO2 del capilar disminuye rápidamente y cuando la sangre llega a las venas desde el tejido la PO2 se ha igualado prácticamente (40 mmHg). La PO2 en el tejido es reflejo de la cantidad de oxígeno transportado por la sangre y la utilización del mismo por parte de las células. Curva de disociación de la hemoglobina La cantidad máxima de oxígeno capaz de combinarse con la hemoglobina es la capacidad de oxígeno. La saturación de oxígeno está dada por O2 combinado con la hemoglobina × 100 capacidad de O2 Cuando la sangre retorna al sistema arterial sin haber pasado por áreas ventiladas del pulmón Shunt anatómico Alveolares Shunt fisiológicos Venas de tebesio Venas pulmonares Unidad absoluta Shunt Valv Qcap o Shunt patológico Refractario a O2 Manejo Integral del paciente crítico 25 geno en la sangre y de un gasto cardiaco apropiado que lo lleve a los tejidos. pH Temp. Durante cada contracción PCO2’ cardiaca 70 ml de sangre 2,3 DPG oxigenada son expulsa70 dos del corazón izquierDesviación 60 do hacia la periferia con a la derecha P50 50 el fin de llevar oxígeno pH 40 a los tejidos. La misma Temperatura PCO2’ cantidad de sangre sale 30 2,3 DPG. durante la sístole del 20 ventrículo derecho para 10 ser oxigenada por el pulmón. En otras palabras, 0 10 20 30 40 50 60 70 80 90 100 110 120 PaO2 mm Hg el corazón se encarga de llevar la sangre oxigena• – temperatura • –temperatura da a la periferia para la • –2,3 difosfoglicerato • –2,3 difosfoglicerato producción celular de energía y de traerla • –PCO2 • –PCO2 de regreso a los pulmones para ser nueva• –pH • –hidrogeniones mente oxigenada. Si consideramos que un adulto normal tiene un gasto cardiaco de 5 Oxígeno unido a la hemoglobina = litros por minuto (gasto cardiaco = volumen Hb x 1,34 x SPO , al reemplazar 14 x 1,34 x latido x frecuencia cardiaca, 70 x 72 respec2 0,97 = 18,19 ml de oxígeno en cada 100 ml tivamente) y lo multiplicamos por el contede sangre. nido arterial de oxígeno, encontramos que Oxígeno disuelto = PaO x coeficiente en un minuto el corazón lleva a los tejidos 2 de solubilidad del oxígeno, al reemplazar periféricos unos 1000 ml de oxígeno. 100 mm Hg x 0,003 = 0,3 ml de oxígeno en cada 100 ml de sangre. La oxigenación tisular Finalmente, contenido total de oxígeno en la sangre = 18,19 + 0, 3 = 18,49 ml de depende de: oxígeno en cada 100 ml de sangre. El anterior ejemplo ilustra claramente • El PaO2 que establece gradientes que la mayor cantidad de oxígeno es transinversos. portado unido a la hemoglobina y que sólo • El gasto cardiaco. una pequeña proporción lo hace disuelto • El porcentaje de saturación de oxíge(18,19 contra 0,3 ml, respectivamente). no de la hemoglobina y la posición de En otras palabras, del contenido total de oxígeno en la sangre, el 98,4% está unido a la curva de disociación. la hemoglobina, mientras que sólo el 1,6% • El contenido arterial de oxígeno. está disuelto. % Saturación Desviación a la izquierda Oxigenación tisular El aporte de oxígeno a los tejidos depende de un adecuado contenido de oxí- 26 Manejo Integral del paciente crítico • El O2 y el CO2 se desplazan entre la sangre capilar sistémica y las células de los tejidos por difusión simple. El intercambio de oxígeno y dióxido de carbono entre la sangre del capilar tisular y las células se denomina respiración interna. Es diferente del proceso de intercambio gaseoso de la membrana alvéolo capilar denominado respiración externa. La difusión de oxígeno a nivel periférico se realiza en el capilar tisular. Como se ha explicado, debe existir un gradiente de presión para la difusión de oxígeno. A nivel periférico el oxígeno difunde primero entre el capilar y el intersticio tisular y luego desde allí hasta la célula. Por tal motivo existe un gradiente de presiones entre estos tres lugares para permitir la difusión de oxígeno. Cuando la sangre llega al capilar periférico trae una presión de oxígeno de 95 mm Hg. Por otra parte, a nivel tisular la presión de este gas es de 40 mm Hg. En estas condiciones existe una gran diferencia de presión a favor de la difusión de oxígeno hacia el intersticio (55 mm Hg). En el líquido intersticial la presión de oxígeno se mantiene constantemente baja (40 mm Hg) porque las células lo utilizan para sus funciones metabólicas. Una vez en el intersticio, el oxígeno difunde hacia las células a favor de un gradiente de presión. Esto genera una disminución progresiva en la presión intersticial de oxígeno a medida que se aleja del capilar tisular y queda una menor cantidad de oxígeno disponible para las células más distales. Sin embargo, como las células siempre están consumiendo oxígeno, la presión parcial intracelular de este gas se conserva más baja que la del líquido intersticial a pesar de estar lejos del capilar, lo que permite la difusión de oxígeno. El valor promedio de la presión de oxígeno intracelular es de 23 mm Hg; oscila entre valores tan bajos como 5 mm Hg y otros tan altos como 60 mm Hg de acuerdo con la proximidad o el distanciamiento que exista con el capilar tisular. Normal- mente son suficientes valores tan bajos de presión intracelular de oxígeno como de 4 mm Hg para mantener los procesos metabólicos intracelulares en donde la célula activa procesos catabólicos y disminuye su función celular, conservando así su estructura. Normoxia, hipoxia y disoxia Es claro que la producción de ATP necesita un aporte constante y suficiente de oxígeno para satisfacer las necesidades energéticas de la célula. Se ha estimado que una presión de oxígeno intracelular mayor de 15 mm Hg es suficiente para la síntesis de ATP, lo que corresponde a un estado de normoxia intracelular. Cuando la presión intracelular de oxígeno cae a rangos entre 15 mm Hg y 4 mm Hg, la célula es capaz de mantener una producción adecuada de ATP pero necesita de algunos mecanismos de adaptación, como cambios en la fosforilación y reclutamiento redox en el transporte de electrones mitocondrial. En estas condiciones la célula se encuentra en un estado de hipoxia adaptada, es decir, mantiene la producción de ATP a través de mecanismos compensatorios sin acudir al metabolismo anaerobio. Cuando la presión de oxígeno intracelular es inferior a los 4 mm Hg la célula entra en un estado de disoxia, o sea, la producción de ATP a través de la fosforilación oxidativa mitocondrial es insuficiente y los mecanismos adaptativos iniciales no logran satisfacer las necesidades de ATP. En estas condiciones la célula sacrifica su función para mantener indemne su estructura, es decir, utiliza la poca energía disponible para el mantenimiento del gradiente iónico a través de las membranas y olvida su función, por ejemplo, la transmisión axonal de las neuronas. En el cerebro este fenómeno se evidencia en los cambios progresivos del nivel de conciencia de un paciente hipóxico. A pesar de ser un mecanismo ineficiente, el Manejo Integral del paciente crítico 27 metabolismo anaerobio permite a la célula vivir durante un determinado tiempo sin que haya deterioro de su estructura. Esto se denomina disoxia sin daño celular. Y si el aporte de oxígeno de la célula vuelve a valores normales, la función celular retorna sin verse afectada (el paciente recupera la conciencia). Finalmente, cuando este meca- 28 Manejo Integral del paciente crítico nismo se agota y las necesidades energéticas de la célula no pueden ser satisfechas, habrá disoxia con daño celular. Aquí el aporte de ATP es insuficiente para mantener la función y la integridad celular (el paciente queda con déficit neurológico permanente). Esto sucede con presiones de oxígeno intracelulares menores de 1 mm Hg. Bibliografía 1. 2. 3. Applied Physicology in Intensive Care Medicine, M.R. Pinsky L., Brochard J. Mancebo, Springer-Verlag Berlín Heidelberg 2006. J.A. Pryor. Physioterapy for airway clearance in adults. Eur Respir J. 14: 1418-24, 1999. DN Homnick, K. Anderson and JH Marks. Chest physiotherapy in hospitalized pa- 4. 5. tients. Comparison of the flutter device to standard with cystic fibrosis: a pilot study. Chest 1998; 114; 993-997. Gases sanguíneos: Fisiología de la respiración e insuficiencia respiratoria. José Félix Patiño Restrepo, 1998; 208, 209 Fisiología Médica. Arthur C. Guyton, John E. Hall – 2006; 491-501. Manejo Integral del paciente crítico 29 30 Manejo Integral del paciente crítico 3. Manejo de la vía aérea en eventos no traumáticos durante la reanimación cardiopulmonar MAURICIO VASCO RAMÍREZ Introducción El propósito de la ventilación durante la reanimación cardiopulmonar es mantener un adecuado aporte de oxígeno a los tejidos y barrer adecuadamente el dióxido de carbono; durante los primeros minutos del paro la prioridad es garantizar adecuadas compresiones cardiacas interrumpiéndolas lo mínimo posible para ventilar a los pacientes. Cuando se realiza manejo avanzado, la colocación de dispositivos no puede implicar retardo del masaje cardiaco. Los cinco cambios principales de las guías de 2005 son: 1. Mayor énfasis y recomendaciones con respecto a cómo mejorar la eficacia de las compresiones torácicas. 2. Establecimiento de una sola relación de compresión-ventilación para todos los reanimadores únicos y para todas las víctimas (excepto los recién nacidos). 3. Recomendación de que cada respiración artificial de rescate, si es que se realiza, dure un segundo y logre que el pecho se levante de forma visible. 4. Nueva recomendación: se debe usar una única descarga, seguida inmediatamente de RCP, para intentar revertir un paro cardiaco por FV. Se debe verificar el ritmo cardiaco cada dos minutos. 5. Se avala la recomendación del ILCOR (International Liaison Committee on Resuscitation) de 2003 sobre la utilización de DEA en niños de 1 a 8 años de edad (y mayores) empleando un sistema de reducción de la dosis en niños si está disponible. Solo una de las recomendaciones está orientada al manejo inicial de la vía aérea de pacientes en paro. Enunciaré a continuación las recomendaciones tanto del ERC (European Resuscitation Council) como las de la AHA (American Heart Association) asumidas por ILCOR (International Liaison Committee on Resuscitation). Deben ser los equipos de reanimación de cada institución los que determinen qué protocolos adoptar de acuerdo con sus necesidades y entrenamiento. Riesgos para el reanimador La seguridad del reanimador y la víctima es de vital importancia durante un intento de resucitación. Los reanimadores han sufrido en muy pocas ocasiones efectos adversos por practicar una RCP; sólo se Manejo Integral del paciente crítico 31 ha informado de algunos casos aislados de infecciones como la tuberculosis (TB)1 y el síndrome de distrés respiratorio agudo (SARS).2 Nunca se ha informado de la transmisión del VIH durante la RCP. No hay estudios en seres humanos que reporten la efectividad de los dispositivos de barrera durante la RCP; no obstante, sí hay estudios de laboratorio que muestran que hay ciertos filtros o dispositivos de barrera con válvulas unidireccionales que impiden la transmisión oral de bacterias de la víctima al reanimador durante la ventilación boca a boca.3,4 Los reanimadores deberán tomar las medidas de seguridad apropiadas siempre que sea factible, especialmente si la víctima padece una grave infección, como TB o SARS. Durante un brote de una enfermedad infecciosa grave como el SARS, es esencial que el reanimador tome todas las medidas necesarias de protección. ABCD primario Apertura de la vía aérea No se recomienda que los legos practiquen la subluxación mandibular, porque es difícil de aprender y practicar y puede provocar movimiento de la columna cervical.5 Por lo tanto, el reanimador debe realizar la apertura de la vía aérea utilizando la maniobra frente-mentón tanto para las víctimas lesionadas como para las no lesionadas. Figura 1. Ventilación de rescate inicial Durante los primeros minutos posteriores a un paro cardiaco no precedido de asfixia (ahogamiento) la sangre aún contiene un alto porcentaje de oxígeno, y el transporte de oxígeno al miocardio y al cerebro está más restringido por la disminución del gasto cardiaco que por una falta de oxígeno en los pulmones. Por lo tanto, la ventilación es menos importante, en principio, 32 Manejo Integral del paciente crítico Figura 1. Maniobra frente – mentón para permeabilizar la vía aérea. que las compresiones torácicas.7 Es sabido que la simplificación de la secuencia de los protocolos soporte vital básico contribuye al aprendizaje y dominio de las técnicas.8 Por otra parte, los reanimadores no suelen estar dispuestos a hacer inicialmente una ventilación boca a boca, por diferentes motivos, como por ejemplo el miedo a contagiarse de una infección o simplemente porque les repugna este procedimiento.9,10 Se recomienda, por estos motivos y para enfatizar la prioridad del masaje cardiaco, que se comience la RCP en adultos con las compresiones torácicas, más que con ventilación inicial, recomendación del ERC (European Resuscitation Council). La recomendación de la AHA (American Heart Association) asumida por ILCOR (International Liaison Committee on Resuscitation), si el paciente está en apnea, es dar ventilaciones de rescate boca a boca o en el ambiente hospitalario con un dispositivo bolsa-válvula-mascarilla, conectado a una fuente de oxígeno a 12 litros por minuto. Se realizarán dos ventilaciones iniciales de un segundo de duración cada una, y observar la expansión simétrica del tórax como medida que verifica la efectividad de las ventilaciones, y realizar presión cricoidea (maniobra de Sellick) si se dispone de un reanimador adicional para esa maniobra. Ventilación Durante la CPR, el propósito de la ventilación es mantener una oxigenación adecuada. Sin embargo, no se sabe con certeza cuáles son el volumen corriente óptimo, la frecuencia respiratoria y la concentración inspirada de oxígeno necesarios para lograrlo. Las recomendaciones actuales se basan en las siguientes pruebas: 1. Durante la RCP se reduce significativamente el flujo sanguíneo pulmonar, de manera que puede mantenerse una adecuada relación ventilación / perfusión con volúmenes corrientes y frecuencias respiratorias más bajos de lo normal.11 2. La hiperventilación (demasiadas ventilaciones o un volumen demasiado grande) no sólo es innecesaria sino también deletérea porque aumenta la presión intratorácica, disminuyendo por tanto el retorno venoso al corazón y el gasto cardiaco. En consecuencia, se reducen las posibilidades de supervivencia.12 3. Cuando la vía aérea no está protegida, un volumen corriente de 1l produce una distensión gástrica significativamente mayor que un volumen corriente de 500 ml.13 4. Una baja ventilación-minuto (un volumen corriente y una frecuencia respiratoria más bajos de lo normal) puede mantener una oxigenación y ventilación efectivas durante la RCP.14—15 Durante la RCP en un adulto, se considera adecuado un volumen corriente de aproximadamente 500-600 ml (6-7 ml por kg). 5. Las interrupciones de las compresiones torácicas (para hacer la ventilación boca a boca, por ejemplo) van en detrimento de la supervivencia.16 Realizar las ventilaciones de rescate durante un tiempo más corto contribuirá a reducir la duración de las interrupciones. La recomendación actual es que los reanimadores realicen la insuflación en aproximadamente un segundo, con el volumen suficiente para hacer que se eleve el tórax de la víctima, pero evitando insuflaciones rápidas o fuertes. Esta recomendación puede aplicarse a todos los tipos de ventilación que se hagan durante la RCP, incluyendo la boca a boca y la ventilación de bolsa-válvula-mascarilla (BVM) con el oxígeno adicional o sin él. La ventilación boca-nariz es una alternativa eficaz a la ventilación boca a boca.17 Se puede practicar en los casos en que la boca de la víctima está gravemente herida o no se puede abrir, cuando el reanimador está socorriendo a una víctima en el agua, o cuando es difícil sellar la boca de la víctima. No existen pruebas documentadas de que la ventilación de boca a traqueostomía sea eficaz, segura o factible; aun así, puede usarse para una víctima con un tubo de traqueostomía o estoma traqueal que necesite una ventilación de rescate. Un reanimador sin ayuda puede abrir la vía aérea subluxando la mandíbula al tiempo que sostiene la mascarilla junto al rostro de la víctima. Esta técnica es apropiada para su uso por personas con entrenamiento médico que trabajen en áreas muy especializadas, como servicios de cuidados intensivos, quirófanos y urgencias o por terapeutas respiratorias. Obstrucción de la vía aérea por un cuerpo extraño (OVACE) atragantamiento La obstrucción de la vía aérea por un cuerpo extraño (OVACE) es una causa de muerte accidental poco común pero potencialmente tratable . 18 Cada año, aproximadamente 16.000 adultos y niños en el Reino Unido reciben tratamiento en Manejo Integral del paciente crítico 33 urgencias por una OVACE. Afortunadamente, menos del 1% de estos incidentes tienen consecuencias fatales.19 La causa más común de atragantamiento en adultos es la obstrucción de la vía aérea producida por alimentos.19 En niños y bebés, la mitad de los casos de atragantamiento notificados tienen lugar mientras el niño está comiendo, y los demás episodios de atragantamiento son provocados por objetos como monedas o juguetes.20 Las muertes por atragantamientos en bebés y niños de corta edad son poco frecuentes; en el Reino Unido, entre 1986 y 1995 se notificó una media de 24 muertes al año, y más de la mitad de esos niños tenían menos de un año.20 Como la mayoría de los casos de atragantamiento están relacionados con la comida, normalmente hay testigos. Por lo tanto, suele haber una oportunidad de intervención temprana mientras la víctima aún puede responder. Reconocimiento Como el reconocimiento de la obstrucción de la vía aérea es la clave del éxito del tratamiento es importante no confundir esta emergencia con un desmayo, infarto agudo de miocardio u otra dolencia que pueda provocar súbitamente dificultad respiratoria, cianosis o pérdida de conciencia. Los cuerpos extraños pueden causar una obstrucción leve o grave de la vía aérea. Los signos y síntomas que permiten diferenciar una obstrucción de la vía aérea grave de una leve se resumen en la Tabla 1. Es importante preguntar a la víctima consciente: “¿Te estás atragantando?” El atragantamiento tiene lugar comiendo; la víctima puede agarrarse el cuello. Secuencia de actuación en la OVACE (atragantamiento) de un adulto. Figura 2. Tratamiento obstrucción vía aérea por cuerpo extraño (ovace) en adulto Evaluar gravedad del cuadro Obstrucción aguda vía aérea (tos ineficaz) Inconsciente iniciar RCP Consciente 5 golpes interescapulares 5 compresiones abdominales Otros signos 34 1. Si la víctima muestra signos de obstrucción leve de la vía aérea - Dígale que siga tosiendo, pero que no haga nada más. 2. Si la víctima muestra signos de obstrucción grave de la vía aérea y está consciente - Dele hasta cinco golpes en la espalda, siguiendo estos pasos: • Colóquese a un lado y ligeramente por detrás de la víctima. • Sosténgale el tórax con una mano e incline bien a la víctima hacia delante, de manera que Obstrucción leve Puede hablar, toser, respirar Manejo Integral del paciente crítico Estimular la tos Continuar a evaluar el deterioro hacia una tos ineficaz o hasta que la obstrucción se haya resuelto Figura 2. Algoritmo de tratamiento de la obstrucción de la vía aérea de un adulto por cuerpo extraño. Tabla 1. Diferenciación entre una obstrucción grave o una leve de la vía aérea por un cuerpo extraño Signo Obstrucción leve vía aérea (tos eficaz) Obstrucción grave No puede respirar Respiración sibilante Intentos silenciosos de toser Inconsciencia en el caso de que se consiga movilizar el objeto que obstruye la vía aérea, lo expulse por la boca y no progrese más en la vía aérea. • Dele hasta cinco golpes interescapulares bruscos con el talón de su otra mano. - Compruebe si cada golpe en la espalda ha aliviado la obstrucción de la vía aérea. El objetivo es aliviar la obstrucción con cada golpe, y no necesariamente dar los cinco. - Si, tras dar los cinco golpes en la espalda, no se ha conseguido aliviar la obstrucción de la vía aérea, dé hasta cinco compresiones abdominales, siguiendo estos pasos: • Colóquese tras la víctima y rodéela con los brazos por la parte alta del abdomen. • Inclínela hacia delante. • Cierre el puño y colóquelo entre el ombligo y el apéndice xifoides. • Agarre el puño con su otra mano y tire con fuerza hacia dentro y hacia arriba. • Repítalo hasta cinco veces. - Si la obstrucción persiste, continúe alternando cinco golpes en la espalda con cinco compresiones abdominales. 3. Si la víctima se queda inconsciente en algún momento. - Tienda a la víctima con cuidado en el suelo. - Active inmediatamente los sistemas médicos de emergencia - Comience con la RCP Los profesionales en salud con ex- periencia en percibir el pulso carotídeo deberían iniciar el masaje cardiaco incluso cuando la víctima de atragantamiento inconsciente tiene pulso. OVACE que produce una ligera obstrucción de la vía aérea. La tos genera presiones altas y sostenidas en la vía aérea, y puede expulsar el cuerpo extraño. Un tratamiento enérgico, con golpes en la espalda, compresiones abdominales y masajes cardiacos puede provocar complicaciones potencialmente serias y empeorar la obstrucción de la vía aérea. Se debe reservar para las víctimas que muestran signos de una obstrucción grave de la vía aérea. Las víctimas con una obstrucción leve de las vías respiratorias deben continuar en observación hasta que mejoren, ya que esa obstrucción puede convertirse en grave. Ovace que produce una obstrucción grave de la vía aérea Los datos clínicos sobre el atragantamiento son, en gran medida, retrospectivos y anecdóticos. Para los adultos conscientes y los niños de más de un año con una OVACE completa, los informes demuestran la eficacia de los golpes interescapulares, las compresiones abdominales y torácicas.21 Aproximadamente un 50% de casos de obstrucción de la vía aérea no se recuperan utilizando una sola técnica.22 La probabilidad de éxito aumenta combinando los golpes interescapulares con las compresiones abdominales y torácicas.21 Un estudio aleatorizado en cadáveres23 y dos estudios prospectivos en voluntarios anestesiados24,25 han demostrado que se pueden generar mayores presiones en la vía aérea por medio de compresiones torácicas que con las compresiones abdominales. Puesto que las compresiones torácicas son prácticamente idénticas a las utilizadas en la RCP, se debe enseñar a los reanimadores a comenzar una RCP si la víctima probable o comprobada de OVACE se queda inconsciente. Durante la RCP, cada vez que se abra la vía aérea se debe comprobar si hay algún Manejo Integral del paciente crítico 35 cuerpo extraño en la boca de la víctima que se haya expulsado parcialmente. La incidencia de un atragantamiento inadvertido como causa de inconsciencia o parada cardiaca es baja; por lo tanto, no es necesario comprobar habitualmente que no hay cuerpos extraños en la boca cada vez que se haga una RCP. Limpieza manual de la cavidad oral Ningún estudio ha evaluado el uso habitual del dedo para despejar la vía aérea cuando no hay una obstrucción visible,26-28 y se han documentado reportes de casos en que la víctima 26,28 o su reanimador han resultado lesionados.21 En consecuencia, se ha de evitar el uso del dedo a ciegas, y extraer manualmente materiales sólidos de la vía aérea sólo si son visibles. Atención posterior y revisión médica Tras el tratamiento con éxito de una OVACE es posible que queden cuerpos extraños en el tracto respiratorio superior o en el inferior que provoquen complicaciones posteriores. Las víctimas que tengan una tos persistente, dificultad para tragar o la sensación de que tienen todavía un objeto alojado en la garganta, deberían consultar a un médico. Las compresiones abdominales pueden provocar graves daños internos, y todas las víctimas tratadas con ellos deberían ser examinadas por un médico en busca de posibles lesiones.21 ABCD secundario Vía aérea y ventilación Durante el tratamiento de un paro cardiaco, cerciórese de que se analicen las causas reversibles (6 H y 6 T) y corríjalas si las identifica. Tradicionalmente en el inicio del ABCD secundario se indicaba la colocación de un tubo endotraqueal. Durante este 36 Manejo Integral del paciente crítico periodo alguien diferente al reanimador que está ventilando debe verificar los equipos, la succión, la fuente de oxígeno, los tubos endotraqueales, los equipos alternos para manejo de vía aérea, el laringoscopio. Recuerde mantener una presión cricoidea adecuada si se dispone de un reanimador adicional. La intubación endotraqueal proporciona la vía aérea más segura, pero sólo se debe realizar en caso de que el profesional sanitario esté debidamente formado en dicha técnica y tenga experiencia. El tubo endotraqueal fue considerado el dispositivo de elección para manejo de la vía aérea por la posibilidad de succionar la tráquea, suministrar medicamentos y proteger contra la broncoaspiracion. Actualmente las guías del 2005 en RCP dicen:29 “El tubo endotraqueal fue una vez considerado el método óptimo para manejar la vía aérea durante el paro cardiaco; sin embargo, está ahora claro que la incidencia de complicaciones es inaceptablemente alta cuando se realiza por personal sin experiencia o cuando no sea posible la monitorización adecuada de la colocación de este dispositivo”. El personal experto en el manejo avanzado de la vía aérea debería intentar realizar la laringoscopia sin interrumpir las compresiones torácicas; quizá sea necesario hacer una breve pausa en las compresiones torácicas cuando se pasa el tubo por las cuerdas vocales. Como alternativa, para evitar la interrupción de las compresiones torácicas se puede retrasar la intubación hasta que se recupere la circulación espontánea. Los intentos de intubación no deberían durar más de 30 segundos: si no se ha realizado la intubación transcurrido ese tiempo, vuelva a comenzar con la ventilación bolsa-mascarilla. Tras la intubación, confirme que la posición del tubo es correcta y fíjelo bien. Recuerde que ya no existe la verificación primaria y secundaria sino verificación, que incluye signos clínicos y utilización de detectores de CO2 exhalado o dispositivos autoinflables. (Figura 3). Figura 3. Sistemas para verificar intubacion. Detector calorimétrico de CO2 a la izquierda, Capnografía/capnometría a la derecha. En la parte inferior sistemas de bulbo autoinflable y jeringa. Una vez intubada la tráquea del paciente, continúe con las compresiones torácicas, a un ritmo de 100 por minuto, sin pausas durante la ventilación. Ventile al paciente a 10 respiraciones por minuto; no hiperventile. Una pausa en las compresiones torácicas produce un descenso significativo de la presión de perfusión coronaria. Al reanudar las compresiones hay una demora hasta que se restaura la presión de perfusión coronaria original, por lo tanto, las compresiones torácicas que no se interrumpen por la ventilación mantienen una presión de perfusión coronaria media sustancialmente más alta. Si no hay personal experto en intubación endotraqueal, otras alternativas aceptables son: el combitubo, la máscara laríngea (Convencional, ProSeal o Fastrach), o el tubo laríngeo (Figura 4). Una vez que se ha insertado uno de estos dispositivos, intente proporcionar compresiones torácicas continuas e ininterrumpidas durante la ventilación. Si hay una fuga excesiva de gas, que provoca la ventilación inadecuada del paciente, habrá que interrumpir las compresiones torácicas para permitir la ventilación (utilizando un ritmo de compresión – ventilación de 30:2). Durante las compresiones torácicas continuas, ventile al paciente a 10 respiraciones por minuto. Si se colocó un dispositivo alterno para manejo de la vía aérea (combitubo, máscara laríngea o tubo laríngeo), se debe recordar que éste no constituye una vía aérea definitiva y en caso de que el paciente requiera ventilación mecánica luego del regreso a la circulación espontánea, el dispositivo debe ser cambiado por un tubo endotraqueal por personal experto en el manejo de la vía aérea. Manejo Integral del paciente crítico 37 Conclusiones Máscaras laríngeas; de izquierda a derecha • Fastrach® • Convencional • Pro-seal® Combitubo Figura 4. Dispositivos supraglóticos 38 Tubo laríngeo Manejo Integral del paciente crítico Durante los primeros minutos del paro la prioridad es garantizar adecuadas compresiones cardiacas, interrumpiéndolas lo mínimo posible para ventilar a los pacientes. Cuando se realiza manejo avanzado, la colocación de dispositivos como el tubo endotraqueal no debe implicar retardo en el masaje cardiaco. Es importante entrenar a los equipos de reanimación básica en la colocación de dispositivos alternos para el manejo de la vía aérea, y reservar la intubación endotraqueal para que sea realizada por personal experto en el manejo de la vía aérea, debido a la incidencia inaceptablemente alta de complicaciones asociadas con este procedimiento cuando se realiza por personal inexperto. Bibliografía 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. Heilman KM, Muschenheim C. Primary cutaneous tuberculosis resulting from mouth-tomouth respiration. N Engl J Med 1965;273:1035—6. Christian MD, Loutfy M, McDonald LC, et al. Possible SARS coronavirus transmission during cardiopulmonary resuscitation. Emerg Infect Dis 2004; 10:287—93. Cydulka RK, Connor PJ, Myers TF, Pavza G, Parker M. Prevention of oral bacterial flora transmission by using mouth-to-mask ventilation during CPR. J Emerg Med 1991;9:317—21. Blenkharn JI, Buckingham SE, Zideman DA. Prevention of transmission of infection during mouth-to-mouth resuscitation. Resuscitation 1990; 19:151—7. Aprahamian C, Thompson BM, Finger WA, Darin JC. Experimental cervical spine injury model: evaluation of airway management and splinting techniques. Ann Emerg Med 1984; 13:584—7. Bahr J, Klingler H, Panzer W, Rode H, Kettler D. Skills of lay people in checking the carotid pulse. Resuscitation 1997; 35:23—6. Kern KB, Hilwig RW, Berg RA, Sanders AB, Ewy GA. Importance of continuous chest compressions during cardiopulmonary resuscitation: improved outcome during a simulated single lay-rescuer scenario. Circulation 2002; 105:645—9. Handley JA, Handley AJ. Four-step CPR—– improving skill retention. Resuscitation 1998;36:3—8. Ornato JP, Hallagan LF, McMahan SB, Peeples EH, Rostafinski AG. Attitudes of BCLS instructors about mouth-to-mouth resuscitation during the AIDS epidemic. Ann Emerg Med 1990; 19:151—6. Hew P, Brenner B, Kaufman J. Reluctance of paramedics and emergency medical technicians to perform mouth-to mouth resuscitation. J Emerg Med 1997; 15:279—84. Baskett P, Nolan J, Parr M. Tidal volumen which are perceived to be adequate for resuscitation. Resuscitation 1996; 31:231—4. Aufderheide TP, Sigurdsson G, Pirrallo RG, et al. Hyperventilation-induced hypotension during cardiopulmonary resuscitation. Circulation 2004; 109:1960—5. Wenzel V, Idris AH, Banner MJ, Kubilis PS, Williams JLJ. Influence of tidal volume on the distribution of gas between the lungs and stomach in the nonintubated patient receiving positivepressure ventilation. Crit Care Med 1998; 26:364 — 8. Idris A, Gabrielli A, Caruso L. Smaller tidal volume is safe and effective for bag-valveventilation, but not for mouthto- mouth ventilation: an animal model for basic life support. Circulation 1999; 100(Suppl. I):I-644. 15. Winkler M, Mauritz W, Hackl W, et al. Effects of half the tidal volume during cardiopulmonary resuscitation on acidbase balance and haemodynamics in pigs. Eur J Emerg Med 1998; 5:201—6. 16. Eftestol T, Sunde K, Steen PA. Effects of interrupting precordial compressions on the calculated probability of S22 A.J. Handley et al. defibrillation success during out-of-hospital cardiac arrest. Circulation 2002; 105:2270—3. 17. Ruben H. The immediate treatment of respiratory failure. Br J Anaesth 1964; 36:542—9. 18. Fingerhut LA, Cox CS, Warner M International comparative analysis of injury mortality. Findings from the ICE on injury statistics. International collaborative effort on injury statistics. Adv Data1998; 12:1—20. 19. Industry DoTa. Choking. In: Home and leisure accident report. London: Department of Trade and Industry; 1998, p. 13—4. 20. Industry DoTa. Choking risks to children. London: Department of Trade and Industry; 1999. 21. International Liaison Committee on Resuscitation. Part 2. Adult basic life support. 2005 international consensus on cardiopulmonary resuscitation and emergency cardiovascular carescience with treatment recommendations. Resuscitation 2005; 67:187—200. 22. Redding JS. The choking controversy: critique of evidence on the Heimlich maneuver. Crit Care Med 1979;7:475—9. 23. Guildner CW, Williams D, Subitch T. Airway obstructed by foreign material: the Heimlich maneuver. JACEP 1976;5:675—7. 24. R u b e n H , M a c n a u g h t o n F I . T h e treatment of food-choking. Practitioner 1978;221:725—9. 25. Hartrey R, Bingham RM. Pharyngeal trauma as a result of blind finger sweeps in the choking child. J Accid Emerg Med 1995;12:52—4. 26. Elam JO, Ruben AM, Greene DG. Resuscitation of drowning victims. JAMA 1960;174:13—6. 27. Ruben HM, Elam JO, Ruben AM, Greene DG. Investigation of upper airway problems in resuscitation. 1. Studies of pharyngeal X-rays and performance by laymen. Anesthesiology 1961; 22:271—9. 28. Kabbani M, Goodwin SR. Traumatic epiglotis following blind finger sweep to remove a pharyngeal foreign body. Clin Pediatr (Phila) 1995;34:495—7. 29. International Liaison Committee on Resuscitation. 2005 International Consensus on Cardiopulmonary Resuscitation and Emergency Cardiovascular Care Science with Treatment Recommendations. Circulation. 2005; 112 suppl III Manejo Integral del paciente crítico 39 40 Manejo Integral del paciente crítico 4. Manejo de vía aérea en trauma MELINA AMAYA PANIAGUA MAURICIO VASCO RAMÍREZ Introducción La perfusión adecuada del sistema nervioso central y demás estructuras vitales determina el pronóstico en los pacientes con trauma múltiple, además de que disminuye el riesgo de complicaciones y de muerte. El mantenimiento de una vía aérea permeable y protegida, acompañada de una ventilación adecuada, debe tener prioridad sobre cualquier otra situación en el paciente politraumatizado. La vía aérea debe estar asegurada, el oxígeno correctamente suministrado, el apoyo ventilatorio adecuadamente proporcionado y como premisa garantizar una correcta estabilización y protección de la columna cervical. Las muertes tempranas evitables que ocurren por problemas en el manejo de la vía aérea se resumen en los siguientes aspectos: 1. Incapacidad para reconocer la necesidad de una vía aérea permeable. 2. Incapacidad para establecer una vía aérea. 3. Incapacidad para reconocer una vía aérea colocada en forma incorrecta. 4. Pérdida de una vía aérea colocada previamente. 5. Incapacidad para reconocer la necesidad de ventilar a un paciente. 6. Aspiración de contenido gástrico. Existen protocolos organizados que indican tratar al paciente politraumatizado por prioridades. Se destacan las recomendaciones del PHTLS (Prehospital Trauma Life Support), ATLS (Advanced Trauma Life Support), FENIX III (Trauma, Desastres y Medicina de Emergencias), y se debe emplear la logística del ABCDE, entendiendo la A como el manejo de la vía aérea con estabilización de la columna cervical. Sobre este aspecto nos referiremos en el presente capítulo. Un punto importante para resaltar es el uso de dispositivos de bioseguridad; siempre que tratemos a los pacientes debemos utilizar gafas, guantes y mascarillas. A. Estabilización de columna cervical Pacientes con alteración del estado de conciencia (Glasgow < 15), dolor cervical o deformidad anatómica evidente, mecanismo de trauma que sugiera lesión cervical, lesiones graves que impidan que el individuo pueda definir si su cuello está comprometido, o cualquier compromiso Manejo Integral del paciente crítico 41 de la columna cervical, requieren inmovilización cervical y posteriormente un collar cervical de talla adecuada, tabla espinal y soportes laterales con cintas de sujeción alrededor de la frente del paciente, como lo indica la Figura 1. E: Escuchar si la respiración es ruidosa. Presencia de ronquidos y estridor pueden alertar sobre lesiones laríngeas. El gorgoreo nos indica presencia de secreciones o cuerpo extraño. S: Sentir dónde está localizada la tráquea, determine rápidamente si está en la línea media y si hay enfisema subcutáneo en el cuello. Estos signos llevan a tomar decisiones de intubar tempranamente al paciente con dispositivos especiales como fibra óptica o realizar traqueostomía antes de que desarrolle edema masivo del cuello con pérdida concomitante de la vía aérea. Idealmente, además de la monitoría clínica, los pacientes deben ser monitorizados con un dispositivo manual o automático para medir la presión arterial; realizárseles oximetría de pulso y electrocardiografía continua. Debe disponerse de detectores de CO2 espirado para confirmación de intubación endotraqueal. B. Técnicas para el mantenimiento de la vía aérea Figura 1. Alineación manual cervical. Estabilización cervical en tabla rígida Es muy importante la valoración inicial y la revaloración frecuente del paciente en busca de signos o síntomas sugestivos de compromiso de la vía aérea, ya que ésta puede ser de aparición gradual o recurrir en un paciente que inicialmente no tenía compromiso de dicha vía. En la valoración inicial podemos utilizar el algoritmo MES. M: Mirar si el paciente está agitado, estuporoso, cianótico, signos que pueden indicar hipoxemia o hipercarbia; el uso de músculos intercostales, taquipnea. Cuando están presentes son evidencia de compromiso de la vía aérea. 42 Manejo Integral del paciente crítico La causa más frecuente de obstrucción de la vía aérea cuando existen alteraciones de la conciencia es el desplazamiento posterior de la lengua, con obstrucción de la hipofaringe (Figura 2), por lo que se deben realizar las maniobras descritas a continuación y mantener en posición neutra la columna cervical. Figura 2. Obstrucción de la vía aérea en paciente inconsciente Elevación del mentón Los dedos de las manos se colocan debajo de la mandíbula y la traccionan hacia arriba con el fin de desplazarla hacia delante. Se aprovechan los pulgares para abrir la boca (Figura 3). Esta maniobra no debe generar hiperextensión del cuello. para retirarlos inmediatamente, o realizar barrido digital a ciegas sólo en población adulta inconsciente en busca de dichos cuerpos. En el caso de secreciones como sangre, saliva, material regurgitado del estómago, se debe contar con sistemas de aspiración adecuados para aclarar la vía aérea (Figura 5). Nunca se debe realizar barrido digital a ciegas en población pediátrica, por el riesgo de empujar el cuerpo extraño más lejos de donde está. Sólo retirar los cuerpos extraños con visualización directa en este grupo etario. Figura 3. Elevación del mentón 2. Levantamiento mandibular La maniobra de levantamiento mandibular permite permeabilizar la vía aérea por dos reanimadores y visualizar y extraer cuerpos extraños. Se debe asegurar la bioseguridad, pues evita ser mordido por el paciente (Figura 4). Figura 4. Levantamiento mandibular 3. Aspiración de secreciones, retiro de cuerpos extraños Cuando se realice la apertura bucal es importante visualizar el interior de la boca a fin de detectar cuerpos extraños (prótesis dentales, dientes fracturados, chicles…) Figura 5. Barrido digital y aspiración de secreciones en la vía aérea 4. Colocación de cánula orofaríngea Si con las maniobras previamente descritas no es posible permeabilizar la vía Manejo Integral del paciente crítico 43 aérea, se utilizan dispositivos con este fin. Entre las cánulas orofaríngeas disponemos de dos tipos en nuestro medio (Figura 6). Las cánulas orofaríngeas sólo deben ser usadas en paciente inconsciente, ya que de lo contrario pueden precipitar vómito al estimular su hipofaringe. Es importante no empujar la lengua hacia atrás en el intento de colocar la cánula, pues esto empeoraría la obstrucción de la vía aérea. El tamaño adecuado se obtiene al medir la cánula desde el borde de la boca hasta el lóbulo de la oreja (Figura 7a). 5. Colocación de cánula nasofaríngea Éste es un dispositivo diseñado para permeabilizar la vía aérea al ser insertado por uno de los orificios nasales y pasar por la parte posterior de la nasofaringe y la orofaringe (Figura 7b). Se puede utilizar en paciente consciente al ser mejor tolerada que la orofaríngea, y no se debe usar en pacientes con sospecha de fracturas de base de cráneo ni en pacientes embarazadas. Su complicación más frecuente es el sangrado nasal por mala lubricación o por inserción traumática. El tamaño ideal se obtiene al medir con la cánula la distancia entre el orificio nasal y el lóbulo de la oreja (Figura 7b). Figura 7a Figura 7b Figura 7. Tamaño adecuado de cánula orofaringea y nasofaringea. 6. Suministro de oxígeno suplementario Figura 6. Cánulas orofaríngeas Guedel (arriba) y Berman (abajo) 44 Manejo Integral del paciente crítico Todo paciente con trauma significativo debe recibir oxígeno por sistemas que permitan suministrar la FiO2 por encima del 85%. Ésto lo logramos con la utilización de máscaras de no reinhalación con reservorio (Figura 8) en pacientes que tengan ventilación espontánea adecuada. Si el individuo tiene un patrón respiratorio inadecuado luego de realizar las maniobras básicas iniciales [como apnea, frecuencia ventilatoria < 12 por minuto o frecuencia ventilatoria por encima de 30 por minuto asociado a transtornos de la oxigenación como alteraciones del sensorio, cianosis o saturación de oxígeno (SpO2) por debajo de 90%] requiere soporte ventilatorio con un dispositivo BVM (Bolsa-válvula-mascarilla) (Figura 9), mientras se busca y se trata la causa del deterioro respiratorio. distensión gástrica por presión excesiva al apretar la bolsa. Representa un coadyuvante importante en la asistencia ventilatoria o en el soporte de pacientes apneicos por su cuadro de base o por efectos farmacológicos (sedación, parálisis neuromuscular) cuando se van a realizar maniobras de intubación endotraqueal (Figura 9). Figura 9. Dispositivo Bolsa-Válvula-Máscara C. Vía aérea definitiva Figura 8. Máscara de no reinhalación con bolsa reservorio 7. Dispositivo Bolsa –Válvula-Mascarilla (BVM) El dispositivo BVM consiste de una bolsa autoinflable con un volumen para adultos de hasta 1600 cc, para neonatos de 250 cc y para niños de 450-500 cc, que se conecta a una fuente de oxígeno con un reservorio que permite proporcionar FiO2 mayores del 90%. No son sencillas de utilizar por una sola persona; requieren entrenamiento, sobre todo para sellar correctamente la máscara facial para brindar volúmenes corrientes adecuados y no generar sobre- Una vía aérea definitiva implica la presencia en la tráquea de un tubo con balón inflado. El tubo va conectado a alguna forma de ventilación asistida rica en oxígeno; la vía aérea, asegurada en su sitio con cinta adhesiva o suturas. Las vías aéreas definitivas son tres: la intubación endotraqueal, la intubación nasotraqueal y la vía aérea quirúrgica (cricotiroidotomía o traqueostomía). Indicaciones de vía aérea definitiva 1. Trauma craneoencefálico con escala de Coma Glasgow < 8. 2. La presencia de apnea. 3. Protección de la aspiración pulmonar de sangre o vómito. 4. Compromiso inminente o potencial de obstrucción de vía aérea. Manejo Integral del paciente crítico 45 Quemados Lesiones graves por inhalación Fracturas faciales graves Hematoma creciente en el cuello Traumas en el cuello asociados a disfonía, estridor, enfisema subcutáneo 5. Incapacidad de mantener oxigenación y ventilación adecuadas con maniobras iniciales (apertura bucal, tracción mandibular, colocación de cánulas oronasofaríngeas, ventilación asistida por BVM). Lista de chequeo cuando se considera vía aérea definitiva 1. Asegurar disponibilidad y funcionamiento del siguiente equipo: a. Suministro de oxígeno. b. BVM del tipo y tamaño adecuados. c. Mascarilla de no reinhalación en el paciente. d. Laringoscopio en función y con valvas adecuadas. e. Cánulas orofaríngeas del tamaño correcto. f. Tubos endotraqueales en los diámetros requeridos, manguito probado. g. Equipo de vía aérea para manejo alterno si falla la vía aérea definitiva. h. Medicamentos con sus dosis y efectos adversos conocidos. i. Equipos de succión activos. j. Materiales para fijación de la vía aérea definitiva. k. Monitores de presión arterial, pulso, oximetría y EKG conectados al paciente. l. Servicio de anestesiología presente o en camino. 2. Dos líneas venosas de calibre 14 ó 16, permeables. 3. Preoxigenación durante tres minutos. 4. Considerar uso de sedantes y relajantes musculares en paciente consciente. 46 Manejo Integral del paciente crítico 5. Realizar inducción de secuencia rápida (ISR). 6. Confirmar la posición del tubo endotraqueal inflado y fijarlo. 7. En caso de dificultad para la intubación considerar planes alternos. 8. Completar ABCD primario y secundario. 9. Disponibilidad de líquidos y vasopresores. 10. Traslado para manejo definitivo. Cuando el manejo de la vía aérea no es emergente es muy importante aclarar la columna cervical antes de que el paciente sea intubado o llevado a cirugía. El médico de urgencias o el especialista deben ordenar radiografías de columna cervical, AP, lateral y proyección de odontoides cuando el paciente reúna las siguientes condiciones: • Alteración del estado de conciencia (Glasgow < 15). • Dolor cervical en la línea media posterior o deformidad anatómica evidente. • Mecanismo de trauma que sugiera lesión cervical. • Lesiones graves distantes del cuello que impidan al paciente definir compromiso cervical. Por favor, si la cirugía no es emergente no envíen a los pacientes a cirugía sin aclarar la columna cervical. Intubación nasotraqueal Se ha considerado tradicionalmente como el método más seguro en pacientes con sospecha de fractura cervical, o en los que el acceso a la tráquea por vía oral es imposible. Durante mucho tiempo ha sido el método utilizado con mayor frecuencia por los sistemas de paramédicos, esencialmente en pacientes con ventilación espontánea. No se recomienda en pacientes apneicos, con fracturas del tercio medio de la cara y fracturas de base de cráneo por el riesgo de que termine el tubo en el cerebro por una falsa ruta. Se requiere estar muy familiarizado con la técnica y no se recomienda para uso habitual por inexpertos. Su complicación más común es el sangrado local, que en un paciente con vía aérea ya comprometida puede empeorar la situación. coordinación del médico especialista, en este caso el anestesiólogo, o de otra persona con entrenamiento adecuado. Intubación orotraqueal La realización de este procedimiento en pacientes despiertos, agitados y combativos se asocia a grandes riesgos como vómito, broncoaspiración, trauma adicional en la vía aérea, dificultades técnicas para que el procedimiento sea efectivo e inestabilidad hemodinámica, principalmente hiperactividad adrenérgica. Todos estos eventos pueden afectar de manera negativa el pronóstico del paciente con una medida que en teoría sería benéfica, por lo cual se recomienda la utilización de coadyuvantes farmacológicos. Cuando la técnica se realiza sólo con agentes sedantes (benzodiacepinas, barbitúricos, etomidato) se denomina intubación asistida con sedación, y es exitosa en alrededor del 70% de los casos. Cuando esta técnica se utiliza con agentes sedantes y relajantes neuromusculares se denomina inducción de secuencia rápida, y tiene las mayores tasas de éxito, superiores al 95%, sin efectos adversos, excepto cuando se emplea por personal inexperto que no es capaz de detectar una intubación fallida, o no se dispone de dispositivos de respaldo en caso de detectarla. Cuando el paciente se somete a estabilización manual de columna cervical para el procedimiento y se realiza preoxigenación, presión cricoidea e intubación endotraqueal y se administran coadyuvantes farmacológicos se completa el estándar de manejo de la vía aérea en trauma (Figura 10). De esta manera se debe desarrollar, siempre con la Figura 10. Inducción de secuencia rápida. Estabilización manual cervical. Presión cricoidea Inducción de secuencia rápida o ágil Tiene como componentes: estabilización manual de la columna cervical, preoxigenación, presión cricoidea, coadyuvantes farmacológicos e intubación endotraqueal. Se considera actualmente el estándar de oro para manejo de la vía aérea en trauma. Se debe efectuar, en la medida de lo posible, con la coordinación del médico especialista, en este caso el anestesiólogo, o de otra persona con entrenamiento adecuado. Debemos recordar que el uso de medicamentos para mejorar las condiciones durante las maniobras de laringoscopia e intubación (inducción de secuencia rápida o ágil) no está permitido para personal no médico en nuestra legislación. Además, no es clara la evidencia que favorezca la utilización de fármacos en el área prehospitalaria con este fin para disminuir las complicaciones; por el contrario, se comprobó que aumentó la morbimortalidad (neumonía, ventilación mecánica prolongada, déficit neurológico) cuando los fármacos fueron administrados por personal no experto. 1. Preoxigenación: Utilización de dispositivo BVM a 12 l por minuto durante tres Manejo Integral del paciente crítico 47 minutos. Ante urgencia extrema, cuatro ventilaciones a capacidad inspiratoria máxima por parte del paciente, si este es capaz. 2. Premedicación: Se utilizan fármacos que brinden profilaxis contra la broncoaspiración de contenidos gástricos, proquinéticos y anti H2. Los más usados son metoclopramida de 10 mg IV, y ranitidina de 50 mg IV. Se aplican durante la preoxigenación o antes, si es posible. No se recomienda el uso habitual de atropina, excepto en menores de seis años ( vagotónicos), ni la utilización de dosis de precurarización, cebamiento o dosis prima. 3. Coadyuvantes: Agentes usados para atenuar la respuesta simpática a la laringoscopia e intubación. Los más utilizados son lidocaína intravenosa (1mg - 1,5 mg por kg): busca disminuir la posibilidad de arritmias, el reflejo de tos y la presión intracraneana (evidencia II). Actualmente su uso es muy discutido. Citrato de fentanilo intravenoso (2-10µg por kg): agente analgésico opióide, duración: 30 - 40 minutos. Inicia su acción a los 90 segundos. Atenúa la hipertensión y la taquicardia, al producir hipotensión leve y bradicardia. Puede presentar complicaciones, como rigidez muscular, especialmente torácica (tórax leñoso). Es el más utilizado actualmente 4. Inductores: Son los encargados de inducir pérdida de la conciencia. Deben ser usados de manera juiciosa y titulada para evitar efectos adversos, en especial colapso hemodinámico y paro cardíaco. Los más empleados en orden de frecuencia y disponibilidad son: Tiopental sódico intravenoso (3mg – 5mg por kg): barbitúrico de acción ultracorta (5 - 10 minutos) sin propiedades analgésicas ni amnésicas. Inicia su acción a los 30 segundos. Recomendado en pacientes 48 Manejo Integral del paciente crítico con TCE sin hipotensión. Puede causar hipotensión grave, depresión respiratoria, laringoespasmo y broncoconstricción con aumento de secreciones. No se recomienda en pacientes con asma o reacción anafiláctica; se debe usar con mucha precaución en pacientes hipovolémicos y en una dosis menor: 0.5 - 1 mg/kg IV. Midazolam intravenoso (0,1 - 0,3 mg por kg): benzodiacepina de corta acción (30 minutos) con inicio a los 2 - 4 minutos. Produce depresión respiratoria e hipotensión, especialmente en pacientes ancianos. No tiene propiedades analgésicas. Recomendado en pacientes con TCE sin hipotensión, con las dosis más bajas. Inicio tardío. No se recomienda como agente único para inducción de secuencia rápida. Etomidato intravenoso (0,1 - 0,3 mg por kg): agente hipnótico y sedante no barbitúrico de corta acción (2 - 4 minutos). Tiene mínimo efecto hemodinámico y puede ser de elección en pacientes hipotensos. Se recomienda en pacientes con TCE, falla cardiaca, edema agudo de pulmón. Puede provocar insuficiencia suprarrenal con una sola dosis. Es importante conocer este efecto para diagnosticarlo y suplementar al paciente con corticoesteroides en caso de que se presente. Propofol intravenoso (1 – 3mg por kg): agente anestésico e hipnótico de corta acción (10 - 20 minutos). Inicia su efecto a los 20 segundos. Genera hipotensión marcada y depresión miocárdica. No produce analgesia. Ketamina intravenosa (1 - 2mg por kg): agente neuroléptico y anestésico disociativo (el paciente puede estar despierto, con amnesia y analgesia) de corta acción: 10 - 15 minutos. Inicia su acción antes de 60 segundos. Aumenta la presión arterial y la presión intracraneana. Es broncodilatador y puede aumentar las secreciones. No se recomienda en TCE. Puede usarse en pacientes hipotensos y es de elección en asmáticos y anafilaxia. Debe usarse con precaución en IAM y en pacientes intoxicados con sicoactivos (en especial cocaína). Es el único agente inductor analgésico. 5. Relajación neuromuscular: Se realiza luego de la inducción. En esta fase se pueden utilizar los siguientes medicamentos: Succinilcolina (1 – 2mg por kg): relajante despolarizante de corta acción (5 – 10 minutos). Es el relajante por excelencia en los protocolos de inducción de secuencia rápida, ya que si la intubación no es exitosa se tendrá control voluntario de la respiración en 5 – 10 minutos. Su efecto clínico se inicia de 35 – 60 segundos. Puede producir aumento de la presión intracraneana y efectos hemodinámicos diversos, pero principalmente la hiperkalemia hace que su uso en quemados, síndrome de aplastamiento, arritmias, hipotermia, enfermedad renal, sea controvertido. La lidocaína y la atropina, junto con la dosis despolarizante, pueden minimizar sus efectos secundarios. Existe un efecto adverso que ocurre en uno de cada 15.000 pacientes tratados con este medicamento y es la “hipertermia maligna”, que se manifiesta con hipertermia, acidosis metabólica, rabdomiolisis y coagulación intravascular diseminada. La mortalidad es casi del 100% en estos casos, en ausencia del dantroleno, que sería el medicamento de elección para tratar esta entidad. Necesita refrigeración. Bromuro de rocuronio intravenoso (0,6 – 1mg por kg): relajante no despolarizante de acción corta (15 – 20 minutos). Su efecto clínico se inicia en 45 – 60 segundos. Tiene efectos cardiovasculares mínimos y es el relajante de elección cuando hay contraindicación para la succinilcolina. Los siguientes relajantes neuromusculares no están indicados para intubación endotraqueal y su uso se reserva para mantenimiento de la relajación durante el transporte, especialmente en pacientes agitados y combativos, en los cuales las dosis adicionales de sedantes y analgésicos pueden comprometer su estado hemodinámico. En caso de requerirse para intubacion, estos relajantes deben ser usados con el criterio de secuencia inversa (aplicación del relajante neuromuscular tres minutos antes del agente inductor). Bromuro de vecuronio intravenoso (0,1 mg por kg): relajante no despolarizante de acción media (30 – 45 minutos). Inicia su efecto clínico a los 3 – 5 minutos. Tiene efectos cardiovasculares mínimos. Es una buena alternativa para relajación luego de intubar con succinilcolina. En caso de requerir una relajación prolongada puede mantenerse a dosis de 0,01 – 0,1 mg por kg (por dosis). Bromuro de pancuronio intravenoso (0,1mg por kg): relajante no despolarizante de acción larga (45 – 90 minutos). Su efecto clínico se inicia a los 3 – 6 minutos y presenta efectos hemodinámicos, como taquicardia e hipertensión. Por su larga duración se recomienda en estos protocolos como relajante de mantenimiento en transportes prolongados. La dosis de mantenimiento es de 0,1mg por kg (por dosis). Necesita refrigeración. Besilato de atracurio intravenoso (0,6 mg por kg): relajante no despolarizante de corta acción (25 – 30 minutos). Su acción se inicia a los 5 minutos y causa efectos cardiovasculares mínimos; llega a liberar histamina. Necesita refrigeración. Su dosis de mantenimiento es de 0,4 mg por kg (por dosis). Besilato de cisatracurio intravenoso (0,2 mg por kg): relajante no despolarizante de duración intermedia (30 minutos). Su acción se Manejo Integral del paciente crítico 49 inicia a los 5 minutos. Genera efectos cardiovasculares mínimos. No libera histamina. Necesita refrigeración. Su dosis de mantenimiento es de 0,05 mg por kg (por dosis). Dispositivos alternos Existen elementos adicionales, como los dispositivos de fibra óptica, de los cuales no se dispone de manera amplia en los servicios de urgencia, por lo que es indispensable tener y saber manejar los dispositivos supraglóticos en caso de no poseer destrezas en intubacion endotraqueal. Los más utilizados son: Combitubo El combitubo (Figura 11) es un dispositivo de doble luz, disponible sólo en dos tamaños: el 37F, para pacientes entre 120 – 180 cm, y el 41F, para pacientes de más de 180 cm. No está diseñado para uso pediátrico. Se inserta a ciegas abriendo la boca y se introduce hasta la marca de líneas negras (anillos) en la parte proximal. Éstos deben quedar en relación con los dientes. Se recomienda curvarlo 90° antes de la inserción. Es el elemento por excelencia para uso prehospitalario en personal no entrenado para intubación orotraqueal. Las tasas de éxito en un primer uso por parte de proveedores prehospitalarios están entre el 80% y el 90%; por tanto, es el más recomendado especialmente en escenarios complejos de rescate. La verificación y el monitoreo del paciente deben realizarse exactamente igual que en la intubación orotraqueal. Debe hacerse esta maniobra sólo en pacientes inconscientes sin reflejo nauseoso, por lo que no debe usarse medicamentos. Tubo laríngeo Es un dispositivo supraglótico para control de vía aérea que se coloca a ciegas. Tiene las mismas indicaciones del combi- 50 Manejo Integral del paciente crítico Figura 11. Combitubos 37 F- 41 F tubo; también posee puerto accesorio para aspiración y descompresión gástrica, pero presenta algunas ventajas sobre el combitubo: la misma jeringa infla los dos balones (Figura 12), y tiene solo un dispositivo de conexión, lo que simplifica el protocolo de verificación. Disponible en cinco tamaños, inclusive pediátricos, población en la cual no sirve el combitubo. Figura 12. Tubo laringeo Máscaras laríngeas Existen tres tipos: convencional, Proseal y Fast-track (Figura 13). La máscara convencional está formada por un componente laríngeo de silicona rodeado de un borde o anillo inflable. Va unida a un tubo estándar de 15 mm con adaptador compatible a sistemas de ventilación aérea y sirve de conducto para la intubación orotraqueal a ciegas. Recibe tubos de mayor diámetro que las máscaras laríngeas convencionales de igual número. No se debe dejar colocada durante largo tiempo debido a que el conductor metálico ejerce mucha presión sobre la mucosa faríngea y puede llevar a isquemia o necrosis. Vía aérea quirúrgica Figura 13. Máscaras laríngeas; de izquierda a derecha, Fast-track, Convencional y Proseal BVM o circuitos de ventilación mecánica. Se inserta a ciegas, con la apertura hacia la lengua y ubicados en la parte posterior del paciente. La línea negra sobre el tubo debe estar siempre en la línea media y en el campo visual de quien la inserta. Viene en diferentes tamaños, de acuerdo con la edad desde uno hasta seis (Tabla 1) Tabla 1. Máscara laríngea convencional. Cálculo del tamaño y volumen a inflar. Tamaño 1 1.5 2 2.5 3 4 5 6 Peso recomendado Niños hasta 5 kg Niños 5 a 10 kg Niños 10 a 20 kg Niños 20 a 30 kg Niños 30 a 50 kg Adultos 50 a 70 kg Adultos 70 a 100 kg Adultos > de 100 kg cc de aire para inflarlas 4 cc 7 cc 10 cc 14 cc 20 cc 30 cc 40 cc 50 cc La máscara laringea Proseal dispone de un puerto accesorio por donde podemos pasar una sonda para descompresión y aspiración gástrica, con la ventaja adicional de que permite ventilar con presiones positivas más altas que la máscara laríngea convencional. Viene en tamaños 3 y 4 para uso en adultos. La máscara laríngea de intubación Fast-track permite permeabilizar la vía Ventilación transtraqueal a presión percutánea. No es una vía aérea definitiva (Cricotiroidotomía percutánea) Consiste en la inserción, durante situaciones de emergencia, de una aguja de calibre 14 en la membrana cricotiroidea dentro de la tráquea para suministrar oxígeno por una fuente que provea 15 l/min, ya sea con un conector en Y o una manguera con orificio lateral (Figura 14), ocluyendo el orificio un segundo y dejándolo sin ocluir durante cuatro segundos. Ésto permite oxigenación durante 30 – 40 minutos, pero lleva a retención importante de CO2. No debe ser utilizado cuando haya obstrucciones de la glotis por el riesgo de barotrauma. CM H TC CC Figura 14. Ventilación transtraqueal Cricotiroidotomía quirúrgica Se hace una incisión horizontal en la piel hasta la membrana cricotiroidea Manejo Integral del paciente crítico 51 (Figura 15). Se puede utilizar una pinza hemostática para dilatación y posteriormente se introduce un tubo endotraqueal tamaño 5 – 7 ID o cánula de traqueostomía con manguito. No se realiza en menores de 12 años. Figura 16. Apertura glótica, visualización de cuerdas vocales Figura 15. Cricotiroidotomía quirúrgica Es importante recordar que luego de este procedimiento se debe inmovilizar nuevamente el cuello con collar de Filadelfia, además de suministrar oxígeno y apoyo ventilatorio. Traqueostomía Este procedimiento no se considera urgente, ya que requiere disección y hemostasia adecuadas de todos los planos hasta llegar a la tráquea. Además, necesita hiperextensión para la apropiada exposición de los anillos traqueales, lo que pondría en riesgo al paciente de potenciales secuelas por compromiso cervical. Se realiza cuando al paciente se le resolvió la urgencia con ventilación transtraqueal o cricotiroidotomía. Confirmación de vía aérea definitiva El único método que asegura la correcta colocación del tubo endotraqueal es la visualización directa de éste al entrar en la glotis (Figura 16). Cuando no es posible visualizar la entrada del tubo a la tráquea se debe 52 Manejo Integral del paciente crítico confirmar su colocación adecuada con métodos complementarios (Figura 17). Los más utilizados son los detectores de CO2 espirado. Hay dispositivos de construcción manual, como el bulbo autoinflable, que generan una fuerza de aspiración en el extremo traqueal del tubo cuando el operador comprime completamente una pera de goma flexible para aspiración. La pera, una vez comprimida, se une firmemente al extremo del tubo que sale por la boca y después se libera la presión. Si el tubo está en el esófago se aspirará mucosa esofágica contra el extremo distal del detector, lo que impedirá la reexpansión de la pera. Si el tubo está en la tráquea los anillos traqueales no dejan colapsar la pera, por lo tanto esta se reexpande y confirma la intubación traqueal. Figura 17. Sistemas para verificar intubación Detector colorimétrico de CO2 a la izquierda; capnografía/capnometría a la derecha. En la parte inferior, sistemas de bulbo autoinflable y jeringa. Conclusiones La prioridad no es intubar a un paciente sino permeabilizar la vía aérea, inicialmente con maniobras básicas, y proteger la columna cervical. El suministro de oxígeno en concentraciones altas en la fase inicial de atención del paciente politraumatizado es esencial. Es necesario conocer las situaciones clínicas que pueden comprometer la vía aérea para tomar decisiones rápidas. El procedimiento de intubación requiere manejo multidisciplinario. No trabaje solo; verifique todo su equipo antes de empezar. Los dispositivos de detección esofágica son importantísimos, ya que una intubación esofágica no percibida es igual a la muerte del paciente. Si la cirugía no es emergente no debe enviarse a los pacientes a cirugía sin aclarar la columna cervical. Manejo Integral del paciente crítico 53 Bibliografía 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 54 Yates DW. Airway patency in fatal accidents. Br Med J. 1977; 2:1249 –1251. Anderson ID, Woodford M, de Dombal FT, et al. Retrospective study of 1000 deaths from injury in England and Wales. Br Med J (Clin Res Ed). 1988;296:1305–1308. Hussain LM, Redmond AD. Are prehospital deaths from accidental injury preventable? BMJ. 1994;308:1077–1080. Stocchetti N, Pagliarini G, Gennari M, et al. Trauma care in Italy: evidence of in-hospital preventable deaths. J Trauma. 1994;36:401– 405. Katsurada K, Yamada R, Sugimoto T. Respiratory insufficiency in patients with severe head injury. Surgery. 1973;73:191–199. Miller JD, Butterworth JF, Gudeman SK, et al. Further experience in the management of severe head injury. J Neurosurg. 1981; 54:289 –299. Eisenberg HM, Gary HE, Aldrich EF, et al. Initial CT findings in 753 patients with severe head injury: a report from the NIH Traumatic Coma Data Bank. J Neurosurg. 1990;73:688– 698. Gentleman D, Jennett B. Audit of transfer of unconscious head-injured patients to a neurosurgical unit. Lancet. 1990;335:330 –334. Chesnut RM, Marshall LF, Klauber MR, et al. The role of secondary brain injury in determining outcome from severe head injury. J Trauma. 1993;34:216 –222. Wald SL, Shackford SR, Fenwick J. The effect of secondary insults on mortality and long-term disability after severe head injury in a rural region without a trauma system. J Trauma. 1993;34:377–381. Johnson DL, Boal D, Baule R. Role of apnea in nonaccidental head injury. Pediatr Neurosurg. 1995;23:305–310. Stocchetti N, Furlan A, Volta F. Hypoxemia and arterial hypotension at the accident scene in head injury. J Trauma. 1996; 40:764 –767. Combes P, Fauvage B, Colonna M, et al. Severe head injuries: an outcome prediction and survival analysis. Intensive Care Med. 1996;22:1391–1395. Talucci RC, Shaikh KA, Schwab CW. Rapid sequence induction with oral endotracheal intubation in the multiply injured patient. Am Surg. 1988;54:185–187. Miklus RM, Elliott C, Snow N. Surgical cricothyrotomy in the field: experience of a helicopter transport team. J Trauma. 1989; 29:506 –508. Spaite DW, Joseph M. Prehospital cricothyrotomy: an investigation of indications, technique, complications, and patient outcome. Ann Emerg Med. 1990;19:279 –285. Manejo Integral del paciente crítico 17. Kuchinski J, Tinkoff G, Rhodes M, et al. Emergency intubation for paralysis of the uncooperative trauma patient. J Emerg Med. 1991; 9:9 –12. 18. Redan JA, Livingston DH, Tortella BJ, et al. The value of intubating and paralyzing patients with suspected head injury in the emergency department. J Trauma. 1991;31:371–375. 19. McBrien ME, Pollok AJ, Steedman DJ. Advanced airway control in trauma resuscitation. Arch Emerg Med. 1992;9:177–180. 20. Oswalt JL, Hedges JR, Soifer BE, et al. Analysis of trauma intubations. Am J Emerg Med. 1992;10:511–514. 21. Wright SW, Robinson GG, Wright MB. Cervical spine injuries in blunt trauma patients requiring emergent endotracheal intubation. Am J Emerg Med. 1992;10:104– 109. 22. Salvino CK, Dries D, Gamelli R, et al. Emergency cricothyroidotomy in trauma victims. J Trauma. 1993;34:503–505. 23. Xeropotamos NS, Coats TJ, Wilson AW. Prehospital surgical airway management: 1 year ’s experience from the Helicopter Emergency Medical Service. Injury. 1993;24:222–224. 24. Norwood S, Myers MB, Butler TJ. The safety of emergency neuromuscular blockade and orotracheal intubation in the acutely injured trauma patient. J Am Coll Surg. 1994;179:646 – 652. 25. Trupka A, Waydhas C, Nast-Kolb D, et al. Early intubation in severely injured patients. Eur J Emerg Med. 1994;1:1– 8. 26. Vilke GM, Hoyt DB, Epperson M, et al. Intubation techniques in the helicopter. J Emerg Med. 1994;12:217–224. 27. Boswell WC, McElveen N, Sharp M, et al. Analysis of prehospital pediatric and adult intubation. Air Med J. 1995;14:125–127. 28. Jacobson LE, Gomez GA, Sobieray RJ, et al. Surgical cricothyroidotomy in trauma patients: analysis of its use by paramedics in the field. J Trauma. 1996;41:15–20. 29. Fortune JB, Judkins DG, Scanzaroli D, et al. Efficacy of prehospital surgical cricothyrotomy in trauma patients. J Trauma. 1997;42:832– 836. 30. Winchell RJ, Hoyt DB. Endotracheal intubation in the field improves survival in patients with severe head injury: Trauma Research and Education Foundation of San Diego. Arch Surg. 1997;132:592–597. 31. Blostein PA, Koestner AJ, Hoak S. Failed rapid sequence intubation in trauma patients: esophageal tracheal combitube is a usefuladjunct. J Trauma. 1998;44:534 –537. 32. Sing RF, Rotondo MF, Zonies DH, et al. Rapid sequence induction for intubation by an 33. 34. 35. 36. 37. 38. 39. 40. 41. 42. 43. 44. 45. 46. aeromedical transport team: a critical analysis. Am J Emerg Med. 1998;16:598– 602. Eckstein M, Chan L, Schneir A, et al. Effect of prehospital advanced life support on outcomes of major trauma patients. J Trauma. 2000;48:643– 648. Sloane C, Vilke GM, Chan TC, et al. Rapid sequence intubation in the field versus hospital in trauma patients. J Emerg Med. 2000; 19:259 –264. Copass MK, Oreskovich MR, Bladergroen MR, et al. Prehospital cardiopulmonary resuscitation of the critically injured patient. Am J Surg. 1984;148:20 –26. O’Brien DJ, Danzl DF, Sowers MB, et al. Airway management of aeromedically transported trauma patients. J Emerg Med. 1988; 6:49 –54. Syverud SA, Borron SW, Storer DL, et al. Prehospital use of neuromuscular blocking agents in a helicopter ambulance program. Ann Emerg Med. 1988;17:236 –242. Gabram SG, Jacobs LM, Schwartz RJ, et al. Airway intubation in injured patients at the scene of an accident. Conn Med. 1989; 53:633– 637. Rhee KJ, Green W, Holcroft JW, et al. Oral intubation in the multiply injured patient: the risk of exacerbating spinal cord damage. Ann Emerg Med. 1990;19:511–514. Ligier B, Buchman TG, Breslow MJ, et al. The role of anesthetic induction agents and neuromuscular blockade in the endotracheal intubation of trauma victims. Surg Gynecol Obstet. 1991;173:477– 481. Meschino A, Devitt JH, Koch JP, et al. The safety of awake tracheal intubation in cervical spine injury. Can J Anaesth. 1992; 39:114 –117. Hsiao AK, Michelson SP, Hedges JR. Emergent intubation and CT scan pathology of blunt trauma patients with Glasgow Coma Scale scores of 3-13. Prehospital Disaster Med. 1993;8:229 –236. Rhee KJ, Muntz CB, Donald PJ, et al. Does nasotracheal intubation increase complications in patients with skull base fractures? Ann Emerg Med. 1993;22:1145–1147. Rhee KJ, O’Malley RJ. Neuromuscular blockade-assisted oral intubation versus nasotracheal intubation in the prehospital care of injured patients. Ann Emerg Med. 1994;23:37– 42. Falcone RE, Herron H, Dean B, et al. Emergency scene endotracheal intubation before and after the introduction of a rapid sequence induction protocol. Air Med J. 1996;15:163–167. Karch SB, Lewis T, Young S, et al. Field intubation of trauma patients: complications, indications, and outcomes. Am J Emerg Med. 1996;14:617– 619. 47. Leibovici D, Fredman B, Gofrit ON, et al. Prehospital cricothyroidotomy by physicians. Am J Emerg Med. 1997;15:91– 93. 48. Slater EA, Weiss SJ, Ernst AA, et al. Preflight versus en route success and complications of rapid sequence intubation in an air medical service. J Trauma. 1998;45:588 –592. 49. Vijayakumar E, Bosscher H, Renzi FP, et al. The use of neuromuscular blocking agents in the emergency department to facilitate tracheal intubation in the trauma patient: help or hindrance? J Crit Care. 1998;13:1– 6. 50. Thomas SH, Harrison T, Wedel SK. Flight crew airway management in four settings: a six-year review. Prehosp Emerg Care. 1999;3:310 –315. 51. Ochs M, Vilke GM, Chan TC, et al. Successful prehospital airway management by EMTDs using the combitube. Prehosp Emerg Care. 2000;4:333–337. 52. Symbas PN, Hatcher CR, Boehm GA. Acute penetrating tracheal trauma. Ann Thorac Surg. 1976;22:473– 477. 53. Carpintero JL, Rodriguez DA, Ruiz Elvira MJ, et al. Methods of management of flail chest. Intensive Care Med. 1980;6:217–221. 54. Dittmann M, Steenblock U, Kranzlin M, et al. Epidural analgesia or mechanical ventilation for multiple rib fractures? Intensive Care Med. 1982;8:89 –92. 55. McGill J, Clinton JE, Ruiz E. Cricothyrotomy in the emergency department. Ann Emerg Med. 1982;11:361–364. 56. Miller HA, Taylor GA, Harrison AW et al. Management of flail chest. Can Med Assoc J. 1983;129:1104 –1107. 57. Gussack GS, Jurkovich GJ. Treatment dilemmas in laryngotracheal trauma. J Trauma. 1988;28:1439–1444. 58. Reece GP, Shatney CH. Blunt injuries of the cervical trachea: review of 51 patients. South Med J. 1988;81:1542–1548. 59. Erlandson MJ, Clinton JE, Ruiz E, et al. Cricothyrotomy in the emergency department revisited. J Emerg Med. 1989;7:115–118. 60. Nugent WL, Rhee KJ, Wisner DH. Can nurses perform surgical cricothyrotomy with acceptable success and complication rates? Ann Emerg Med. 1991;20:367–370. 61. Boyle MF, Hatton D, Sheets C. Surgical cricothyrotomy performed by air ambulance flight nurses: a 5-year experience. J Emerg Med. 1993;11:41– 45. 62. Broos PL, D’Hoore A, Vanderschot P, et al. Multiple trauma in patients of 65 and over: injury patterns—factors influencing outcome: the importance of an aggressive care. Acta Chir Belg. 1993;93:126 –130. 63. Scannell G, Waxman K, Tominaga G, et al. Orotracheal intubation in trauma patients with cervical fractures. Arch Surg. 1993; 128:903–905. Manejo Integral del paciente crítico 55 64. Shearer VE, Giesecke AH. Airway management for patients with penetrating neck trauma: a retrospective study. Anesth Analg. 1993; 77:1135–1138. 65. Kollmorgen DR, Murray KA, Sullivan JJ, et al. Predictors of mortality in pulmonary contusion. Am J Surg. 1994;168:659 – 663. 66. Ahmed Z, Mohyuddin Z. Management of flail chest injury: internal fixation versus endotracheal intubation and ventilation. J Thorac Cardiovasc Surg. 1995;110:1676 –1680. 67. Hawkins ML, Shapiro MB, Cue JI, et al. Emergency cricothyrotomy: a reassessment. Am Surg. 1995;61:52–55. 68. Mandavia DP, Qualls S, Rokos I. Emergency airway management in penetrating neck injury. Ann Emerg Med. 2000;35:221–225. 69. Murray JA, Demetriades D, Berne TV, et al. Prehospital intubation in patients with severe head injury. J Trauma. 2000;49:1065– 1070. 70. Fischer RP, Flynn TC, Miller PW, et al. Urban helicopter response to the scene of injury. J Trauma. 1984;24:946 –951. 71. Anderson TE, Rose WD, Leicht MJ. Physician-staffed helicopter scene response from a rural trauma center. Ann Emerg Med. 1987; 16:58 – 61. 72. Baxt WG, Moody P. The impact of a physician as part of the aeromedical prehospital team in patients with blunt trauma. JAMA. 1987;257:3246 –3250. 73. Rose WD, Anderson LD, Edmond SA. Analysis of intubations: before and after establishment of a rapid sequence intubation protocol for air medical use. Air Med J. 1994;13:475– 478. 74. Gerich TG, Schmidt U, Hubrich V, et al. Prehospital airway management in the acutely injured patient: the role of surgical cricothyrotomy revisited. J Trauma. 1998;45:312–314. 75. Garner A, Rashford S, Lee A, et al. Addition of physicians to paramedic helicopter services decreases blunt trauma mortality. AustNZJ Surg. 1999;69:697–701. 76. Paul TR, Marias M, Pons PT, et al. Adult versus pediatric prehospital trauma care: is there a difference? J Trauma. 1999; 47:455– 459. 77. Jacobs LM, Sinclair A, Beiser A, et al. Prehospital advanced life support: benefits in trauma. J Trauma. 1984;24:8 –13. 78. Cwinn AA, Pons PT, Moore EE, et al. Prehospital advanced trauma life support for critical blunt trauma victims. Ann Emerg Med. 1987;16:399 – 403. 79. Spaite DW, Tse DJ, Valenzuela TD, et al. The impact of injury severity and prehospital procedures on scene time in victims of major trauma. Ann Emerg Med. 1991;20:1299 –1305. 56 Manejo Integral del paciente crítico 80. Rotondo MF, McGonigal MD, Schwab CW, et al. Urgent paralysis and intubation of trauma patients: is it safe? J Trauma. 1993; 34:242–246. 81. Dunham CM, Britt LD, Stene JK. Proceedings of the Eastern Association for the Surgery of Trauma Scientific Meeting, 1988: emergency tracheal intubation in the blunt-injured patient. Panam J Trauma. 1989;1:9 –12. 82. Cameron PA, Flett K, Kaan E, et al. Helicopter retrieval of primary trauma patients by a paramedic helicopter service. AustNZJ Surg. 1993;63:790–797. 83. Ghurye M, McQuillan PJ, Madden GJ, et al. Acute upper airway obstruction due to a ruptured vertebral artery caused by minor cervical trauma. Injury. 1992;23:424 – 425. 84. Meakem TD, Meakem TJ, Rappaport W. Airway compromise from prevertebral soft tissue swelling during placement of halo-traction for cervical spine injury. Anesthesiology. 1990;73:775–776. 85. Mazzon D, Zanatta P, Curtolo S, et al. Upper airway obstruction by retropharyngeal hematoma after cervical spine trauma: report of a case treated with percutaneous dilational tracheostomy. J Neurosurg Anesthesiol. 1998;10:237–240. 86. Kuhn JE, Graziano GP. Airway compromise as a result of retropharyngeal hematoma following cervical spine injury. J Spinal Disord. 1991;4:264 –269. 87. Lord SA, Boswell WC, Williams JS, et al. Airway control in trauma patients with cervical spine fractures. Prehospital Disaster Med. 1994;9:44 – 49. 88. Criswell JC, Parr MJ, Nolan JP. Emergency airway management in patients with cervical spine injuries. Anaesthesia. 1994;49:900 –903. 89. Shatney CH, Brunner RD, Nguyen TQ. The safety of orotracheal intubation in patients with unstable cervical spine fracture or high spinal cord injury. Am J Surg. 1995;170:676 – 679. 90. Bent JP, Silver JR, Porubsky ES. Acute laryngeal trauma: a review of 77 patients. Otolaryngol Head Neck Surg. 1993;109:441– 449. 91. Lawhorne TW, Jeyasingham K, Kieffer RF. Transection of the trachea secondary to blunt trauma. Br J Surg. 1978;65:176 –178. 92. Armstrong WB, Funk GF, Rice DH. Acute airway compromise secondary to traumatic thyroid hemorrhage. Arch Otolaryngol Head Neck Surg. 1994;120:427– 430. 93. Biby L, Santora AH. Prevertebral hematoma secondary to whiplash injury necessitating emergency intubation. Anesth Analg. 1990; 70:112–114. 94. Blaivas M, Hom DB, Younger JG. Thyroid gland hematoma after blunt cervical trauma. Am J Emerg Med. 1999;17:348 –350. 95. Cox RG. Retropharyngeal haematoma leading to airway obstruction in a child with closed head trauma. Paediatr Anaesth. 1998;8:353– 356. 96. Daniello NJ, Goldstein SI. Retropharyngeal hematoma secondary to minor blunt head and neck trauma. Ear Nose Throat J. 1994;73:41– 43. 97. McLauchlan CA, Pidsley R, Vandenberk PJ. Minor trauma–major problem: neck injuries, retropharyngeal haematoma and emergency airway management. Arch Emerg Med. 1991;8:135–139. 98. Mitchell RO, Heniford BT. Traumatic retropharyngeal hematoma: a cause of acute airway obstruction. J Emerg Med. 1995;13:165–167. 99. Myssiorek D, Shalmi C. Traumatic retropharyngeal hematoma. Arch Otolaryngol Head Neck Surg. 1989;115:1130 –1132. 100. Mace SE. Blunt laryngotracheal trauma. Ann Emerg Med. 1986; 15:836 – 842. 101. Trone TH, Schaefer SD, Carder HM. Blunt and penetrating laryngeal trauma: a 13year review. Otolaryngol Head Neck Surg. 1980;88:257–261. 102. Minard G, Kudsk KA, Croce MA, et al. Laryngotracheal trauma. Am Surg. 1992;58:181–187. 103. LeJeune FE. Laryngotracheal separation. Laryngoscope. 1978; 88:1956 –1962. 104. Harris HH, Tobin HA. Acute injuries of the larynx and trachea in 49 patients: observations over a 15-year period. Laryngoscope. 1970;80:1376 –1384. 105. Kaufman HJ, Ciraulo DL, Burns RP. Traumatic fracture of the hyoid bone: three case presentations of cardiorespiratory compromise secondary to missed diagnosis. Am Surg. 1999;65:877– 880. 106. Camnitz PS, Shepherd SM, Henderson RA. Acute blunt laryngeal and tracheal trauma. Am J Emerg Med. 1987;5:157–162. 107. Thompson JN, Strausbaugh PL, Koufman JA, et al. Penetrating injuries of the larynx. South Med J. 1984;77:41– 45. 108. Flynn AE, Thomas AN, Schecter WP. Acute tracheobronchial injury. J Trauma. 1989;29:1326 –1330. 109. Eggen JT, Jorden RC. Airway management, penetrating neck trauma. J Emerg Med. 1993;11:381–385. 110. Hirshberg A, Wall MJ, Johnston RH, et al. Transcervical gunshot injuries. Am J Surg. 1994;167:309 –312. 111. Hartmann PK, Mintz G, Verne D, et al. Diagnosis and primary management of laryngeal trauma. Oral Surg Oral Med Oral Pathol. 1985;60:252–257. 112. Mathisen DJ, Grillo H. Laryngotracheal trauma. Ann Thorac Surg. 1987;43:254 –262. 113. Levy RD, Degiannis E, Hatzitheophilou C, et al. Management of penetrating injuries of the cervical trachea. Ann R Coll Surg Engl. 1997;79:195–197. 114. Kelly JP, Webb WR, Moulder PV, et al. Management of airway trauma: I—tracheobronchial injuries. Ann Thorac Surg. 1985; 40:551–555. 115. Grewal H, Rao PM, Mukerji S, et al. Management of penetrating laryngotracheal injuries. Head Neck. 1995;17:494 –502. 116. Edwards WH, Morris JA, DeLozier JB, et al. Airway injuries: the first priority in trauma. Am Surg. 1987;53:192–197. 117. Sofferman RA. Management of laryngotracheal trauma. Am J Surg. 1981;141:412– 417. 118. Grover FL, Ellestad C, Arom KV, et al. Diagnosis and management of major tracheobronchial injuries. Ann Thorac Surg. 1979;28:384 – 391. 119. Herrin TJ, Brzustowicz R, Hendrickson M. Anesthetic management of neck trauma. South Med J. 1979;72:1102–1106. 120. Lambert GE, McMurry GT. Laryngotracheal trauma: recognition and management. JACEP. 1976;5:883–887. 121. Tung TC, Tseng WS, Chen CT, et al. Acute life-threatening injuries in facial fracture patients: a review of 1,025 patients. J Trauma. 2000;49:420 –424. 122. Seshul MB, Sinn DP, Gerlock AJ. The Andy Gump fracture of the mandible: a cause of respiratory obstruction or distress. J Trauma. 1978;18:611– 612. 123. Morrissette MP, Chewning LC. Rapid airway compromise following traumatic laceration of the facial artery. J Oral Maxillofac Surg. 1990;48:989 –990. 124. Steinig JP, DeLoach ED, Boyd CR. Transection of the base of the tongue caused by penetrating injury. Am Surg. 1999;65:133–134. 125. McIntosh GC, Steadman RK, Gross BD. Aspiration of an unerupted permanent tooth during maxillofacial trauma. J Oral Maxillofac Surg. 1982;40:448 – 450. 126. Heggie AA, Walker JD. Traumatic pharyngeal displacement of a full maxillary denture: case report. J Oral Maxillofac Surg. 1989; 47:1208 –1210. 127. Chase CR, Hebert JC, Farnham JE. Posttraumatic upper airway obstruction secondary to a lingual artery hematoma. J Trauma. 1987;27:953–954. 128. Rosen CL, Wolfe RE, Chew SE, et al. Blind nasotracheal intubation in the presence of facial trauma. J Emerg Med. 1997; 15:141–145. 129. Rose J, Valtonen S, Jennett B. Avoidable factors contributing to death after head injury. Br Med J. 1977;2:615– 618. Manejo Integral del paciente crítico 57 130. Gentleman D, Jennett B. Hazards of interhospital transfer of comatose head-injured patients. Lancet. 1981;2:853– 854. 131. Clark WR, Bonaventura M, Myers W, et al. Smoke inhalation and airway management at a regional burn unit: 1974 to 1983. II— airway management. J Burn Care Rehabil. 1990;11:121–134. 132. Bingham HG, Gallagher TJ, Powell MD. Early bronchoscopy as a predictor of ventilatory support for burned patients. J Trauma. 1987;27:1286 –1288. 133. Rue LW III, Cioffi WG, Mason AD, et al. Improved survival of burned patients with inhalation injury. Arch Surg. 1993;128:772– 778. 134. DiVincenti FC, Pruitt BA, Reckler JM. Inhalation injuries. J Trauma. 1971;11:109 –117. 135. Herndon DN, Barrow RE, Linares HA, et al. Inhalation injury in burned patients: effects and treatment. Burns Incl Therm Inj. 1988; 14:349 –356. 136. Peitzman AB, Shires GT, Teixidor HS, et al. Smoke inhalation injury: evaluation of radiographic manifestations and pulmonary dysfunction. J Trauma. 1989;29:1232–1238. 137. Muehlberger T, Kunar D, Munster A, et al. Efficacy of fiberoptic laryngoscopy in the diagnosis of inhalation injuries. Arch Otolaryngol Head Neck Surg. 1998;124:1003–1007. 138. Hantson P, Butera R, Clemessy JL, et al. Early complications and value of initial clinical and paraclinical observations in victims of smoke inhalation without burns. Chest. 1997;111:671– 675. 139. Fry WA, Semerdjian RA. Inhalation injury: evaluation and management in a burn unit. Ann Otol Rhinol Laryngol. 1977; 86:667– 670. 140. Moylan JA, Adib K, Birnbaum M. Fiberoptic bronchoscopy following thermal injury. Surg Gynecol Obstet. 1975;140:541–543. 141. Hunt JL, Agee RN, Pruitt BA Jr. Fiberoptic bronchoscopy in acute inhalation injury. J Trauma. 1975;15:641– 649. 142. O’Hickey SP, Pickering CA, Jones PE, et al. Manchester air disaster. Br Med J (Clin Res Ed). 1987;294:1663–1667. 143. Haponik EF, Meyers DA, Munster AM, et al. Acute upper airway injury in burn patients: serial changes of flow-volume curves and nasopharyngoscopy. Am Rev Respir Dis. 1987;135:360 –366. 144. Murphy-Macabobby M, Marshall WJ, Schneider C, et al. Neuromuscular blockade in aeromedical airway management. Ann Emerg Med. 1992;21:664 – 668. 145. Dolin J, Scalea T, Mannor L, et al. The management of gunshot wounds to the face. J Trauma. 1992;33:508 –514. 146. Bartlett RH, Niccole M, Tavis MJ, et al. Acute management of the 58 Manejo Integral del paciente crítico upper airway in facial burns and smoke inhalation. Arch Surg. 1976;111:744 –749. 147. Achauer BM, Allyn PA, Furnas DW, et al. Pulmonary complications of burns: the major threat to the burn patient. Ann Surg. 1973;177:311–319. 148. Lund T, Goodwin CW, McManus WF, et al. Upper airway sequelae in burn patients requiring endotracheal intubation or tracheostomy. Ann Surg. 1985;201:374 –382. 149. American College of Surgeons, Committee on Trauma. Advanced Trauma Life Support, Instructor Manual. Chicago: American College of Surgeons; 1997. 150. National Association of Emergency Medical Technicians Prehospital Life Support Committee, American College of Surgeons. Prehospital Trauma Life Support. St. Louis: Mosby; 1999. 151. Wang HE, O’Connor RE, Domeier RM. Position paper: National Association of EMS Physicians—prehospital rapid-sequence intubation. Prehosp Emerg Care. 2001;5:40 – 48. 152. De Troyer A, Estenne M, Vincken W. Rib cage motion and muscle use in high tetraplegics. Am Rev Respir Dis. 1986;133:1115–1119. 153. Ledsome JR, Sharp JM. Pulmonary function in acute cervical cord injury. Am Rev Respir Dis. 1981;124:41– 44. 154. Sinha RP, Ducker TB, Perot PL. Arterial oxygenation: findings and its significance in central nervous system trauma patients. JAMA. 1973;224:1258 –1260. 155. Scanlon PD, Loring SH, Pichurko BM, et al. Respiratory mechanics in acute quadriplegia: lung and chest wall compliance and dimensional changes during respiratory maneuvers. Am Rev Respir Dis. 1989;139:615– 620. 156. North JB, Jennett S. Abnormal breathing patterns associated with acute brain damage. Arch Neurol. 1974;31:338 –344. 157. Andrews PJ, Piper IR, Dearden NM, et al. Secondary insults during intrahospital transport of head-injured patients. Lancet. 1990; 335:327–330. 158. Pfenninger EG, Lindner KH. Arterial blood gases in patients with acute head injury at the accident site and upon hospital admission. Acta Anaesthesiol Scand. 1991;35:148–152. 159. Vicario SJ, Coleman R, Cooper MA, et al. Ventilatory status early after head injury. Ann Emerg Med. 1983;12:145–148. 160. Cooke RS, McNicholl BP, Byrnes DP. Early management of severe head injury in Northern Ireland. Injury. 1995;26:395–397. 161. Cooper KR, Boswell PA. Reduced functional residual capacity and abnormal oxygenation in patients with severe head injury. Chest. 1983;84:29 –35. 162. Dunn LT. Secondary insults during the interhospital transfer of head-injured patients: an audit of transfers in the Mersey Region. Injury. 1997;28:427– 431. 163. Froman C. Alterations of respiratory function in patients with severe head injuries. Br J Anaesth. 1968;40:354 –360. 164. Frost EA, Arancibia CU, Shulman K. Pulmonary shunt as a prognostic indicator in head injury. J Neurosurg. 1979;50:768 –772. 165. Kokoska ER, Smith GS, Pittman T, et al. Early hypotension worsens neurological outcome in pediatric patients with moderately severe head trauma. J Pediatr Surg. 1998;33:333–338. 166. Mayer T, Walker ML, Shasha I, et al. Effect of multiple trauma on outcome of pediatric patients with neurologic injuries. Childs Brain. 1981;8:189 –197. 167. Ong L, Selladurai BM, Dhillon MK, et al. The prognostic value of the Glasgow Coma Scale, hypoxia and computerised tomography in outcome prediction of pediatric head injury. Pediatr Neurosurg. 1996;24:285–291. 168. Piek J, Chesnut RM, Marshall LF, et al. Extracranial complications of severe head injury. J Neurosurg. 1992;77:901–907. 169. Pigula FA, Wald SL, Shackford SR, et al. The effect of hypotension and hypoxia on children with severe head injuries. J Pediatr Surg. 1993;28:310 –314. 170. Robertson C. Desaturation episodes after severe head injury: influence on outcome. Acta Neurochir Suppl (Wien). 1993;59:98 – 101. 171. Silverston P. Pulse oximetry at the roadside: a study of pulse oximetry in immediate care. BMJ. 1989;298:711–713. 172. Olson RO, Johnson JT. Diagnosis and management of intrathoracic tracheal rupture. J Trauma. 1971;11:789 –792. 173. Mizushima Y, Hiraide A, Shimazu T, et al. Changes in contused lung volume and oxygenation in patients with pulmonary parenchymal injury after blunt chest trauma. Am J Emerg Med. 2000;18:385–389. 174. Deslauriers J, Beaulieu M, Archambault G, et al. Diagnosis and long-term followup of major bronchial disruptions due to nonpenetrating trauma. Ann Thorac Surg. 1982;33:32–39. 175. Wilson RF, Soullier GW, Wiencek RG. Hemoptysis in trauma. J Trauma. 1987;27:1123– 1126. 176. Vermeer M. Air transport of a patient with head injury. J Emerg Nurs. 1982;8:60 – 62. 177. Ecker RR, Libertini RV, Rea WJ, et al. Injuries of the trachea and bronchi. Ann Thorac Surg. 1971;11:289 –298. 178. Allen GS, Cox CS Jr, Moore FA, et al. Pulmonary contusion: are children different? J. Am Coll Surg. 1997;185:229 –233. 179. Gbaanador GBM, Dunham M, Rodriguez A, et al. Does pulmonary contusion contribute to mortality in multiply injured patients. Panam J Trauma. 1990;2:26 –34. 180. Hoff SJ, Shotts SD, Eddy VA, et al. Outcome of isolated pulmonary contusion in blunt trauma patients. Am Surg. 1994; 60:138 –142. 181. Johnson JA, Cogbill TH, Winga ER. Determinants of outcome after pulmonary contusion. J Trauma. 1986;26:695– 697. 182. Sharma S, Mullins RJ, Trunkey DD. Ventilatory management of pulmonary contusion patients. Am J Surg. 1996;171:529 –532. 183. Barone JE, Pizzi WF, Nealon TF, et al. Indications for intubation in blunt chest trauma. J Trauma. 1986;26:334 –338. 184. Bulger EM, Arneson MA, Mock CN, et al. Rib fractures in the elderly. J Trauma. 2000;48:1040 –1046. 185. Ciraulo DL, Elliott D, Mitchell KA, et al. Flail chest as a marker for significant injuries. J Am Coll Surg. 1994;178:466 – 470. 186. Freedland M, Wilson RF, Bender JS, et al. The management of flail chest injury: factors affecting outcome. J Trauma. 1990; 30:1460 –1468. 187. Richardson JD, Adams L, Flint LM. Selective management of flail chest and pulmonary contusion. Ann Surg. 1982;196:481– 487. 188. Shackford SR, Virgilio RW, Peters RM. Selective use of ventilator therapy in flail chest injury. J Thorac Cardiovasc Surg. 1981; 81:194 –201. 189. Tanaka H, Tajimi K, Endoh Y, et al. Pneumatic stabilization for flail chest injury: an 11-year study. Surg Today. 2001;31:12–17. 190. Helling TS, Evans LL, Fowler DL, et al. Infectious complications in patients with severe head injury. J Trauma. 1988;28:1575–1577. 191. Hoyt DB, Simons RK, Winchell RJ, et al. A risk analysis of pulmonary complications following major trauma. J Trauma. 1993; 35:524 –531. 192. Hsieh AH, Bishop MJ, Kubilis PS, et al. Pneumonia following closed head injury. Am Rev Respir Dis. 1992;146:290 –294. 193. Jeffreys RV, Jones JJ. Avoidable factors contributing to the death of head injury patients in general hospitals in Mersey Region. Lancet. 1981;2:459 – 461. 194. Lockey DJ, Coats T, Parr MJ. Aspiration in severe trauma: a prospective study. Anaesthesia. 1999;54:1097–1098. 195. Mayer TA, Walker ML. Pediatric head injury: the critical role of the emergency physician. Ann Emerg Med. 1985;14:1178–1184. 196. Rello J, Ausina V, Castella J, et al. Nosocomial respiratory tract infections in multiple trauma patients: influence of level of consciousness with implications for therapy. Chest. 1992;102:525– 529. Manejo Integral del paciente crítico 59 197. Rodriguez JL, Gibbons KJ, Bitzer LG, et al. Pneumonia: incidence, risk factors, and outcome in injured patients. J Trauma. 1991; 31:907–912. 198. Hicks IR, Hedley RM, Razis P. Audit of transfer of head-injured patients to a stand-alone neurosurgical unit. Injury. 1994;25:545– 549. 199. Gentleman D. Causes and effects of systemic complications among severely head injured patients transferred to a neurosurgical unit. Int Surg. 1992;77:297–302. 200. Brain Trauma Foundation, American Association of Neurological Surgeons. Management and Prognosis of Severe Traumatic Brain Injury. New York: Brain Trauma Foundation; 2000. 201. Brain Trauma Foundation. Guidelines for Prehospital Management of Traumatic Brain Injury. New York: Brain Trauma Foundation; 2000. 202. Procaccio F, Stocchetti N, Citerio G, et al. Guidelines for the treatment of adults with severe head trauma (part I): initial assessment; evaluation and pre-hospital treatment; current criteria for hospital admission; systemic and cerebral monitoring. J Neurosurg Sci. 2000;44:1–10. 203. Basic Trauma Life Support International. Basic Trauma Life Support for Paramedics and Other Advanced Providers. Upper Saddle River, NJ: Brady/Prentice Hall Health; 2000. 204. European Resuscitation Council. Guidelines for the advanced management of the airway and ventilation during resuscitation. A statement by the Airway and Ventilation Management of the Working Group of the European Resuscitation Council. Resuscitation. 1996;31:201–230. 205. American Heart Association. Guidelines 2000 for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 6: advanced cardiovascular life support: section 3: adjuncts for oxygenation, ventilation and airway control. The American Heart Association in collaboration with the International Liaison Committee on Resuscitation. Circulation. 2000;102:I95– I104. 206. Wherrett LJ, Boulanger BR, McLellan BA, et al. Hypotension after blunt abdominal trauma: the role of emergent abdominal sonography in surgical triage. J Trauma. 1996;41:815– 820. 207. Bickell WH, Wall MJ Jr, Pepe PE, et al. Immediate versus delayed fluid resuscitation for hypotensive patients with penetrating torso injuries. N Engl J Med. 1994;331:1105–1109. 208. Rhodes M, Brader A, Lucke J, et al. Direct transport to the operating room for re- 60 Manejo Integral del paciente crítico suscitation of trauma patients. J Trauma. 1989;29:907–913. 209. Velmahos GC, Degiannis E, Souter I, et al. Outcome of a strict policy on emergency department thoracotomies. Arch Surg. 1995; 130:774 –777. 210. Velidedeoglu E, Ozdemir A, Ozenc A, et al. Factors affecting postoperative mortality in abdominal trauma. Int Surg. 1992; 77:198 –202. 211. Hoyt DB, Shackford SR, McGill T, et al. The impact of in-house surgeons and operating room resuscitation on outcome of traumatic injuries. Arch Surg. 1989;124:906 –909. 212. Burch JM, Ortiz VB, Richardson RJ, et al. Abbreviated laparotomy and planned reoperation for critically injured patients. Ann Surg. 1992;215:476 – 483. 213.Feliciano DV, Burch JM, Spjut-Patrinely V, et al. Abdominal gunshot wounds: an urban trauma center ’s experience with 300 consecutive patients. Ann Surg. 1988;208:362–370. 214. Garrison JR, Richardson JD, Hilakos AS, et al. Predicting the need to pack early for severe intra-abdominal hemorrhage. J Trauma. 1996;40:923–927. 215. Hirshberg A, Wall MJ Jr, Mattox KL. Planned reoperation for trauma: a two year experience with 124 consecutive patients. J Trauma. 1994;37:365–369. 216. Rotondo MF, Schwab CW, McGonigal MD, et al. ‘Damage control’: an approach for improved survival in exsanguinating penetrating abdominal injury. J Trauma. 1993;35:375–382. 217. Shook CD, MacMillan BG, Altemeier WA. Pulmonary complications of the burn patient. Arch Surg. 1968;97:215–224. 218. Hunt JL, Purdue GF, Gunning T. Is tracheostomy warranted in the burn patient? Indications and complications. J Burn Care Rehabil. 1986;7:492– 495. 219. Dancey DR, Hayes J, Gómez M, et al. ARDS in patients with thermal injury. Intensive Care Med. 1999;25:1231–1236. 220. Thompson PB, Herndon DN, Traber DL, et al. Effect on mortality of inhalation injury. J Trauma. 1986;26:163–165. 221. Venus B, Matsuda T, Copiozo JB, et al. Prophylactic intubation and continuous positive airway pressure in the management of inhalation injury in burn victims. Crit Care Med. 1981;9:519–523. 222. Stone HH, Martin JD Jr. Pulmonary injury associated with thermal burns. Surg Gynecol Obstet. 1969;129:1242–1246. 223. Shirani KZ, Pruitt BA, Mason AD. The influence of inhalation injury and pneumonia on burn mortality. Ann Surg. 1987;205:82– 87. 224. Blinn DL, Slater H, Goldfarb IW. Inhalation injury with burns: a lethal combination. J Emerg Med. 1988;6:471– 473. 225. Lee ST, Leung CM. Epidemiology and management of respiratory burns in National Burns Centre, Singapore. Ann Acad Med Singapore. 1992;21:612– 618. 226. Wroblewski DA, Bower GC. The significance of facial burns in acute smoke inhalation. Crit Care Med. 1979;7:335–338. 227. Masanes MJ, Legendre C, Lioret N, et al. Fiberoptic bronchoscopy for the early diagnosis of subglottal inhalation injury: comparative value in the assessment of prognosis. J Trauma. 1994;36:59 – 67. 228. Ma OJ, Atchley RB, Hatley T, et al. Intubation success rates improve for an air medical program after implementing the use of neuromuscular blocking agents. Am J Emerg Med. 1998;16:125– 127. 229. Tayal VS, Riggs RW, Marx JA, et al. Rapidsequence intubation at an emergency medicine residency: success rate and adverse events during a two-year period. Acad Emerg Med. 1999;6:31–37. 230. Thompson JD, Fish S, Ruiz E. Succinylcholine for endotracheal intubation. Ann Emerg Med. 1982;11:526 –529. 231. Wang HE, O’Connor RE, Megargel RE, et al. The utilization of midazolam as a pharmacologic adjunct to endotracheal intubation by paramedics. Prehosp Emer Care. 2000;4:14 –18. 232. Wayne MA, Friedland E. Prehospital use of succinylcholine: a 20-year review. Prehosp Emerg Care. 1999;3:107–109. 233. Koenig KL. Rapid-sequence intubation of head trauma patients: prevention of fasciculations with pancuronium versus minidose succinylcholine. Ann Emerg Med. 1992;21:929 –932. 234. Muckart DJ, Bhagwanjee S, van der Merwe R. Spinal cord injury as a result of endotracheal intubation in patients with undiagnosed cervical spine fractures. Anesthesiology. 1997;87:418 – 420. 235. Deo S, Knottenbelt JD. The use of midazolam in trauma resuscitation. Eur J Emerg Med. 1994;1:111–114. 236. Plewa MC, King R, Johnson D, et al. Etomidate use during emergency intubation of trauma patients. Am J Emerg Med. 1997; 15:98 –100. 237. Sakles JC, Laurin EG, Rantapaa AA, et al. Airway management in the emergency department: a one-year study of 610 tracheal intubations. Ann Emerg Med. 1998;31:325–332. 238. Grande CM, Barton CR, Stene JK. Appropriate techniques for airway management of emergency patients with suspected spinal cord injury. Anesth Analg. 1988;67:714 –715. 239. Holley J, Jorden R. Airway management in patients with unstable cervical spine fractures. Ann Emerg Med. 1989;18:1237–1239. 240. Davis D, Ochs M, Hoyt D, et al. Proceedings of the 61st Annual Meeting of the American Association for the Surgery of Trauma, 2001: The safety and efficacy of paramedic rapid sequence intubation of patients with severe traumatic brain injury. Available at: http:// www aast org/01 abstracts. Accessed 2001. 241. Myles PS, Venema HR, Lindholm DE. Trauma patient managed with the laryngeal mask airway and percutaneous tracheostomy after failed intubation. Med J Aust. 1994;161:640. 242. Flancbaum L, Wright J, Trooskin SZ, et al. Orotracheal intubation in suspected laryngeal injuries. Am J Emerg Med. 1986;4:167–169. 243. O’Brien DJ, Danzl DF, Hooker EA, et al. Prehospital blind nasotracheal intubation by paramedics. Ann Emerg Med. 1989; 18:612– 617. 244. Mlinek EJ, Clinton JE, Plummer D, et al. Fiberoptic intubation in the emergency department. Ann Emerg Med. 1990;19:359 –362. 245. Mulder DS, Wallace DH, Woolhouse FM. The use of the fiberoptic bronchoscope to facilitate endotracheal intubation following head and neck trauma. J Trauma. 1975;15:638 – 640. 246. Neal MR, Groves J, Gell IR. Awake fibreoptic intubation in the semi-prone position following facial trauma. Anaesthesia. 1996; 51:1053–1054. 247. Staudinger T, Brugger S, Watschinger B, et al. Emergency intubation with the Combitube: comparison with the endotracheal airway. Ann Emerg Med. 1993;22:1573–1575. 248. O’Connor RE, Swor RA. Position paper: National Association of EMS Physicians— verification of endotracheal tube placement following intubation. Prehosp Emerg Care. 1999;3:248 –250. 249. American College of Surgeons, Committee on Trauma. Resources for Optimal Care of the Injured Patient: 1999. Chicago: American College of Surgeons; 1999. 250. Chang RS, Hamilton RJ, Carter WA. Declining rate of cricothyrotomy in trauma patients with an emergency medicine residency: implications for skills training. Acad Emerg Med. 1998; 5:247–251. 251. Trimble LD. Severe facial trauma resulting in airway obstruction. Oral Surg Oral Med Oral Pathol. 1986;62:476 –478. 252. Eichinger S, Schreiber W, Heinz T, et al. Airway management in a case of neck impalement: use of the oesophageal tracheal combitube airway. Br J Anaesth. 1992;68:534 –535. Manejo Integral del paciente crítico 61 253. Wagner A, Roeggla M, Roeggla G, et al. Emergency intubation with the combitube in a case of severe facial burn. Am J Emerg Med. 1995;13:681– 683. 254. Aye T, Milne B. Use of the laryngeal mask prior to definitive intubation in a difficult airway: a case report. J Emerg Med. 1995; 13:711–714. 255. Greene MK, Roden R, Hinchley G. The laryngeal mask airway: two cases of prehospital trauma care. Anaesthesia. 1992;47:688 – 689. 256. McNamara JT, Fisher WJ. The laryngeal mask airway and the multiple injured patient. Anaesthesia. 1996;51:97–98. 257. Wakeling HG, Bagwell A. The intubating laryngeal mask (ILMA) in an emergency 62 Manejo Integral del paciente crítico failed intubation. Anaesthesia. 1999;54:305– 306. 258. Schuschnig C, Waltl B, Erlacher W, et al. Intubating laryngeal mask and rapid sequence induction in patients with cervical spine injury. Anaesthesia. 1999;54:793–797. 259. Benumof AJ. Laryngeal mask airway and the ASA difficult airway algorithm. Anesthesiology. 1996;84:686 – 699. 260. Levitan RM. Myths and realities: the “difficult airway” and alternative airway devices in the emergency setting. Acad Emerg Med. 2001;8:829 – 832. 261. Campo SL, Denman WT. The laryngeal mask airway: its role in the difficult airway. Int Anesthesiol Clin. 2000;38:29 – 45. Manejo Integral del paciente crítico 63 Mi corazón de mi madre, mi corazón de mi madre, mi corazón de mis formas cambiantes, no te levantes como testigo contra mí, no te rebeles contra mí en la sala del tribunal, no te doblegues en mi perjuicio ante el maestro de la balanza (Plegaria del escriba Ani) (Fragmento del Libro de los muertos, del escriba Ani, hacia 1300 a. C.) 64 Manejo Integral del paciente crítico 5. Diagnóstico y manejo de la falla ventilatoria * ISABEL CRISTINA ARIAS VILLEGAS Es una falla del intercambio gaseoso por una mala función de alguno de los componentes del sistema respiratorio. Las manifestaciones clínicas son hipoxemia, hipercarbia y puede ser mixta. Clasificación Falla respiratoria tipo I, o falla respiratoria hipoxémica aguda Se produce como consecuencia de inundación alveolar. Al tener los alvéolos ocupados de líquido se genera un patrón de alteración fisiológica tipo shunt, es decir, la sangre que pasa por los alvéolos no se oxigena. Los ejemplos incluyen edema agudo de pulmón, neumonía, hemorragia alveolar. Falla respiratoria tipo II, o falla respiratoria hipercárbica Es el resultado de la hipoventilación alveolar; el sistema respiratorio no es capaz de eliminar el CO2. Puede ser por alteraciones del sistema nervioso central, disminución de la fuerza muscular, o exceso de trabajo del sistema respiratorio. Los ejemplos incluyen lesiones del tallo cerebral, intoxicación con drogas, myastenia gravis Guillain Barrè y otras alteraciones musculares. El trabajo del sistema respiratorio se puede sobrecargar en casos de broncoespasmo y neumotórax. Falla respiratoria tipo III, o falla respiratoria perioperatoria Se produce como consecuencia de las atelectasias. El paciente sometido a anestesia presenta una disminución en la capacidad residual funcional. Ésto colapsa las unidades pulmonares dependientes y genera atelectasias. Falla respiratoria tipo IV, o falla respiratoria por hipoperfusión Se produce por hipoperfusión muscular de un paciente en shock. La función * Tomado del libro Fisiología Respiratoria, autor: West, John B. 7 edición. Editorial Médica Panamericana, año 2005 Manejo Integral del paciente crítico 65 respiratoria normal consume el 5% del gasto cardiaco. En pacientes con shock la sobrecarga al trabajo respiratorio aumenta el consumo a niveles tan altos como el 40% del gasto cardiaco. Existen otras formas de clasificación de la falla respiratoria. Puede ser aguda o crónica, o se puede explicar de acuerdo con el mecanismo fisiológico que se encuentra alterado. Esta clasificación es especialmente útil porque permite entender en forma más precisa lo que les pasa a estos pacientes. En este caso se divide en cinco formas, así: Alteraciones del sistema nervioso central La alteración de los núcleos dorsales y ventrales del centro de la respiración del tallo cerebral bloquea las vías aferentes y eferentes al sistema nervioso central. Como resultado, se afectan la frecuencia y el esfuerzo respiratorio. El caso extremo es la apnea de origen central. Alteraciones de la musculatura La ventilación, definida en los libros de fisiología como la entrada y salida de un fluido de los pulmones, es un proceso mecánico que sigue las leyes de los fluidos. El movimiento de los fluidos (en este caso de gases) se genera por un gradiente de presión. Si consideramos que la presión atmosférica es 0, los músculos inspiratorios generan una presión negativa que “succiona el aire” y produce la inspiración. La espiración es, por el contrario, un proceso pasivo, pero solo en condiciones basales. Con sobrecarga de trabajo del sistema respiratorio la espiración debe ser activa e involucra la función muscular para “expulsar” el aire de los pulmones. En la medida en que disminuye la fuerza de este sistema muscular el cambio de presión generado será cada vez menor, o sea un volumen corriente cada vez menor. 66 Manejo Integral del paciente crítico Alteración de las vías respiratorias El sistema de conductos por los cuales viajan los gases, formado por tráquea, bronquios y bronquiolos hasta sus ramas terminales, puede verse comprometido en múltiples patologías. De nuevo, el proceso mecánico de la ventilación se afecta por alteración en el calibre de estas vías. Alteracion de las unidades alveolares El área de los alvéolos, si se extendiera, sería mayor que una cancha de tenis. A través de esta inmensa área se genera el intercambio gaseoso. Y es, además, esta red suficientemente elástica para que su retroceso normal genere la espiración en condiciones basales. Alteración de la vasculatura La red de vasos sanguíneos que irriga el pulmón es amplia y compleja. Grosso modo se clasifica como micro vasculatura y macro vasculatura. Su alteración afecta también el intercambio gaseoso. Evaluación inicial del paciente con falla ventilatoria Se debe sospechar marcadamente en los pacientes que tienen alguna patología que genere alteración de la mecánica ventilatoria. En el examen físico son importantes: Permeabilidad de la vía aérea La inminencia de obstrucción de la vía aérea es un signo claro de alerta, ya que de no tratarse en forma emergente el paciente puede fallecer. Un ejemplo son los pacientes víctimas de trauma, quemadura de las vías aéreas o hematomas en el cuello. El diagnóstico requiere alta sospecha clínica. Frecuencia respiratoria El volumen minuto de un paciente se calcula al multiplicar la frecuencia respiratoria por el volumen corriente: VM = FR x VC En pacientes conectados al ventilador es fácil medir el volumen corriente. El valor normal es de 7 ml / kilo; para un adulto promedio de 70 kilos son 490 ml. En la evaluación de un paciente con patología pulmonar, sin posibilidad de espirometría, se debe mirar la expansión torácica. Un paciente con adecuada expansión torácica es probable que movilice 7 ml por kilo. La frecuencia ventilatoria es, por otra parte, mucho más fácil de medir y su valor, incalculable. Los cambios en la frecuencia ventilatoria alteran el volumen minuto y llevan a hiperventilaciones o hipoventilaciones. El único examen que lo confirma es el de gases arteriales. No medir la frecuencia respiratoria en forma habitual en nuestros servicios y por el contrario medir la saturación de oxígeno por pulsoximetría genera una falsa sensación de seguridad. En pacientes con suministro adicional de oxígeno la oxigenación sólo se disminuye en la hipoventilación, al final del espectro, segundos antes de un evento mortal . Esto se puede explicar mejor en forma numérica. A. Hipoventilación sin suministro de oxígeno: (PaCO2=80) Ejercicio a nivel del mar. PAO2 = PiO2 – PaC O2/0.8 PAO2 = (P BAROMÉTRICA-P H20)* FiO2 - PaCO2/0.8 PAO2 = (760-47)*0.21 – 80/0.8 PAO2 = (760-47)*0.21 – 80/0.8 PAO2 = 49.73 = Saturacion menor de 90 B. Hipoventilación con oxígeno por venturi al 50%: (PaCO2=80) Ejercicio a nivel del mar. PAO2 = PiO2 – PaCO2/0.8 PAO2 = (P BAROMÉTRICA-P H20)* FiO2 - PaCO2/0.8 PAO2 = (760-47)*0.5 – 80/0.8 PAO2 = (760-47)*0.5 – 80/0.8 PAO2 = 256 = Saturacion mayor de 90 Vemos que el paciente con hipoventilación, sin oxígeno suplementario, está desaturado, a diferencia del que tiene suplemento de oxígeno . Patrón y profundidad de la respiración Es el otro parámetro clínico que permite inferir cómo se encuentra el volumen minuto de un paciente. Presencia de cianosis La ausencia de cianosis no asegura una adecuada oxigenación, ya que los pacientes deben tener más de 4 g/dl de hemoglobina reducida para lograr esta coloración. En pacientes de pieles claras la cianosis se puede ver con Sat inferiores al 85%. En pacientes morenos puede ser necesario tener valores inferiores a 75%. En pacientes con anemias agudas puede simplemente no verse, ya que lo necesario son 4 g/dl de hemoglobina reducida, como valor absoluto y no relativo. Su presencia, en cambio, una vez se haya descartado la cianosis periférica, es una clara indicación de enfermedad cardiaca o pulmonar. Saturación de oxígeno por pulsooximetría Los oxímetros de pulso son herramientas útiles en la práctica clínica, y su uso se ha expandido a todas las áreas del hospital. La saturación de oxígeno de la hemoglobina se encuentra relacionada con la presión de oxígeno de la hemoglobina. Esta relación se ve en la curva de disociación de la hemoglobina. Como la curva puede desviarse hacia la izquierda o la derecha, es difícil predecir el valor de la presión arterial de oxígeno que tendrá un paciente, de acuerdo con su saturación. Manejo Integral del paciente crítico 67 Sin embargo, existe un punto que es constante y permite hacer un acercamiento a la gravedad de la hipoxemia antes de la llegada de los gases. En general, si la presión arterial de oxígeno es mayor de 60 la saturación de oxígeno será mayor de 90 y viceversa. De nuevo es más fácil explicar este concepto con números. A. Saturación mayor de 90 en paciente sin oxígeno suplementario: Ejercicio a nivel del mar. Sat = mayor de 90 ( dato conocido) FiO2 = 0.21% (dato conocido) PaO2 = dato desconocido. Necesito gases arteriales. Qué puedo esperar de los gases: Si la Sat es mayor de 90, La presión arterial de oxígeno es por lo menos 60 (o más) Puedo predecir que el peor escenario de índice de oxigenación de este paciente sería: 60/0.21 = 285.71 PaFi Peor escenario: 285.71 Paciente con buena saturación Paciente con buen índice de oxigenación. B. Saturación mayor de 90 en paciente con oxígeno suplementario con máscara de no reinhalación (FiO2=90%): Ejercicio a nivel del mar. Sat = mayor de 90 ( dato conocido) FiO2 = 0.9% (dato conocido) PaO2 = dato desconocido. Necesito gases arteriales. Qué puedo esperar de los gases: Si la Sat es mayor de 90, La presión arterial de oxígeno es por lo menos 60 (o más) Puedo predecir que el peor escenario de índice de oxigenación de este paciente sería: 60/0.9 = 66.66 PaFi Peor escenario: 66.66 68 Manejo Integral del paciente crítico Paciente con adecuada saturación. Paciente con mal índice de oxigenación C. Saturación menor de 90 en paciente con oxígeno suplementario con máscara de no reinhalación (FiO2=90%): Ejercicio a nivel del mar. Sat = menor de 90 ( dato conocido) FiO2 = 0.9% (dato conocido) PaO2 = dato desconocido. Necesito gases arteriales. Qué puedo esperar de los gases: Si la Sat es menor de 90, La presión arterial de oxígeno debe ser 59 o menos Puedo predecir que el mejor escenario para inducir oxigenación de este paciente sería: 59/0.9 = 66.66 PaFi Mejor escenario: 65 Paciente con mala saturación. Paciente con mal índice de oxigenación Estos ejemplos nos llaman a sacar el mejor provecho de la pulsoximetría en la evaluación inicial de los pacientes, y a relacionar siempre el valor obtenido en la misma con el suplemento de oxígeno entregado al paciente para definir su estado real de oxigenación. Gases arteriales Finalmente, el diagnóstico definitivo de la falla ventilatoria se realiza por gases arteriales, los cuales permiten diferenciar el tipo y la gravedad. La hipoxemia se valora con índices de oxigenación. La oxigenación se valora con índices. El más conocido de todos es PaFi; este es la relación entre la presión arterial de oxígeno tomada de los gases arteriales y la fracción inspirada de oxígeno. PaFi = PaO2 / FiO2 A nivel del mar, el PaFi debe ser mayor de 300. Cuanto más bajo, peor la oxigenación. La hipoxemia tiene cuatro mecanismos fisiopatológicos de base, que se pueden diagnosticar con los gases arteriales. Ellos son: a. Disminución de la presión inspirada de oxígeno b. Hipoventilación c. Shunt d. Alteraciones ventilación–perfusión e. Alteraciones de difusión Disminución de la presión inspirada de oxígeno e hipoventilación: Los dos primeros tienen el mismo comportamiento fisiológico: una disminución en la presión alveolar de oxígeno. Se diagnostican en los gases arteriales por aumento del nivel de CO2 más un gradiente alveolo arterial normal. ( PAO2-PaO2) La valoración de la presión arterial de CO2 de un paciente se debe correlacionar con el estado ácido base del mismo. En estado de equilibrio acido básico y a nivel del mar, la PaCO2 normal es de 40 mmHg. Esto es para un bicarbonato de 24 mEq/l. Cuando el paciente está con acidosis metabólica y el nivel de bicarbonato ha caído, se dice que está normocárbico si la relación entre el CO2 y el bicarbonato es la siguiente ( en forma aguda): Por cada unidad de caída del HCO3 = 1-1.5 veces caída del PaCO2. Shunt: Se produce cuando la sangre pasa de un extremo capilar a otro sin intercambio gaseoso por problemas en el alvéolo. Clínicamente se observa una resistencia a mejorar los índices de oxigenación con el aumento de la fracción inspirada de oxígeno. Típicamente mejoran con maniobras que expandan los alvéolos, como el reclutamiento, la ventilación con presión positiva, ya sea invasiva o no, y el PEEP. El gradiente alveolo–arterial se eleva. Alteraciones de la relación ventilación–perfusión Se caracteriza por niveles de CO2 normales; gradiente alveolo–arterial elevado y mejoría de los índices de oxigenación con oxígeno suplementario. Ademas de la historia clínica y el examen físico, al aplicar el algoritmo a la toma de gases podemos esclarecer la causa de la hipoxemia del paciente. Figura 1. Manejo inicial del paciente en falla ventilatoria La falla ventilatoria es una emergencia médica. Después de una valoración rápida, con los puntos anteriormente anotados, probablemente es necesario intervenir antes de continuar el estudio. Algunos pacientes pueden necesitar solo oxígeno suplementario; otros, intubación y ventilación mecánica; y los más comprometidos, todo lo anterior más soporte cardiovascular. Hay situaciones en las que se debe instaurar el manejo antes del desarrollo de la falla como tal. Por ejemplo, en víctimas de politraumatismo grave, en las cuales se realiza la intubación y ventilación por la alta probabilidad de desarrollar falla ventilatoria tipo IV. En todos los casos se debe estabilizar la enfermedad de base como piedra angular del tratamiento. Las estrategias de manejo se discuten en otros capítulos, pero incluyen oxígeno suplementario en pacientes con ventilación espontánea, ventilación de presión positiva no invasiva y ventilación de presión positiva invasiva. Manejo Integral del paciente crítico 69 Figura 1. Aplicación del algoritmo para esclarecer Hipoxemia Paciente hipoxémico ¿Cómo está la PaCO2? Alta: Hipoventilación Normal ¿PaO2-PaO2? ¿PaO2-PaO2? Normal: Hipoventilación sola Aumentado: Hipoventilación + Otro mecanismo Normal: Disminución PIO2 Elevado Respuesta al oxígeno suplementario Positiva: Mejora oxigenación Alteraciones V/Q Negativa: No mejora oxigenación Shunt 70 Manejo Integral del paciente crítico 6. Principios de la ventilación mecánica OLGA LUCÍA PÉREZ O. Vesalius tiene el mérito de haber efectuado la primera descripción de la ventilación mecánica a presión positiva; cuatrocientos años después, en 1955, durante una epidemia de poliomielitis, se aplicaron los conceptos de Vesalius en los pacientes. En ese entonces la demanda de la ventilación asistida superó el número de ventiladores existentes, que eran tanques de presión negativa (pulmones de acero). Así comenzó la era de la ventilación mecánica. Su entendimiento es muy importante para la adecuada aplicación en los pacientes. El principal objetivo de la respiración es el intercambio de O2 por CO2. Basados en la ecuación de movimiento, según la cual a toda fuerza aplicada a un cuerpo se le opone otra igual, se puede deducir que para que haya flujo de aire debe existir un gradiente de presión entre el inicio y el final del trayecto que éste debe recorrer, o sea entre la atmósfera y el alvéolo. Este gradiente de presión determina un flujo de aire que finalmente produce un cambio en el volumen del pulmón. Conceptos físicos: 1. Presión: Es el resultado de aplicar una fuerza sobre una superficie. Su unidad internacional es el pascal, y su múltiplo, el kilo pascal, es igual a 1.000 pascal. En medicina, a causa del hecho heredado de trabajar con manómetros de agua, 1 cm de H2O es igual 0.1 kPa. La presión que ejerce el pulmón contra el ingreso de aire, y que debe ser vencida, está constituida por la suma de la presión elástica y la presión de resistencia del sistema respiratorio. • Presión elástica: El pulmón y la pared del tórax están constituidos por una gran cantidad de fibras elásticas, las cuales son responsables de que el pulmón pueda llenarse de aire y regresar a su forma inicial. Estas fibras elásticas generan una fuerza o presión. Esta presión tiene una relación con el volumen, pues a mayor volumen introducido más estiramiento de las fibras. La medida de esta fuerza es lo que se ha denominado elastancia. En la práctica clínica se utiliza el término distensibilidad, que es el inverso de la elastancia. Manejo Integral del paciente crítico 71 Cuando un pulmón sufre algún cambio en su tejido o del contenido del colágeno será menos distensible y desarrollará una mayor fuerza para regresar a su estado de reposo. • Presión de resistencia: Corresponde a la fricción o resistencia que oponen las superficies a ser desplazadas como consecuencia de la entrada de aire a los pulmones (órganos adyacentes, caja torácica, diafragma, órganos abdominales). Como se mencionó anteriormente, el flujo de aire depende del gradiente de presión que hay a través de la vía aérea. Tenemos, entonces, que el ventilador genera una presión que empuja el aire; parte de esta presión es utilizada para vencer la resistencia, tratar de expandir el conducto y permitir que el gas llegue al alvéolo. Cuando hay una vía aérea artificial, cuanto menor sea su diámetro ofrecerá mayor resistencia. Se llama gradiente de presión a cualquier diferencia en el valor absoluto de presión entre dos puntos de un gas entre los que no existe solución de continuidad. En ventilación mecánica son especialmente importantes los gradientes que se establecen entre el generador y la vía aérea y entre la vía aérea y el alvéolo. 2. Flujo: Se define como el movimiento de fluido consecuente a la aparición de un gradiente de presión y que tiende a compensarlo. Se expresa en l/min. 3. Volumen: Se conoce como el volumen muerto instrumental el compuesto por el tubo orotraqueal, filtros y humidificadores. Deberá sustraerse del volumen corriente suministrado cuando se calcule la ventilación alveolar. 4. Resistencia: Es el conjunto de determinantes existentes entre los dos puntos de un gradiente de presión, que modulan el flujo circulante. 72 Manejo Integral del paciente crítico La resistencia es directamente proporcional a la distancia que separa los puntos A y B, e inversamente proporcional al área de sección transversal por la que circula el flujo. Se ha de estudiar por separado las resistencias fijas debidas a los circuitos y al tubo orotraqueal de las resistencias variables, que a su vez se dividen en resistencias elásticas (debidas al parénquima pulmonar y a la caja torácica) y resistencias al flujo (en relación con el diámetro efectivo de las vías aéreas). Estudio de los generadores por su forma de ciclado Los ventiladores incorporan un sistema de válvulas cuya abertura o cierre determina el inicio o el fin de las distintas fases de un ciclo respiratorio. La válvula inspiratoria es unidireccional, y permite suministrar un determinado flujo de gas al paciente; permanece abierta durante la insuflación y se cierra una vez finalizada. La válvula espiratoria también es unidireccional. Permite la salida de los gases al exterior o hacia el circuito espiratorio y puede contribuir a oponer un cierto grado de resistencia espiratoria a la salida de los gases. Permanece cerrada durante toda la insuflación y pausa inspiratoria. Se abre únicamente en la espiración y se cierra una vez finalizada. Inicio de la insuflación El ventilador puede iniciar la insuflación de dos modos diferentes. El primero de ellos permite el ciclado por el esfuerzo inspiratorio generado por el paciente y al llegar al nivel de sensibilidad programado inicia una insuflación. Este mecanismo se denomina habitualmente disparo o trigger, y se puede regular su sensibilidad a distintos grados de esfuerzo inspiratorio. Los ventiladores actuales pueden disponer de dos tipos de sensores: activados por presión o activados por flujo. El sensor de presión detecta la presión negativa generada en la vía aérea del paciente al iniciar la inspiración, que al alcanzar el nivel de sensibilidad (habitualmente 1 – 2 cm H2O por debajo de la presión en la vía aérea al final de la espiración) origina la apertura de la válvula inspiratoria. El sensor de flujo reconoce los mínimos incrementos del flujo inspiratorio que acontecen cuando el paciente realiza un esfuerzo inspiratorio y que, al igual que el sensor de presión, originan la apertura de la válvula inspiratoria al llegar a un nivel crítico. El segundo modo se denomina ciclado por tiempo, en el cual la válvula inspiratoria se abre regularmente al transcurrir un determinado tiempo previamente seleccionado en el ventilador. De este modo, la frecuencia respiratoria es directamente programada por el personal que maneja el ventilador y la duración de las distintas fases del ciclo respiratorio se expresan y seleccionan como un porcentaje del mismo. En algunos ventiladores el ciclado por tiempo se realiza en tiempo real, es decir, el aparato dispone de tres mandos que permiten regular el tiempo inspiratorio, tiempo de pausa inspiratoria y tiempo espiratorio, con lo cual la duración de un ciclo respiratorio será la suma de los tiempos parciales de cada uno de ellos. Insuflación Una vez abierta la válvula inspiratoria por cualquiera de los mecanismos anteriormente explicados se producirá la entrega de gas a los pulmones. En los generadores de baja presión la insuflación se lleva a cabo por la diferencia de presión existente entre el generador y los alvéolos y a medida que la insuflación va trascurriendo el gradiente de ambas presiones disminuye, el flujo desciende y la entrega de un determinado volumen circulante está en función del tiempo inspiratorio. La duración de la insuflación esta en función de la celeridad o demora en alcanzar el valor crítico predeterminado de presión en la vía aérea, y el volumen corriente es mayor o menor en proporción al nivel de flujo inicial y al tiempo inspiratorio en caso de que se programe la duración de la insuflación en tiempo real. Los generadores de alta presión mantienen constante el gradiente de presión entre el ventilador y los alvéolos pulmonares durante la insuflación, a pesar de cualquier aumento de presión en la vía aérea. La morfología del flujo es lineal e independiente de la mecánica pulmonar del paciente; el volumen circulante es constante, y la presión en la vía aérea es variable y depende exclusivamente del efecto del flujo sobre el circuito rama inspiratoria-vía aérea-alvéolo. En todos los ventiladores el tiempo inspiratorio es de gran importancia. Debido a que el flujo es volumen por unidad de tiempo, la entrega de un determinado volumen está en función directa del tiempo inspiratorio. Si en un ventilador se mantiene constante el nivel de flujo, cualquier codificación en la duración del tiempo inspiratorio originará una variación en el volumen. Supongamos que se quiere entregar a un paciente un volumen de 600 ml durante un tiempo inspiratorio de 0.8 s, y con un ventilador que mantiene el flujo constante. Si alargamos el tiempo inspiratorio a 1.2 s, el volumen circulante será de 900 ml, y al contrario, si disminuimos el tiempo inspiratorio a 0.4 s el volumen circulante será de 300 ml, modificándose la presión en la vía aérea paralelamente al volumen entregado. Manteniendo constante el volumen circulante, las modificaciones del tiempo inspiratorio originan cambios en el valor del flujo, es decir, si deseamos entregar un mismo volumen circulante durante menos Manejo Integral del paciente crítico 73 tiempo, el flujo necesario será mayor, dando lugar a un aumento de la presión en la vía aérea. Si, por el contrario, se alarga el tiempo inspiratorio, el valor del flujo declinará así como en la presión de la vía aérea. La selección de un flujo óptimo permite adecuar la ventilación a las necesidades del paciente. Se considera suficiente un flujo de 40l/min en un enfermo sin patología pulmonar previa, pudiendo incrementarse en el enfermo con obstrucción crónica al flujo aéreo, a fin de lograr volúmenes altos durante un tiempo inspiratorio corto. Morfología de la onda de flujo El patrón de la onda de flujo puede presentar cuatro morfologías fundamentales: desacelerado, constante, acelerado y sinusoidal. El flujo desacelerado muestra un ascenso rápido inicial y posteriormente se caracteriza por un descenso progresivo, que depende de las características mecánicas del sistema respiratorio del paciente; la presión máxima de la vía aérea se reduce de forma significativa, y dado que la presión de la vía aérea es casi constante a igualdad de volumen, presenta una mayor presión intratorácica media en comparación con el resto de patrones. El patrón de flujo acelerado se incrementa de forma progresiva hasta un valor máximo. Pausa inspiratoria Es el periodo que sigue a la insuflación. Se caracteriza por un flujo cero, manteniéndose en los pulmones el volumen corriente entregado durante la insuflación. La pausa inspiratoria se consigue con el cierre de la válvula inspiratoria cuando todavía permanece sin abrir la válvula espiratoria. Al inicio de la pausa inspiratoria, la presión en la vía aérea experimenta un moderado descenso, y permanece estática mientras trascurre el tiempo. Refleja la 74 Manejo Integral del paciente crítico presión necesaria para mantener en los pulmones el volumen corriente entregado. La diferencia entre la presión máxima de la vía aérea obtenida al final de la insuflación y la presión estática o de pausa inspiratoria expresa la presión necesaria para vencer la resistencia al flujo. La adición de la pausa inspiratoria tiene como fin la homogenización de la ventilación alveolar y la disminución del espacio muerto. Inicio de la espiración El inicio de la espiración se produce cuando el ventilador percibe, a través de un mecanismo sensor, que se ha alcanzado un predeterminado valor en alguna de las siguientes variables: tiempo, presión, volumen o flujo. La consecuencia inmediata es la apertura de la válvula espiratoria. Espiración El volumen de gas previamente insuflado sale libremente al exterior. La mayoría de los ventiladores permite el vaciado pulmonar pasivo sin intervenir activamente. El flujo durante la espiración está originado por la retracción del pulmón y de la caja torácica, siendo la combinación de la resistencia de la vía aérea del paciente y la del ventilador los determinantes del flujo espiratorio. El flujo espiratorio declina exponencialmente, ya que la presión alveolar es inversamente proporcional al volumen expelido. La presión en la vía aérea se va aproximando a la presión atmosférica hasta que desaparece el gradiente entre ambas. La espiración finaliza con el inicio de un nuevo ciclo respiratorio y su duración depende del mecanismo o modo de inicio de una nueva inspiración. Mandos comunes de los ventiladores En condiciones normales, la contracción coordinada de los músculos inspiratorios permite la inspiración. La entrada de aire en los pulmones se hace posible gracias al acortamiento de los músculos inspiratorios, el cual condiciona un aumento de los diámetros torácicos, generándose así una presión negativa intratorácica subatmosférica que permite la movilización de aire hacia los pulmones. También en condiciones normales la espiración ocurre de manera pasiva. Ello se debe a la propiedad elástica del pulmón, que le permite recuperar su volumen una vez ha cesado la fuerza que lo deforma. Para poder sustituir la función ventilatoria con aparatos mecánicos se requiere la generación de una fuerza inspiratoria (presión) que supla la fase activa del ciclo respiratorio. Una vez generada la fuerza necesaria para que la inspiración se lleve a cabo, debe establecerse el mecanismo de ciclado que permita remedar cada una de las fases del ciclo ventilatorio. Regulación de la fase inspiratoria Sin ninguna duda, constituye el punto central de la utilización y de la regulación de la ventilación mecánica. La mayoría de los equipos disponen de un tipo de mando agrupado con el nombre genérico de control de sensibilidad inspiratoria, cuyo establecimiento permite regular la magnitud del esfuerzo inspiratorio que el paciente debe realizar para iniciar una inspiración. Por tanto, es a través de la generación de una presión negativa intratorácica creada por el propio esfuerzo inspiratorio espontáneo del paciente como se da inicio a la fase inspiratoria mecánica. En este modo, llamado ventilación asistida, la frecuencia respiratoria del paciente dependerá del número de esfuerzos inspiratorios útiles capaces de producir la apertura de la válvula. No se recomiendan niveles de sensibilidad muy altos, ya que ocasionan angustia y aumento del trabajo respiratorio. Si el comienzo de cada ciclo depende completamente de la frecuencia respiratoria establecida por el operador del equipo, hablamos de un modo de ventilación controlada. En ocasiones el operador puede escoger la combinación de las dos situaciones anteriores. En estos casos, el esfuerzo inspiratorio del paciente inicia el ciclo inspiratorio y en consecuencia, según sea el número de estos esfuerzos, así será la frecuencia respiratoria del paciente en modo asistido. Sin embargo, el operador puede activar el mecanismo de ciclado por tiempo a una frecuencia menor a la realizada por el paciente. Si la frecuencia del paciente llegara a ser menor que la que proporciona el ventilador, esta última tomaría el control del inicio de la fase inspiratoria. Mandos de los ventiladores ciclados por presión Los equipos disponen de un control en el cual se regula la cantidad de presión que una vez alcanzada iniciará la fase espiratoria. Para establecer la duración de la fase inspiratoria se utiliza el control del flujo inspiratorio. Así tenemos que para una presión determinada, un aumento en el flujo inspiratorio ocasionará una menor duración de la fase espiratoria, y viceversa. Mando de los ventiladores ciclados por tiempo El paso de la inspiración a la espiración está determinado por el mando que regula la duración del tiempo inspiratorio. El funcionamiento de éste es independiente de la presión o volumen alcanzado. Su manejo se lleva a cabo junto con los controles de flujo y límite de presión inspiratoria. A tiempo inspiratorio fijo un aumento del flujo inspiratorio causaría el aumento del volumen corriente, mientras que una disminución del flujo producirá un efecto contrario. Manejo Integral del paciente crítico 75 Mando de los ventiladores ciclados por volumen En estos equipos el factor determinante del paso de inspiración a espiración es el volumen prefijado por el operador, el cual es constante en todos los ciclos. Debido al peligro de generar grandes presiones inspiratorias se cuenta con mandos para limitar esta presión. Mandos que regulan la fase espiratoria Como en la respiración normal, la espiración se produce debido principalmente a la elasticidad de los pulmones. En los ventiladores ciclados por tiempo y en algunos ciclados por presión, el mando denominado tiempo espiratorio nos permite establecer la frecuencia respiratoria. Posteriormente procedemos a escoger el tiempo inspiratorio, 76 Manejo Integral del paciente crítico preferiblemente guardando una relación con la espiración de 1: 2. La duración de la fase espiratoria será la diferencia entre la duración total del ciclo respiratorio y la de la fase de la inspiración. La salida de aire de los pulmones en la fase espiratoria se hace de manera rápida. Debido a ésto la mayor parte del tiempo espiratorio tiene lugar sin presión positiva intratorácica. Todos los equipos de ventilación mecánica tienen sistemas incorporados que permiten que una vez que los pulmones hagan su vaciado rápido no llegue la presión a cero, sino que permanezca en un valor por encima de éste. Son los sistemas generadores de PEEP, donde la presión en la vía aérea al final de la espiración permanece positiva. Bibliografía 1. 2. 3. The ICU Book. Ventilacion mecanica. Cuidados Intensivos Hall, Schmidt, Wood. DEgunda edicion Vol1. Ventilacion mecanica. Aplicacion en el paciente critico. carmelo Dueñas, Gillermo Ortiz, Marco gonzales. 4. Critical care medicine, third edition. John Marini Manejo Integral del paciente crítico 77 78 Manejo Integral del paciente crítico 7. Ventilación mecánica no invasiva JAIME ANDRÉS GIRÓN BANGUERO Definida por el International Consensus Conferences in Intensive Care Medicine en el 2000 como cualquier forma de soporte ventilatorio aplicado sin el uso de un tubo endotraqueal. El desarrollo de la ventilación mecánica no invasiva (VMNI) como modalidad terapéutica se centró en enfermos con insuficiencia respiratoria crónica restrictiva, fundamentalmente en aquellos con enfermedades neuromusculares, secuelas de tuberculosis, deformidades de la caja torácica y síndrome de apnea obstructiva del sueño asociado con obesidad. En el presente capítulo intentaremos definir las bases fisiopatológicas, los equipos, las técnicas, indicaciones y contraindicaciones así como la aplicación práctica de la ventilación mecánica no invasiva, enfatizando sobre su uso en entidades donde ha ganado especial importancia en la medicina de urgencias, en las unidades de cuidado intensivo e intermedios, como son la insuficiencia respiratoria aguda, EPOC descompensado, edema agudo de pulmón y el asma. Aunque existe literatura que avala la utilización de ventilación mecánica no invasiva en el servicio de urgencias1 e in- cluso en el ámbito prehospitalario para el transporte de pacientes, no hay estudios clínicos controlados randomizados grandes que demuestren su eficacia en estos contextos. Sin embargo, en urgencias, en casos específicos como patologías potencialmente recuperables, pacientes cuya situación basal desaconseja medidas intensas y pacientes con enfermedad crónica en los que no están indicadas medidas de ventilación mecánica invasiva2 es útil si se administra correctamente por personal idóneo y con la monitorización adecuada y el equipo necesario de intervención si fracasa la misma. De lo contrario, la VMNI podría convertirse en un factor de retraso de la intubación orotraqueal y causa de aumento de la mortalidad hospitalaria.3 Bases fisiopatológicas de la aplicación de la VMNI Enfermedades neuromusculares La alteración común en pacientes con estas entidades es la debilidad de los músculos inspiratorios (diafragma, paraesternales, escalenos, y accesorios de la respiración), cuya consecuencia es la hipoventilación alveolar con la correspondiente Manejo Integral del paciente crítico 79 hipoxemia e hipercapnia; los espiratorios (intercostales externos y abdominales), que determinan la aparición de tos ineficaz; y los que soportan la vía aérea superior (faringeos, palatinos, genioglosos), que afectan la deglución.4 En la cifoescoliosis grave el mecanismo es el aumento de la impedancia de la caja torácica, que determina un mayor trabajo respiratorio y una disminución de la fuerza de los músculos respiratorios, que pueden llevarlos a la fatiga muscular respiratoria. Aunque los mecanismos por los cuales la ventilación mecánica no invasiva es benéfica en esta entidad no están claramente establecidos, se sugieren los siguientes: – Reposo de los músculos respiratorios. – Mejoría de la sensibilidad del centró respiratorio al CO2. – Cambios en la mecánica pulmonar. – Mejoría de la arquitectura del sueño. Edema agudo de pulmón El efecto hemodinámico de la ventilación mecánica no invasiva no está totalmente claro; sin embargo, se piensa que ayuda a disminuir la presión transmural en el ventrículo izquierdo, a reducir la postcarga y a aumentar el gasto cardíaco.5 La influencia de la ventilación a presión positiva sobre el trabajo cardíaco es compleja, e involucra cambios en la precarga y la postcarga del corazón tanto en el ventrículo izquierdo como en el derecho. Para entender estos cambios es importante revisar la influencia de la presión torácica sobre la presión transmural del corazón (en condiciones asociadas a disminución de la compliance pulmonar la presión positiva tiende a comprimir el corazón y los vasos sanguíneos intratorácicos), ya que es la que determina el llenado ventricular (precarga) y la resistencia al vaciamiento ventricular (postcarga). Precarga: La presión positiva pulmonar reduce la distensibilidad Fallo respiratorio progresivo cardíaca, lo que puede disminuir el en la enfermedad neuromuscular llenado ventricular durante la diásColapso faríngeo Debilidad muscular tole. Además, la compresión sobre los vasos pulmonares puede aumenDisminución de la fuerza Apnea o hipopnea tar la resistencia vascular pulmonar muscular inspiratoria del sueño y disminuir el gasto del ventrículo derecho. En esta situación el venTos ineficiente Hipoventilación nocturna Alteración de la deglución trículo derecho se dilata y empuja Compromiso de la caja el septum interventricular hacia el torácica ventrículo izquierdo, lo que reduce Retención de CO2 su tamaño y contracción.6 Nicroatelectasias ↑HCO3 Postcarga: La compresión del co↓ distensibilidad pulmonar y torácica razón por la presión positiva dismi↓ ↓ nuye el llenado ventricular durante VT Ppl/Plmáx ↑Trabajo respiratorio la diástole. Esta misma compresión facilita el vaciamiento ventricular en ↑ Ppl/Pl ↓PaO2 ↓PaCO2 máx la sístole. En términos de precarga se dice que la transmisión incompleta Fatiga muscular inspiratoria de la presión positiva intratorácica ↓Riesgo de fatiga dentro de las cámaras ventriculares ↑PaCO2 ↓PaO2 disminuye la presión transmural a través de los ventrículos durante 80 Manejo Integral del paciente crítico nica se tratan con ventilación mecánica no invasiva, y es con ellas con las que más se han estudiado los mecanismos de acción de la misma. Se conoce que este sistema reduce el trabajo respiratorio y por consiguiente la fatiga muscular respiratoria al evitar el colapso alveolar y disminuir del mismo modo la presión necesaria para abrir los alvéolos y aumentar su volumen, lo que desplaza el punto de inflexión inferior hacia la derecha (hipercapnia). La VMNI, al ser un sistema a base de flujo y volumen, permite que el paciente aumente su volumen corriente y disminuya su frecuencia respiratoria, lo cual reduce la producción excesiva de ácido láctico, que incrementa la acidosis muscular. La ventilación mecánica no invasiva aumenta la presión alveolar, lo que aumenta la capacidad funcional residual y disminuye el shunt intrapulmonar (hipoxemia).7 la sístole, y ésto disminuirá la precarga ventricular. La administración de presión positiva al final de una expiración produce la apertura de los alvéolos inundados o colapsados, mientras aumenta la capacidad funcional y mejora el intercambio gaseoso. Además del efecto mecánico sobre los grandes vasos torácicos y la reducción de la potscarga cardíaca antes mencionada, la ventilación mecánica no invasiva merma el trabajo respiratorio en parte al reducir la resistencia de la vía aérea superior, que puede estar aumentada por el edema de tejido blando asociado a la falla cardíaca. Insuficiencia respiratoria aguda hipoxémica e hipercápnica En la actualidad, las insuficiencias respiratorias agudas hipoxémica e hipercáp- VENTILACIÓN MECÁNICA NO INVASIVA CPAP EPAP IPAP PEEP Fatiga músculos respiratorios Reclutaminento alveolar Relación V / P Presión trasmural Distensibilidad pulmonar Frecuencia respiratoria Shunt Acidosis muscular Volumen tidal PCO2 Enfermedad neuromuscular (ELA, Guillain Barrè) Gasto cardíaco Postcarga PO2 Insuficiencia respiratoria hipercápnica e hipoxémica (Epoc, asma, SDRA) Edema pulmonar cardiogénico Manejo Integral del paciente crítico 81 Indicación de la ventilación mecánica no invasiva Las indicaciones son muy variadas, tanto en la insuficiencia respiratoria hipoxémica como en la hipercápnica, entidades en las cuales se deben considerar criterios clínicos (disnea, frecuencia respiratoria, uso de músculos accesorios) como gasométricos (PO2 / FiO2, pH arterial, PCO2). Las indicaciones principales serían: 1. Descompensación de enfermedad neuro-muscular o de caja torácica. 2. Exacerbaciones de la EPOC. 3. IRA en el postoperatorio o postextubación. 4. Pacientes en espera de trasplante pulmonar. 5. Edema pulmonar cardiogénico con estabilidad hemodinámica. 6. Neumonía, asma, pacientes inmunocomprometidos. 7. Destete de la ventilación mecánica invasiva. 8. Situaciones de no respuesta a los tratamientos convencionales. Contraindicaciones de la ventilación mecánica no invasiva Absolutas 1. Paro cardíaco o respiratorio. 2. Encefalopatía aguda. 3. Inestabilidad hemodinámica. 4. Arritmias cardíacas inestables. 5. Hemorragia digestiva alta. 6. Neumotórax no drenado. 7. Cirugía facial, trauma o deformidad. 8. Paciente no colaborador. 9. Quemaduras o lesiones de la vía aérea superior. Relativas 1. Intolerancia-ansiedad. 2. Inadecuado manejo de secreciones. 3. Obstrucción de vía aérea superior. 82 Manejo Integral del paciente crítico 4. Glasgow < 10 5. Emesis, distensión gástrica. Predictores de éxito en ventilación mecánica no invasiva Los siguientes son factores que se consideran predictivos de éxito en la utilización de la ventilación mecánica no invasiva: • Enfermos jóvenes. • Menor gravedad establecida por el Apache o el SAPS. • Ausencia de enfermedad neurológica. • Buena adaptación al respirador y la interfase. • Dentición intacta. Ausencia de fuga de aire. • Hipercapnia no aguda ( PCO2 > 45 y < 92 mmHg). • Acidosis no severa ( pH < 7,35 y > 7,10). • Mejoría gasométrica y de la mecánica respiratoria durante las primeras dos horas. • Entrenamiento del personal. En un reciente estudio Antonelli, Massimo MD8 (2007) concluyen que un SAPS ll > 34 y la inhabilidad de mejorar la PaO2/FiO2 después de una hora son predictores de falla en ventilación mecánica no invasiva. Monitorización La utilización de la ventilación mecánica no invasiva exige más tiempo del personal, sobre todo en la primera media hora de implementación, puesto que es necesario la vigilancia estrecha del paciente para lograr una adecuada programación, de acuerdo con la tolerancia, los signos clínicos y la valoración subjetiva por el personal que la aplica. Se debe preguntar frecuentemente sobre la sensación de disnea y de fatiga, y observar si realmente ha disminuido el trabajo respiratorio del paciente. Objetivamente se debe valorar la frecuencia respiratoria, la frecuencia cardíaca, Equipos, modos e interfaces Respiradores volumétricos: Generalmente más sofisticados, poseen una monitorización más amplia y pueden ser ciclados por presión. Utilizados tanto para la VMNI como para la VMI, pero algunos no son capaces de compensar fugas de la interfase. Existen otros modos y equipos no disponibles en nuestro medio y que no están completamente aprobados, como la ventilación asistida proporcional y la ventilación mecánica no invasiva con presión negativa, modalidades a las cuales no se hará referencia. Equipos y modos Interfases la sincronía con el ventilador, la pulsoximetría, la presión arterial, el nivel de conciencia, la gasometría arterial después de una o dos horas, y posteriormente de cuatro a seis horas. La ventilación mecánica no invasiva cumplirá sus objetivos cuando se garantice una sincronía paciente/ventilador y el confort del paciente, lo que evita el trabajo muscular excesivo y genera alivio de la disnea. CPAP: Proporcionan una presión constante en la vía aérea en inspiración y espiración. Son incapaces de asistir la respiración activamente, por lo que no se consideran respiradores. Requieren suplemento adicional de O2 para regular FiO2. Es también un modo ventilatorio, frecuentemente más utilizado en edema pulmonar. BIPAP: Generan una presión de aire en inspiración y otra más baja en espiración, disminuyendo así el trabajo respiratorio y haciendo más confortable la ventilación. Los más modernos son capaces de asistir activamente la respiración del paciente, compensar fugas y monitorear frecuencia respiratoria y volúmenes. Al igual que el anterior, es un modo ventilatorio incorporado en los ventiladores modernos, más utilizado en Epoc, asma y enfermedades neuromusculares. Respiradores de presión: A ellos se anexan los dos anteriores. Los respiradores modernos incluyen modos como presión de soporte con la opción de programar un nivel de PEEP (presión positiva al final de la espiración), donde la frecuencia y la relación I/E están determinadas por el propio paciente y el modo de PC donde, además de presión, se programan la frecuencia respiratoria, el retardo inspiratorio y la relación I/E. Son los medios o aditamentos necesarios para conectar el tubo del respirador con la superficie facial del paciente. Deben ser cómodas, eficaces, transparentes, ligeras, inodoras, adaptables a diferentes tamaños, poco distensibles, fáciles de colocar, ofrecer baja resistencia al flujo y tener un espacio muerto mínimo. Existen diferentes clases, como: Mascarilla nasal: Se utiliza en pacientes con ventilación mecánica no invasiva de uso crónico. Es más cómoda, pero su eficacia depende de la colaboración del paciente, que debe mantener la boca cerrada. Es mejor tolerada, pero menos eficaz en reducir la PCO2 debido a la existencia de fugas.9 Mascarilla facial: Se aplica sobre la boca y la nariz, por lo que se desaparece la fuga oral. Es más útil en pacientes poco colaboradores, taquipneicos, ansiosos o con insuficiencia respiratoria aguda. Las modernas poseen válvula antiasfixia y reinhalación. Sistema Helmet “Casco”: Tipo escafandra, evita el apoyo sobre las estructuras faciales, por lo que es más cómoda y mejor tolerada. Se recomienda utilizarla con mayor presión de soporte y velocidad de flujo que con la mascarilla facial. Puede producir edema de miembros superiores, trombosis venosa, parestesias y lesión timManejo Integral del paciente crítico 83 pánica. El estudio de Taccone, Paolo MD et col10, concluye que el “casco” predispone la reihnalación de CO2 y no debería utilizarse para dar CPAP con ventilador, el uso de altos flujos minimiza la reinflación y que la PCO2 y la ventilación minuto deben ser monitorizadas durante CPAP con el casco. Distrés respiratorio Intubación Indicación No Sí VMNI INTUBE VMI Contraindicación Equipo interfase modo ventilatorio No Sí Prepare Aplique Posición 45º Retiro prótesis dentales Protección nasal Educación de paciente y su familia Evalúe y modifique parámetros 0 – 30’ ↓Disnea ↓Frecuencia respiratoria ↓Trabajo respiratorio ↓FC y presión arterial ↑Sincronía con VMNI ↑Gasimetría arterial 1 – 2 horas Considere No Mejoría (4 – 6 h) Sí Continúe tratamiento Evalúe Destete VMNI 84 Manejo Integral del paciente crítico EPOC: La VMNI en estos pacientes, con la modalidad presión de soporte, ayuda a disminuir la carga muscular inspiratoria. Si además añadimos una PEEP ligeramente menor (en torno al 80 – 90 % sería lo ideal) de la PEEPi, se contribuye a disminuir el trabajo respiratorio de esa primera fase de contracción isométrica. Se ha comprobado una clara disminución del trabajo inspiratorio cuando se ventila con apropiados niveles de presión inspiratoria y PEEP, aumentando el volumen corriente y disminuyendo la frecuencia respiratoria. La VMNI se asocia a una reducción significativa de la mortalidad y la necesidad de ventilación invasiva, y es más efectiva que el tratamiento convencional para mejorar el pH, el PCO2 y la oxigenación, como lo demuestran los diferentes estudios publicados ( Plant.11 2000; Peter JV, 2002; Daniel del Castillo, 2003;12 José Fernández Guerra. 200313). Aunque no hay consenso general en los parámetros iniciales puesto que varían entre los 8 – 12 cm de agua y los 15 – 18 cm de agua en general, en esta entidad se recomienda empezar la VMNI con doble nivel de presión en Bipap con modo espontáneo temporizado (S/T), IPAP de 10 – 12 cm H2O y EPAP de 5 – 7 cm H2O con FiO2 para alcanzar una saturación > de 90% e incrementar hasta alcanzar volúmenes corrientes entre 10 – 15 ml/kg de peso ideal. Edema pulmonar: Son varios los estudios que demuestran la efectividad de la VMNI como parte del manejo del edema pulmonar cardiogénico, como en el metanálisis de Masip et al14 del 2005 donde concluyen que disminuye la necesidad de intubación, la mortalidad y señalan que las diferencias entre el CPAP y la ventilación no invasiva con presión soporte no son significativas. Otro metanálisis15 desestima las precauciones del uso del Bipap en los pacientes con infarto de miocardio y sugiere que las posibles diferencias pueden presentarse por la experiencia del personal que aplica la VMNI. En la mayoría de estudios encontrados, el modo ventilatorio de mayor beneficio resultó ser el CPAP, comparado con el Bipap, con parámetros de inicio del CPAP de 10 cmH2O, aunque en la práctica la PS con PEEP adecuado es de gran ayuda para el manejo de pacientes con esta entidad. Asma y otras condiciones: El impacto de la VMNI en la falla respiratoria secundaria al estatus asmático no está bien definido, aunque sobre ello hay estudios interesantes, como el de D. Rodríguez et al,16 en el cual una de sus conclusiones señala: “La necesidad de conversión a ventilación convencional con intubación endotraqueal fue muy baja en esta serie y estuvo relacionada con la mala aceptación de la interfase, de manera que puede aceptarse que la ventilación no invasiva es eficaz para el manejo de las agudizaciones graves del asma bronquial”; sin embargo, la mayoría de las revisiones sistemáticas concluyen que faltan estudios controlados randomizados que demuestren su efectividad y sirvan para determinar, por tanto, el mejor equipo, modo y parámetros de inicio para el manejo de las agudizaciones del asma, como también el papel de la VMNI en el síndrome obesidad-hipoventilación. Aplicación de la VMNI Para lograr una adecuada colaboración del paciente y de su familia debemos explicarles la necesidad de la implementación de esta modalidad para su bienestar: 1. Instruya al paciente que debe respirar por la nariz con boca cerrada y la necesidad de no hablar durante la VMNI (para evitar distensión gástrica). 2. Suspenda vía oral o nutrición. 3. Coloque al paciente en posición de 30 – 45 grados. 4. Proteja el tabique nasal con apósito (duoderm). Manejo Integral del paciente crítico 85 5. Programe el ventilador en presión soporte, BIPAP o CPAP según patología (siempre con mínimo de Ipap de 10 cm H2O y Epap de 5 cm H2O). 6. Aplique la máscara seleccionada inicialmente sin arnés e intermitente hasta asegurar buena tolerancia. 86 Manejo Integral del paciente crítico 7. Sujete el arnés y verifique fugas mínimas, evitando hacer presión sobre los ojos y las orejas. 8. Modifique parámetros según valoración subjetiva y objetiva del paciente. 9. Valore constantemente el estado y el confort del paciente. Bibliografía 1. 2 3 4 5 6 7 8 9 10 11 12 13 Collins, Sean P. MD, MSC; Mielniczuk. The Use of Noninvasive Ventilation in Emergency Department Patients With Acute Cardiogenic Pulmonary Edema: A Systematic Review. Annals of Emergency Medicine. 48(3):260-269e4, September 2006. R. Artacho Ruíz et al. Ventilación no Invasiva Aplicada por Facultativos de Urgencias en Atención Primaria: SEMERGEN. 2005 ; 31(11):521-7 KA Wood, L Lewis, B Von Harz and MH Kollef. The use of noninvasive positive pressure ventilation in the emergency department: results of a randomized clinical trial. Chest, Vol 113, 1339-1346. C. Lisboa, Q Díaz y R. Fadic. Ventilación mecánica no invasive en pacientes con enfermedades musculares y alteración de la caja torácica. Arch Bronconeumol 2003; 39(7): 314-20. R. Orejón, P. Ureta Tolsada. Ventilación mecánica no invasiva. Revista Española de Anestesiología. Reanim. 2005; 2 : 88-100 Paul L. Marino. ICU . lll Edición 2007. by Lippinctt Willian American Thoracic Society. International Consensus Conferences in Intensive Care Medicine: Noninvasive Positive Pressure Ventilation in Acute Respiratory Failure. Am J Respir Crit Care Med Vol 163. pp 283-291, 2001 Antonelli, Massimo MD; Conti, Giorgio MD; Esquinas, Antonio MD. A multiple-center survey on the use in clinical practice of noninvasive ventilation as a first-line intervention for acute respiratory distress syndrome. 2007 Lippincott Williams & Wilkins, Inc. Volume 35(1), January 2007, pp 18-25. S, Díaz Lobato, Ventilación no invasiva. Arch Bronconeumol 2003 ; 39 (12): 566 – 79 Taccone, Paolo MD; Hess, Dean PhD, RRT; Caironi, Pietro MD; Bigatello, Luca M. MD. Continuous positive airway pressure delivered with a “helmet”: Effects on carbon dioxide rebreathing *: Crit Care Med, Volume 32(10)_October 2004_2090-2096. Plant Pk, Owen Jl. Early use of noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease on general respiratory wards: a multicenter randomized controlled trial. Lancet 2000; 335: 1931-1935. Daniel del Castillo, Emilia Barro T, Remedios Otero; Ventilación no invasiva por soporte de presión en pacientes con enfermedad pulmonar obstructive crónica en insuficiencia respiratoria aguda hipercápnica ingresados en una unidad de neumología convencional. Med Clin (Barc) 2003:120 (17):647-51. José Fernández Guerra et al. Metanálisis de la eficacia de la ventilación mecánica no invasiva en la exacerbación aguda de la Epoc. Med Clin (Barc) 2003; 120(8):281-6 14 Masid . Noninvasive Ventilation in Acute Cardiogenic Pulmonary Edema: Systematic Review and Meta-analysis.[Review]JAMA. 294(24):3124-3130, December 28, 2005 15 Caples, Sean M. DO; Gay, Peter C. MD. Noninvasive positive pressure ventilation in the intensive care unit: A concise review. Lippincott Williams & Wilkins, Inc. Volume 33(11), November 2005, pp 2651-2658 16 Daniela Rodríguez Menéndez M.D. 1, Aurelio Rodríguez Fernández M.D.2, Daimarelis Rodríguez G M.D.3, Josefina Bruzos Gordín M.D. 4, Ventilación Mecánica No Invasiva en Pacientes Asmáticos. Medicrit 2005; 2(5):62-71 17. Carvalho, Werther Brunow MD; Johnston, Cíntia RRT. The fundamental role of interfaces in noninvasive positive pressure ventilation.; The Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies Volume 7(5), September 2006, pp 495-496 18. Oh, Younsuck MD, PhD, FCCM. Indications for Noninvasive Positive Pressure Ventilation. Lippincott Williams & Wilkins, Inc. Volume 43(4), Fall 2005, pp 109-117 19 Dueñas-Pareja,a S López-Martín,a J GarcíaGarcía,a R Melchora.. Ventilación no invasiva en pacientes con encefalopatía hipercápnica grave en una sala de hospitalización convencional. Arch Bronconeumol 2002; 38: 372 - 375 20 Caples, Sean M. DO; Gay, Peter C. MD. Noninvasive positive pressure ventilation in the intensive care unit: A concise review. Lippincott Williams & Wilkins, Inc. Volume 33(11), November 2005, pp 2651-2658. 21 Peter JV, Moran JL. Noinvasive Ventilation in Acute Respiratory Failure. A Meta- Analysis update. Cric Cara Med : 2002; 30: 555-62 22 S. Lasdica D. Fainsteis. P. Casasa I. Frizzaa M. Ontiveroa J. P. Giussania R. Urizar. Ventilación mecánica no invasiva en la lesión pulmonar aguda hipoxémica. Medicina Intensiva: Noviembre 2001. Volumen 25 Número 08 p. 303 - 309 23 Keenan, Sean P. MD, FRCPC, MSc (Epid); Sinuff, Tasnim MD. Does noninvasive positive pressure ventilation improve outcome in acute hypoxemic respiratory failure? A systematic review. Lippincott Williams & Wilkins, Inc. Volume 32(12), December 2004, pp 2516-2523 24 Matteo Giacomini, MD; Gaetano Iapichino, MD; Marco Cigada. Short-term Noninvasive Pressure Support Ventilation Prevents ICU Admittance in Patients With Acute Cardiogenic Pulmonary Edema. Chest. 2003;123:2057-2061. Manejo Integral del paciente crítico 87 88 Manejo Integral del paciente crítico 8. Estrategias de protección pulmonar MARTHA VIVIANA PINEDA VÉLEZ Introducción La ventilación mecánica, a pesar de sus reconocidos beneficios y amplias indicaciones como herramienta terapéutica, no se encuentra exenta de complicaciones. La más significativa de ellas, inherente a su propio uso, lo constituye la lesión pulmonar asociada o inducida. En la lesión pulmonar asociada a la ventilación mecánica, el evento inicial puede ser de naturaleza mecánica y tiene el riesgo potencial de disparar una compleja cascada de eventos locales o sistémicos, que desencadenan una liberación de mediadores inflamatorios. Esto es de capital importancia si tenemos en cuenta que la superficie epitelial más grande del organismo es la pulmonar (varía entre 50 – 100 cm2), lo cual la hace muy susceptible a lesiones de diversa índole, y la célula no parenquimatosa más abundante en dicho tejido son los macrófagos alveolares, células con reconocidas funciones en la cascada inflamatoria. Desde las primeras descripciones de SDRA y su tratamiento con ventilación mecánica alrededor de 1967 y 1971, la única intervención terapéutica que ha demostrado de manera convincente una significativa reducción en la mortalidad de pacientes con LPA y SDRA es la ventilación mecánica con estrategias de protección pulmonar (EPP), cuyo objetivo principal se fundamenta en la mejoría de la función pulmonar simultánea a la prevención del colapso alveolar persistente de unidades potencialmente reclutables, sumado a la reducción de la apertura cíclica del tejido pulmonar generada por el estiramiento que genera la presión positiva de la ventilación mecánica; y su más relevante resultado es la disminución de las complicaciones pulmonares y de la mortalidad en pacientes que han desarrollado SDRA, con efectos positivos adicionales relacionados con la oxigenación y distensibilidad pulmonar. Dichos efectos producidos por las EPP en su objetivo de minimizar la lesión pulmonar no se limitan al sistema respiratorio; incluyen también importantes beneficios sistémicos como: • Disminución de la liberación de mediadores proinflamatorios. • Disminución de la diseminación de infecciones. • Disminución de complicaciones relacionadas con el embolismo aéreo. Manejo Integral del paciente crítico 89 A partir de la idea de que enfrentamos una situación clínica de difícil solución, cuyo origen en ocasiones se asocia con múltiples lesiones orgánicas, conviene revisar los mecanismos de producción de la lesión pulmonar y a partir de ellos orientar nuestros objetivos e intervenciones terapéuticas hacia el uso de una ventilación mecánica racional, teniendo presente que ésta es una herramienta terapéutica dinámica que permite variaciones derivadas de la evolución y la gravedad de la enfermedad. Fisiopatología de la lesión asociada o inducida por la ventilación mecánica (LPAVM) Teniendo presente que en condiciones normales el proceso ventilatorio es generado por presión negativa dentro del tórax, no es difícil inferir que en condiciones de ventilación asistida mecánicamente con presión positiva se presentan importantes diferencias que afectan de manera significativa el proceso respiratorio y la mecánica pulmonar de los pacientes en unidades de terapia intensiva. Desde 1970 se han publicado múltiples descripciones sobre los sucesos fisiopatológicos relacionados con la lesión asociada a la ventilación mecánica. Presentamos a continuación los aspectos más relevantes: 1. Toxicidad por oxígeno cuando los valores superan el 0.6 de FiO2. 2. Ruptura de los septos alveolares cuando se emplean volúmenes corrientes altos (> 8 – 10 ml/kg) lo que se conoce como volutrauma. 3. Filtraciones de aire ante la presencia de presiones altas en la vía aérea (> 40 cm H2O). Se conoce como barotrauma. 4. Pérdida de volumen pulmonar por la presencia de lesiones epiteliales y endoteliales, zonas del pulmón con edema alveolar y el intersticio rico en proteínas, que determinan un déficit en 90 Manejo Integral del paciente crítico la acción del surfactante pulmonar con la consecuente tendencia a la atelectasia. Esto se denomina atelectrauma. También es ocasionado por la apertura y cierre cíclico de las unidades alveolares, que someten el tejido pulmonar a amplias variaciones de volumen durante la ventilación. 5. Inflamación pulmonar por la presencia de citoquinas y mediadores inflamatorios en el interior del parénquima pulmonar y a nivel intersticial, estimulada por mecanotransducción, recientemente descrito como biotrauma. Estímulo mecánico Inflamación local (macrófagos, neutrófilos, células epiteliales) Interrupción barrera Disminución en el espacio aéreo y aclaramiento del edema Edema pulmonar Múltiple lesión celular (necropsis/apoptosis) Falla orgánica multisistémica Figura 1. Mecanismos potenciales de LPAVM.3 El principal mecanismo de lesión asociada a la ventilación mecánica es la disrupción de la membrana alvéolo-capilar, que conlleva la formación de edema alveolar por aumento de la permeabilidad con la consecuente liberación de citoquinas proinflamatorias en la circulación pulmonar y sistémica. En el pulmón los alvéolos se ocupan por fluidos, lo cual causa el colapso alveolar por inactivación del factor surfactante. En todo el organismo migran los mediadores proinflamatorios, que activan los sistemas de coagulación, el complemento fibrinolítico, el metabolismo del ácido araquidónico y de agentes proteolíticos y oxidantes con producción de daño hístico y apoptosis celular renal, elevación de los niveles de creatinina plasmática y un incremento en la permeabilidad intestinal (Figura 1). Todo lo anterior indica que la ventilación mecánica puede ser altamente nociva en presencia de estas condiciones fisiopatológicas que incluyen fenómenos tanto mecánicos como histológicos y explican parcialmente el progreso de los pacientes con SDRA hacia la disfunción orgánica múltiple y la disminución de la mortalidad observada en pacientes tratados con estrategias de protección pulmonar; por tal motivo, las recomendaciones actuales están dirigidas a minimizar el daño disminuyendo la cantidad de volumen y presión que se ofrece durante la asistencia ventilatoria. Dreysuss y Saumon realizaron trabajos experimentales decisivos que remarcan la evidencia del daño celular e introducen el concepto de lesión pulmonar inducida por la ventilación mecánica. Las estrategias de protección pulmonar surgen como respuesta y puntos clave de manejo del paciente con riesgo de desarrollar lesión pulmonar aguda asociada a la ventilación mecánica, especialmente de aquellos cuya patología pulmonar cursa por estadios de mayor gravedad, y persigue como principales objetivos: • Mejorar la función pulmonar global en términos de oxigenación y distensibilidad del tejido pulmonar. • Reducir la aparición de complicaciones asociadas con la ventilación mecánica. • Disminuir el tiempo de ventilación mecánica. • Incrementar el destete ventilatorio exitoso. Las estrategias de protección pulmonar están basadas en el mantenimiento de una presión inspiratoria baja, usualmente inferior a 20 cm de H2O sobre el nivel de PEEP (presión positiva al final de espiración), sumado al uso de volúmenes corrientes bajos que simultáneamente regulan los niveles de CO2, evitan el colapso alveolar, mantienen los niveles de PEEP óptima y a su vez minimizan el estrés del epitelio pulmonar durante los ciclos de ventilación. Para lograr los efectos de reclutamiento alveolar máximos es preciso recordar que la ventilación pulmonar no es un proceso homogéneo, pues se encuentran unidades potencialmente reclutables (aquellas que se hallan anatómicamente preservadas pero que requieren una mayor presión de apertura para permitir su aireación o inflación) junto a unidades que están ya reclutadas, lo cual dificulta precisar los valores adecuados para alcanzar el reclutamiento alveolar dentro de los límites de seguridad. Estudios dirigidos por L. Gattinoni, con imágenes de TAC, muestran cómo el volumen pulmonar de pacientes con SDRA se encuentra marcadamente disminuido por el colapso alveolar de las zonas declives y que la distensibilidad de las zonas sanas era normal. Concluye que al utilizar un volumen calculado para un pulmón normal, se produce sobredistensión de las zonas sanas con el consecuente empeoramiento del daño. Éste es sólo un sencillo ejemplo que nos permite visualizar la complejidad que implica el uso de las estrategias de protección pulmonar y el reto que representa para quienes abordan pacientes en unidades de terapia intensiva. Profundizaremos sobre los diferentes aspectos que se toman en cuenta con el uso de las estrategias de protección pulmonar recomendadas para la prevención y el manejo de la lesión pulmonar asociada a la ventilación con presión positiva. Alternativas terapéuticas Volumen corriente bajo Para los autores que participaron en el ARDS Network, el verdadero determinanManejo Integral del paciente crítico 91 bajos, no consiguieron demostrar mejoría en la supervivencia (Tabla 1). El incremento de la mortalidad se demostró sólo cuando los pacientes que fueron sometidos a ventilación mecánica convencional tuvieron valores de presión de meseta que excedían los 32 cm de H2O. El pulmón normal es distendido al máximo con una presión transpulmonar de 30 – 35 cm H2O. Valores superiores generan sobredistensión. En el paciente en ventilación mecánica, las medidas de presión están dadas por la presión inspiratoria máxima o pico, la presión de meseta o plateau y la presión positiva al final de espiración (PEEP). La medida que mejor refleja la presión alveolar es la presión de meseta, así que el monitoreo respiratorio debe concentrarse en la medición de dicha presión para determinar la presencia de sobredistensión alveolar, ya que es poco probable que incrementos en la presión inspiratoria máxima sin elevación concomitante de la presión de meseta 0.6 generen sobredistensión, debido Volúmenes corrientes bajos Volúmenes corrientes normales a que el gradiente entre estas dos 0.5 presiones está altamente rela0.4 cionado con la resistencia de la 0.3 vía aérea al flujo de aire. En las 0.2 unidades de terapia intensiva, el modo de elección para el inicio de 0.1 la ventilación mecánica está usual0.0 0.15 - 0.40 0.41 - 0.50 0.51 - 0.62 0.63 - 1.5 mente limitado por volumen, de Cuartil de compliance estática tal manera que las presiones en la (ml/cc de agua/kg de peso corporal predicho) vía aérea son una resultante deriFigura 2. Mortalidad del distrés respiratorio agudo. vada del volumen corriente proMortalidad te de la protección pulmonar y la buena evolución del paciente con LPA o SDRA lo constituye el uso de volúmenes corrientes bajos. Algunos estudios han pretendido demostrar una importante relación entre mortalidad y el uso de volúmenes corrientes bajos. M. Amato y col., tras un estudio significativo, reportan una disminución de la mortalidad en un 46%. The Acute Respiratory Distress Síndrome Network, trabajo publicado en el año 2000 en New England Journal of Medicine (ARDS Network) con una muestra de 861 pacientes en 10 centros hospitalarios, finalizó con anterioridad debido a la diferencia significativa en la mortalidad (39.8% vs 31%) y a la menor cantidad de días en ventilación mecánica (12+- 11 vs 10+- 11) entre el grupo control y el grupo manejado con estrategias de protección pulmonar. Este fue el estudio más concluyente. Por el contrario, en los trabajos de Stewart y col., Brochard y col. y Brower y col., pese a que usaron volúmenes Tabla 1. Estudios que comparan la mortalidad con el uso de volumen corriente bajo.32 Estudio No. Pacientes Amato et al.14 Stewart et al.14 Brochard et al.13 Brower et al.15 ARDSNet et al.12 53 120 116 52 861 VT, ml/kg Bajo Alto 11.9 ± 0.5 6.1 ± 0.2 7.2 ± 0.8 10.8 ± 1.0 7.2 ± 0.2 10.4 ± 0.2 7.3 ± 0.1 10.2 ± 0.1 6.3 ± 0.1 11.7 ± 0.1 * Datos presentados con desviaciones estándar a menos que se indique de otra manera. 92 Manejo Integral del paciente crítico Bajo 38 50 47 50 31 Mortalidad % Alto 71 47 38 46 40 p Valor < 0.001 0.72 0.38 0.60 0.007 gramado. De aquí surge la recomendación de mantener presiones de meseta inferiores a 30 cm H2O como estrategia de protección pulmonar, para lo cual en pacientes con diversos grados de SDRA con compromiso de la distensibilidad pulmonar se requiere el empleo de volúmenes corrientes bajos, 6 – 8 ml/kg de peso ideal, y en pacientes con SDRA grave incluso entre 4 – 6 ml/ kg para no exceder los niveles de presión permitidos; sin embargo, el costo de esta medida terapéutica es la hipercapnia y el deterioro en los niveles de oxigenación por disminución del volumen alveolar. Surgen a partir de estos efectos colaterales otras alternativas dentro de las estrategias de protección pulmonar como la hipercapnia permisiva y el uso de PEEP como medida para optimizar la oxigenación, que se emplean de manera simultánea en los pacientes con LPA y SDRA (Figura 3). Sobredistensión alveolar Ventilación protectora 1.000 Volumen total (ml) 600 400 200 0 0 2 4 6 Segundos 800 600 600 400 400 200 200 0 0 Elección de la FiO2 Esta elección constituye un elemento incluido en una estrategia de ventilación del paciente con LPA o SDRA, y nuestra meta debe ser intentar corregir el mecanismo responsable de los trastornos de la oxigenación y no simplemente elevar la PaO2, cuya caída es una consecuencia. La hiperoxia causada por el uso indiscriminado de altas concentraciones de oxígeno (>0.6) produce toxicidad e incrementa la susceptibilidad del tejido pulmonar a la lesión. De aquí que incrementos en la FiO2 se aceptan de manera transitoria mientras se aborda la causa y se consideran otras medidas terapéuticas. Elección de la PEEP Ventilación convencional 800 de la FiO2 y la PEEP. Ambos tratamientos tienen potenciales efectos adversos que deben ser considerados de manera cuidadosa e individual con cada paciente. 10 20 30 Presión (cm de agua) 40 0 0 2 4 6 Segundos Colapso alveolar Figura 3. Uso de volúmenes corrientes bajos más nivel óptimo de PEEP. 4 PEEP óptimo Como se mencionó en el capítulo de LPA y SDRA, una característica fisiopatológica significativa en el SDRA es el desarrollo de hipoxemia refractaria. La mayoría de los pacientes que cursan con estas patologías requieren de un soporte en la oxigenación con una combinación entre incrementos La PEEP reduce el shunt intrapulmonar y mejora la oxigenación arterial, permitiendo con ello el uso de concentraciones de oxígeno inferiores a 0.5, correspondientes al rango terapéutico y consideradas seguras en pacientes que cursan con algún grado de LPA; sin embargo, el uso de PEEP produce también efectos adversos bien conocidos, como la disminución del retorno venoso, gasto cardíaco, incremento en la resistencia vascular pulmonar, formación de edema y espacio muerto. En pacientes con SDRA de origen intrapulmonar el uso de PEEP, adicionalmente, incrementa el volumen alveolar y las fuerzas de estiramiento durante los ciclos ventilatorios con consecuente aumento del riesgo de barotrauma, atelectrauma y lesión asociada a la ventilación mecánica. A partir de las teorías anteriores surge la definición de PEEP óptimo como aquel que me permita gozar de sus beneficios sin alcanzar los potenciales efectos adversos. Manejo Integral del paciente crítico 93 Dicho en otras palabras, se debe optar por el nivel más bajo de PEEP que permita alcanzar una PaO2 > 60 mmHg o una SpO2 > 90%, siendo estrictos en mantener la FiO2 inferior a 0.5; no obstante, en la práctica clínica encontramos pacientes que cursan por estadios muy graves de SDRA con importantes trastornos en la difusión y oxigenación que requieren niveles mucho más altos para alcanzar dichos objetivos, e incluso se observa que, paradójicamente, cuando se alcanzan valores por encima de 12 cm H2O se produce una caída en la PaO2. La razón de este retroceso en la oxigenación es la disminución de la perfusión, que ocurre en unidades alveolares sobredistendidas. Si recordamos que la ventilación alveolar no es homogénea y que varía en relación con las diferentes zonas pulmonares, podemos inferir que un mismo nivel de PEEP puede ser suficiente para reclutar ciertas zonas del pulmón, pero para otras no. Lo ideal sería poder determinar el punto en el cual se antagonizan las presiones que favorecen el colapso alveolar, lo cual es difícil de medir en la práctica clínica. En una curva de presión-volumen el punto de inflexión inferior delimita el punto de apertura crítico de las unidades alveolares, a partir del cual se produce el máximo reclutamiento alveolar, ya que 12 Zonas de lesiones 10 Inflexión superior Volumen (ml) 8 6 4 Inflexión inferior 2 0 0 5 10 15 20 25 30 35 Presión (cm H2O) Figura 4. Curva estática de presión-volumen.3 94 Manejo Integral del paciente crítico frente a pequeños cambios de presión se generan grandes cambios de volumen. Ocurre lo opuesto cuando se alcanza el punto de inflexión superior, donde a pesar de grandes cambios de presión no se producen importantes cambios en el volumen pero sí se presentará la sobredistensión alveolar. Se han descrito muchos métodos para determinar este valor, como la ubicación del punto de inflexión inferior en una curva estática de P/V y la correlación entre la distensibilidad estática y la PaO2, pero en muchas ocasiones, cuando nos enfrentamos a situaciones clínicas de difícil resolución, es válido optar por el uso de maniobras de reclutamiento alveolar, que permiten alcanzar presiones en la vía aérea capaces de superar las presiones críticas de apertura del mayor número de unidades alveolares posibles, incluyendo no sólo las zonas que se desreclutan en espiración sino aquellas unidades o zonas con pérdida definitiva del volumen alveolar, lo que permite que una mayor superficie pulmonar se encuentre disponible para el intercambio gaseoso y a su vez evita los ciclos de colapso y reapertura que tienen lugar en las zonas más declives, en un intento por anular uno de los principales mecanismos involucrados en la lesión inducida o asociada a la ventilación mecánica. El mejor método para determinar el PEEP óptimo no se ha establecido, ya que la mayoría requiere de tiempo así como del uso de bloqueadores neuromusculares o sedación profunda, lo cual los hace alternativas poco útiles para los pacientes en la UCI. Para Amato y col., el verdadero mecanismo de protección pulmonar se encuentra en el uso de PEEP alta sin superar una presión de meseta de 30 cm H2O, con un valor menor para el uso de volúmenes corrientes bajos. En sus estudios emplea un PEEP de 2 cm H2O sobre el punto de inflexión inferior. Hipercapnia permisiva La tolerancia de altos niveles en la presión arterial de CO2 más que una alternativa surge como una consecuencia del uso de volúmenes corrientes bajos como estrategia de protección pulmonar. La acidosis respiratoria puede ser bien tolerada y los objetivos de protección pulmonar en pacientes con LPA y SDRA son más importantes que los objetivos ácido-base tradicionales. En ausencia de clara contraindicación impuesta por el sistema cardiovascular o neurológico, la hipercapnia permisiva debe ser considerada como estrategia ventilatoria cuando los niveles de CO2 se encuentran elevados, frente a las serias desventajas que produciría optar por un incremento de la frecuencia respiratoria, como lo son el aumento del espacio muerto con la subsiguiente disminución de la ventilación alveolar y la aparición de autopeep, con el efecto paradójico de mayor retención de CO2 por tiempo espiratorio insuficiente. La hipercapnia grave puede tener efectos adversos que comprometen los sistemas cardiovascular y nervioso central, el equilibrio ácido-base y alteraciones en el transporte de oxígeno: • Incremento de la presión endocraneana por vasodilatación cerebral. • Depresión en la contractilidad miocárdica. • Incremento de la actividad simpática con aumento en la liberación de catecolaminas y vasoconstricción periférica. • Hipertensión pulmonar. • Depresión del flujo sanguíneo renal mediado por vasoconstricción adrenérgica. • Aumento de la excreción de ácidos y aumento de la producción de bicarbonato como medida compensatoria frente a la acidosis. • Disminución de la presión alveolar y arterial de oxígeno derivado de la ecuación del gas alveolar. La hipercapnia no es inocua. El objetivo terapéutico se concentra en evitar la caída del pH a niveles inferiores de 7.20 con gran variabilidad en la tolerancia de los niveles de CO2 siempre que se pretenda evitar la sobredistensión pulmonar. El paciente debe estar suficientemente bien sedado para evitar la lucha fisiológica contra la narcosis inducida por CO2 y debe desarrollarse de forma gradual que permita la adaptación renal (alcalosis metabólica que se presenta entre las 24 – 48 horas de la exposición a la hipercapnia) y que la caída del pH favorezca también la entrega tisular de oxígeno al desviar la curva de disociación de la hemoglobina hacia la derecha. Ventilación controlada por presión Cuando se selecciona el modo de ventilación limitada por presión, la presión máxima de la vía aérea y la distensibilidad pulmonar determinan el volumen corriente, de tal manera que éste es una resultante. Por ello esta forma asegura no superar la presión inspiratoria máxima preestablecida por el operador del ventilador, aunque el volumen puede variar según las condiciones mecánicas del sistema respiratorio. Constituye una estrategia útil en la práctica clínica cuando nos enfrentamos a pacientes cuya distensibilidad se encuentra extremadamente baja y la ventilación limitada por volumen conlleva el incremento de la presión inspiratoria máxima en la vía aérea, aun cuando se emplea como estrategia el uso de volúmenes corrientes bajos, ya en el límite inferior de 5 ó 4 ml/kg de peso ideal. En este caso se considera el uso de la ventilación limitada por presión de tal forma que se seleccione un valor de presión ideal inferior del que podría causar lesión pulmonar por sobredistensión, lo cual, como hemos visto, es muy variable para cada paciente. Manejo Integral del paciente crítico 95 El control de la presión provee altos flujos inspiratorios, lo cual da más tiempo al volumen corriente para distribuirse entre las unidades alveolares a pesar de la diferencia de resistencia y así mejorar la relación V/Q, además de elevar la presión media de la vía aérea, lo cual se correlaciona también con mejoría en la oxigenación. Por estas razones la PC parece una alternativa atractiva para optimizar la oxigenación; sin embargo, los estudios no han logrado demostrar mayor o menor incidencia en la mortalidad entre la ventilación limitada por volumen y la limitada por presión. Patrón de onda desacelerante Esta medida consiste en modificar la forma en que se entrega el volumen a un paciente que es ventilado con límite de volumen. Al inicio de la fase inspiratoria el ventilador parte de una alta velocidad de flujo, el cual disminuye de manera progresiva hasta finalizar la entrega del volumen preestablecido. Constituye el mejor patrón de onda cuando los objetivos son disminuir la presión inspiratoria máxima, por lo que es una medida de gran utilidad y ampliamente usada en pacientes con incremento de la resistencia en la vía aérea o con disminución de la distensibilidad. Figura 5. Flujo Figura 5. Gráfica de flujo-tiempo Inversión de la relación I:E En condiciones fisiológicas la relación entre los tiempos de duración de ambas fases del proceso ventilatorio es de 1:2 para la inspiración y espiración, respectivamente. Cuando se inicia la ventilación 96 Manejo Integral del paciente crítico mecánica se pretende mantener dicha relación dentro de los parámetros normales. En situaciones clínicas específicas, la tendencia es a prolongar la fase espiratoria, como en los pacientes con patologías obstructivas de la vía aérea, quienes requieren de mayor tiempo espiratorio para evitar la hiperinsuflación dinámica. Sin embargo, en casos de hipoxemia grave y disminución de la distensibilidad pulmonar es necesario el incremento progresivo de los parámetros ventilatorios para optimizar los niveles de oxigenación. Una de las alternativas disponibles para incrementar dicho valor es el incremento de la presión media de la vía aérea, la cual se puede lograr mediante cuatro formas: elevando la PIM, incrementando la PEEP, empleando un patrón de onda cuadrada y prolongando el tiempo inspiratorio. En este último punto se basa la ventilación con relación I:E invertida. Cuando se agotan las estrategias de protección pulmonar tendientes a minimizar el daño por sobredistensión, y hemos alcanzado ya valores críticos en el límite superior de lo permisible relacionados con el uso de PEEP y presión inspiratoria máxima en la vía aérea, es útil recurrir a la inversión de la elevación I:E como medida para optimizar la oxigenación en aquellos pacientes con graves trastornos de la difusión. El tiempo inspiratorio prolongado asegura una ventilación más homogénea y un mayor tiempo de apertura alveolar con mantenimiento del contacto en la membrana alveolo-capilar, lo cual permite o facilita el intercambio de gases. Si se mantienen los valores de frecuencia respiratoria, el incremento de las presiones se realiza a expensas del tiempo espiratorio, lo que genera autopeep al alcanzar valores de relación I:E de 1:1 hasta 2:1 o incluso 3:1, según se modifiquen los parámetros de tiempo o flujo inspiratorio. En pacientes cuyo modo ventilatorio se encuentre limitado por volu-