ESTRUCTURA ATÓMICA
Anuncio
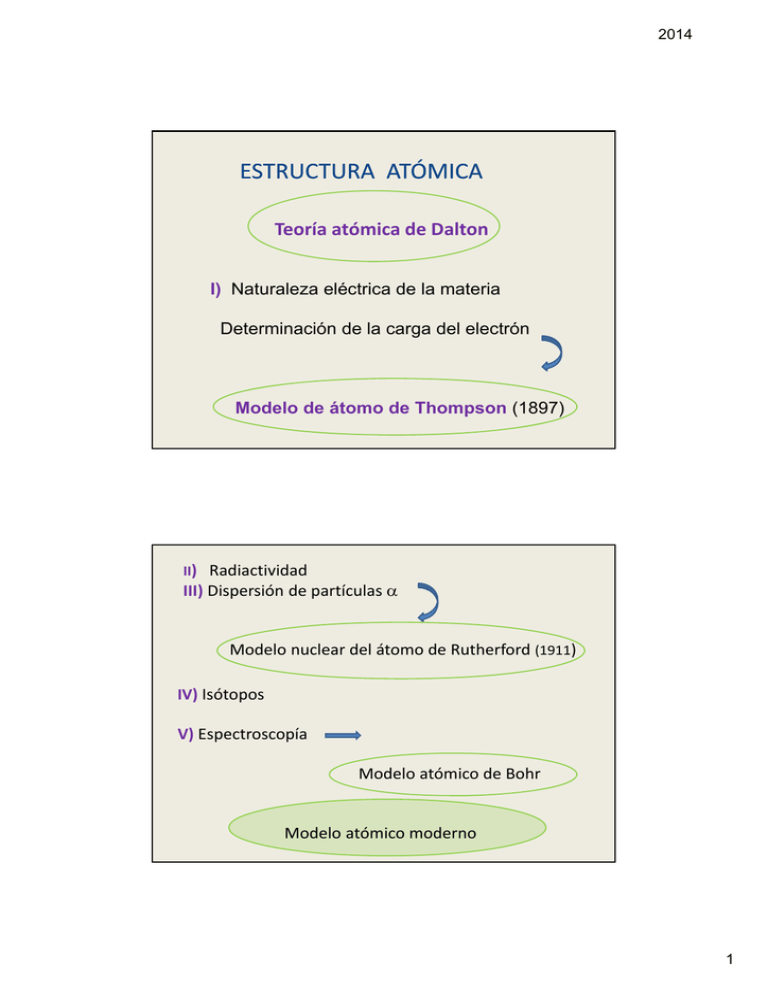
2014 ESTRUCTURA ATÓMICA Teoría atómica de Dalton I) Naturaleza eléctrica de la materia Determinación de la carga del electrón Modelo de átomo de Thompson (1897) II) Radiactividad III) Dispersión de partículas α Modelo nuclear del átomo de Rutherford (1911) Modelo nuclear del átomo de Rutherford IV) Isótopos V) Espectroscopía Modelo atómico de Bohr Modelo atómico moderno 1 2014 I) Naturaleza eléctrica de la materia Conducción electrolítica de la corriente eléctrica i Observaciones de Faraday y Se producen cambios químicos en soluciones acuosas cuando circula a través de ellas una corriente eléctrica i • Thompson (1897) Tubos de descarga altos voltajes y bajas presiones ( 10‐4 Torr) S + N Placa de ZnS El gas conduce la corriente eléctrica mediante los • viajan en línea recta • tienen masa • son Θ ELECTRONES “rayos catódicos” 2 2014 Determinada estudiando la magnitud de la desviación en el campo magnético. q/ m = 1,76 108 coul/g De otras experiencias con tubos de descarga conteniendo H De otras experiencias con tubos de descarga conteniendo H2 a a bajas presiones Se descubrieron partículas ⊕ con masa igual a la del átomo de H y carga igual a la del e‐ con signo opuesto e- distribuidos PROTONES Modelo de átomo Thompson al azar, compensando las cargas. Una esfera con carga ⊕ distribuida uniformemente Determinación de la carga del electrón Experimento de la “ gota de aceite” de Millikan Pudo calcular q = 1,6 .10‐19 C ⇒ m= 9,1 10‐28 g 3 2014 II) RADIACTIVIDAD Becquerel Existen elementos (U, Th, Ra, etc) que emiten radiación espontáneamente Radiación α : Radiación α : núcleos de He : partículas de masa 4 veces la del H y ú l d H tí l d 4 l d lH con 2 cargas ⊕ Radiación β : partículas con carga y masa igual al electrón Radiación γ: Radiación electromagnética de baja λ y alta energía ( > que Rx) III) Dispersión de partículas α Modelo nuclear del átomo de Rutherford ranura hoja de oro Pantalla detectora Emisor de partículas α 4 2014 Observó : la mayoría de las partículas no se desviaba unas pocas partículas α rebotaban en la lámina Partículas α incidentes como si hubieran interactuado con una gran masa y carga + núcleos sólo una fracción muy pequeña de todo el volumen concentra toda la masa. Rutherford propone Átomos de oro Modelo nuclear del átomo Átomo constituido por 1 núcleo donde se concentra toda la masa +, del orden de 10 –12 cm ⊕ e- Los e‐ giran alrededor (“como un sistema solar”) 100 m ( 25 pisos) φ = 1 cm • φNúcleo = 10-12 cm φÁtomo = 10-8 cm Los átomos son neutros n° e‐ = n° protones φNúcleo ≅ 10000 veces menor que φÁtomo 5 2014 número atómico Z = n° protones determina su identidad = n° total de cargas en el núcleo n p = n e- A= Z + N número de masa = n° protones + n° neutrones NEUTRONES descubiertos por Chadwich (1932) Partícula sin carga y masa ligeramente superior al protón. Simbolismo de las partículas subatómicas carga masa -1,6.10-19C electrón -19 protón +1,6.10 C neutrón - Simbolismo del núcleo 1 N = 7+1 p + 710 n 14 7 9,1.10-28 g m q 0 -1 1 +1 1 0 -24 1,87.10 g -24 ~1,87.10 g A Z 0 -1 e 1p +1 1n 0 X 23 Na 11 = 11 1p+ 12 10 n +1 6 2014 IV) ISÓTOPOS Todos los átomos de un elemento no son estrictamente iguales ⇒ los elementos ∃ en la naturaleza, como una mezcla de 2 o más isótopos mezcla de 2 o más isótopos átomos de 1 elemento que contienen el mismo número de protones (Z) y ≠ número de neutrones ⇒varía su masa La masa atómica de 1 elemento es un promedio en masa de los isótopos. 10 B 11 B, la Ej.: El elemento Boro tiene 2 isótopos: y 5 5 abundancia del 105B es 20 %. ¿Cuál es la masa atómica del boro? Si sus masas en la escala del 12C son 10,01 10 01 y 11,01 11 01 respectivamente. MA (Boro) = 10,01 x 0,20 + 11,01 x 0,80 = 10,81 7 2014 V) ESPECTROSCOPÍA estudia la luz emitida por sistemas materiales en distintas condiciones experimentales. Cada elemento se caracteriza por su espectro de líneas Es una propiedad específica de los elementos ♦ pelicula fotografica Bohr Espectro de emision atomica consigue explicar las líneas de absorción del hidrógeno, aplicando La Teoría cuántica de la radiación formulada por Planck (1900) Postula la discontinuidad de la Energía Toma en cuenta la Naturaleza dual de la luz 8 2014 Amplitud La luz es la energía que se desplaza con movimiento ondulatorio λ longitud de onda LUZ comportamiento ondulatorio formada por partículas o fotones (“cuanto”) Planck cada fotón tiene una energía g Efotón = h ν h = constante de Planck = 6,63.10-34 J.s ν= frecuencia = c/λ Un cuerpo no emite ni absorbe energía en forma continua sino que lo hace en forma de “cuantos” (paquetes”) de energía luminosa Modelo atómico de Bohr Propone un modelo teórico que explica las experiencias de espectroscopía. Postula: e‐ se mueven en órbitas de energía fija (estable) •Los Los e se mueven en órbitas de energía fija (estable) •Estas órbitas son niveles estacionarios de E Son los únicos permitidos para que el e‐ se ubique La E del e‐ está “cuantizada” (restingida) h2 núcleo h1 n1 n2 El átomo posee niveles discretos de energía Los ≠ niveles de E permitidos los indicó con n n = número cuántico principal Los e- pasan a otro nivel absorbiendo o emitiendo energía en forma de fotón. 9 2014 MODELO ATÓMICO MODERNO Modelo Mecánico‐cuántico Actualmente para explicar el comportamiento de los átomos se utiliza la mecánica ondulatoria Se origina en g una hipótesis formulada por de Broglie (1924) Así como la luz presenta comportamiento tanto corpuscular como ondulatorio, cualquier partícula, λ = h/ m v en circunstancias adecuadas puede mostrar propiedades ondulatorias longitud de onda asociada a la partícula en movimiento Toda la materia tiene propiedades ondulatorias, pero éstas son notables sólo en partículas pequeñas (de masa muy chica), sino la λ asociada es muy pequeña (indetectable) Modelo MECÁNICO‐CUÁNTICO Principio fundamental de la Mecánica Cuántica: Principio de Incertidumbre de Heisemberg Es imposible determinar con exactitud el momento (velocidad) y la posición de un electrón de manera simultánea (1926) Erwin Schröedinger propuso una Ecuación matemática (de la Mecánica Cuántica) “Ecuación de ONDA” referida al sistema formado por un núcleo y 1e- en movimiento. ∂2Ψ + ∂ 2Ψ + ∂ 2Ψ ∂ x2 ∂ y2 ∂ z2 + 8 p2m (E‐U) Ψ h2 = 0 al resolverla obtuvo un conjunto de funciones matemáticas 10 2014 Ψ = funciones de onda orbital describen el movimiento y estado energético del electrón Ψ2 probabilidad de encontrar 1 e‐ en una cierta región del espacio Para tener una imagen física del movimiento electrónico suele representarse una región del espacio: ORBITAL: función de onda de los electrones en los átomos D la De l resolución l ió de d la l Ec E de d Schröedinger S h ö di surgen valores numéricos: los números cuánticos A cada uno de ellos se le puede atribuir un sentido físico NÚMEROS CUÁNTICOS n n° cuántico principal nivel energético del electrón l Toma valores enteros relacionado con la energía asociada al e‐ y con el positivos 1,2,3.. volumen o tamaño del orbital. n° cuántico azimutal o secundario l = 0 1 2 3 s p d f (forma del orbital y subnivel de energia) valores: desde 0 hasta (n‐1) está caracterizado por letras para n =1 n=2 l = 0 (1 s) l =0 (2 s) l = 1 (2p) 11 2014 m n° cuántico magnético relacionado con la orientación espacial del orbital toma valores: ‐l….0…+l l= 0 m = 0 l = 1 m = 1 m = ‐1 m = 0 m = +1 = 1 m = 0 m = +1 (el orbital p puede orientarse de 3 formas distintas) l = 2 m = ‐2 , ‐1, 0, 1, 2 px, py, pz están asociados a un mismo valor de energía (5 orientaciones espaciales) s n° cuántico spin orbitales degenerados g el e‐ se comporta como si estuviera girando sobre sí mismo. Valores : ‐½ o + ½ (indican el sentido de giro) 12 2014 CONFIGURACIÓN ELECTRÓNICA Describe el ordenamiento electrónico para cada átomo • Principio de Exclusión de Pauli • Principio de Construcción ordenada • Regla de Hund Cada e- de un átomo está descripto por un conjunto de 4 números cuánticos sujetos a una restricción expresada por el Principio de Exclusión de Pauli: “En un átomo no existen 2 e- cuyos 4 números cuánticos sean iguales” cada e- tiene “su nombre” que lo caracteriza y es único En un orbital sólo hay 2 e- como máximo 13 2014 Principio de construcción ordenada Regla nemotécnica 1s 2s 2p 3s 3p 3d 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 6s 6p 6d 7s 7p 7s 7p 1s, 2s, 2p, 3s, 3p, 4s ≅ 3d, 4p, 5s ≅ 4d, 5p, 6s, 4f, 5f.. Cd (48) 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 [Kr] 5s2 4d10 Configuración electrónica Para el átomo de H: 1s1 n Li (Z = 3) 1 s2 2 s1 o B ( Z = 5)) 1s2 2s2 2 p1 C (Z= 6) 1 s 2 2 s2 2 p 2 n° de e- l=0 1s 2s ↑↓ ↑ 14 2014 • Regla de máxima multiplicidad de Hund “Los e- tenderán “L t d á a ocupar distintos di ti t orbitales bit l d l mismo del i subnivel b i l dentro de un orden de llenado que permite la máxima cantidad de orbitales semillenos” ↑↓ N (z = 7) 1 s2 2 s2 2 p3 ↑↓ ↑ ↑ ↑ Ca ( z = 20) 1 s2 2 s2 2 p63s2 3p6 4s2 Configuración indicando los números cuánticos N(z = 7) Electrón n 1y2 3y4 5,6 y 7 1 1 2 2 l m 0 0 0 0 0 0 2 2 2 0 0 1 1 1 s +1/2 1/2 -1/2 +1/2 -1/2 -1 0 +1 +1/2 +1/2 +1/2 configuración e1s2 1 2s2 2px1 2py1 2pz1 15 2014 Ca (Z=20) Electrón n l m s configuración e- 1,2 3,4 , 1 2 0 0 0 0 ±1/2 ±1/2 1s2 2s2 5-10 2 2 2 1 1 1 -1 0 +1 ±1/2 ±1/2 ±1/2 2p6 3 3 3 3 4 0 1 1 1 0 0 -1 0 +1 0 ±1/2 ±1/2 ±1/2 ±1/2 ±1/2 11,12 13-18 19,20 3s2 3p6 4s2 Tabla Periódica actual 7 filas PERÍODOS 18 columnas GRUPOS 1 IA 1 18 VIIIA V 2 IIA 13 IIIA 14 IVA 15 VA 16 VIA 17 VIIA 2nd Período 2 3 3 IIIB 4 IVB 5 VB 6 VIB 7 VIIB 8 9 VIIIB 4 5 Metales 10 11 IB 12 IIB No metales 6th Periodo 6 7 16 2014 Gases Nobles Metales de transición Halógenos Metales Alcalinos Térreos Número de Grupo Metales Alcalinos Número de Período Nombres de algunos Grupos importantes de la Tabla Periódica Lantánidos Actínidos 17 2014 Relación entre configuración electrónica y tabla periódica En el grupo 18 el último nivel está completo Se considera el anillo externo con 8 electrones, la configuración más estable de los átomos. Todos los elementos del mismo grupo tienen el mismo n° de e- en el último nivel energético y coincide con el n° de grupo GRUPO 1 H (Z =1) Li (Z =3) Na (Z =11) K (Z =19) He(2) Ne (10) Ar (18) Kr (36) 1s1 1s2 2s1 1s22s22p63s1 1s22s22p63s23p64s1 GRUPO 18 1s2 1s22s22p6 1s22s22p63s23p6 [Ar] 4s23d104p6 Configuración electrónica externa (CEE) Configuración correspondiente a aquellos e- involucrados en las reacciones químicas electrones de valencia Ca 1s22s22p63s23p64s2 o [Ar] 4s2 CEE 1 IA 1 H 1s1 2 IIA 13 IIIA Li Be 2s1 2s2 Na Mg 3s1 3s2 3 IIIB 4 IVB 4 K 4s1 Sc 3d1 V Ti Cr Mn 3d2 3d3 4s13d5 3d5 5 Rb 5s1 Ca 4s2 Sr 5s2 6 Cs 6s1 Ba 6s2 7 Fr 7s1 Ra 7s2 2 3 18 VIIIA B 2p1 5 VB 6 VIB 7 VIIB 8 9 VIIIB Fe Co 3d6 3d7 10 Ni 3d8 11 IB 12 IIB Cu Zn 3d10 4s13d10 14 IVA 15 VA C N 2p2 2p3 Al Si 3p1 3p2 P 3p3 16 VIA O 2p4 S 3p4 17 VIIA He 1s2 F 2p5 Cl 3p5 18 2014 Los elementos pertenecientes a la misma columna o grupo tienen en general la misma CEE B L O Q U E s Propiedades químicas semejantes BLOQUE Q p G I = ns1 G(III) ns2np1 Metales de transición BLOQUE d Gases nobles ns2 np6 bloque f Metales de transición interna 19






