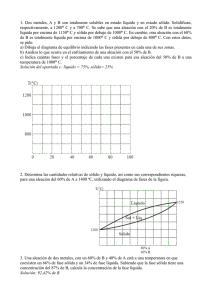
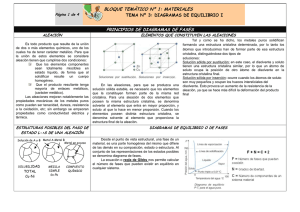
TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones
Anuncio

Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz TEMA 3: DIAGRAMAS DE EQUILIBRIO 1.- Aleaciones Características Los metales puros tienen poca aplicación en la industria. La mayoría de ellos se combinan con otros metales o no metales para mejorar sus propiedades (mayor dureza, resistencia mecánica, resistencia a la corrosión, etc.) Se denomina aleación metálica a la mezcla de dos o más elementos químicos, uno de los cuales tiene carácter metálico, que en estado sólido tiene propiedades metálicas. Los elementos de una aleación deben ser totalmente miscibles en estado líquido, de forma que al solidificarse resulte un producto homogéneo. Cuando se mezclan metales que cristalizan en la misma red tridimensional, se denomina disolvente al que interviene en mayor proporción y soluto al que lo hace en proporción menos. Cuando se mezclan metales que cristalizan en distinta red, se llama disolvente al metal cuya estructura cristalina es la misma que la de la aleación, aunque intervenga en menor proporción. Estructura: soluciones sólidas Las aleaciones metálicas son soluciones sólidas entre 2 ó más elementos. Dependiendo de la disposición de los átomos del disolvente y del soluto, nos podemos encontrar con dos tipos de soluciones: Solución solidas de sustitución: son aquellas aleaciones en las que los átomos del elemento disuelto (soluto) sustituyen y ocupan los nudos de los átomos del elemento disolvente en su red cristalina, sin modificarla, siendo ambos casi del mismo tamaño Para que dos átomos A y B sean totalmente solubles en estado sólido, se deben cumplir varias condiciones: - Ambos metales han de cristalizar en el mismo sistema. Ambos metales deben tener la misma valencia. Ambos metales han de poseer una electronegatividad semejante Los diámetros atómicos no deben diferir en más de un 15%. Ejemplo: cobre con niquel (Cu-Ni); oro con plata (Au-Ag) La mayor parte de los metales forman únicamente soluciones sólidas de solubilidad parcial. Solución sólidas de inserción son aquellas aleaciones en las que los átomos del elemento soluto se sitúan en los intersticios, entre los átomos del elemento disolvente, siendo el tamaño de los átomos del elemento disuelto mucho menores. El elemento que suele actuar de soluto es un no metal de pequeño tamaño (C, N, O ó H). 1 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Los metales que actúan de disolvente suelen ser metales de transición (Fe, Cr, Mn, Co, Ni,…) Las aleaciones hierro-carbono (acero) se presentan siempre como soluciones sólidas intersticiales, (Ferrita que es hierro α con carbono intersticial y la Austerita, que es hierro γ con carbono intersticial). El radio atómico del hierro es de 0,129 nm y el del carbono es de 0,075 nm. 2.- Solidificación de las aleaciones La solidificación de materiales y aleaciones metálicas es un proceso industrial que parte del estado líquido y enfría el material en forma de lingote o en un molde con la forma definitiva. Las propiedades dependen en gran medida de la manera en que se lleva a cabo la solidificación. El proceso de solidificación de un metal o de una aleación metálica puede dividirse en dos etapas, que se regulan por sus velocidades: - Velocidad de nucleación: es la velocidad a la que se forman pequeños núcleos estables sólidos en el interior del líquido fundido. Velocidad de cristalización: es la velocidad a la cual los núcleos estables crecen hasta dar lugar a la estructura cristalina. Según este proceso se obtiene la curva de enfriamiento de un material, en función de la temperatura y el tiempo. Curva de enfriamiento de un metal y de una aleación METAL PURO Temperatura Temperatura Líquido T solidificación ALEACIÓN EUTÉCTICA ALEACIÓN Temperatura Líquido 2 1 T inicio solidificación 1 T fin solidificación 2 Líquido Intervalo solidificación T solidificación 2 1 Sólido Sólido tiempo tiempo 1 = Inicio del proceso de solidificación Sólido tiempo 2 = Fin del proceso de solidificación Los metales puros tienen una sóla temperatura de solidificación, mientras que las aleaciones tienen un intervalo de solidificación (excepto la aleación eutéctica, que veremos más adelante).. 3.- Diagrama de equilibrio en aleaciones Se llaman diagramas de equilibrio o diagrama de fases. Representan la relación entre la estructura, la composición, el número de fases y las transformaciones desde el estado líquido al estado sólido. Fase: es cada una de las partes o masa homogénea de que se compone un sistema y se diferencia físicamente del resto (ej: fase sólida, líquida y gaseosa). Dentro de un sólido pueden existir varias fases 2 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Componente: son cada una de las sustancias o elementos químicos que forman un material. (ej: el Fe (hierro) y el Fe3C (cementita)son constituyentes del acero) Los diagramas de equilibrio nos permiten saber qué fases se encuentran presentes para cada composición de una aleación y a qué temperatura. También permiten saber las temperaturas de inicio y fin del proceso de solidificación; las temperaturas en que se produce un cambio de fases y la solubilidad que tienen los componentes en estado sólido y líquido. En todos los diagramas vamos a analizar tres datos: Numero de fases Composición de cada fase (mediante la regla de la horizontal), Cantidad o proporción de cada fase (mediante la regla de la palanca o de los segmentos inversos), Representación de diagramas de equilibrio de la aleación A-B: Para dibujar un diagrama hay que seguir los siguientes pasos: - Se dibujan las curvas de enfriamiento de los metales puros A y B, indicando el punto de fusión o solidificación. Se dibujan las curvas de enfriamiento de aleaciones A-B de diferentes composiciones, marcando las temperaturas de inicio y fin de la solidificación Con las curvas anteriores se dibuja la gráfica temperatura-concentración. Para ello se unen todos los puntos de inicio del proceso de solidificación, obteniendo una línea por encima de la cual todo es líquido (línea de liquidus). Y se unen todos los puntos del fin del proceso de solidificación, obteniendo una línea por debajo de la cual todo es sólido (línea de solidus). La zona comprendida entre ambas líneas está formada por una mezcla de aleación en estado líquido y estado sólido. DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN ESTADO LÍQUIDO Y ESTADO SÓLIDO Tª 1600 0%B 100%A T1=T2 25%B 75%A 1500 T1 50%B 50%A Se toman diferentes aleaciones A-B, se funden y se dejan enfriar lentamente. 75%B 25%A T1 1300 Se dibujan sus gráficas de enfriamiento. T1 1400 100%B 0%A T1 = temperatura de inicio de solidificación (comienza la formación de cristales) T2 T2 T2 T1 =T2 1200 1100 t Línea de liquidus Tª 1600 1500 T1 En estas aleaciones existe una solubilidad en estado sólido por lo que los átomos se mezclan en el interior del grano cristalino, es decir, dentro de los granos hay metal A y B. Todos los granos son similares. T1 T1 1400 L+s T2 1300 T2 T2 1200 1100 Se dibuja la gráfica Temperatura- concentración. LÏQUIDO L T1 =T2 SÓLIDO s 0%B 100%A 25%B 75%A Línea de 3 solidus 50%B 50%A 75%B 25%A T2 = temperatura de fin de solidificación (formación del último cristal T1=T2 100%B 0%A %B Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz El diagrama se divide en tres zonas. En la zona L hay una sola fase, líquida y homogénea. En la zona L+α hay dos fases, una de líquido y otra de cristales de aleación sólida α (AB mezclados). En la zona α hay una fase sólida formada por la mezcla AB. Vamos a analizar el diagrama fijándonos en los siguientes puntos: Tª Ejemplo: Aleación 75% A y 25% B: - 1600 En el punto “a” LÏQUIDO L 1500 Numero de fases = 1 (liquido) s 1400 Composición de cada fase: Líquido =75% A - 25 %B l b L+S 1300 Cantidad o proporción de cada fase: Wlíquido = 100 % - a c 1200 SÓLIDO S 1100 En el punto “b” 0 10 25 50 75 Numero de fases = 2 (liquido y sólido α) Composición de cada fase: se aplica la regla de la horizontal para hallar la composición química del sólido y del líquido (se traza una línea horizontal que pase por el punto “b” y corte a las líneas de fase; el punto de corte con la línea de líquido nos da la composición de la fase líquida y el punto de corte con la línea de sólido nos da la composición de la fase sólida) Líquido L= l % B = 75% B y 25% A Sólido S = s % B = 10% B y 90% A Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos para hallar la cantidad en tanto por ciento de la fase sólida y de la fase líquida (se traza una línea horizontal que pase por el punto “b” y corte a las líneas de fase; esa línea s-l es el denominador y en el numerador se coloca el segmento inverso desde nuestro punto “b” a la línea de fase) Wlíquido = Wsólido = - 100 (%) = 100 (%) = 100 = 23% 100 = 77% En el punto “c” Numero de fases = 1 (sólido α) Composición de cada fase: Solido =75% A - 25 %B Cantidad o proporción de cada fase: Wsólido = 100 % 4 %B 100 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN ESTADO LÍQUIDO E INSOLUBLES EN ESTADO SÓLIDO Tª 100%B 0%A 0%B 100%A 20%B 40%B 60%B 80%A 60%A 40%A 1500 T1=T2 1400 80%B 20%A T1 Se dibujan las curvas de enfriamiento en un diagrama Tª – t T1 =T2 Observamos que todas las aleaciones A-B acaban de solidificar a la misma temperatura. T1 T1 1300 1200 T2 T1 =T2 T2 T2 1100 1000 t 1500 T1 =T2 LÏQUIDO L T1 =T2 1400 Se representa el diagrama de fases Línea de liquidus Tª T1 T1 T1 1300 L+B L+A 1200 T2 T2 T2 1100 Línea de solidus SÓLIDO A+B 1000 0 %B 20 40 Aleación hipoeutéctica 60 Los metales puros A y B y la aleación eutéctica tienen una sola temperatura de solidificación. El resto de aleaciones tiene un intervalo de solidificación 80 100 El diagrama se divide en cuatro zonas. - En la zona L hay una sola fase, líquida y homogénea. - En la zona L+A hay dos fases, una de líquido A-B y otra de cristales de solido A. - En la zona L+B hay dos fases, una de líquido A-B y otra de cristales de solido B. En la zona sólida hay un sólido formado por dos fases A y B, que no se mezclan. Aleación hipereutéctica En estas aleaciones existe una insolubilidad entre sus elementos en estado sólido, lo que hace que, Aleación al formarse los granos cristalinos, eutéctica los metales no se mezclan dentro del grano por lo que cada grano es de un metal puro; Es decir, tenemos granos formados por el metal A y granos del metal B (dos fases) mezclados al azar. A la aleación de punto de fusión más bajo se le llama aleación eutéctica. Reacción eutéctica: transformación de un líquido a cierta temperatura en dos fases sólidas. Es la aleación de menor temperatura de fusión 5 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Línea de liquidus Ap = A proeutéctico Bp = B proeutéctico Tª 1500 (A+B)eu = aleación eutéctica LÏQUIDO L a 1400 b 1300 L + Bp L + Ap 1200 1100 c A+B Línea de solidus Aleación eutéctica 1000 Ap+(A+B)eu 0 Bp+(A+B)eu %B 20 60 40 Aleación hipoeutéctica 80 100 Aleación hipereutéctica - En las aleaciones hipoeutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+A son de sólido puro A, mientras que el líquido que queda se va empobreciendo en A. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación formada contiene cristales de A puro y B puro que no se mezclan (sólido con dos fases A+B) Pero podemos considerar que existe un constituyente A proeutéctico (se formó antes de la temperatura eutéctica)), más una estructura compuesta de A+B (composición eutéctica). Es la zona Ap+(A+B)eu - En la aleación eutéctica sólo hay un punto de solidificación y toda la aleación pasa - de estado líquido a sólido a la temperatura T2. Se forman dos fases A y B, que no se mezclan. En las aleaciones hipereutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+B son de sólido puro B, mientras que el líquido que queda se va empobreciendo en B. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación formada contiene cristales de de A puro y B puro que no se mezclan (sólido con dos fases A+B) Pero podemos considerar que existe un constituyente B proeutéctico (se formó antes de la temperatura eutéctica)), más una estructura compuesta de A+B (composición eutéctica). Es la zona Bp+(A+B)eu Para calcular la composición de cada una de las fases se emplea la regla de la horizontal. Y para calcular la cantidad de cada fase se emplea la regla de la palanca. Ejemplo: Aleación 80% A y 20% B: - En el punto “a” Numero de fases = 1 (liquido) Composición de cada fase: Líquido =80% A - 20 %B Cantidad o proporción de cada fase: Wlíquido = 100 % 6 Departamento de Tecnología. - IES Nuestra Señora de la Almudena Mª Jesús Saiz En el punto “b” Numero de fases = 2 (liquido y sólido A) Composición de cada fase: se aplica la regla de la horizontal Líquido = l %B = 40% B y 60% A Sólido A = s % B = 0% B y 100% A Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos Wlíquido = 100 (%) = Wsólido = - 100 (%) = 100 = 50% 100 = 50% En el punto “c” Numero de fases = 2 (solido A y sólido A+B) Cantidad o proporción de cada fase: Primero se calculan las cantidades totales de A y B WA = 80% y WB = 20% Para conocer las cantidades de cada fase A y fase A+B, se compara la fase A+B con la composición del punto eutéctico. WAeutectico = 40% WBeutectico = 60% Comparamos los cristales de B que son todos eutécticos, mediante regla de tres: Aeutéctico Beutéctico Eutéctico 40 60 Punto c x 20 Resolviendo: x = 13,3%, de modo que el A primario será 80-13,3 = 66,7. Y la cantidad de cada fase es: WA proeutéctico = 66,7% y W(A+B) eutéctico = 13,3 + 20 = 33,3% 7 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz DIAGRAMA DE EQUILIBRIO EN ALEACIONES TOTALMENTE SOLUBLES EN ESTADO LÍQUIDO Y PARCIALMENTE SOLUBLES EN ESTADO SÓLIDO La mayor parte de los metales de uso industrial presentan alguna solubilidad entre sí al alearse. Por ejemplo: en la aleación Cu-Zn, el cobre no es capaz de solubilizar más de un 30% de Zn Se representa el diagrama de fases Línea de liquidus Tª A 1800 B LÏQUIDO L 1600 Línea de solidus 1400 L+ 1200 1000 α L+ α β β α+β Aleación eutéctica SÓLIDO α+β 800 0 %B 20 40 Aleación hipoeutéctica 60 80 100 Aleación hipereutéctica Aleación eutéctica En estos sistemas los metales son solubles pero en pequeña cantidad (parcialmente solubles, Al solidificar aparecen soluciones sólidas α y β α = solución sólida de B disuelto en A (mucha cantidad de A y poca de B) β = solución sólida de A disuelto en B (mucha cantidad de B y poca de A) A la temperatura eutéctica las fases sólidas que se forman son soluciones α y β. Se observa en el diagrama que ocurren transformaciones en estado sólido. El diagrama se divide en seis zonas: - En la zona L hay una sola fase, líquida y homogénea. En la zona L+α hay dos fases, una de líquido y otra de cristales de aleación sólida α (sólido α con solubilidad parcial) En la zona L+β también hay dos fases, una de líquido y otra de cristales de aleación sólida β (sólido β con solubilidad parcial) En la zona α, hay una fase sólida formada por cristales de aleación sólida α. En la zona β, hay una fase sólida formada por cristales de aleación sólida β. En la zona α+β hay un sólida formado por dos fases α y β, que son soluciones sólidas con solubilidad parcial. 8 Departamento de Tecnología. IES Nuestra Señora de la Almudena - En las aleaciones hipoeutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+α son de sólido α, mientras que el líquido que queda se va empobreciendo en A. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación formada contiene cristales de α (proeutécticos), más una estructura compuesta de α+β (composición eutéctica). Es la zona α+(α+β). Por debajo de la temperatura T2, disminuye la solubilidad de A y B, por lo que la solución α pierde cristales de B y la solución β pierde cristales de A. - - - Mª Jesús Saiz Tª A B 1800 LÏQUIDO L 1600 a 1400 L+ αP L+ b βP 1200 1000 α c Aleación eutéctica αP+(α+β)eu 800 357 0 β α+β βP+(α+β)eu 90 92 50 20 40 Aleación hipoeutéctica 60 80 100 Aleación hipereutéctica En aleaciones hipoeutécticass con pequeñas cantidades de B, todo el sólido está en forma de α y este sólido no sufre transformaciones, todo es solución sólida α En la aleación eutéctica sólo hay un punto de solidificación y toda la aleación pasa de estado líquido a sólido α+β a la temperatura T2. Por debajo de esta temperatura disminuye la solubilidad de A y B, por lo que la solución α pierde cristales de B y la solución β pierde cristales de A. En las aleaciones hipereutécticas, comienza la solidificación a la temperatura T1, los cristales que solidifican en la zona L+β son de sólido β, mientras que el líquido que queda se va empobreciendo en B. Al llegar a la temperatura T2 desaparece todo el líquido y la aleación formada contiene cristales de β (proeutécticos), más una estructura compuesta de α+β (composición eutéctica). Es la zona β+(α+β) Por debajo de la temperatura T2, disminuye la solubilidad de A y B, por lo que la solución α pierde cristales de B y la solución β pierde cristales de A. En aleaciones hipereutécticas,con pequeñas cantidades de A, todo el sólido está en forma de β y este sólido no sufre transformaciones, todo es solución sólida β Para calcular la composición de cada una de las fases se emplea la regla de la horizontal. Y para calcular la cantidad de cada fase se emplea la regla de la palanca. Ejemplo: Aleación 60% A y 40% B: - En el punto “a” Numero de fases = 1 (liquido) Composición de cada fase: Líquido =60% A - 40 %B Cantidad o proporción de cada fase: Wlíquido = 100 % - En el punto “b” Numero de fases = 2 (liquido y sólido α) 9 %B Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Composición de cada fase: se aplica la regla de la horizontal Líquido = l %B = 50% B y 50% A Sólido α = s % B = 3% B y 97% A Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos Wlíquido = 100 (%) = Wsólido = - 100 (%) = 100 = 78,7% 100 = 21,3% En el punto “c” Numero de fases = 2 (solido α y sólido α+β) Composición de cada fase: se aplica la regla de la horizontal Sólido α = 5% B y 95% A Sólido β = 92% B y 8% A Cantidad o proporción de cada fase: se aplica la regla de la palanca o de los segmentos inversos Primero se calculan las cantidades totales de α y β Wα = 100 = 59,8% Wβ = 100 = 40,2% Para conocer las cantidades de cada fase α y fase α+β, se compara la fase α+β con la composición del punto eutéctico. Wαeutectico = Wβeutectico= 100 = 36,1% 100 = 63,9% Comparamos los cristales de β que son todos eutécticos, mediante regla de tres: αeutéctico βeutéctico Eutéctico 36,1 63,9 Punto c x 40,2 Resolviendo: x = 22,7%, de modo que el α primario será 36,1 - 22,7 = 13,4%. Y la cantidad de cada fase es: Wα proeutéctico = 13,4% y W(α+β) eutéctico = 22,7 + 63,9 = 86,6 % 10 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz Ejercicios: PAU Septiembre 2013/2014 A partir del siguiente diagrama de equilibrio de fases simplificado de la aleación de cobre y níquel: a) Indique a qué situación de solubilidad corresponde. b) Indique la temperatura de fusión y solidificación de los metales puros. c) Describa el proceso de enfriamiento desde 1.400 ºC hasta la temperatura ambiente de una aleación con un 65 % de cobre, indicando las temperaturas más significativas. d) Determine la proporción de las fases presentes a 1.300 ºC en una aleación con un 45 % de níquel. PAU Modelo 2010/2011 En la figura adjunta se representa el diagrama de fases de la aleación de los metales A-B. a) Determine la composición del eutéctico y la temperatura a la que solidifica. Indique los diferentes estados por los que pasa al enfriar desde el estado líquido al sólido, las temperaturas a las que se produce el cambio y las composiciones de la fase líquida y sólida, en los siguientes casos: b) Metal A puro (0,5 puntos) c) Aleación con 80% de A y 20% de B. (1 punto) 11 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz PAU Junio 2007/2008 Sea el siguiente diagrama de fases de la aleación de los metales A-B. Comente los estados por los que pasa cuando se enfría desde el estado líquido hasta temperatura ambiente, indicando las temperaturas a las que se producen, en los siguientes casos: a) Metal A puro b) Aleación con 80% de A y 20 % de B c) Aleación con 40% de A y 60 % de B PAU Septiembre 2006/2007 En la Figura adjunta se muestra el diagrama de fases de una aleación A-B. Conteste a las siguientes cuestiones: a) ¿Cuál es la temperatura de inicio y de fin del proceso de solidificación para las siguientes composiciones? i) 20% A ii) 40% de B b) ¿A partir de qué composición de B una aleación estaría totalmente líquida a 1300ºC? ¿Y sólida? c) Calcule el número de fases y, de forma aproximada, la composición de cada una y las cantidades relativas de cada fase para una aleación del 50% de A a 1300ºC 12 Departamento de Tecnología. IES Nuestra Señora de la Almudena Mª Jesús Saiz PAU Junio 2004/2005 En la figura adjunta se muestran las curvas de enfriamiento para una aleación de metales A-B completamente soluble en estado líquido e insoluble en estado sólido. Determine: a) La composición del eutéctico y temperatura a la que solidifica b) El diagrama de fases, indicando las fases existentes en cada una de las áreas en que se subdivide el diagrama c) La proporción de los constituyentes (A-eutéctico) de una aleación con 80 % de A y 20 % de B a temperatura ambiente Ejercicio: Defina los siguientes términos: a) b) c) d) Aleación metálica Solución solidas de sustitución Solución sólidas de inserción Aleación eutéctica 13